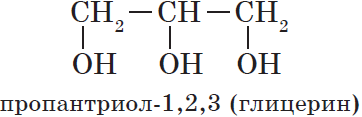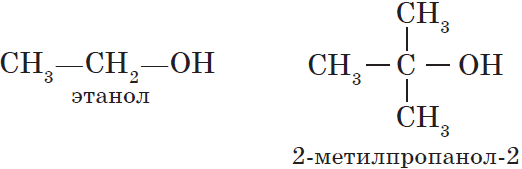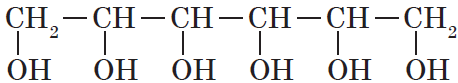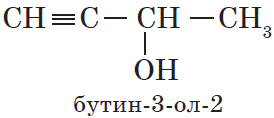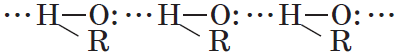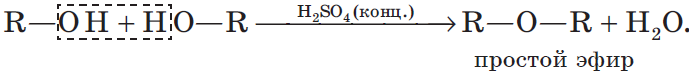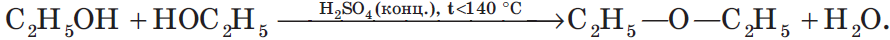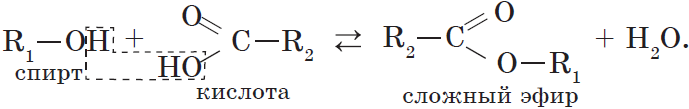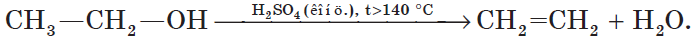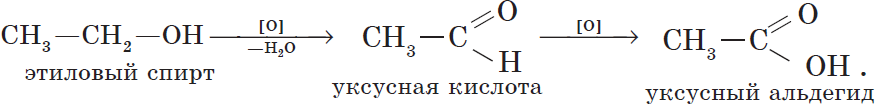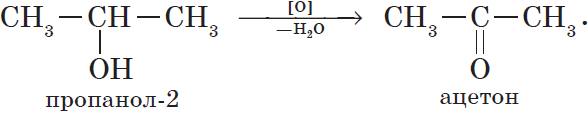Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
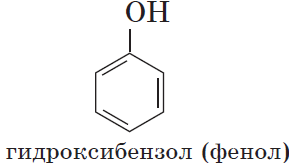
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3.
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.
Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
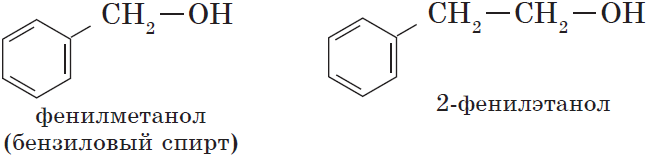
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):
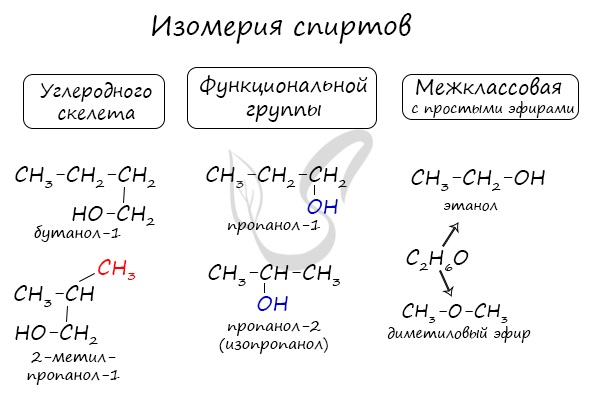
Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
Например. Пропанол-1 и пропанол-2
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
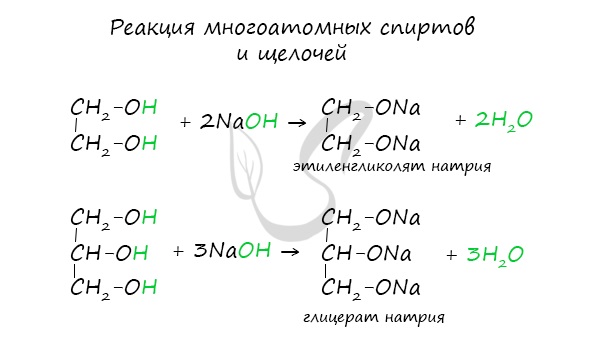
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
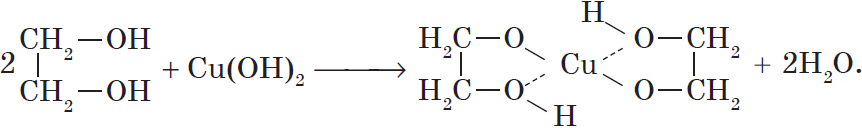
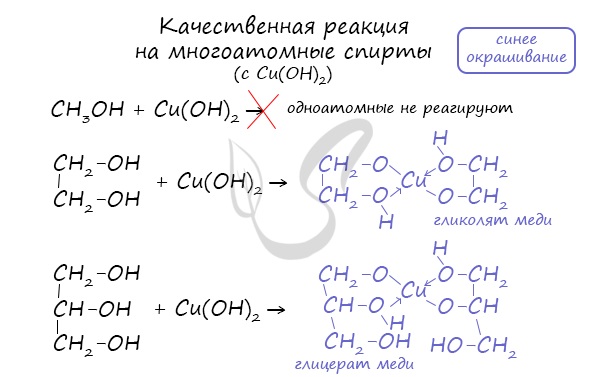
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
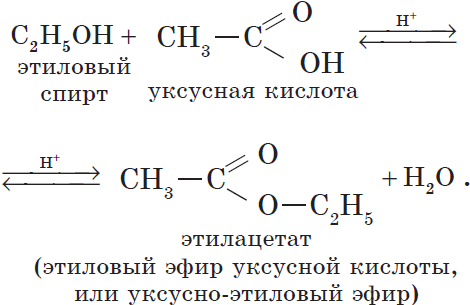
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
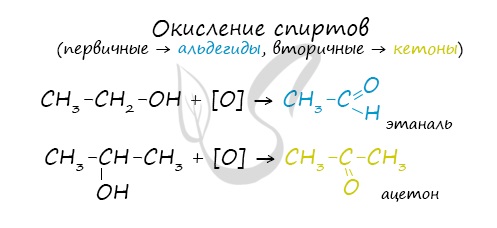
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + 3n/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
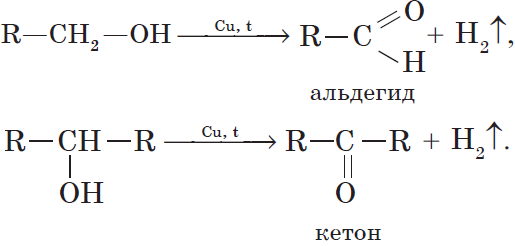
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь
Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)
Получение спиртов
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол
Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана:
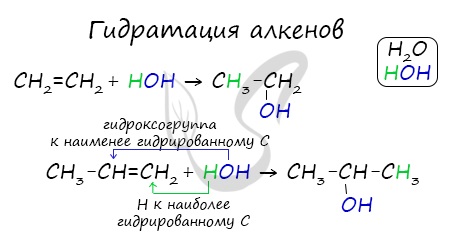
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
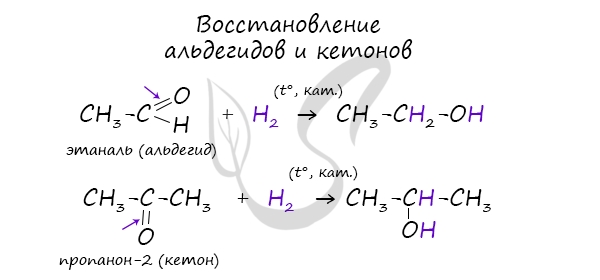
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
Например: при гидрировании ацетона образуется изопропанол
Например, гидрирование диальдегида – один из способов получения этиленгликоля
4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).
5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
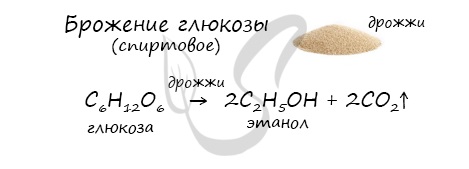
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат)
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.
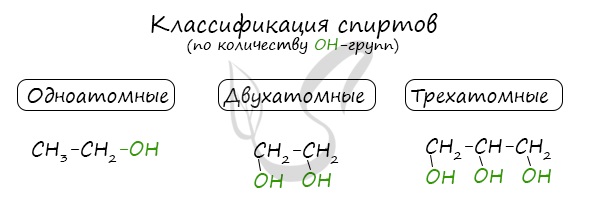
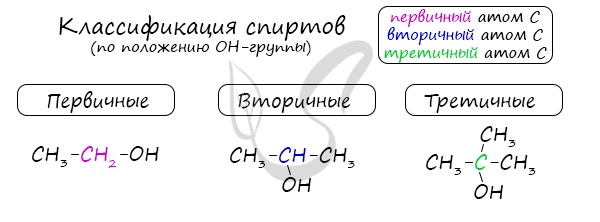
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
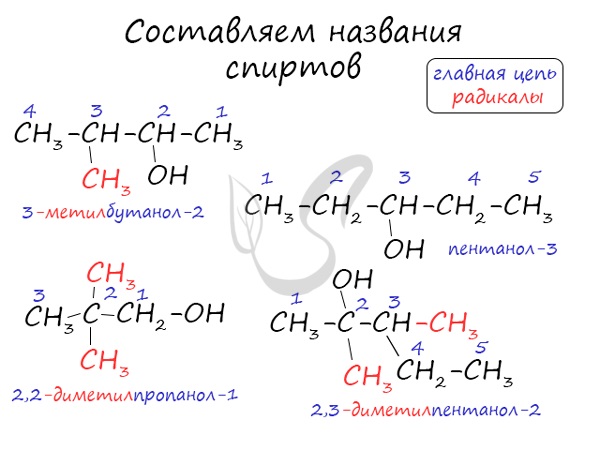
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
- Гидратация алкенов
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
- Получение этанола брожением глюкозы
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
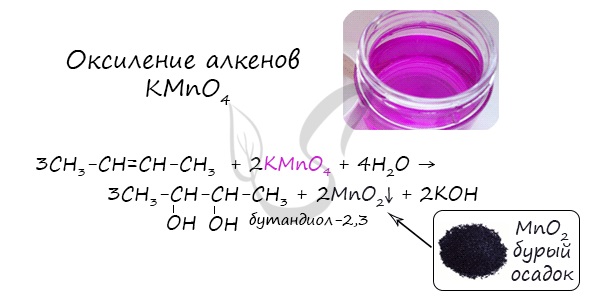
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
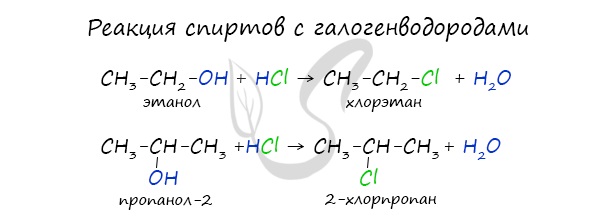
В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более
высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.
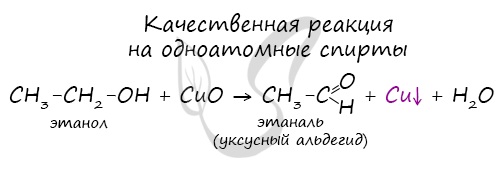
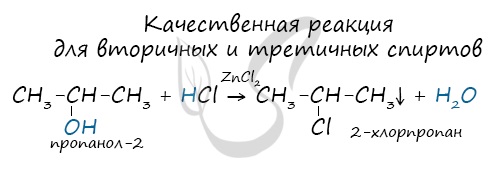
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
— одноатомные, например:
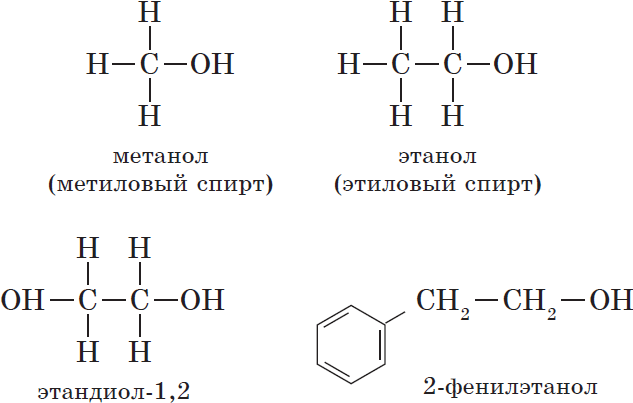
${CH_3-OH}↙{метанол(метиловый спирт)}$ ${CH_3-CH_2-OH}↙{этанол(этиловый спирт)}$
— двухатомные (гликоли), например:
${OH-CH_2-CH_2-OH}↙{этандиол-1,2(этиленгликоль)}$
${HO-CH_2-CH_2-CH_2-OH}↙{пропандиол-1,3}$
— трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
— непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
${CH_2=CH-CH_2-OH}↙{пропен-2-ол-1 (аллиловый спирт)}$
— ароматические, т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
${CH_3-CH_2-OH}↙{этанол}$ ${CH_3-O-CH_3}↙{диметиловый эфир}$
Физические и химические свойства спиртов
Физические свойства.
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_{12}Н_{25}ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
$2Na+2H_2O=2NaOH+H_2↑$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2↑$,
$2Na+2ROH=2RONa+H_2↑$.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при $200–300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
СПИРТЫ- это соединения, содержащие помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Классификация спиртов.
1.По числу гидроксильных групп:
- одноатомные (одна группа -ОН).
Общая формула CnH2n+1–OH или CnH2n+2O.
- многоатомные (две и более групп -ОН).
Общая формула CnH2n+2Om.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т.д).
Двухатомный спирт – этиленгликоль (этандиол) СH2–CH2
│ │
ОН ОН
Трехатомный спирт – глицерин (пропантриол-1,2,3) СH2–СН–CH2
│ │ │
ОН ОН ОН
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа:
3. По строению радикалов, связанных с атомом кислорода:
- предельные, или алканолы (например, СH3CH2–OH)
- непредельные, или алкенолы (CH2=CH–CH2–OH)
- ароматические (C6H5CH2–OH).
- Фенолы (C6H5–OH).
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (ЭО = 3,5), водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Разрыв таких связей происходит преимущественно по ионному механизму.
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две sp3-гибридные орбитали, валентный угол C–О–H близок к тетраэдрическому.
В фенолах одна из электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца:
ВОДОРОДНЫЕ СВЯЗИ И ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей:
Ассоциация молекул ROH
Это объясняет, почему даже низшие спирты — жидкости с относительно высокой температурой кипения (t кип. метанола +64,5оС). При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Гидратация молекул ROH
Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. C увеличением молярной массы растворимость спиртов в воде уменьшается.
Предельные одноатомные спирты
Общая формула – СnH2n+1OH или СnH2n+2O n>1
НОМЕНКЛАТУРА
В названии появляется суффикс: -«ОЛ» и номер атома углерода, к которому он присоединен. Нумерация ведется от ближайшего к ОН-группе конца цепи.
Приведенные выше соединения называют: метиловый спирт, этиловый спирт, н—пропило-вый спирт, изопропиловый спирт.
Метиловый спирт (метанол) CH3-OH
Этиловый спирт (этанол) CH3CH2-OH
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
ИЗОМЕРИЯ СПИРТОВ.
Для спиртов характерна структурная изомерия:
*изомерия положения ОН-группы (начиная с С3);
*углеродного скелета (начиная с С4);
например, формуле C4H9OH соответствует 4 структурных изомера:
*межклассовая изомерия с простыми эфирами
(например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3).
Получение.
|
1. Щелочной гидролиз галогенпроизводных алканов. |
CH3–Br + NaOH(водн.) 🡪CH3–OH +NaBr |
|
2. Гидратация алкенов: присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов. |
CH2=CH2 + H2O –(H+)🡪CH3CH2OH CH3–CH=CH2 + H2O–(H+)🡪CH3CHCH3 ОН ОН / CH3–C=CH2 + H2O –(H+)->CH3 –C–СH3 ⎮ ⎮ СН3 СН3 |
|
3.Восстановление карбонильных соединений. |
При гидрировании альдегидов получаются первичные спирты: СН3-С=О + Н2 -(t,kat)🡪 CH3-CH2-OH ⎮ этанол Н При гидрировании кетонов образуются вторичные спирты: СН3-С=О + Н2 -(t,kat)🡪 CH3-CH-OH ⎮ ⎮ СН3 СН3 пропанол-2 |
|
4. Гидролиз сложных эфиров. |
CH3-C=O + H2O –(H2SO4,t)🡪 │ OC2H5 🡪 CH3-COOH + C2H5OH этанол |
|
5. Получение метанола из синтез-газа. |
1. Конверсия природного газа в синтез-газ: СН4 +Н2О = СО + 3Н2 2. Каталитический синтез метанола из монооксида углерода и водорода при температуре 300-400°С и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: CO + 2 H2 ⇄ CH3OH Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор. |
|
6. Получение этанола спиртовым брожением. |
Спиртовое брожение глюкозы. С6Н12О6 –(фермент)-> 2С2Н5ОН + 2СО2 |
ХИМИЧЕСКИЕ СВОЙСТВА.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
- С–ОН с замещением или отщеплением ОН-группы
- О–Н с замещением водорода.
|
1.Одноатомные спирты реагируют с активными металлами (Na, K, Mg), образуя соли — алкоголяты (алкоксиды): |
Реакционная способность одноатомных спиртов в реакциях по связи О–Н: CH3OH > первичные > вторичные > третичные. 2R–OH + 2Na 🡪 2 R-ONa + H2 этилат калия (алкоголят) Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла: C2H5OК + H2O 🡪C2H5OH + КOH Со щелочами одноатомные спирты НЕ реагируют. |
|
2.Окисление одноатомных спиртов. |
1) Горение: 2CH3OH + 3O2 🡪2CO2 + 4H2O 2) Окисление первичных спиртов до альдегидов: Реагенты – CuO (to), O2 (Cu, to), а также дегидрирование при нагревании над медной сеткой. СН3-СН2-ОН +СuO –(to)🡪 CH3-C=O + Cu + H2O этанол ⎮ этаналь H 2) Дегидрирование: СН3-СН2-СН2-ОН –(Сu, to)🡪 CH3-CH2-C=O + H2 пропанол ⎮ пропаналь H 3) Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот: СН3-СН2-ОН + KMnO4 + H2SO4 -> CH3-COOH + MnSO4 + K2SO4 +H2O уксусная кислота При окислении метанола образуется углекислый газ!!! 5СН3ОН +6KMnO4 + 9H2SO4 -> 5CО2 + 6MnSO4 + 3K2SO4 +19H2O 4) При окислении вторичных спиртов любым окислителем образуются кетоны. |
|
3. Реакции замещения ОН на галоген: происходит в реакции с галогеноводородами в присутствии сильной кислоты (конц. H2SO4). |
Реакционная способность одноатомных спиртов в реакциях по связи С–О: третичные > вторичные > первичные > CH3OH |
|
4. Образование сложных эфиров. |
Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры. |
|
5. Реакции дегидратации спиртов. |
|
|
Внутримолекулярная дегидратация: образуются алкены. |
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре: Основной продукт – бутен-2. Правило Зайцева – водород отщепляется от менее гидрогенизированного атома углерода. |
|
Межмолекулярная дегидратация: образуются простые эфиры. |
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. |
МНОГОАТОМНЫЕ СПИРТЫ.
ПОЛУЧЕНИЕ.
|
1.Окисление алкенов холодным водным раствором KMnO4: |
R-CH=CH2 + KMnO4 + H2O🡪 R- CH-CH2 +MnO2 + KOH алкен │ │ диол OH OH |
|
2. Замещение галогенов на гидроксогруппу: |
СН2— СН — СН2 + 3KOH 🡪 СН2— СН — СН2 + 3KCl │ │ │ (вод.р-р) │ │ │ Cl Сl Cl OH OH OH |
|
3.Восстановление поликарбонильных соединений: |
O=CH – CH =O + H2 –(t,kat)🡪 CH2-CH2 диальдегид │ │ OH OH |
ХИМИЧЕСКИЕ СВОЙСТВА.
|
1.Кислотные свойства. Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. |
Образуют соли не только в реакциях с активными металлами, но и под действием щелочей (частично и обратимо): HO–CH2-CH2–OH + 2Na 🡪 CH2-CH2 +H2 │ │ ONa ONa HO–CH2-CH2–OH +2NaOH ⇄ CH2-CH2 +2H2O │ │ ONa ONa |
|
2.Взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения (качественная реакция на многоатомные спирты ): |
— ярко-синий раствор гликолята меди. |
|
3.Образование сложных эфиров азотной кислоты: реакция с азотной кислотой. |
|
|
4. Замещение ОН на галоген: также, как и одноатомные спирты, реагируют с галогеноводородами. |
HO–CH2-CH2–OH + 2HBr 🡪 CH2-CH2 + 2H2O │ │ Br Br Можно заместить 1 или 2 группы ОН. |
|
5. Окисление. Так же, как и одноатомные спирты – оксидом меди или над медной сеткой многоатомные спирты окисляются в карбонильные соединения. |
CH2-CH2 –(t,Сu)🡪 O=CH–CH=O + H2 │ │ диальдегид — глиоксаль OH OH |
ФЕНОЛЫ
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Общая формула – СnH2n-7OH n>6 (для фенолов с одной ОН-группой)
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
Изомерия
1. Фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
2. Фенолы изомерны ароматическим спиртам
C6H4(СН3)OН – крезол и C6H5-СН2-OН бензиловый спирт
ПОЛУЧЕНИЕ.
|
1. Из хлорбензола. |
+ Cl2 –(AlCl3)🡪 C6H5Cl + HCl Хлорбензол обрабатывают избытком щелочи, получая водный раствор фенолята натрия: C6H5Cl + 2NaOH –(t,p)🡪C6H5ONa + NaCl хлорбензол фенолят натрия Затем фенол выделяют, пропуская углекислый газ. С6H5ONa + CO2 +H2O 🡪 C6H5OH + Na2CO3 |
|
2. Из кумола. |
1) Алкилирование бензола пропеном: + CH3-CH=CH2 –(H3PO4)🡪 2) Окисление кумола кислородом на катализаторе: |
СВОЙСТВА ФЕНОЛОВ.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Сходство и отличие фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличие:
-фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
-фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
-фенол не вступает в реакции дегидратации.
|
Кислотные свойства фенолов. |
|
|
1. Как и спирты, реагируют с активными металлами. |
2C6H5OH + 2Na ->2C6H5ONa + H2 Феноляты легко гидролизуются: C6H5ONa + HСl 🡪 C6H5OH + NaCl C6H5ONa +H2О +СО2 🡪 C6H5OH + NaНСО3 |
|
2. Реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты. |
C6H5OH + NaOH 🡪C6H5ONa + H2O |
|
Реакции фенола по бензольному кольцу. |
|
|
3. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол №1). |
|
|
4. Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов. При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота). |
|
|
5. Конденсация с альдегидами. С формальдегидом фенол образует фенолоформальдегидные смолы. |
|
|
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. |
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон: |
|
6. Гидрирование (восстановление) |
C6H5OН +3Н2 –(Ni)🡪 C6H11OH циклогексанол |
|
7. Качественная реакция на фенол №2: с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа. |
Спирты. Тренировочные задания для подготовки к ЕГЭ
Спирты. Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, которые справедливы для метанола:
1) является жидкостью с характерным запахом
2) является токсичным
3) имеет атом углерода в состоянии sp2-гибридизации
4) является вторичным спиртом
5) плохо растворим в воде
Решение
Ответ: 12
Задание №2
Выберите два утверждения, которые справедливы для метанола:
1) является электролитом
2) не вступает в реакцию внутримолекулярной дегидратации
3) плохо растворяется в воде
4) между молекулами есть водородные связи
5) является изомером этанола
Решение
Ответ: 24
Задание №3
Выберите два утверждения, которые справедливы для этанола:
1) все связи в молекуле ковалентные неполярные
2) хорошо растворим в воде
3) не вступает в реакцию внутримолекулярной дегидратации
4) изменяет окраску индикаторов
5) обладает наркотическим действием на организм человека
Решение
Ответ: 25
Задание №4
Выберите два утверждения справедливых для этанола:
1) проявляет сильные кислотные свойства
2) является электролитом
3) получают сбраживанием сахаристых веществ
4) содержит один первичный атом углерода
5) используют в медицине
Решение
Ответ: 35
Задание №5
Выберите два утверждения, которые справедливы для всех одноатомных спиртов:
1) жидкости с характерным запахом
2) токсичны
3) содержат межмолекулярные водородные связи
4) при окислении дают альдегиды
5) их можно обнаружить с помощью гидроксида меди (II)
Решение
Ответ: 23
Задание №6
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует метанол:
- 1. СH3OH
- 2. KOH
- 3. Н2
- 4. KMnO4
- 5. C2H6
Решение
Ответ: 14
Задание №7
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует этанол:
- 1. [Ag(NH3)2]OH
- 2. Na
- 3. HBr
- 4. Cu
- 5. Cu(OH)2
Решение
Ответ: 23
Задание №8
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует пропанол-1:
- 1. CH3COOH
- 2. KOH
- 3. СH3OH
- 4. FeCl3
- 5. Н2
Решение
Ответ: 13
Задание №9
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует пропанол-2:
1) гидроксид меди (II)
2) оксид алюминия
3) пропановая кислота
4) пропанол-2
5) ацетат натрия
Решение
Ответ: 34
Задание №10
Из предложенного перечня веществ выберите два таких, с которыми не реагирует метанол:
- 1. KOH
- 2. С2H5OH
- 3. CuO
- 4. Cu
- 5. HBr
Решение
Ответ: 14
[adsp-pro-3]
Задание №11
Из предложенного перечня веществ выберите два таких, с которыми не реагирует этанол:
- 1. CH3-O-CH3
- 2. Na
- 3. HBr
- 4. K2Cr2O7
- 5. Cu(OH)2
Решение
Ответ: 15
Задание №12
Из предложенного перечня веществ выберите два таких, с которыми не реагирует пропанол-1:
1) этан
2) аммиак
3) этаналь
4) гидроксид натрия
5) метанол
Решение
Ответ: 14
Задание №13
Из предложенного перечня веществ выберите два таких, с которыми не реагирует пропанол-2:
- 1. H2
- 2. H2O
- 3. CuO
- 4. HCl
- 5. CH3CHO
Решение
Ответ: 12
Задание №14
Из предложенного перечня веществ выберите два таких, которые нельзя получить из метанола в одну стадию:
1) диметиловый эфир
2) ацетон
3) этилметаноат
4) метилат натрия
5) метилацетат
Решение
Ответ: 23
Задание №15
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этаналь
2) метилэтаноат
3) этилат калия
4) этилформиат
5) дихлорэтан
Решение
Ответ: 25
Задание №16
Из предложенного перечня веществ выберите два таких, которые нельзя получить из метанола в одну стадию:
1) метиламин
2) метилат натрия
3) этилформиат
4) метаноат натрия
5) метаналь
Решение
Ответ: 34
Задание №17
Из предложенного перечня веществ выберите два таких, которые нельзя получить из пропанола-1 в одну стадию:
1) этилпропаноат
2) пропилацетат
3) пропен
4) пропанон
5) дипропиловый эфир
Решение
Ответ: 14
Задание №18
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этановую кислоту
2) этилен
3) этандиол-1,2
4) 1,2-дихлорэтан
5) диэтиловый эфир
Решение
Ответ: 34
Задание №19
Из предложенного перечня веществ выберите два таких, которые можно получить из метанола в одну стадию:
1) метилэтиловый эфир
2) этилметаноат
3) диизопропиловый эфир
4) хлорметан
5) метан
Решение
Ответ: 14
Задание №20
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) ацетальдегид
2) дивинил
3) этилхлорид
4) этиленгликоль
5) метилацетат
Решение
Ответ: 45
[adsp-pro-3]
Задание №21
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этилат натрия
2) этиламин
3) изопрен
4) этан
5) уксусную кислоту
Решение
Ответ: 34
Задание №22
Из предложенного перечня веществ выберите два таких, которые нельзя получить из этанола в одну стадию:
1) этановая кислота
2) ацетон
3) диэтиловый эфир
4) бутадиен-1,3
5) этан
Решение
Ответ: 25
Задание №23
Из предложенного перечня веществ выберите два таких, которые нельзя получить из пропанола-2 в одну стадию:
1) этилпропаноат
2) изопропилацетат
3) пропен
4) пропановую кислоту
5) диизопропиловый эфир
Решение
Ответ: 14
Задание №24
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить пропанол-2 в одну стадию:
1) гидратация пропена
2) взаимодействие 1-хлорпропана с водным раствором щелочи
3) гидрирование пропанона
4) гидролиз изопропилацетата
5) взаимодействие 1-хлорпропана со спиртовым раствором щелочи
Решение
Ответ: 25
Задание №25
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить этанол в одну стадию:
1) гидролиз метиформиата
2) гидрирование этаналя
3) щелочной гидролиз метилацетата
4) гидролиз этилата калия
5) гидратация этилена
Решение
Ответ: 13
Задание №26
Из предложенного перечня реакций выберите две таких, с помощью которых нельзя получить пропанол-2 в одну стадию:
1) гидратация пропина
2) гидролиз изопропилпропионата
3) гидрирование пропена
4) щелочной гидролиз изопропилформиата
5) гидратация пропена
Решение
Ответ: 13
Задание №27
Из предложенного перечня выберите две реакции, в которые может вступать бутанол-1:
1) внутримолекулярная дегидратация
2) гидрирование
3) взаимодействие со щелочами
4) этерификация
5) гидролиз
Решение
Ответ: 14
Задание №28
Из предложенного перечня реакций, выберите две таких, в которые не может вступать бутанол-1:
1) межмолекулярная дегидратация
2) окисление
3) этерификация
4) гидрирование
5) гидролиз
Решение
Ответ: 45
Задание №29
Из предложенного перечня веществ выберите два таких, из которых нельзя получить при дегидрировании кетон:
1) бутанол-2
2) пропанол-2
3) бутанол -1
4) о-крезол.
5) циклогексанол
Решение
Ответ: 34
Задание №30
Из предложенного перечня веществ выберите два таких, из которых можно получить при окислении кетон:
1) бутанол-2
2) пропанол-1
3) толуол
4) бутанол-1
5) 3-метилпентанол-2
Решение
Ответ: 15
[adsp-pro-3]
Задание №31
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) толуол
2) кумол
3) фенол
4) пентанол
5) метанол
Решение
Ответ: 45
Задание №32
Из предложенного перечня веществ выберите два таких, которые не являются спиртами:
1) глицерин
2) кумол
3) крезол
4) пентанол-2
5) этиленгликоль
Решение
Ответ: 23
Задание №33
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) бутанол
2) изопропилбензол
3) гидроксибензол
4) о-ксилол
5) циклогексанол
Решение
Ответ: 15
Задание №34
Из предложенного перечня веществ выберите два таких, которые являются спиртами:
1) пропаналь
2) фенилметанол
3) гидроксибензол
4) кумол
5) изопропанол
Решение
Ответ: 25
Задание №35
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи С―О в молекуле спирта:
1) C2H5OH+ CH3OH → C2H5OCH3 + H2O
2) 2C2H5OH + 2Na → 2C2H5ONa + H2
3) CH3OH + CH3COOH ⇆ CH3COOCH3+H2O
4) CH3OH+HCl → CH3Cl+H2O
5) HO-CH2-CH2-OH + 2K → KO-CH2-CH2-OK + H2
Решение
Ответ: 14
Задание №36
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи С―О в молекуле спирта:
1) HO-CH2-CH2-OH + 2K → KO-CH2-CH2-OK + H2
2) 2C2H5OH + 2Na → 2C2H5ONa + H2
3) CH3OH + CH3COOH ⇆ CH3COOCH3 + H2O
4) 2CH3OH → CH3OCH3 + H2O
5) CH3OH + HBr → CH3Br + H2O
Решение
Ответ: 45
Задание №37
Из предложенного перечня реакций, характеризующих свойства спиртов, выберите две таких, которые сопровождаются разрывом связи O―H в молекуле спирта:
1) CH3OH + HCl → CH3Cl + H2O
2) CH3OH + CH3COOH ⇆ CH3COOCH3 + H2O
3) C2H5OH → CH2=CH2 + H2O
4) C2H5OH + CuO → CH3CHO + H2O + Cu
5) HO-CH2-CH2-OH + 2HCl → Cl-CH2-CH2-Cl + H2O
Решение
Ответ: 24
Задание №38
Из предложенного перечня реактивов, выберите два таких, с помощью которых можно обнаружить этанол
1) хлороводород
2) оксид меди (II)
3) гидроксид меди (II)
4) метанол
5) калий
Решение
Ответ: 25
Задание №39
Из предложенного перечня веществ, выберите два таких, которые являются одноатомными спиртами.
1) глицерин
2) бензиловый спирт
3) этиленгликоль
4) метанол
5) сорбит
Решение
Ответ: 24
Задание №40
Из предложенного перечня веществ, выберите два таких, с которыми этанол вступает в реакцию этерификации.
- 1. CH3OH
- 2. CH3CHO
- 3. HOCH2CH2OH
- 4. CH3COOH
- 5. H2SO4
Решение
Ответ: 45
[adsp-pro-3]
Задание №41
Из предложенного перечня веществ, выберите два таких, которые могут образоваться в результате взаимодействия этанола с концентрированной серной кислотой
1) этилен
2) этаналь
3) диэтиловый эфир
4) этан
5) этановая кислота
Решение
Ответ: 13
Задание №42
Из предложенного перечня веществ, выберите два таких, которые могут образоваться в результате взаимодействия пропанола-2 с концентрированной серной кислотой.
1) пропадиен
2) пропаналь
3) дипропиловый эфир
4) пропен
5) диизопропиловый эфир
Решение
Ответ: 45
Задание №43
Из предложенного перечня веществ, выберите два таких, которые при взаимодействии с этанолом образуют хлорэтан
1) хлорид натрия
2) хлорид меди (II)
3) хлорид фосфора (V)
4) хлорид фосфора (III)
5) хлорметан
Решение
Ответ: 34
Задание №44
Из предложенного перечня веществ, выберите два таких, которые при взаимодействии с этанолом образуют хлорэтан
- 1. SOCl2
- 2. FeCl3
- 3. C2H5Cl
- 4. Cu[(NH3)2]Cl
- 5. HCl
Решение
Ответ: 15
Задание №45
Из предложенного перечня формул, выберите две, которые соответствуют формуле предельного одноатомного спирта
- 1. СnH2n+2O
- 2. СnH2nO
- 3. СnH2n+2O2
- 4. СnH2n+1OH
- 5. СnH2nO2
Решение
Ответ: 14
Задание №46
Из предложенного перечня веществ выберите два таких, с которыми реагирует натрий:
1) этен
2) этин
3) этанол
4) толуол
5) этан
Решение
Ответ: 23
Задание №47
Из предложенного перечня веществ выберите два таких, с которыми при определенных условиях реагирует натрий:
1) изопрен
2) ксилол
3) бензол
4) пропанол-2
5) циклогексанол
Решение
Ответ: 45
Из предложенного перечня классов органических соединений, выберите два таких, которые образуются в реакциях дегидратации спиртов.
1) алкены
2) сложные эфиры
3) простые эфиры
4) альдегиды
5) кетоны
Решение
Ответ: 13
Задание №49
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию этерификации с карбоновыми кислотами
1) фенол
2) бензиловый спирт
3) этаналь
4) пентанол
5) м-крезол
Решение
Ответ: 24
Задание №50
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с пропанолом
- 1. HCOOH
- 2. HBr
- 3. Cu(OH)2
- 4. С2Н4
- 5. Br2(р-р)
Решение
Ответ: 12
[adsp-pro-3]
Задание №51
Из предложенного перечня реакций выберите все такие, в которые могут вступать предельные одноатомные спирты:
1) дегидрирование
2) нейтрализации
3) этерификация
4) окисление
5) поликонденсация
Решение
Ответ: 134
Задание №52
Из предложенного перечня реакций, выберите две таких, в которые могут вступать предельные одноатомные спирты:
1) нейтрализации
2) дегидрирование
3) полимеризации
4) дегидратация
5) гидрирование
Решение
Ответ: 24
Задание №53
Из предложенного перечня реакций, выберите две таких, которые характерны для предельных одноатомных спиртов:
1) нейтрализации
2) дегидрирование
3) гидратация
4) дегидратация
5) поликонденсация
Решение
Ответ: 24
Задание №54
Из предложенного перечня соединений, выберите два таких, которые способны вступать в реакцию внутримолекулярной дегидратации:
1) метанол
2) циклогексанол
3) фенол
4) стирол
5) пропанол-2
Решение
Ответ: 25
Задание №55
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с циклогексанолом:
- 1. CuO
- 2. NaOH
- 3. Br2(р-р)
- 4. HCl
- 5. Cu(OH)2
Решение
Ответ: 14
Задание №56
Из предложенного перечня реагентов выберите такие, которые вступают в реакцию с циклогексанолом:
- 1. H2
- 2. K
- 3. Cu
- 4. KOH
- 5. K2Cr2O7, H2SO4
Решение
Ответ: 25
Задание №57
Из предложенного перечня веществ выберите два таких, которые вступают в реакцию с циклогексанолом:
- 1. H2O
- 2. СН4
- 3. СН3СООН
- 4. СН3ОН
- 5. [Аg(NH3)2]OH
Решение
Ответ: 34
[adsp-pro-3]
Спирты. Задания на установление соответствия.
Задание №1
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) этен 2) пропен 3) бутен-1 4) бутен-2 |
1) пропанол-1 2) этаналь 3) этанол 4) пропанол-2 5) бутанол-1 6) бутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3466
Задание №2
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) 2,3-диметилбутен-1 2) 2,3-диметилбутен-2 3) 2-метилбутен-1 4) 3,3-диметилбутен-1 |
1) 2,3-диметилбутанол-2 2) 2,2-диметилбутанол-2 3) 2-метилбутанол-1 4) 2,2-диметилбутанол-3 5) 2-метилбутанол-2 6) 3,3-диметилбутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1156
Задание №3
Установите соответствие между названием алкена и основным продуктом его взаимодействия с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКЕН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) 3-метилпентен-1 2) 2-метилбутен-1 3) пентен-1 4) 3,3-диметилбутен-1 |
1) 3-метилпентанол-2 2) 2-метилбутанол-2 3) пентанол-1 4) пентанол-2 5) 2,2-диметилбутанол-3 6) 3,3-диметилбутанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1246
Задание №4
Установите соответствие между назвванием спирта и продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
|
А) пропанол-2 Б) пропанол-1 В) бутанол-1 Г) этанол |
1) бутен-1 2) пропен 3) этилен 4) этан 5) бутен-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2213
Задание №5
Установите соответствие между названием спирта и возможным продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
|
А) пропанол-2 Б) пропанол-1 В) бутанол-1 Г) бутанол-2 |
1) бутен-2 2) пропан 3) бутен-1 4) пропен 5) бутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4431
[adsp-pro-3]
Задание №6
Установите соответствие между названием спирта и основным продуктом его внутримолекулярной дегидратации: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПИРТ | ПРОДУКТ ДЕГИДРАТАЦИИ |
|
А) 2-метилпропанол-2 Б) 2,4-диметилпентанол-3 В) 3-метилбутанол-2 Г) 2-метилбутанол-2 |
1) 2,4-диметилпентен-3 2) 3-метилбутен-2 3) 2-метилпропен 4) 2,4-диметилпентен-2 5) 2-метилбутен-2 6) 2,4-диметилпентен-1 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3455
Задание №7
Установите соответствие между схемой реакции и возможным органическим продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
А) CH3OH Б) CH3OH + CuO В) C2H5OH Г) C2H5OH |
1) ацетальдегид 2) метаналь 3) диэтиловый эфир 4) углекислый газ 5) диметиловый эфир 6) этан 7) метилэтиловый эфир |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5213
Задание №8
Установите соответствие между исходными веществами и возможным органическим продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3-CH(OH)-CH3 Б) CH3-CH2-CH2-OH В) CH3-CH2-CH(OH)-CH3 Г) CH3-CH2-CH(OH)-CH3 |
1) пропен 2) бутен-2 3) диизопропиловый эфир 4) бутен-1 5) дипропиловый эфир 6) бутанон |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1526
Задание №9
Установите соответствие между реагирующими веществами и возможным органическим продуктом реакции между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) C2H5OH + HCl → Б) CH3-CH2-CH2-OH + HCl → В) C2H5OH + PCl5 → Г) CH3OH+HCOOH |
1) метилацетат 2) метилформиат 3) хлорметан 4) хлорэтан 5) 2-хлорпропан 6) 1-хлорпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4642
Задание №10
Установите соответствие парой веществ и органическим продуктом, образующимся при действии на их смесь концентрированной серной кислоты при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) C2H5OH + CH3COOH Б) HCOOH + CH3-CH(OH)-CH3 В) СH3COOH + CH3OH Г) C2H5OH + С2H5COOH |
1) метилэтаноат 2) этилацетат 3) метилпропионат 4) изопропилформиат 5) этилпропионат 6) пропилацетат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2415
[adsp-pro-3]
Задание №11
Установите соответствие между формулой сложного эфира и одним из продуктов его кислотного гидролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| СЛОЖНЫЙ ЭФИР | ПРОДУКТ ГИДРОЛИЗА |
|
А) СH3COOCH(CH3)2 Б) С2H5COOCH3 В) С2H5COOC2H5 Г) СH3COOCH2CH2CH3 |
1) бутановая кислота 2) пропанол-1 3) метанол 4) этанол 5) метановая кислота 6) пропанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6342
Задание №12
Установите соответствие между исходными веществами и органическим продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) C2H5OH + HСl → Б) C2H5OH + K → В) CH3OH + KOH → Г) C2H5OH + SOCl2 → |
1) хлорэтан 2) 1,1-дихлорэтан 3) этилат калия 4) этаноат калия 5) метилат калия 6) вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1361
Задание №13
Установите соответствие между исходными веществами и углеродсодержащим продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | УГЛЕРОДСОДЕРЖАЩИЙ ПРОДУКТ |
|
А) CH3OH + KMnO4 + H2SO4 Б) C2H5OH + KMnO4 + H2SO4 В) C2H5OH + KMnO4 + KOH Г) CH3-CH2-CH2-OH + KMnO4 + H2SO4 |
1) метаналь 2) метановая кислота 3) углекислый газ 4) уксусная кислота 5) ацетат калия 6) пропановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3456
Задание №14
Установите соответствие между названием спирта и продуктом, который образуется при окислении вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) пропанол-2 Б) метанол В) циклогексанол Г) этанол |
1) пропаналь 2) метаналь 3) ацетон 4) ацетальдегид 5) циклогексен 6) циклогексанон 7) углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3264
Задание №15
Установите соответствие между названием спирта и продуктом, который образуется при его окислении оксидом меди (II) при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СПИРТА | ПРОДУКТ ОКИСЛЕНИЯ |
|
А) циклогексанол Б) бензиловый спирт В) пропанол-2 Г) пропанол-1 |
1) циклогексан 2) бензойная кислота 3) пропанон 4) пропаналь 5) циклогексанон 6) бензальдегид |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5634
[adsp-pro-3]
Задание №16
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) циклогексанол + HCl Б) бензиловый спирт + HCl В) циклогексанол + Na Г) бензиловый спирт + CH3OH |
1) циклогексанолят натрия 2) бензилат натрия 3) бензоат натрия 4) метилбензиловый эфир 5) хлорциклогексан 6) хлорфенилметан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5614
Задание №17
Установите соответствие между схемой реакции и основным органическим продуктом, который образуется в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) циклогексанол + KOH → Б) бензиловый спирт + Na → В) циклогексанол Г) фенилметанол + CH3COOH → |
1) циклогексен 2) бензоат натрия 3) бензилат натрия 4) бензилацетат 5) циклогексанон 6) исходные вещества не взаимодействуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6314
Задание №18
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) этилат натрия и вода Б) метилат натрия и хлорэтан В) метилат натрия и вода Г) метилат натрия и соляная кислота |
1) хлорметан 2) этанол 3) метилэтиловый эфир 4) диметиловый эфир 5) диэтиловый эфир 6) метанол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2366
Задание №19
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) метанол и этанол Б) метанол и аммиак В) пропанол-1 и муравьиная кислота Г) метанол и оксид меди(II) |
1) пропилформиат 2) метилацетат 3) метилэтиловый эфир 4) метиламин 5) метилпропионат 6) метаналь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3416
Задание №20
Установите соответствие между схемой реакции и продуктом, образующимся в результате ее протекания: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ |
|
А) этанол Б) C2H5OH+ HNO3 В) C2H5OH + SOCl2 Г) C2H5OH + HCl |
1) CH3CH2Cl 2) CH3CH2NO2 3) CH3CH2ONO2 4) ClCH2CH2Cl 5) CH2=CH2 6) CH2=CH-CH=CH2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 6311
[adsp-pro-3]
Цепочки на спирты.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетальдегид X1
X2
X3
X1
X4
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
ацетон X1
X2
X3
X1
X4
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
глюкоза этанол
этаналь
этанол
этилен
этиленгликоль
Решение
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
н-бутиловый спирт бутен-1
бутанол-2
2-бромбутан
бутен-2
уксусная кислота
изопропилацетат
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
синтез-газ CH4O
X1
X2
X3
X4
C4H10O
Решение
[adsp-pro-3]
Задание №6
Навеску неизвестного соединения массой 4,4 г сожгли в избытке кислорода, в результате чего в качестве продуктов сгорания образовались только углекислый газ объемом 5,6 л и вода массой 5,4 г. Определите молекулярную формулу данного соединения и его структуру, если известно, что его молекула содержит четвертичный атом углерода.
Решение
n(CO2) = V(CO2)/Vm = 5,6/22,4 = 0,25 моль, следовательно, n(C) = n(CO2) = 0,25 моль,
тогда, m(C) = n(C)⋅M(C) = 0,25⋅12 = 3 г,
n(H2O) = m(H2O)/M(H2O) = 5,4/18 = 0,3 моль, следовательно, n(H) = 2⋅n(H2O) = 2⋅0,3 = 0,6 моль,
тогда, m(H) = n(H)⋅M(H) = 0,6⋅1 = 0,6 г,
m(O) = m(в-ва) — m(C) — m(H) = 4,4 – 3 – 0,6 = 0,8 г,
n(O) = m(O)/M(O) = 0,8/16 = 0,05 моль,
n(С):n(H):n(O) = 0,25:0,6:0,05 = 5:12:1
Таким образом, простейшая формула искомого соединения C5H12O.
Предположим, что простейшая формула совпадает с истинной. Тогда, искомым веществом может являться какой-либо предельный нециклический одноатомный спирт. В условии сказано, что искомое вещество содержит четвертичный углеродный атом. Единственным подходящим веществом в таком случае является 2,2-диметилпропанол-1, структурная формула которого:
Задание №7
При сжигании 5,8 г неизвестного вещества в качестве продуктов сгорания образовались только вода и углекислый газ, масса которого составила 13,2 г. Определите молекулярную формулу вещества и его структуру, если известно, что оно содержит кислород с массовой долей 27,59%. При этом само вещество может быть получено в одну стадию из циклогексена.
Решение
n(CO2) = m(CO2)/M(CO2) = 13,2/44 = 0,3 моль, следовательно, n(C) = n(CO2) = 0,3 моль,
m(C) = n(C) ·M(C) = 0,3·12 = 3,6 г,
m(O) = m(в-ва)·w(O) = 5,8·0,2759 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
m(H) = m(в-ва) – m(O) – m(C) = 5,8 – 1,6 – 3,6 = 0,6 г, следовательно,
n(H) = m(H)/M(H) = 0,6/1 = 0,6 моль,
n(С):n(H):n(O) = 0,3:0,6:0,1 = 3:6:1
Таким образом, простейшая формула искомого соединения C3H6O.
Соединений с такой истинной молекулярной формулой, которые могли бы быть получены в одну стадию из циклогексена не существует. Поэтому попробуем удвоить простейшую формулу. Получаем C6H12O2. Искомым соединением может быть циклогександиол-1,2 со структурной формулой:
Задание №8
Навеску неизвестного соединения массой 7,4 г сожгли в избытке кислорода. В результате сгорания данной порции вещества в качестве продуктов сгорания образовались только 8,96 л углекислого газа и 11,2 л паров воды (в пересчете на н.у.). Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно реагирует с щелочными металлами, а также является устойчивым к окислению раствором перманганата калия.
Решение
n(CO2) = V(CO2)/Vm = 8,96/22,4 = 0,4 моль, следовательно, n(C) = n(CO2) = 0,4 моль,
тогда, m(C) = n(C)·M(C) = 0,4·12 = 4,8 г,
n(H2O) = V(H2O)/Vm = 11,2/22,4 = 0,5 моль, следовательно, n(H) = 2n(H2O) = 2·0,5 = 1 моль,
тогда, m(H) = n(H)·M(H) = 1·1 = 1 г,
m(O) = m(в-ва) — m(H) — m(С) = 7,4 – 1 – 4,8 = 1,6 г,
n(O) = m(O)/M(O) = 1,6/16 = 0,1 моль,
n(C):n(H):n(O) = 0,4:1:0,1 = 4:10:1
Таким образом, простейшая формула искомого органического вещества C4H10O.
Данная формула, очевидно, является также и истинной молекулярной, поскольку ее удвоение, утроение и т.д. приводит к невозможному для органического вещества составу молекулы.
Исходя из того, что искомое соединение является устойчивым к окислению раствором перманганата калия, можно заключить, что им является третбутиловый спирт:
[adsp-pro-10]
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 818 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 …
Добавить в вариант
Из предложенного перечня выберите все вещества, которые вступают в реакцию с водородом.
1) олеиновая кислота
2) стеариновая кислота
3) ацетон
4) изопрен
5) изопропиловый спирт
Запишите номера выбранных ответов в порядке возрастания.
Источник: ЕГЭ по химии 2022. Досрочная волна
Задания Д19 № 480
И для этиленгликоля, и для глицерина характерна(-о):
1) sp-гибридизация атомов углерода
2) хорошая растворимость в воде
3) образование водородных связей с молекулами воды
4) взаимодействие с гидроксидом меди (II)
5) обесцвечивание бромной воды
6) взаимодействие с водородом
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и
Б) пропанол-2 и
В) пропанол-1 и
Г) пропанол-1
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропилнатрий
2) пропен
3) пропаналь
4) пропанон
5) пропилат натрия
6) пропановая кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) диэтиловый эфир
2) метилацетат
3) метилат калия
4) метан
5) диметиловый эфир
6) метаналь
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) уксусная кислота и оксид меди (II)
Б) этанол и оксид меди (II)
В) пропанол-1 и перманганат калия (сернокислый раствор)
Г) пропанол-2 и перманганат калия (сернокислый раствор)
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Установите соответствие между схемой реакции и органическим веществом — продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ РЕАКЦИИ
1) пропаналь
2) ацетат меди(II)
3) ацетон
4) пропионат меди(II)
5) пропионовая кислота
6) глицерат меди(II)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 1
И для этанола, и для глицерина характерна(-о):
1) sp2-гибридизация атомов углерода
2) хорошая растворимость в воде
3) наличие водородных связей между молекулами
4) реакция горения
5) взаимодействие с хлоридом натрия
6) взаимодействие с гидроксидом меди (II)
Легче всего из перечисленных гидроксильных соединений с соляной кислотой реагирует
1) фенол
2) этанол
3) пропанол-2
4) 2-метилпропанол-2
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и оксид меди (II)
Б) пропанол-2 и оксид меди (II)
В) пропанол-2 и муравьиная кислота
Г) пропин и вода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропаналь
2) ацетон
3) пропен
4) изопропанол
5) пропилацетат
6) изопропилформиат
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и натрий
Б) этанол и бромоводород
В) этан и бром
Г) этанол и метанол
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этилнатрий
2) этилат натрия
3) бромэтан
4) бромэтен
5) метилэтанол
6) метилэтиловый эфир
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и оксид меди (II)
Б) уксусная кислота и оксид меди (II)
В) этанол и натрий
Г) этанол и гидрид натрия
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди (I)
2) ацетат меди (II)
3) этилат натрия
4) этилнатрий
5) этаналь
6) ацетон
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и концентрированная серная кислота
Б) этанол и оксид меди(II)
В) этанол и муравьиная кислота
Г) этанол и соляная кислота
ОРГАНИЧЕСКИЙ ПРОДУКТ
РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Из предложенного перечня выберите все вещества, с которыми реагирует муравьиная кислота.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Установите соответствие между веществом и продуктом реакции этого вещества с бромоводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) изопропанол
Б) этиленгликоль
В) этилат натрия
Г) акриловая кислота
ПРОДУКТ РЕАКЦИИ
1) бета-бромпропановая кислота
2) 2,2-дибромэтан
3) 1,2-дибромэтан
4) альфа-бромпропановая кислота
5) 2-бромпропан
6) этанол
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Верны ли следующие суждения о свойствах метанола?
А Между молекулами метанола образуются водородные связи»
Б. В реакции метанола с натрием выделяется водород.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Для глицерина характерна(-о):
1) sp3-гибридизация атомов углерода
2) твёрдое агрегатное состояние (при стандартных условиях)
3) реакция с азотной кислотой
4) реакция изомеризации
5) взаимодействие с гидроксидом меди (II)
6) взаимодействие с диэтиловым эфиром
И для этиленгликоля, и для глицерина характерна(-о):
1) sp-гибридизация атомов углерода
2) хорошая растворимость в воде
3) наличие водородных связей между молекулами
4) взаимодействие с натрием
5) взаимодействие с бромной водой
6) взаимодействие с водородом
Для глицерина характерно(-а)
1) взаимодействие с уксусной кислотой
2) твёрдое агрегатное состояние
3) плохая растворимость в воде
4) взаимодействие с гидроксидом меди(II)
5) обесцвечивание бромной воды
6) хорошая растворимость в воде
Этандиол-1,2 может реагировать с
1) гидроксидом меди(II)
2) оксидом железа(II)
3) хлороводородом
4) водородом
5) калием
6) гидроксидом алюминия
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2
Этандиол реагирует с
1) уксусной кислотой
2) гидроксидом железа(III)
3) гидроксидом меди(II)
4) сульфатом натрия
5) натрием
6) хлоридом натрия
Всего: 818 1–20 | 21–40 | 41–60 | 61–80 | 81–100 | 101–120 …
СПИРТЫ- это соединения,
содержащие помимо углеводородной цепи, одну или несколько гидроксильных групп
ОН.
Классификация спиртов.
1.По числу гидроксильных групп:
·
одноатомные (одна
группа -ОН).
Общая формула CnH2n+1–OH
или CnH2n+2O.
·
многоатомные (две и более
групп -ОН).
Общая
формула CnH2n+2Om.
Современное название многоатомных спиртов — полиолы
(диолы, триолы и т.д).
Двухатомный спирт – этиленгликоль
(этандиол) СH2–CH2
│ │
ОН ОН
Трехатомный
спирт – глицерин
(пропантриол-1,2,3) СH2–СН–CH2
│ │ │
ОН ОН ОН
2. В зависимости от того, с каким атомом
углерода (первичным, вторичным или третичным)
связана гидроксигруппа:
3. По строению радикалов, связанных с атомом
кислорода:
·
предельные, или алканолы (например, СH3CH2–OH)
·
непредельные, или алкенолы (CH2=CH–CH2–OH)
·
ароматические (C6H5CH2–OH).
·
Фенолы (C6H5–OH).
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ
ГРУППЫ.
Связи О–Н и С–О – полярные
ковалентные. Это следует из различий в электроотрицательности
кислорода (ЭО = 3,5), водорода (ЭО = 2,1) и углерода (ЭО =
2,4).
Электронная плотность обеих связей
смещена к более электроотрицательному атому кислорода:
Разрыв таких связей происходит преимущественно
по ионному механизму.
Атому кислорода в спиртах свойственна
sp3-гибридизация. В образовании его связей с
атомами C и H участвуют две sp3-гибридные орбитали, валентный угол
C–О–H близок к тетраэдрическому.
В фенолах одна из электронных пар
кислорода участвует в сопряжении с π–системой бензольного кольца:
ВОДОРОДНЫЕ СВЯЗИ И
ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Следствием полярности связи О–Н и наличия
неподеленных пар электронов на атоме кислорода является способность
гидроксисоединений к образованию водородных связей:
Ассоциация
молекул ROH
Это
объясняет, почему даже низшие спирты — жидкости с относительно высокой температурой
кипения (t кип. метанола +64,5оС). При переходе
от одноатомных к многоатомным спиртам или фенолам температуры кипения и
плавления резко возрастают.
Образование
водородных связей с молекулами воды способствует растворимости гидроксисоединений
в воде:
Гидратация
молекул ROH
Метанол, этанол, пропанол, изопропанол,
этиленгликоль и глицерин смешиваются с водой в любых соотношениях.
Растворимость фенола в воде ограничена. C увеличением
молярной массы растворимость спиртов в воде уменьшается.
Предельные одноатомные
спирты
Общая формула – СnH2n+1OH или СnH2n+2O n>1
НОМЕНКЛАТУРА
В названии появляется суффикс: -«ОЛ» и номер атома углерода, к которому он
присоединен. Нумерация ведется от ближайшего к ОН-группе конца цепи.
Приведенные выше
соединения называют: метиловый спирт, этиловый спирт, н—пропило-вый
спирт, изопропиловый спирт.
Метиловый спирт (метанол) CH3-OH
Этиловый спирт (этанол) CH3CH2-OH
В названиях многоатомных
спиртов (полиолов) положение и число гидроксильных групп
указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол
(три ОН-группы) и т.д. Например:
ИЗОМЕРИЯ СПИРТОВ.
Для спиртов характерна структурная
изомерия:
*изомерия положения ОН-группы (начиная с С3);
*углеродного скелета (начиная с С4);
например, формуле C4H9OH
соответствует 4 структурных изомера:
*межклассовая изомерия с простыми эфирами
(например, этиловый спирт СН3CH2–OH
и диметиловый эфир CH3–O–CH3).
Получение.
|
1. Щелочной гидролиз |
CH3–Br + NaOH(водн.) |
|
2. Гидратация алкенов: присоединение |
CH2=CH2 + H2O –(H+)àCH3CH2OH CH3–CH=CH2 + H2O–(H+)àCH3CHCH3 ОН CH3–C=CH2 + H2O –(H+)->CH3 –C–СH3 ô ô СН3 |
|
3.Восстановление карбонильных соединений. |
При гидрировании альдегидов получаются первичные СН3-С=О + Н2 -(t,kat)à ô этанол Н При гидрировании кетонов образуются вторичные СН3-С=О + Н2 -(t,kat)à ô ô СН3 |
|
4. Гидролиз сложных эфиров. |
CH3-C=O + H2O –(H2SO4,t)à │ OC2H5 à этанол |
|
5. Получение метанола из синтез-газа. |
1. Конверсия природного газа в синтез-газ: 2. Каталитический синтез метанола из (CO + H2), обогащенный Газ на выходе из реактора содержит 3-5% |
|
6. Получение этанола спиртовым брожением. |
Спиртовое брожение глюкозы. С6Н12О6 |
ХИМИЧЕСКИЕ СВОЙСТВА.
В химических реакциях гидроксисоединений возможно
разрушение одной из двух связей:
- С–ОН с замещением или
отщеплением ОН-группы - О–Н с замещением
водорода.
|
1.Одноатомные |
Реакционная CH3OH 2R–OH + 2Na à 2 R—ONa + H2 этилат калия Алкоголяты под действием воды полностью C2H5OК + H2O àC2H5OH + КOH Со щелочами одноатомные спирты НЕ |
|
2.Окисление одноатомных спиртов. |
1) Горение: 2CH3OH + 3O2 à2CO2 + 4H2O 2) Окисление первичных спиртов до альдегидов: Реагенты – CuO (to), O2 (Cu, to), а также дегидрирование при нагревании над медной сеткой. СН3—СН2—ОН +СuO –(to)à CH3-C=O + Cu + H2O этанол ô этаналь 2) Дегидрирование: СН3-СН2-СН2-ОН 3) Окисление подкисленным раствором СН3-СН2-ОН + KMnO4 + H2SO4 -> CH3—COOH + MnSO4 + K2SO4 +H2O При окислении метанола образуется 5СН3ОН 4) При окислении вторичных спиртов |
|
3. Реакции замещения ОН на галоген: происходит в реакции с галогеноводородами в |
Реакционная способность одноатомных спиртов |
|
4. Образование сложных эфиров. |
Спирты вступают в реакции с карбоновыми |
|
5. Реакции дегидратации спиртов. |
|
|
Внутримолекулярная дегидратация: образуются алкены. |
Внутримолекулярная дегидратация спиртов с Основной продукт – бутен-2. Правило Зайцева – водород отщепляется от менее |
|
Межмолекулярная дегидратация: образуются простые эфиры. |
При межмолекулярной дегидратации спиртов |
МНОГОАТОМНЫЕ СПИРТЫ.
ПОЛУЧЕНИЕ.
|
1.Окисление алкенов холодным водным раствором |
R-CH=CH2 + KMnO4 + H2Oà R- CH-CH2 +MnO2 алкен OH OH |
|
2. Замещение галогенов на гидроксогруппу: |
СН2— СН │ │ │ (вод.р—р) │ │ │ Cl Сl |
|
3.Восстановление поликарбонильных соединений: |
O=CH – CH =O + H2 –(t,kat)à CH2-CH2 диальдегид │ │ OH OH |
ХИМИЧЕСКИЕ СВОЙСТВА.
|
1.Кислотные свойства. Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект |
Образуют соли не только в реакциях с активными HO–CH2-CH2–OH + 2Na à CH2-CH2 +H2 │ │ ONa ONa HO–CH2-CH2–OH +2NaOH ⇄ CH2-CH2 │ │ ONa ONa |
|
2.Взаимодействуют с раствором гидроксида |
— ярко-синий раствор |
|
3.Образование сложных эфиров азотной кислоты: |
|
|
4. Замещение ОН на галоген: также, как и одноатомные спирты, реагируют с галогеноводородами. |
HO–CH2-CH2–OH + 2HBr à CH2-CH2 + 2H2O │ │ Br Br Можно заместить 1 или 2 группы ОН. |
|
5. Окисление. |
CH2-CH2 –(t,Сu)à O=CH–CH=O + H2 │ │ диальдегид — OH OH |
ФЕНОЛЫ
Фенолы –
гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с
бензольным ядром.
Общая формула – СnH2n-7OH n>6 (для фенолов с одной ОН-группой)

зависимости от числа ОН-групп различают одноатомные фенолы (например,
вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных
фенолов наиболее распространены двухатомные:
Изомерия
1. Фенолам свойственна структурная изомерия
(изомерия положения гидроксигруппы).
2. Фенолы изомерны ароматическим спиртам
C6H4(СН3)OН – крезол и C6H5-СН2—OН бензиловый спирт
ПОЛУЧЕНИЕ.
|
1. Из хлорбензола. |
+ Cl2 –(AlCl3)à C6H5Cl + HCl Хлорбензол обрабатывают избытком щелочи, C6H5Cl + 2NaOH –(t,p)àC6H5ONa + NaCl хлорбензол фенолят натрия Затем фенол выделяют, пропуская углекислый С6H5ONa + CO2 |
|
2. Из кумола. |
1) Алкилирование бензола пропеном: + CH3—CH=CH2 –(H3PO4)à
|
СВОЙСТВА ФЕНОЛОВ.
Фенолы
являются более сильными кислотами, чем спирты и вода, т.к. за счет
участия неподеленной электронной пары кислорода в сопряжении с π-электронной
системой бензольного кольца полярность связи О–Н увеличивается.
Сходство и отличие
фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными
металлами с выделением водорода.
Отличие:
-фенол не
реагирует с галогеноводородами: ОН- группа очень прочно связана с
бензольным кольцом, её нельзя заместить;
-фенол не
вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
-фенол не
вступает в реакции дегидратации.
|
Кислотные свойства |
|
|
1. Как и спирты, реагируют с активными |
2C6H5OH + 2Na ->2C6H5ONa Феноляты легко гидролизуются: C6H5ONa + HСl à C6H5OH + NaCl C6H5ONa +H2О +СО2 à |
|
2. Реагируют с гидроксидами |
C6H5OH + NaOH àC6H5ONa |
|
Реакции фенола по |
|
|
3. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной |
|
|
4. Нитрование. |
|
|
5. Конденсация с альдегидами. С формальдегидом фенол образует фенолоформальдегидные смолы. |
|
|
5. Окисление. Фенолы |
При энергичном окислении фенола хромовой |
|
6. Гидрирование (восстановление) |
C6H5OН +3Н2 циклогексанол |
|
7. Качественная |