Аммиак
Строение молекулы и физические свойства
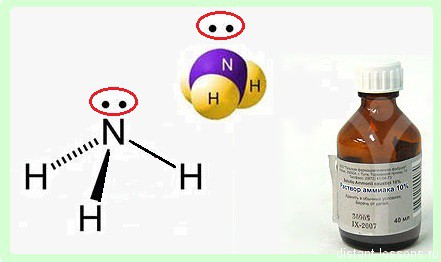
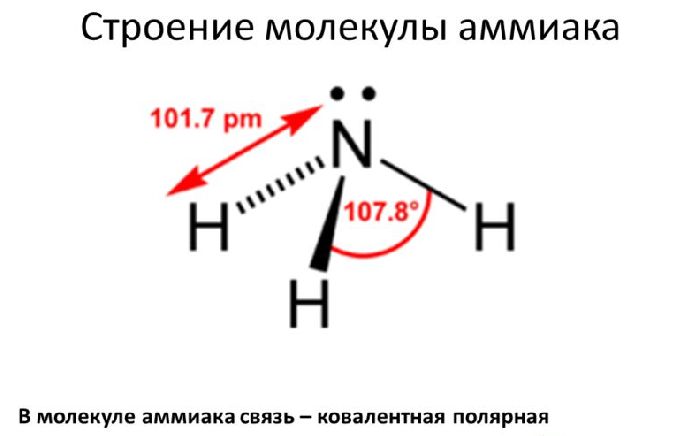
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
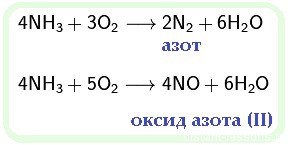
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.

Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
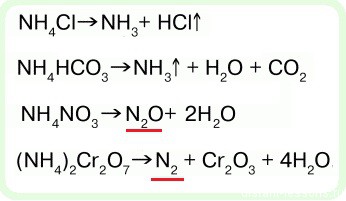
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Задание:
изучите
материал, напишите уравнения реакций по схемам, расставьте коэффиценты.
Аммиак
—
NH3
1. Строение молекулы
— структура треугольной пирамиды;
— атом азота в sp3-гибридизации;
— одна неподеленная электронная пара на атоме азота;
— химическая связь ковалентная полярная, в жидком
состоянии между молекулами водородные связи;
— с.о. на атоме азота = -3.
2.
Физические свойства
Бесцветный
газ с резким запахом («нашатырного спирта»), в 14,5 раз легче воздуха, очень
хорошо растворимый в воде (в 1 V Н2О – 700 V NH3 при
комн. t)
Аммиачная вода — 18,5 – 25%-ный раствор
Нашатырный спирт – 3 – 10%-ный
3. Получение
В
промышленности – синтез из простых веществ (обратимая,
экзотермическая, каталитическая)
Азот +
водород ®
Сырье — азотоводородная
смесь
(азот – фракционная перегонка жидкого воздуха, водород – конверсия метана(из
природного газа)) подвергают тщательной очистке
Условия:р=25*106
Па (300 атм.), Т=450-500 0С, кат. – губчатое Fe, Pt.
Давление
азотоводородной смеси создается при помощи турбокомпрессора. Реакцию проводят в
колене синтеза. Теплоту, выделяющуюся при реакции используют для прогревания
смеси азота и водорода (принцип теплообмена).
Образующиеся NH3 и
непрореагировавшие газы поступают в холодильник (NH3 сжижается)
=> сепаратор
(отделяется от непрореагировавших газов) ==> склад готовой продукции.
Оставшаяся смесь с
помощью циркуляционного компрессора с новой порцией сырья в колонну синтеза (принцип
циркуляции) (h(NH3) = 95%).
В
лаборатории – нагревание солей аммония со щелочью
Хлорид аммония +
гидроксид кальция ®
Собирают методом
вытеснения воздуха в перевернутый сосуд, доказательство наличия (посинение
влажной индикаторной бумаги, по запаху, «дым без огня»)
4. Химические
свойства
1) с водой
NH3(г) + H2O ↔ NH3
* H2O (р)↔ NH4++ OH–
слабое
основание, среда
раствора – щелочная, изменяет окраску индикаторов
2) с кислотами ® соли аммония (хим.связь образуется по донорно-акцепторному
механизму)
NH3
+ соляная кислота ® NH3 +
серная кислота ®
NH3
+ серная кислота(изб) ® NH3 + СО2
+ Н2О ®
NH3
+ СО2(изб) + Н2О ® NH3
+ фосфорная к-та ®
NH3
+ уксусная кислота ® NH3 +
уксусная к-та ®(при
t)
3) c
кислородом
NH3
+ кислород ®
(сгорание)
NH3
+ кислород ®
(каталитическое окисление, кат Pt)
4)
восстанавливает малоактивные металлы из их оксидов при нагревании
аммиак
+ оксид меди (II) ®
5) с
растворами солей, если образуется ¯
Аммиак
+ вода + сульфат железа (III) ®
Аммиак
+ вода + хлорид хрома (III) ®
6)
комплексообразование (донорно-акцепторн мех-зм)
Сульфат
меди (II) + аммиак ®
Гидроксид
меди (II) + аммиак ®
Нитрат
серебра + аммиак + вода ®
Хлорид
серебра + аммиак ®
6) с
различными окислителями – восстановительные свойства
(чаще до N2)
Аммиак
+ хлор ®
Аммиак
+ пероксид водорода ®
Аммиак
+ перманганат калия ®
7) с
активными металлами ® амиды или нитриды
NH3
+ Na ®
NaNH2 + H2O
NH3
+ Mg®
Mg3N2 + H2O
Амиды и нитриды
легко гидролизуются
NaNH2 + H2O ®
Mg3N2
+ H2O ®

углекислым газом ®
карбамид или мочевина
NH3 + СО2 ® (NH2)2СО
+ H2O
9) с
органическими веществами
+
карбоновые кислоты ®
+
спирты ®
+
галогеналканы ®
+
хлорбензол ®
+
хлоруксусная кислота ®
5. Качественные реакции – образование
белого «дыма» при контакте с газообразным HCl, почернение бумажки,
смоченной раствором Hg2(NO3)2.
6. Применение
Промежуточный продукт при синтезе азотной
кислоты и солей аммония. Применяется в производстве соды,
азотных удобрений (аммиачная селитра – NH4NO3.мочевины (NH2)2СО
и др), красителей, взрывчатых веществ, уротропина, синтетических волокон (нейлона и капрона), в медицине, в быту. Жидкий аммиак в качестве хладагента в промышленных холодильных установках,
в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.
Химические свойства аммиака
01-Мар-2014 | Нет комментариев | Лолита Окольнова
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков.
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи
В больших количествах токсичен для человека.
Химические свойства аммиака
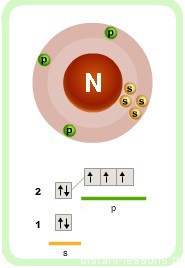
Интересными химическими свойствами молекула аммиака обязана атому азота — p-элемент элемент 2-го периода V группы периодической системы имеет на внешнем энергетическом уровне 5 электронов.
На 3 ковалентных связи с водородом расходуются 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют неподеленную электронную пару.
Именно эта свободная неподеленная пара электронов определяет многие химические свойства аммиака.
- Образование иона аммония:
NH3 + H+ → NH4+ —
— у аммиака есть неподеленная электронная пара, а у иона водорода есть абсолютно свободная орбиталь;
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный «нашатырный спирт» — жидкость с очень характерным запахом
Формулу такого раствора часто записывают вот в таком виде:
NH3 + H2O → NH3•H2O или NH4OH
NH4OH — гидроксид аммония. Т.к. азот притягивает к себе водород из воды, то по химическим свойствам аммиак — слабое основание, т.е. очень слабо диссоциирует на NH4+ (ион аммония) и OH— — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HСl → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
2NH3 + CuSO4 = (NH4)2SO4 + Cu
- к химическим свойствам аммиака относятся и реакции окисления:
2NH3 + 6KMnO4+ 6KOH → 6K2MnO4+N2 + 6H2O
(аммиак окисляется до азота)
В чистом кислороде он сгорает бледно-желтым пламенем:
- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции на аммиак:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
лакмус — становится синим,
фенолфталеин — малиновым,
метиловый-оранжевый — желтым;
- если к пробирке с раствором NH3 (NH3•H2O или NH4OH) поднести палочку, смоченную в концентрированной соляной кислоте HCl – будет выделяться видимый белый дым – образуется хлорид аммония (NH4Cl);
Свойства солей аммония:
- ионная кристаллическая решетка;
- в растворе диссоциируют:
NH4X → NH4+ + X—
- подвергаются гидролизу с образованием кислой среды:
гидролиз по катиону:
NH4Сl + H2O → NH3 ↑+ H2O + HCl (кислая среда)
гидролиз по катиону и аниону:
(NH4)2СO3 + H2O → 2NH3 ↑+ 2H2O + СO2 ↑ (нейтральная среда)
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
- важное химическое свойство солей аммония — разложение при нагревании:
Последняя реакция — разложение бихромата аммония часто используется в заданиях С3 ЕГЭ по химии (химический эксперимент), так что стоит ее выучить.
Химические свойства аммиака обусловлены строением молекулы, т.е. электронной конфигурацией атома азота. Т.к. в заданиях ГИА и ЕГЭ уделяется много внимания как самому аммиаку, так и его соединениям, то эту тему надо знать хорошо.
Обсуждение: «Химические свойства аммиака»
(Правила комментирования)
14. Свойства аммика (NH3)
1. Окисление аммиака:
4NH3 + 3O2 → 2N2
4NH3 + 5O2 → 4NO
2. При взаимодействии аммиака с кислотами образуются соли аммония:
2NH3 + H2SO4 → (NH4)2SO4 сульфат аммония
NH3 + HCl → NH4Cl хлорид аммония
3. Термическое разложение солей аммония:
NH4Cl → NH3

(NH4)3PO4 → H3PO4 + 3NH3
(NH4)2CO3 → 2NH3

NH4HCO3 → NH3

Чтобы поделиться, нажимайте
Азот – элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др.
Шкала степеней окисления у азота:
+5 — N2O5, NO3, NaNO3, AgNO3
+4 — NO2
+3 – N2O3, NO2, HNO2, NaNO2, NF3
+2 — NO
+1 – N2O
0 — N2
-3 — NH3, NH4, NH3 * H2O, NH2Cl, Li3N, Cl3N.
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2. Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.


Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
N2 + 3F2 = 2NF3, N2 + O2 ↔ 2NO
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
N2 + 3H2 ↔ 2NH3 + 92 кДж
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N-3H4N+3O2(T) = N20 + 2H2O (60-70)
NH4Cl(p) + KNO2(p) = N20↑ + KCl +2H2O (100˚C)
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3. Бинарное соединение , степень окисления азота равна – 3. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3] (sp3-гибридизация). Наличие у азота в молекуле NH3 донорской пары электронов на sp3-гибридной орбитали обуславливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4.

Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л H2O при 20˚C); доля в насыщенном растворе равна 34% по массе и = 99% по объему, pH= 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N-3) и окислительные (за счет H+1) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным HCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
2NH3(г) ↔ N2 + 3H2
NH3(г) + H2O ↔ NH3 * H2O (р)↔ NH4++ OH–
NH3(г) + HCl(г) ↔ NH4Cl(г) белый «дым»
4NH3 + 3O2 (воздух) = 2N2 + 6 H2O (сгорание)
4NH3 + 5O2 = 4NO+ 6 H2O (800˚C, кат. Pt/Rh)
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O (500˚C)
2 NH3 + 3Mg = Mg3N2 +3 H2 (600 ˚C )
NH3(г) + CO2(г) + H2O = NH4HCO3 (комнатная температура, давление)
Получение. В лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + CaO):
NH4Cl NH3
Или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак получают из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH3 H2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и H2O, связанные слабой водородной связью NH3N .. HOH. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4 и анион OH). Катион аммония имеет правильно-тетраэндрическое строение (sp3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет N-3) в концентрированном растворе. Вступает в реакцию ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным HCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
в 1 М растворе аммиака содержится в основном гидрат NH3 H2O и лишь 0,4% ионов NH4 OH (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4 OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате.
Уравнения важнейших реакций:
NH3 H2O (конц.) = NH3↑ + H2O (кипячение с NaOH)
NH3 H2O + HCl (разб.) = NH4Cl + H2O
3(NH3 H2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3 NH4Cl
8(NH3 H2O) (конц.) + 3Br2(p) = N2↑ + 6 NH4Br + 8H2O (40-50˚C)
2(NH3 H2O) (конц.) + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
4(NH3 H2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 H2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4H2O
6(NH3 H2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6H2O
Разбавленный раствор аммиака (3-10%-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5 – 25%-ный) – аммиачный раствор (выпускается промышленностью).

4.3
Средняя оценка: 4.3
Всего получено оценок: 856.
4.3
Средняя оценка: 4.3
Всего получено оценок: 856.
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.
Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Уравнение |
|
С кислородом |
Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота |
– 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
|
С галогенами |
Азот, кислота |
2NH3 + 3Br2 → N2 + 6HBr |
|
С водой |
Гидроксид аммония или нашатырный спирт |
NH3 + H2O → NH4OH |
|
С кислотами |
Соли аммония |
– NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
|
С солями |
Замещает металл, образуя новую соль |
2NH3 + CuSO4 → (NH4)2SO4 + Cu |
|
С оксидами металлов |
Восстанавливает металл, образуется азот |
2NH3 + 3CuO → 3Cu + N2 + 3H2O |
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Костя Антонюк
4/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 856.
А какая ваша оценка?