1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
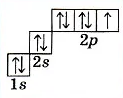
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
Например, электронная конфигурация фтора:
Электронная концигурация хлора:
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s22p5 | … 3s23p5 | … 4s24p5 | … 5s25p5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220оС | –101оС | –7оС | 113,5оС |
| Т кипения | –188оС | –34оС | 58оС | 185оС |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4
Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3
Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO
Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются ионы натрия:
K(–): Na+ +1e → Na0
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза расплава хлорида натрия:
2Na+ + 2Cl− → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH−
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза раствора хлорида натрия:
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например, взаимодействием соляной кислоты с оксидом марганца (IV)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
Бром можно получить окислением ионов Br– сильными окислителями.
Например, бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например, оксид марганца (IV):
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + H2O2 → 2HCl + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например, действием концентрированной серной кислоты на хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
Галогеноводороды получают также прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами, расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют, образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F–
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например, соляная кислота реагирует с карбонатом кальция:
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами. При этом более активные галогены вытесняют менее активные.
Например, бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например: концентрированная соляная кислота окисляется оксидом марганца (IV):
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например, бромоводород окисляется концентрированной серной кислотой:
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
Или с оксидом марганца (IV):
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
Пероксид водорода также окисляет бромоводород до молекулярного брома:
2HBr + H2O2 → Br2 + 2H2O
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
Например, хлор взаимодействует с магнием и кальцием:
Cl2 + Mg → MgCl2
Cl2 + Ca → CaCl2
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например, соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например, при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример: взаимодействие оксида алюминия с соляной кислотой:
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например, при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Например, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
Например, магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
4. Галогениды металлов проявляют восстановительные свойства. Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например, бромид калия окисляется концентрированной серной кислотой:
2KBr + 2H2SO4 (конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
Еще пример: йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
8KI + 5H2SO4 (конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4 (конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака.
Например, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например, хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями.
Например, с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например, хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например, пероксид водорода:
HClO + H2O2 → HCl + H2O + O2
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например, соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Даже угольная кислота вытесняет гипохлориты:
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
2. Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Например, гипохлорит кальция реагирует с растворимыми карбонатами:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
3. При нагревании гипохлориты разлагаются:
Ca(ClO)2 → CaCl2 + O2
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2ClO2 + H2O2 → 2HClO2 + O2
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
2. При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например, из хлората бария под действием серной кислоты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
2. Хлорноватая кислота – сильный окислитель.
Например, хлорноватая кислота окисляет фосфор:
6P + 5HClO3 → 3P2O5 + 5HCl
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример: хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например, из перхлората натрия под действием серной кислоты:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
2. Хлорная кислота – сильный окислитель.
Например, хлорная кислота окисляет углерод:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
3. При нагревании хлорная кислота разлагается:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
KClO4 → KCl + 2O2↑
Еще пример: перхлорат калия окисляет алюминий:
3KClO4 + 8Al → 3KCl + 4Al2O3
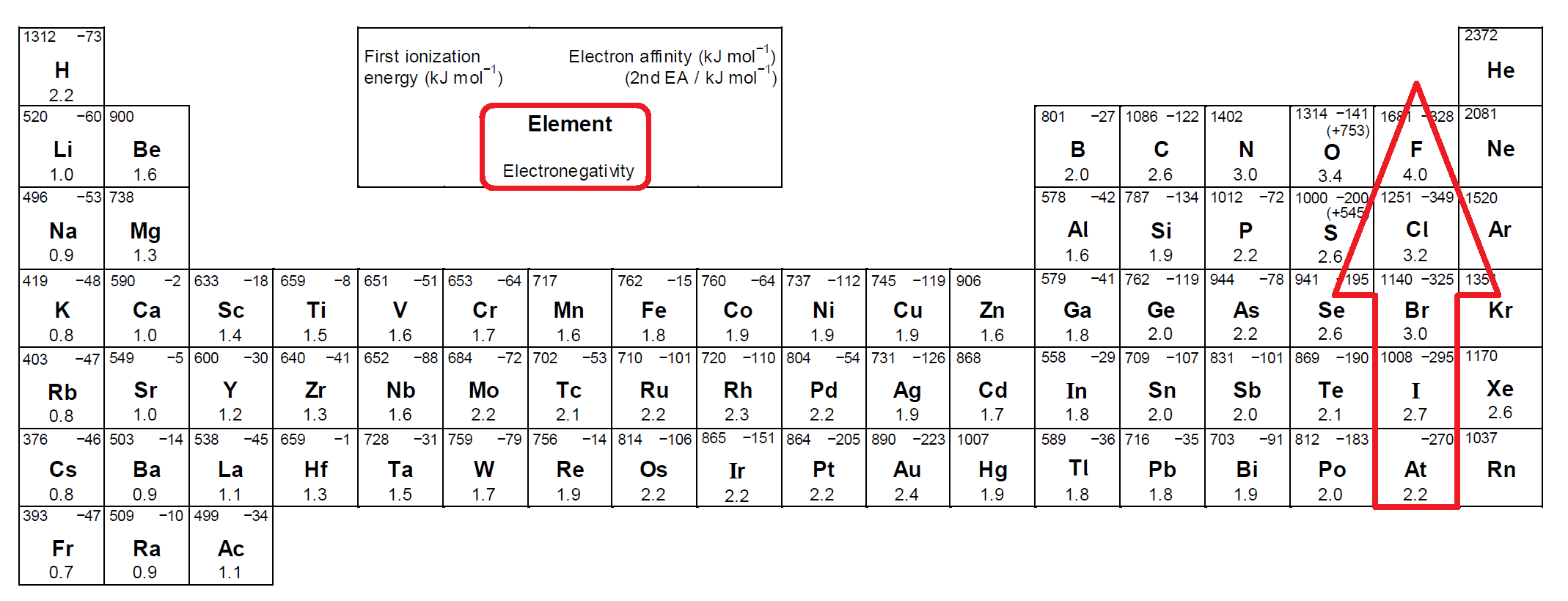
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством
других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов
в возбужденном состоянии.

Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F—)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br—)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при
нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить
водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)

Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HBr + H2SO4 → Br2 + SO2 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
2.3.1. Химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген |
Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
1. Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 1.1. Простые вещества
Водный раствор Cl2 окисляет соединения S–2 (H2S и сульфиды) до S+6, восстанавливаясь до степени окисления -1 (так как, находясь в седьмой группе периодической таблицы элементов, принять они могут только один электрон):
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
4Cl2 + Na2S + 4H2O → Na2SO4 + 8HCl
Br2 и I2 являются более слабыми окислителями и поэтому окисляют сероводород преимущественно до S:
Br2 + H2S → S
Водные растворы Cl2 и Br2 окисляют соединения S+4 до S+6:
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Br2 + SO2 + 2H2O → H2SO4 + 2HBr
Cl2 и Br2 окисляют аммиак с образованием хлорида и бромида аммония:
3Cl2 + 8NH3 → N2 + 6NH4Cl
3Br2 + 8NH3 → N2 + 6NH4Br
F2, Cl2 и Br2 окисляют пероксид водорода с образованием кислорода:
F2 + H2O2 → O2
Cl2 + H2O2 → O2
Br2 + H2O2 → O2
F2, Cl2 и Br2 окисляют соединения железа, хрома, марганца и др. в промежуточных степенях окисления, преимущественно в щелочной среде:
3F2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KF + 8H2O
3Cl2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
3Br2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
2Br2 + 2CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
3Br2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
3Cl2 + 2CrCl3 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
3Br2 + Cr2(SO4)3 + 16NaOH → 2Na2CrO4 + 3Na2SO4 + 6NaBr + 8H2O
3Cl2 + 2K3[Cr(OH)6] + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Br2 + Mn(NO3)2 + 8NaOH → Na2MnO4 + 4NaBr + 2NaNO3 + 4H2O
F2 + NaBrO3 + 2NaOH → NaBrO4 + 2NaF + H2O
I2 + K2SO3 + 2KOH → K2SO4 + 2KI + H2O
Br2 + 2K2MnO4 → 2KMnO4 + 2KBr
Галогены также окисляют кислоты и кислотные оксиды, в которых неметалл имеет промежуточную степень окисления:
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2I2 + As2O3 + 5H2O → 2H3AsO4 + 4HI
F2 + KClO3 + 2NaOH → KClO4 + 2NaF + H2O.
Правило 1.2. Кислородсодержащие кислоты и соли хлора являются сильными окислителями.
При восстановлении любых соединений с положительными степенями окисления галогенов последние восстанавливается по максимуму, до Г– .
Восстановление кислот:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
2HClO3 + 3P2O3 + 9H2O → 2HCl + 6H3PO4
4HClO + PH3 → 4HCl + H3PO4
HClO3 + 6HBr → 3Br2 + HCl + 3H2O
HClO3 + 6HI → 3I2 + HCl + 3H2O.
Восстановление солей:
KClO4 + 8HI → KCl + 4I2 + 4H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + 3P2O3 → 2KCl + 3P2O5
KClO3 + 3H2O2 → KCl + 3O2 + 3H2O
NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O.
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
В щелочной среде соединения Fe, Cr и Mn окисляются до ферратов (FeO42–), хроматов (CrO42–) и манганатов (MnO42–), соответственно:
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
KClO3 + 2CrCl3 + 10KOH → 7KCl + 2K2CrO4 + 5H2O
KClO3 + 2Cr(OH)3 + 4NaOH → KCl + 2Na2CrO4 + 5H2O
2KClO3 + 3MnO + 6KOH → 2KCl + 3K2MnO4 + 3H2O
KClO3 + 3MnO2 + 6KOH → KCl + 3K2MnO4 + 3H2O
NaClO3 + Cr2O3 + 2K2CO3 → NaCl + 2K2CrO4 + 2CO2
NaClO3 + Cr2O3 + 4NaOH → NaCl + 2Na2CrO4 + 2H2O.
Правило 1.3. При окислении галогенидов Г– как правило образуются простые вещества (Cl2, Br2 и I2).
Примеры реакций с Cl–, Br–, I– :
16HCl + 2KMnO4 → 5Cl2 + 2KCl + 8H2O + 2MnCl2
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
2HCl + KClO → Cl2 + KCl + H2O
HCl + HClO → Cl2 + H2O
4HCl + PbO2 → Cl2 + PbCl2 + 2H2O
4HCl + Ca(ClO)2 → 2Cl2 + CaCl2 + 2H2O
14HI + K2Cr2O7 → 3I2 + 2CrI3 + 2KI + 7H2O
8HI + KClO4 → 4I2 + KCl + 4H2O
6KI + KClO3 + 3H2SO4 → 3I2 + 3K2SO4 + KCl + 3H2O
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
2KI + MnO2 + 2H2SO4 → I2 + MnSO4 + K2SO4 + 2H2O
10KBr + 2KMnO4 + 8H2SO4 → 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O
Правило 1.4. Только I– окисляется соединениями Fe+3 и Cu+2 :
6HI + 2Fe(OH)3 → I2 + 2FeI2 + 6H2O
6HI + Fe2O3 → I2 + 2FeI2 + 3H2O
6KI + 2FeBr3 → I2 + 2FeI2 + 6KBr
4HI + 2CuCl2 → I2 + 2CuI + 4HCl
4KI + 2CuSO4 → I2 + 2CuI + 2K2SO4
4KI + 2Cu(NO3)2 → I2 + 2CuI + 4KNO3
При взаимодействии HI с соединениями Fe+2 и Cu+1, а также других галогеноводородов с Fe+3 и Cu+2, идут обычные реакции ионного обмена:
HI + Fe(OH)2 → FeI2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
Правило 1.5. Ионы I– и Br– могут окисляться кислотами-окислителями:
8HI + H2SO4(к) → 4I2 + H2S
2HBr + H2SO4(к) → Br2 + SO2
8KI + 5H2SO4(к) → 4I2 + H2S
2KBr + 2H2SO4(к) → Br2 + SO2
2KI + 4HNO3(к) → I2 + 2NO2
2KBr + 4HNO3(к) → Br2 + 2NO2
Галогены.
Хлор. Соединения хлора.
- Хлор — простое вещество
Получение.
- В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 2Na + Cl2↑
2NaCl + 2H2O H2↑ + 2NaOH + Cl2↑
- В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Химические свойства. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
- С неметаллами
Cl2 + H2 = 2HCl 3Cl2+ 2P = 2PCl3 5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4 2Cl2 + C (кокс) + 2H2O (пар)= CO2 + 4HCl
- С металлами
Cl2 + 2Na = 2NaCl Cl2 + Mg = MgCl2 3Cl2 + 2Fe = 2FeCl3
- Со сложными веществами
Cl2 + H2O↔ HCl + HClO (хлорная вода)
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
Сl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
3Cl2 + 6NaOH(гор.) = 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH)2 (хол.) = СaCl2 + Сa(ClO)2 + 2H2O хлорная известь
Cl2 + 2NaI = 2NaCl + I2 Cl2 + H2S = S + 2HCl
Cl2 + 3H2O2 = 2HCl + 2H2O + O2
Cl2 + H2O + Na2SO3 = 2HCl + Na2SO4
- Соединения хлора.
- Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ: Cl2 + H2 2HCl
- Кислоты.
Соляная кислота. В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + H2
2HCl + CaO = CaCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
HCl + NaOH = NaCl + H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
HCl + NaHCO3 = NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3 (качественная реакция на галогенид-ионы)
6HCl(конц.) + 2HNO3(конц.) = 3Cl2 + 2NO + 4H2O
Кислородсодержащие кислоты:
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
2HClO 2HCl + O2 HClO + 2HI = HCl + I2 + H2O
HClO + H2O2 = HCl + H2O + O2
- Соли.
Соли соляной кислоты – хлориды.
AgCl + 2(NH3∙ H2O) = [Ag(NH3)2]Cl + 2H2O
2AgCl 2Ag + Cl2
Соли кислородсодержащих кислот.
|
Кислота |
название солей |
|
HClO |
гипохлориты |
|
HClO2 |
хлориты |
|
HClO3 |
Хлораты |
|
HClO4 |
перхлораты |
NaClO + 2HCl = NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HCl + 2O2
Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2 CaCl2 + O2
4KClO3 3KClO4 + KCl
Бертолетова соль
2KClO3 2KCl + 3O2↑
KClO4 2O2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br2 + H2 = 2HBr 3Br2 + 2Fe = 2FeBr3
Br2 + H2O = НBr + НBrO – бромная вода
3Br2 + 6NaOH(конц.) = 5NaBr + NaBrO3 + 3H2O при нагревании
Br2 + 2NaOH(конц.) = NaBr + NаBrO + H2O без нагревания
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4H2O = 6HBr + H2SO4
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Br2 + 2NaI = 2NaBr + I2 Br2 + H2S = S + 2HBr
4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr + 5H2O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 = MnBr2 + Br2 + 2H2O
2HBr + H2O2 = Br2 + 2H2O
2KBr + 2H2SO4 (конц.) = 4K2SO4 + 4Br2 + SO2 + 2H2O
2KBrO3 3O2 + 2KBr
2KBrO4O2 + 2KBrO3 (до 275°С)
KBrO4 2O2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I2 + 3P = 2PI3 I2 + H2 = 2HI I2 + Fe = FeI2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I2 + 6NaOH(гор.) = 5NaI + NaIO3 + 3H2O
I2 + 2NaOH(хол) =NaI + NaIO + H2O
3I2 + 10HNO3(разб) = 6HIO3 + 10NO + 2H2O
I2 + 10HNO3(конц.)= 2HIO3 + 10NO2 + 4H2O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + H2O
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4
2HI + NO2 = I2 + NO + H2O
2HI + S = I2 + H2S
8KI + 5H2SO4 (конц.) = 4K2SO4 + 4I2 + H2S + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 = HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O = 2CuI + 2K2SO4 + H2SO4
2HIO3 I2O5 + H2O
2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + H2O
2HIO3 + 5H2SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6H2O
I2O5 + 5CO I2 + 5CO2
2KIO3 3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6H2O
KIO3+ 3H2SO4 + 5KI = 3I2 + 3K2SO4 + 3H2O
KIO3 + 3H2O2 = KI + 3O2 + 3H2O
2KIO4 O2 + 2KIO3
5KIO4+ 3H2O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2H2SO4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли.Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.

9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв.Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13)Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 2Na + I2
на катоде на аноде
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2+ 2HCl
I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
2) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + H2O ↔HCl + HClO
HCl + NaOH = NaCl+ H2O
HClO + NaOH = NaClO+ H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
5) 2KClO3 2KCl + 3O2↑
4KClO3KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 2P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3

16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O 2H2 + 2NaOH + Cl2
на катоде на аноде
H2 + Cl2 = 2HCl
10) 4HCl+ MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2H2O 2H2 + 2NaOH + I2
на катоде на аноде
I2 + H2 = 2HI
8HI + H2SO4(конц.) = 4I2↓ + H2S↑ + 4H2Oили
2HI + H2SO4(конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHSили
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) 4HCl+ PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
2KClO3 2KCl + 3O2↑
13) I2 + 10HNO32HIO3 + 10NO2 + 4H2O
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3 I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) I2+ 2HClO3 = 2HIO3 + Cl2
2HIO3 I2O5 + H2O
I2O5 + 5CO I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl 2Na + CL2
на катоде на аноде
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 2KCl + 3O2↑
Галогены – элементы главной подгруппы 7 группы таблицы Менделеева: фтор, хлор, бром, йод, астат. Название “галогены” происходит с греческого: “hals” – соль, “genes” – рождаю. В природе в свободном виде не встречаются из-за высокой реакционной способности. Как простые вещества (за исключением астата) записываются в виде двухатомных молекул – F2, Cl2, Br2, I2. Астат является радиоактивным веществом (период полураспада – 8,1 часа) и не рассматривается в рамках школьного курса.
Общие сведения
| Химическая формула | Агрегатное состояние (н.у.) | Цвет | Вид | Запах | Кем и когда открыт |
| F2 | газ | почти бесцветный (газ), бледно желтый |  |
резкий неприятный, удушающий | 1816, Андре Ампер |
| Cl2 | газ | желто-зеленый газ |  |
резкий неприятный, удушающий | 1772 или 1774, Пристли и Шееле |
| Br2 | жидкость | темно-красный |  |
резкий неприятный, удушающий | 1825-1826, Карл Людвиг и Антоин Балар |
| I2 | твердый, кристаллический | черно-серый с металлическим блеском |  |
резкий неприятный, удушающий | 1811, Бернар Куртуа |
| At | твердый | тёмно-синего цвета | неизвестно | неизвестно | 1940, Корсон, Маккензи, Серге |
Интересные факты о галогенах
- Бром – одна из двух простых веществ-жидкостей при нормальных условиях! Второй элемент, обладающий таким же агрегатным состоянием – ртуть (Hg)!
- Запах галогенов специфический и похож между собой.
- Хлор использовался в качестве боевого отравляющего вещества в первую мировую войну.
- Астат может быть получен в результате ядерных реакций и не встречается в природе.
- Фтор получен в чистом виде лишь спустя 76 лет после открытия!
Особенности строения атома
На внешнем энергетическом уровне имеют 7 электронов. Так как по правилу октета элементам седьмой группы не хватает до полного заполнения всего одного электрона, они обладают высокой электроотрицательностью, которая увеличивается снизу вверх (из-за уменьшения радиуса и увеличения силы взаимодействия электронов с ядром). Фтор – элемент с наивысшей электроотрицательностью не только среди галогенов, но и среди всех элементов:
Электроотрицательность галогенов по Полингу.
Семь электронов заполняют соответствующие s и p орбитали следующим образом: ns2np5, где n – номер периода, для фтора -2, хлора – 3, брома – 4, йода -5.
Графическая электронная схема фтора.
В атоме присутствует один неспаренный электрон, что и объясняет двухатомность молекул галогенов. В двухатомной молекуле два неспаренных электрона каждого атома объединяются в общую электронную пару, что хорошо иллюстрирует следующий рисунок (структура Льюиса):
Образование двухатомной молекулы хлора. Структура Льюиса.
Валентность галогенов варьируется от I до VII у хлора, брома и йода. У фтора теоретическая максимальная валентность IV (так как нет d-подуровня на 2 уровне, следовательно одна s-орбиталь и три p (1+2=4)), но на практике встречается в основном I из-за высокой электроотрицательности.
Основное и три возбужденных состояния атома хлора
| Электронная конфигурация | Графическая схема | Валентность | Cтепени окисления | Примеры |
| 1s22s22p63s23p53d0 | 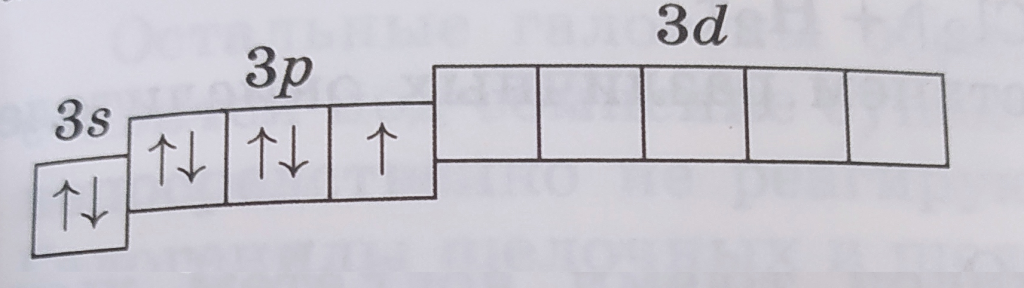 |
I | -1, 0, +1 | NaCl, Cl2, HClO |
| 1s22s22p63s23p43d1 | 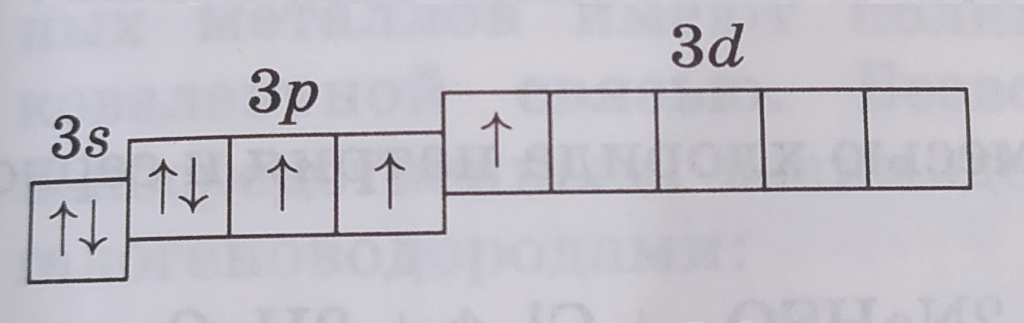 |
III | +3 | HClO2 |
| 1s22s22p63s23p33d2 | 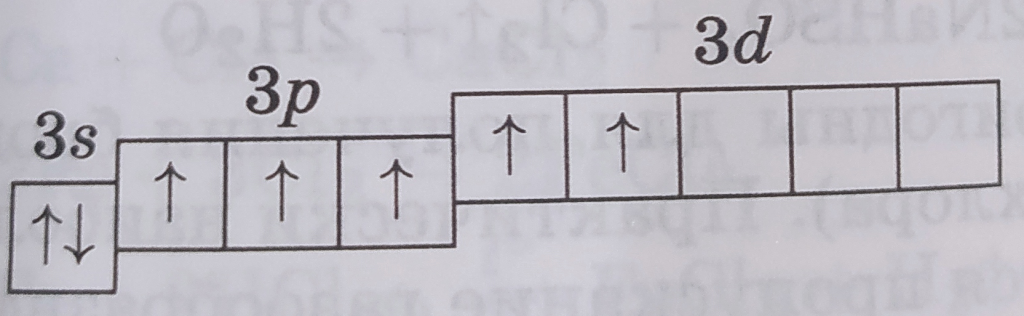 |
V | +5 | NaClO3 |
| 1s22s22p63s13p13d3 | 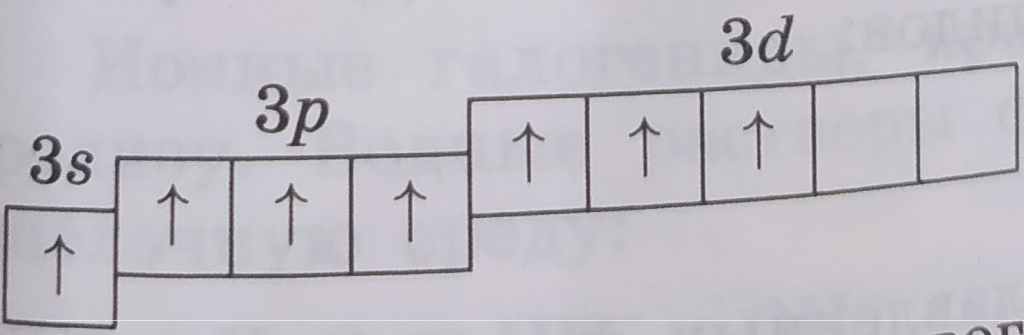 |
VII | +7 | KClO4 |
Для брома и йода схемы внешнего уровня аналогичны хлору (3 меняется на 4 или 5).
Получение галогенов
Получение фтораЭлектролиз расплавов фторидов:
2KF=2K+F2↑
Получение хлора1. Электролиз расплавов и растворов хлоридов:
2NaCl+2H2O=2NaOH+Cl2↑ +H2↑
2. Окисление соляной кислоты оксидом марганца (IV), перманганатом калия или дихроматом калия (возможны, конечно, другие окислители, но эти самые частые):
MnO2+4HCl=MnCl2+H2O+Cl2↑
2KMnO4+16HCl=2MnCl2+2KCl +8H2O+5Cl2↑
K2Cr2O7+14HCl=2CrCl3+3Cl2+2KCl+7H2O
Получение брома
1. Электролиз расплавов и растворов бромидов:
2KBr+2H2O=2KOH+Br2+H2↑
2. Окисление бромоводорода оксидом марганца (IV), перманганатом калия или дихроматом калия:
MnO2+4HBr=MnBr2+H2O +Br2
2KMnO4+16HBr=2MnBr2+2KBr+8H2O+5Br2
K2Cr2O7+14HBr=2CrBr3+3Br2+2KBr+7H2O
3. Вытеснение брома хлором из растворов бромидов:
2NaBr+Cl2=2NaCl+Br2
Получение йода
1. Электролиз расплавов и растворов йодидов:
2KI+2H2O=2KOH+I2+H2↑
2. Окисление йодоводорода оксидом марганца (IV), перманганатом калия или дихроматом калия:
MnO2+4HI=MnI2+H2O +I2
2KMnO4+16HI=2MnI2+2KI+8H2O+5I2
K2Cr2O7+14HI=2CrI3+3I2+2KI+7H2O
3. Вытеснение йода хлором или бромом из растворов йодидов:
2NaI+Cl2=2NaCl+I2
2NaI+Br2=2NaBr+I2
Правило вытеснения одного галогена другим из раствора его соли
Более активный (или с меньшим порядковым номером = с меньшей молекулярной массой) галоген вытесняет менее активный из раствора его галогенида. Фтор в этих реакциях не рассматривается из-за высокой реакционной способности!
- Хлор вытесняет бром из бромидов, йод из йодидов. С помощью хлора можно получить и бром и йод.
- Бром вытесняет йод из йодидов. С помощью брома можно получить только йод.
- Йод не вытесняет другие галогены! С помощью йода получить другие галогены нельзя!
Химические свойства галогенов
Взаимодействие с неметаллами
- Фтор взаимодействует со всеми элементами, за исключением аргона, неона гелия. Со многими веществами реагирует со взрывом! Знать уравнения реакций со фтором для ЕГЭ необязательно, но важно знать, что реакции идут! Валентность элементов чаще всего максимальная:
- взаимодействие с азотом: 2F2+N2=NF3 (при электрическом разряде, реакция не входит в ЕГЭ!)
- взаимодействие с серой: 2F2+S=SF6
- взаимодействие с водородом: F2+H2=2HF
- Хлор взаимодействует с неметаллами, за исключением прямого взаимодействия с кислородом, азотом и благородными газами:
- взаимодействие с серой: 2Cl2+S=SCl4 (возможны SCl4, S2Cl2, SCl2)
- взаимодействие с фосфором: 3Cl2+2P=2PCl3 или 5Cl2+2P=2PCl5
- взаимодействие с кремнием: 2Cl2+Si=SiCl4
- взаимодействие с углеродом: 2Cl2+С(графит)=CCl4
- взаимодействие с водородом: Cl2+H2=2HCl
- взаимодействие с йодом 3Cl2+I2=2ICl3 (реакция не входит в ЕГЭ)
- Бром взаимодействует со многими неметаллами аналогично хлору:
- взаимодействие с серой: Br2+2S=S2Br2 (не входит в ЕГЭ, но знать, что реагирует!)
- взаимодействие с кремнием: 2Br2+Si=SiBr4
- взаимодействие с водородом: Br2+H2=2HBr
- Йод сильно отличается от остальных галогенов и практически не взаимодействует с неметаллами. Уравнений и реакций с неметаллами в обычной школьной программе практически нет.
Вышеописанные реакции демонстрируют очевидное снижение химической активности сверху вниз в 7 группе! Если фтор реагирует практически со всеми элементами, то йод практически инертен по отношению к неметаллам.
Взаимодействие с металлами
Все галогены реагируют со всеми металлами!
Даже платина (не входит в ЕГЭ) – один из самых инертных металлов – реагирует с бромом, а с йодом при нагревании.
Взаимодействие с водой
- Фтор реагирует с водой со взрывом! В результате реакции образуются различные продукты в зависимости от температуры. Знать факт реакции обязательно!
- Хлор вступает в реакцию диспропорционирования – продуктами реакции являются соляная и хлорноватистая кислоты. Реакция обратима: Cl2+H2O ⇔ HCl + HClO
- Бром так же может реагировать с водой, но равновесие сильно сдвинуто в сторону исходного брома. Кроме того, всем известна бромная вода из курса органической химии, которая представляет раствор брома в воде, – а значит бром реагирует с ней незначительно.
- Йод практически не реагирует с водой.
В школьном курсе знание реакций с водой встречается очень редко, а если и встречается, то но примере хлора и фтора.
Взаимодействие со щелочами
Со щелочами реакции дипропорционирования для галогенов (хлора, брома и уже йода) проходят необратимо, так как образуются соли их кислот, а не сами кислоты. Очень важно! Продукты реакций зависят от температуры и это знать обязательно.
- Фтор не рассматривается в данных реакциях.
- Хлор вступает в реакцию диспропорционирования:
- на холоду по следующему уравнению: Cl2+2NaOH=NaCl + NaClO + H2O
- при нагревании (над стрелочкой ставят t): 3Cl2+6NaOH=5NaCl + NaClO3 + 3H2O
- Бром реагирует аналогично хлору:
- на холоду по следующему уравнению: Br2+2NaOH=NaBr + NaBrO + H2O
- при нагревании (над стрелочкой ставят t): 3Br2+6NaOH=5NaBr + NaBrO3 + 3H2O
- Йод реагирует только следующим образом:
- 3I2+6NaOH=5NaI+NaIO3+3H2O
Внимательные ученики заметят, что реакции при нагревании протекают до более высокой степени окисления +5 для хлора и брома, то есть при нагревании диспропорционирование идет глубже. С уменьшением электроотрицательности, которая наблюдается при переходе к йоду, возможность глубокого диспропорционирования достигается при комнатной температуре для йода. Запомните это рассуждение, оно хорошо иллюстрирует химическую логику.
Галогеноводороды
Получение
- Прямой синтез из простых веществ. Чаще всего знания данных реакций проверяют на примере фтора, хлора и реже брома, так как реакция с йодом обратима.
- F2+H2=2HF
- Cl2+H2=2HCl
- Br2+H2=2HBr (обратима, но продукта около 95% )
- I2+H2⇔2HI (более обратима, то есть продукта меньше, если сравнивать с бромом в равных условиях)
- Вытеснение сильными кислотами галогеноводородов из их солей. Суть данного метода основана на летучести галогеноводородов.
- Для фтороводорода и хлороводорода можно и нужно использовать серную кислоту (не применять для брома и йода, так как сильные кислоты-окислители способны окислить галогеноводороды или их соли!).
- CaF2+H2SO4(конц)=2HF↑+CaSO4
- NaCl+H2SO4(конц)=HCl↑+NaHSO4 или 2NaCl+H2SO4(конц)=2HCl↑+Na2SO4
- Для получения бромоводорода необходимо применять кислоту-неокислитель, например, фосфорную:
- NaBr+H3PO4(конц)=HBr↑+NaH2PO4
- Для фтороводорода и хлороводорода можно и нужно использовать серную кислоту (не применять для брома и йода, так как сильные кислоты-окислители способны окислить галогеноводороды или их соли!).
- Гидролиз галогенидов:
- PBr3+3H2O=H3PO3+3HBr↑
- Галогенирование органических соединений.
Химические свойства галогеноводородов
Растворы галогеноводородов в воде – сильные кислоты, за исключением фтороводородной кислоты. Однако галогеноводороды кислоты-НЕокислители! Проявляют типичные свойства кислот из программы 8-го класса.
- Реагируют с металлами в ряду напряжений до водорода: 2HCl+Zn=ZnCl2+H2↑
- Реагируют с основными и амфотерными оксидами и гидроксидами:
- 2HCl+BaO=BaCl2+H2O
- 6HCl+Al2O3=2AlCl3+3H2O
- 2HCl+Ca(OH)2=CaCl2+2H2O
- 2HBr+Zn(OH)2=ZnBr2+2H2O
- Реагируют с солями, если выделяется газ или осадок (реакции ионного обмена), чаще всего это нитрат серебра, карбонаты, сульфиты и сульфиды:
- AgNO3+HCl=AgCl+HNO3
- Фтороводородная кислота реагирует оксидом кремния (запомните!):
- 4HF+SiO2=SiF4+2H2O
Кислородные соединения галогенов
Необходимо запомнить названия кислот и их солей, а так же то, что они являются достаточно сильными окислителями.
| Степень окисления | +1 | +3 | +5 | +7 |
| Кислота | HClO (хлорноватистая) | HClO2 (хлористая) | HClO3 (хлорноватая) | HClO4 (хлорная) |
| Соль | гипохлорит | хлорит | хлорат | перхлорат |
Естественно, аналогичные кислоты существуют и у брома и йода (разве что аналоги хлористой под вопросом), но в школьной программе работают именно с хлором.
Получение солей данных кислот, а именно хлорноватистой и хлорноватой рассматривалось в химических свойствах галогенов – реакции диспропорционирования. Из основных свойств, встречающихся в школьной программе, необходимо знать:
- Разложение хлоратов и перхлоратов, чаще всего имеется в виду реакции разложения до хлорида:
- 2KClO3=2KCl+3O2 (катализатор – оксид марганца 4)
- KClO4=KCl+2O2 (может быть вариант и с выделением хлора)
- Окислительные свойства:
- 5KClO3+6P=KCl+P2O5
- Сопропорционирование:
- KClO3+6HCl=KCl+3H2O+3Cl2
Даниил Романович | Просмотров: 643
Галогены
– 7 А группа (F, CL, Br, I,At).
1.Строение – ns2np5, F наиболее
электроотрицательный, его степень окисления – 0, — 1, остальные галогены имеют
положительную – 0, — 1, + 1, +3, + 5, + 7, т.к. у элементов есть d – подуровень.
2.Физические свойства:
F2 – cветло –
жёлтый, с запахом, с водой реагирует ниже 0, tпл = -2200,
tкип = -1830;
CI2 – жёлто – зелёный газ, с удушливым
запахом, tпл = — 1010, tкип
= — 340; растворяется в воде
CI2 + H2O = HCI + HCIO, HCIO – хлорноватистая разлагается с выделением O2,
2CI2 + 2H2O = 4HCI + O2 (раствор CI2 – хлорная вода, раствор Br2 – бромная вода).
Br2 – тёмно – красная, летучая жидкость, tпл = — 7, tкип = + 60, реагирует с водой
аналогично хлору, но менее активно.
I2 – фиолетово –
чёрные с металлическим блеском кристаллы, tпл + 113,50,
tкип = + 1840, характерна возгонка – переход из
твёрдого состояния в газообразное, минуя жидкое, йод плохо растворим в воде.
Галогены – ядовитые вещества.
3.Распространение в природе: в природе
наиболее распространены хлориды и бромиды, астат встречается в продуктах
распада радиоактивных элементов.
4.Химические свойства: окислительная
активность убывает от фтора – хлора – брома – йода.
1). Более активные галогены
вытесняют менее активные из галогеноводородных кислот и их солей.
F2
вытесняет CI2, Br2,
I2.
CI2 вытесняет из галогеноводородных кислот
и солей Br2 , I2.
CI2
+ 2HBr =2HCI + Br2
CI2 +
2KI = 2KCI + I2
Br2
вытесняет только I2
Галогены с более сильной окислительной способностью могут окислить
галоген — менее сильные окислители: Br2 +5CI2 +12KOH = 2KBrO3 + 10KCI +6H2O
Галогены вступают в реакцию между собой: СI2 + I2 = 2ICI
2). C металлами образуют галогениды.
Фтор реагирует с металлами при обычных условиях, но иногда на
поверхности образуется фторидная малорастворимая плёнка, поэтому реакция не
протекает, медь и никель устойчивы к фтору.
Хлор активно реагирует с металлами, с медью – при комнатной температуре
в присутствии влаги:
Cu + CI2 = CuCI2 ,
с золотом – при
температуре 3CI2 + 2Au = 2AuCI3 ,
с железом и
хромом при нагревании — t = 1000 2Fe + 3CI2 = 2FeCI3
2Cr + 3CI2 = 2CrCI3
3).Взаимодействие с неметаллами: галогены реагируют с водородом,
фосфором, серой и другими неметаллами, продукты
зависят от температуры, аллотропных модификаций и количества вещества.
Фтор –
«всёсъедающий», реагирует с неметаллами на холоду, а со взрывом, при
температуре с хлором, криптоном, ксеноном: F2 + Xe =XeF2
Хлор не
взаимодействует с кислородом, азотом и благородными газами.
2P + 3CI2(НЕД) = 2PCI3 или 2P + 5CI2(ИЗБ) = 2PCI5
S +CI2 = SCI2
или 2S + CI2 = S2CI2
H2 +CI2 = 2HCI (образование хлороводорода ускоряется на свету, происходит
радикальный механизм реакции)
H2 +I2 = 2HI – реакция обратима
I2 + Fe = FeI2
I2 +S – реакция не происходит
4). Взаимодействие с водой:
При обычных
условиях с водой взаимодействует только F2.
F2 + H2O = HF + O (атомарный кислород обладает высокой химической
активностью),
Образуется смесь
веществ – O2, O3, OF2 – фторид кислорода.
Частично с водой
реагирует CI2 и Br2, но равновесие сильно смещено влево,
поэтому иногда реакциями пренебрегают, считая раствор CI2 – хлорной водой, а раствор Br2 – бромной водой:
CI2 + H2O =HCIO + HCI Br2 + H2O =HBrO + HBr
5). Взаимодействие с водными растворами щелочей.
CI2 + 2KOH = KCI +KCIO + H2O KCIO + CO2 + H2O = KHCO3 +HCIO
KCIO – гипохлорит
калия, разлагается, применятся для отбеливания бумаги и ткани.
3 CI2 +
6KOH = t 5KCI + KCIO3+ H2O
CI2 +
Ca(OH)2 = CaOCI2 + H2O
CaOCI2 – хлорная известь,
CaCI-1(OCI+1) – хлорид – гипохлорит кальция (смешанная соль)
CaCI-1(OCI+1)
+CO2 + H2O = CaCO3 +CaCI2 +2HCIO
HCIO – хлорноватистая
кислота слабее угольной, вытесняется из солей.
CaOCI2 +2HCI = CaCI2
+ CI2 + H2O
2F2 +2NaOH = 2NaF + H2O
+OF2
OF2 – газ, с резким запахом, ядовит, сильный окислитель, применяется в
ракетном топливе.
6). Взаимодействие с кислотами.
H2S + Гaл2 = HГaл +
S (кроме F2)
H2SO3 + Гaл2 + H2O = 2 HГaл + H2SO4 (кроме F2).
5. Получение
галогенов.
А) в
промышленности:
F2 – получают при электролизе расплава солей CaF2, KHF2
CI2 – получают при электролизе раствора NaCI, Br2, I2 – при электролизе растворов солей.
Б) в лаборатории —
действием сильных окислителей (MnO2, KMnO4, K2Cr2O7) на кислоты, чтобы получить CI2 – действуют HCI, Br2 – HBr, I2 – HI.
4HCI + MnO2 = CI2 + MnCI2 +2H2O
16HCI +2 KMnO4 = 5CI2 + 2MnCI2 + 2KCI +8H2O
14HCI + K2Cr2O7
= 3CI2 + 2CrCI3 + 2KCI + 7H2O