Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
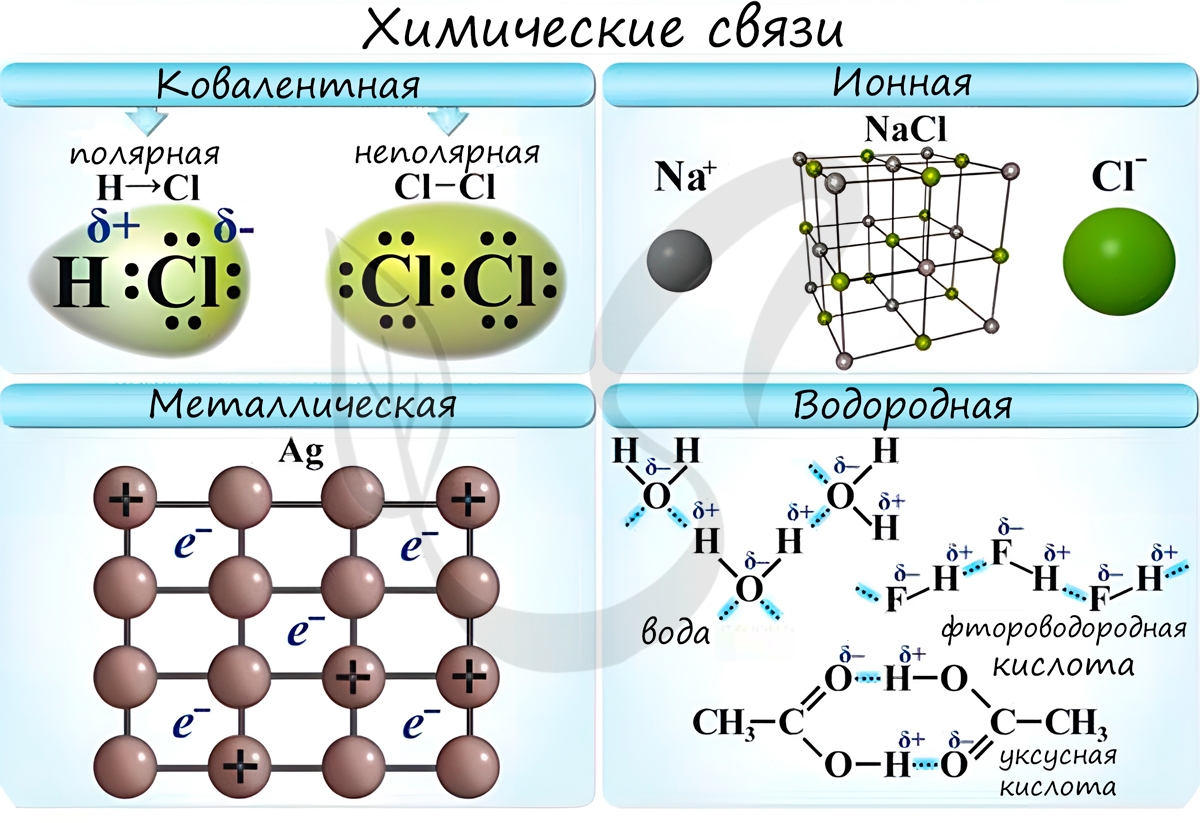
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
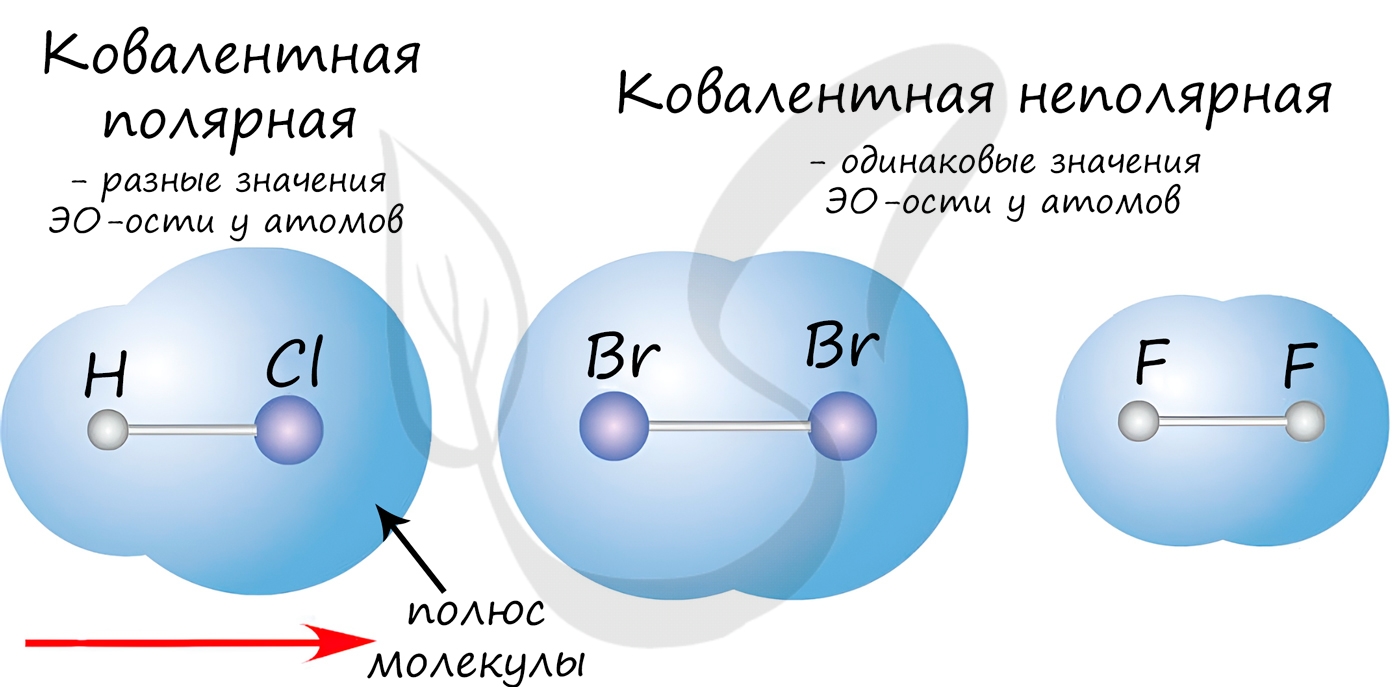
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
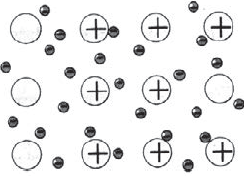
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
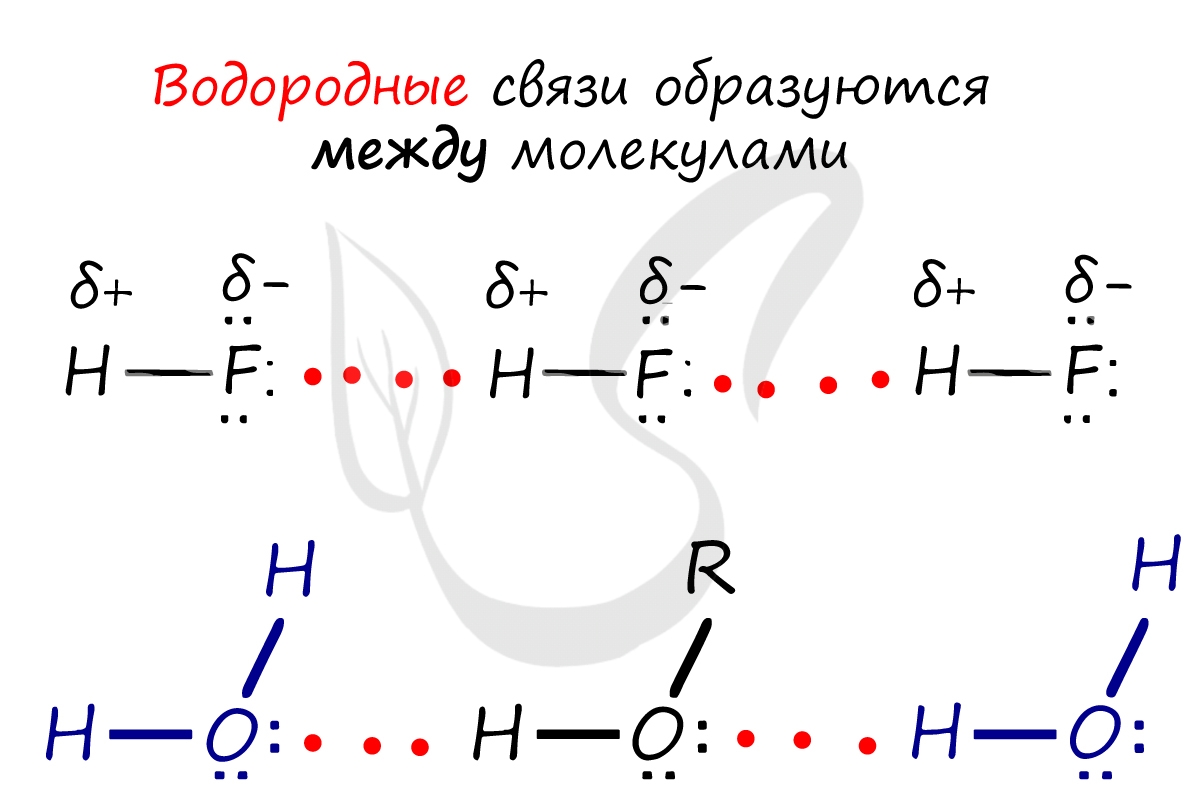
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
261
Создан на
07 января, 2022 От Admin
Тренировочный тест «Химические связи»
2 / 10
Из предложенного перечня выберите два вещества, между молекулами которых существует водородная связь.
1) метан
2) метанол
3) фосфин
4) водород
5) муравьиная кислота
3 / 10
Из предложенного перечня выберите два вещества, в молекуле каждого из которых присутствует ровно одна ковалентная неполярная связь.
1) метан
2) этан
3) этилен
4) фосфин
5) пероксид водорода
4 / 10
Из предложенного перечня выберите два вещества с ковалентной неполярной химической связью, которые имеют молекулярную кристаллическую решётку.
1) пероксид водорода
2) хлороводород
3) кремний
4) азот
5) графит
5 / 10
Из предложенного перечня выберите два свойства, которые характеризуют вещества с ионной кристаллической решёткой.
1) высокая электропроводность в кристаллическом состоянии
2) высокая температура плавления
3) пластичность,
4) высокая электропроводность в расплаве
5) летучесть
Запишите в поле ответа номера выбранных свойств.
6 / 10
Из предложенного перечня выберите два вещества немолекулярного строения.
1) Al4C3
2) C3H8O3
3) CH3ONa
4) H2SO4
5) P4
7 / 10
Из предложенного перечня выберите два вещества молекулярного строения, в которых присутствует
ковалентная неполярная связь.
1) метилформиат
2) серная кислота
3) этиленгликоль
4) бутадиен-1, 3
5) этилат натрия
8 / 10
Из предложенного перечня выберите два вещества, которые имеют атомную кристаллическую решётку.
1) оксид углерода(IV)
2) оксид кремния
3) карбид кремния
4) оксид калия
5) карбид кальция
Запишите в поле ответа номера выбранных веществ.
9 / 10
Из предложенного перечня выберите два соединения, между молекулами каждого из которых образуется водородная связь.
1) HCOOCH3
2) HCOOH
3) HF
4) HCHO
5) CH4
10 / 10
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1) H2SO3
2) NaNO2
3) SCl2
4) KF
5) CH2Cl2
Ваша оценка
The average score is 39%
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с
одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов
донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2),
а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной
связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2,
N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной.
В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3,
H2O.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково»
вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для
создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной
электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- NO3— — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь,
возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между
противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и
типичным неметаллом. Примеры:
NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4.
Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в
соединениях: NH4I, NH4NO3,
(NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой
молекулы.

Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является
наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности
металлов.

Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых
ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот:
HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты
отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Например, фторид лития $LiF$ относят к ионным соединениям. Фактически же в нем связь на $80%$ ионная и на $20%$ ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов $HF—HCl—HBr—HI—HАt$ степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной $(ЭО(Н) = 2.1; ЭО(At) = 2.2)$.
Различные типы связей могут содержаться в одних и тех же веществах, например:
- в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная;
- в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
- в солях аммония, метиламмония и т. д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
- в пероксидах металлов (например, $Na_2O_2$) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.д.
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
1) $H_2$ — водород:
Связь возникает благодаря образованию общей электронной пары $s$-электронами атомов водорода (перекрыванию $s$-орбиталей):
2) $HCl$ — хлороводород:
Связь возникает за счет образования общей электронной пары из $s-$ и $p-$электронов (перекрывания $s-p-$орбиталей):
3) $Cl_2$: в молекуле хлора ковалентная связь образуется за счет непарных $p-$электронов (перекрывание $p-p-$орбиталей):
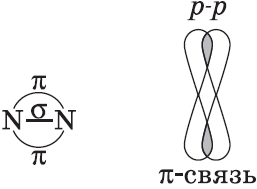
4) $N_2$: в молекуле азота между атомами образуются три общие электронные пары:
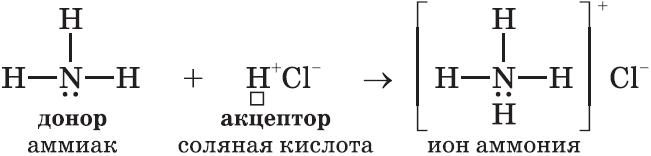
II. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на примере иона аммония $NH_4^+$.
Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
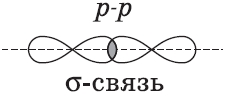
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются $σ$-связями (сигма-связями). Сигма-связь очень прочная.
$p-$Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются $π$-связями (пи-связями).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул $H_2, Cl_2$ и $N_2$ соответственно составляют $0.074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
- Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:${Ca^0}↙{атом}-2e↖{-}→Ca^{2+}↙{ион}$.
- Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:${Cl^0}↙{атом}+1e↖{-}→Cl^{-}↙{ион}$.
- Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно $2 (2 · 1)$. Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом $Са$, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома $Cl$.
- Схематично образование ионной связи между атомами кальция и хлора можно записать так:
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
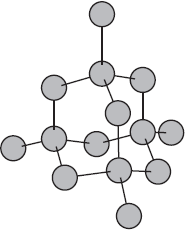
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — $1, 2, 3$. Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Соединяясь с ионами, эти электроны образуют временно атомы, потом снова отрываются и соединяются уже с другим ионом и т.д. Следовательно, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
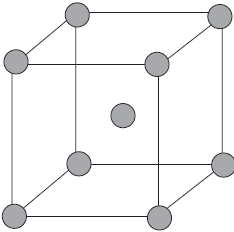
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары ($F, O, N$ и реже $S$ и $Cl$), другой молекулы (или ее части) называют водородной.
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
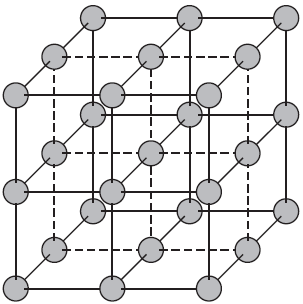
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы $Na^{+}, Cl^{–}$, так и сложные $SO_4^{2−}, ОН^–$. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия состоит из чередующихся положительных ионов $Na^+$ и отрицательных $Cl^–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь.
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY) < E(X) + E(Y)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
Упрощенно можно считать, что в основе химических связей лежат электростатические силы, обусловленные взаимодействиями положительно заряженных ядер и отрицательно заряженных электронов.
В образовании химических связей элементов главных подгрупп принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными. Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s-орбитали и 1 на 2p-орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl4, H2S, CO2, NH3, SiO2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента. Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH4+:
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI < HBr < HCl < HF
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом, а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом.
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F−, Cl−, S2-), а также между простыми катионами и сложными анионами (NO3−, SO42-, PO43-, OH−). Поэтому к ионным соединениям относят соли и основания (Na2SO4, Cu(NO3)2, (NH4)2SO4), Ca(OH)2, NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
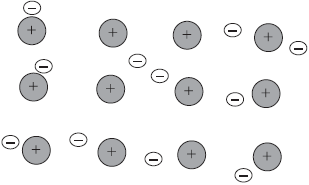
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Ковалентная связь – связь между
двумя атомами, которые соединяются друг с другом за счет образования ОБЩЕЙ
электронной пары.
Существует два
возможных механизма
образования общей электронной пары:
·
обменный
механизм, когда каждый из взаимодействующих атомов предоставляет
в пару по одному электрону,
·
донорно-акцепторный
механизм, если один из атомов предоставляет электронную ПАРУ, а
другой – пустую (вакантную) орбиталь.

‼ По донорно-акцепторному механизму образованы
связи в следующих веществах:
1.
Все комплексные соединения, например: K3[Al(OH)6]
2.
Соли аммония и аминов: NH4Cl и т.п.
3.
Азотная кислота, нитраты.
4.
Газы СО- угарный газ, О3 – озон.
Электроотрицательность
(ЭО) –
способность атома притягивать электроны при образовании химической связи.
Таким образом, электрон сместится к атому того элемента, который имеет
большую электроотрицательность.
Возможно три случая
для двух атомов А и В, образующих связь: А — В
1)
ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю).
Общая электронная пара не смещена ни к одному из атомов. Не возникает
ПОЛЮСОВ, электронная плотность у обоих атомов одинакова.
Это НЕПОЛЯРНАЯ ковалентная связь.
‼Примеры неполярной ковалентной связи: а) двухатомные
простые вещества: H–H, F–F,
б)
симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь
между двумя атомами кислорода и т.п.
2) ЭО (А) > ЭО(В). При образовании ковалентной связи электронная
пара смещена к более электроотрицательному атому А, на нём возникает
частичный отрицательный заряд, а на В – частичный положительный.
Такая связь называется ковалентной ПОЛЯРНОЙ.
‼ Такой тип связи характерен для молекул (или
частей молекул), состоящих из двух и более неметаллов (HCl, H2O,
СН3СООН).
Чем больше разность ЭО, тем выше полярность
связи (при этом электронная пара принадлежит
обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается.
3) ЭО (А) >> ЭО(В). Разность электроотрицательностей настолько
велика, что атом В (металл) ОТДАЁТ свой электрон атому В (неметалл).
Возникают ИОНЫ — катион В+ и анион А—.
Такая связь называется ИОННОЙ.
Ионная
связь
– предельный случай ковалентной полярной связи.
‼Такой тип
связи характерен для соединений металлов с неметаллами, оксидов металлов,
оснований и солей, в том числе солей органических и солей аммония.
В ионном кристалле нет
молекул. Каждый ион окружен определенным числом ионов другого знака.
Ионная
связь характеризуется ненаправленностью и ненасыщенностью. Вещества с
ионной связью имеют ионную кристаллическую решетку.
‼Необходимо помнить, что
существуют вещества, в молекуле которых одновременно присутствуют и ионные, и
ковалентные связи (например, NaOH, KNO3).
3. Металлическая связь возникает в
простых веществах – металлов между положительно заряженными
ионами металла и свободно движущимися электронами («электронный газ»).
Наличие такого свободного движения электронов является причиной хорошей
тепло- и электропроводности металлов.
Атомы металлов отличаются от атомов других элементов тем, что сравнительно
слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои
атомы, превращая их в положительно заряженные ионы. «Обобществленные»
электроны передвигаются в пространстве между катионами металлов и удерживают
их вместе.
_________________________________________________________
Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями
молекул.
Водородная связь – возникает между сильно электроотрицательными атомами
(обычно водорода или фтора, реже азота) и атомом водорода другой молекулы или
части молекулы:
(сплошной чертой обозначена
ковалентная связь, точками – водородная связь).
Наличие водородных связей приводят к аномальному повышению температур
кипения у веществ, в которых она присутствует.
Температуры
кипения водородных соединений неметаллов VIА группы
|
|
|
tкип, oС |
Сильные водородные связи между молекулами воды препятствуют ее плавлению и
испарению.
Если водородная связь
объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно
для многих органических соединений, например, для салициловой кислоты.
Если же водородная связь
образуется между атомом водорода одной молекулы и атомом неметалла другой
молекулы (межмолекулярная водородная
связь), то молекулы образуют довольно прочные пары, цепочки,
кольца.
Уксусная, муравьиная и другие
карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:
Необходимые для образования водородных связей атомы кислорода и азота
содержат все углеводы, белки, нуклеиновые кислоты.
Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в
воде. Не последнюю роль в этом играют водородные связи, образующиеся в
растворе между молекулами воды и многочисленными OH-группами углеводов.
‼ Вещества, между молекулами которых есть
водородные связи:
1. Вода, лёд.
2. Фтороводород, раствор фтороводорода (плавиковая кислота).
3. Растворы аммиака
NH3
и аминов – между азотом аммиака
(амина) и атомами водорода воды.
4. Органические вещества,
имеющие гидроксильную группу: спирты, фенолы,
карбоновые кислоты.
5. Растворы
углеводов – моносахаридов и
дисахаридов.
6. Белки.
ВАЛЕНТНОСТЬ
–
число связей, образованных данным атомом в данной молекуле.
Например, в молекуле SO3 у серы 6
связей, т.е. сера в этой молекуле имеет валентность VI.

Валентные возможности атомов – весь набор
возможных валентностей.
Они определяются числом неспаренных электронов и возможных
донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру
группы.
Исключения:
А)
азот, кислород, фтор.
Б)
элементы VIII группы (в
главной подгруппе для гелия, неона и в побочной подгруппе для элементов
триад)
В)
элементы I группы
побочной подгруппы – медь, серебро, золото (у них высшая валентность больше
номера группы).
Степень окисления
–
гипотетический заряд у атома в молекуле, рассчитанный, исходя
из предположения об ионном характере всех связей и из того, что в целом
молекула электронейтральна.
Пример:
+1 +6 -2
K2 Cr2 O7 (+1)
∙2 + (+6) ∙2 + (-2) ∙7 = 0
Длина, энергия (прочность) и полярность связи.
Длина связи – расстояние между ядрами атомов в соединении.
Она
зависит:
А)
от радиусов атомов, образующих связь
Б)
от кратности связи (одинарная, двойная, тройная).
Обычно
чем короче связь, тем она прочнее.
Связь
считается прочной, если ее энергия превышает 500 кДж/моль (например, 942
кДж/моль для N2), слабой — если ее энергия меньше 100 кДж/моль
(например, 69 кДж/моль для NO2).
|
HF |
HCl |
HBr |
HI |
|
|
Длина |
92 |
128 |
141 |
160 |
|
Энергия |
565 |
431 |
364 |
217 |
Чем больше кратность связи, тем она прочнее:
тройная>двойная >одинарная.
Энергии связей между атомами углерода.
|
Связь |
Энергия |
|
С-С |
343 |
|
С=С |
615 |
|
С≡С |
812 |
Полярность ковалентной связи
Полярность химической связи зависит от разности электроотрицательностей связываемых
атомов.
Чем больше разность электроотрицательностей двух атомов
в связи, тем она более полярная.
Для ионной связи существует понятие степень ионности, которое тоже
зависит от того, насколько велика разность электроотрицательностей атомов.
По характеру перекрывания различают сигма
σ- и пи- связи — π.
σ-связь- это
связь, в которой перекрывание атомных орбиталей происходит вдоль
оси, связывающей ядра атомов.
Сигма
связь может образовываться всеми типами орбиталей.

Между
двумя атомами в химической частице возможна только одна σ-связь.
При перекрывании параллельных друг другу атомных орбиталей
перпендикулярно оси связи образуются π-связи.

Пи-связь:
дополнительная к сигма связи. Одинарная связь – всегда сигма-связь. Двойная
связь – состоит из 1 сигма и 1 пи-связи.
Тройная
связь: 1 сигма и 2 пи-связи.
|
Одинарная (σ) |
Двойная (σ+π) |
Тройная (σ + π + π) |
|
С–С С–Н С–О H–Cl |
С=O С=С О=О |
С≡С С≡N N≡N |
Гибридизация
Если атом связан с другими атомами ОДИНАКОВЫМИ СВЯЗЯМИ, но при их образовании
участвуют орбитали разного типа, то используется метод ГИБРИДИЗАЦИИ.
Пример: Молекула СН4
имеет форму правильного тетраэдра, в ней все 4 связи имеют одинаковую длину,
прочность, находятся под одинаковыми углами друг к другу.
Однако
у четырёхвалентного атома углерода электроны расположены на трёх р-орбиталях
и одной s-орбитали. Они
разные по энергии, форме и расположены в пространстве иначе.
Для объяснения используется понятие ГИБРИДИЗАЦИИ:
из четырёх атомных орбиталей образуются 4 новых,
гибридных орбитали, которые в пространстве располагаются НА
МАКСИМАЛЬНОМ УДАЛЕНИИ ДРУГ ОТ ДРУГА. Это правильный тетраэдр, углы между
связями равны 109° 29´.
Так как в образовании четырёх связей участвуют одна s и три р-оболочки, то
такой тип гибридизации обозначается sp3
В
зависимости от числа и типа орбиталей, которые принимают участие в
гибридизации, отличают следующие типы гибридизации:
1) sp-гибридизация. Участвуют одна s-орбиталь и одна р-орбиталь. Молекула
имеет линейную структуру, валентный угол – 1800.
2) sp2-гибридизация. Участвуют одна s-орбиталь и две р-орбитали. Молекула
располагается в плоскости (концы гибридных орбиталей направлены к вершинам
равностороннего треугольника), валентный угол – 1200.
3) sp3-гибридизация. Участвуют одна s-орбиталь и три р-орбитали. Молекула
имеет тетраэдрическую форму, валентный угол – 109,280.
Как
определить тип гибридизации?
1.
В гибридизации участвуют сигма-связи и НЕПОДЕЛЁННЫЕ ИОННЫЕ ПАРЫ.
2.
Общее число участвующих орбиталей сигма-связей + электронных пар = числу
гибридных орбиталей и определяет тип гибридизации.
Задание: определить
тип гибридизации атома углерода в молекуле фосгена.
O=C – Cl
Cl
1)
углерод образует 2 одинарные связи (это сигма-связи) и одну двойную связь
(сигма+пи).Все 4 электрона углерода участвуют в образовании этих связей.
2)
таким образом, в гибридизации примут участие ТРИ СИГМА-связи. Это sp2—гибридизация, молекула
имеет форму плоского треугольника. Пи-связь располагается перпендикулярно
плоскости этого треугольника.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Химическая связь — это взаимодействие двух атомов, осуществляемое путем обмена электронами.
ХАРАКТЕРИСТИКА СВЯЗЕЙ:
Энергия связи — энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
Длина связи (нм) – расстояние между ядрами в том или ином соединении, зависит от количества электронных уровней у каждого элемента.
Полярность молекулы определяется разностью электроотрицательностей атомов. Чем больше разность электроотрицательностей, тем больше полярность связи
Направленность — Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Например, молекула СО2 является линейной (нет неподеленных электронных пар), а Н2О и SO2 — уголковыми (есть неподеленные пары).
Насыщенность — связи характеризует способность каждого атома образовать ограниченное число связей, которое обусловлено количеством валентных орбиталей.
Ненаправлены и ненасыщены ионные связи
От данных характеристик зависит тип связи.
КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь формируется между атомами неметаллов в результате перекрывания электронных облаков.
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла). Самый электроотрицательный элемент – F.
Механизм образования связи
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Примеры неполярной ковалентной связи:
а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т.п.
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ
Образуют атомы неметаллов с разной электротрицательностью.
Механизм образования связи
Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу
Механизмы образования общей электронной пары:
Обменный механизм — каждый из взаимодействующих атомов предоставляет в пару по одному электрону.
Донорно-акцепторный механизм — один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
По донорно-акцепторному механизму образованы связи в следующих веществах:
1. Все комплексные соединения, например: K3[Al(OH)6]
2. Соли аммония и аминов: NH4Cl и т.п.
3. Азотная кислота, нитраты.
4.Газы СО- угарный газ, О3 – озон.
Ковалентные связи могут быть одинарными, двойными и тройными.
Двойные и тройные называются кратными
Форма ковалентных связей тоже различна. Ковалентные связи — сигма и пи
Сигма-связь – это связь, в которой перекрывание орбиталей происходит ВДОЛЬ ОСИ, соединяющей ядра атомов. Может быть образована всеми типами орбиталей (s,p,d).
Основная связь в молекуле, они более прочные и образуют скелет молекулы. Между двумя атомами в химической частице возможна только одна σ-связь.
Электронные облака при образовании σ связи могут изменять форму. Этот процесс называется гибридизацией.
Гибридные орбитали образуют только σ-связи. Образуются, чтобы обеспечить максимальное удаление друг от друга.
Пи-связь – это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
Пи-связь- дополнительная к сигма-связи, она менее прочная и легче разрывается при химических реакциях.
ИОННАЯ СВЯЗЬ
Между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности
Механизм образования связи
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами.
Ионная связь характеризуется ненаправленностью и ненасыщенностью.
‼! Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3).
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке
Атомы металлов слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы.
«Обобществленные» электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
ВОДОРОДНАЯ СВЯЗЬ
Связь между атомами водорода одной молекулы и сильноотрицательными элементами (O, N, F) другой молекулы
Механизм возникновения связи:
Протон одной молекулы притягивается неподеленной электронной парой атома другой молекулы
3(Б) Тесты ЕГЭ ФИПИ 2015 к теме «Химические связи»






















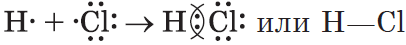
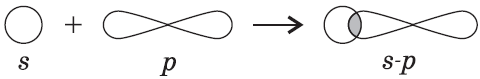
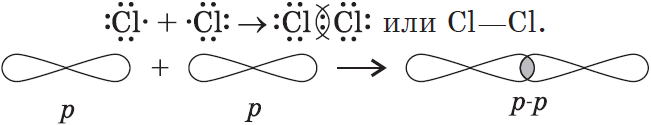

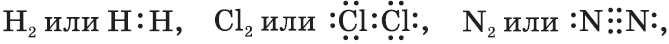
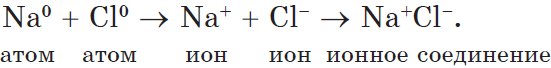
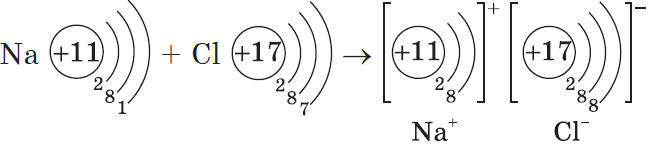
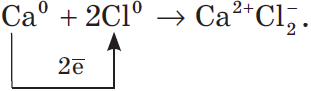

















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)

















