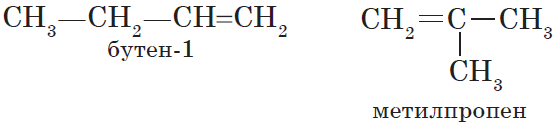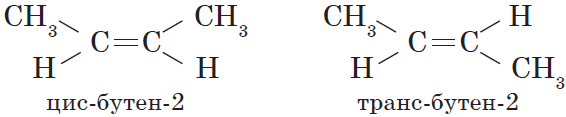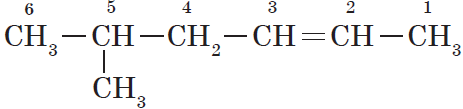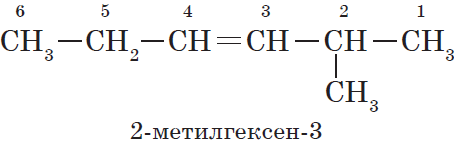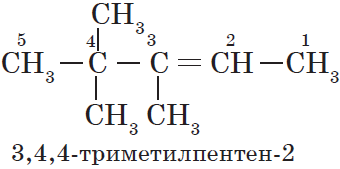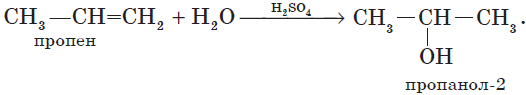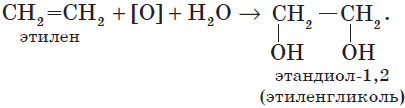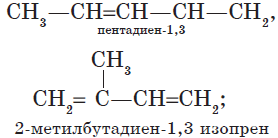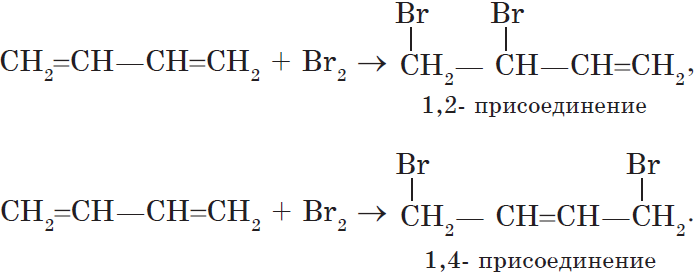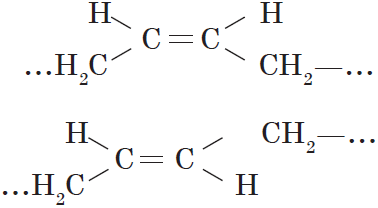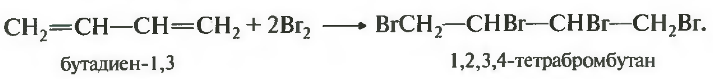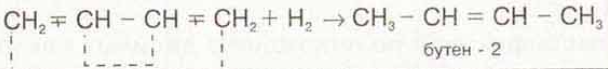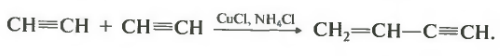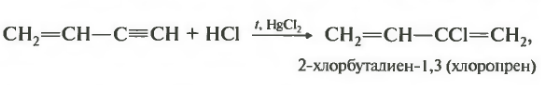Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
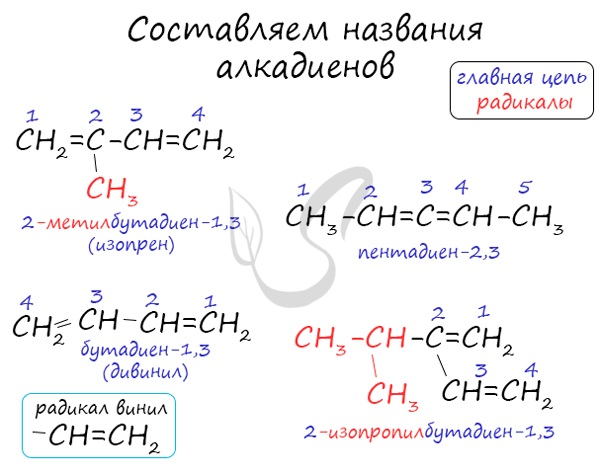
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2.
Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкадиенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом:
пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация
атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
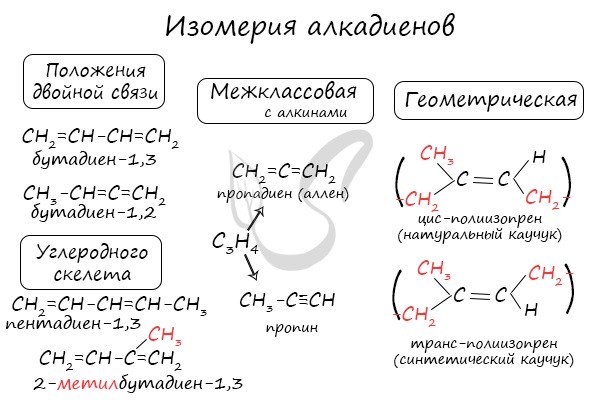
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом — sp-гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в
молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией
плоскости (линией, соединяющей центры атомов).
Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
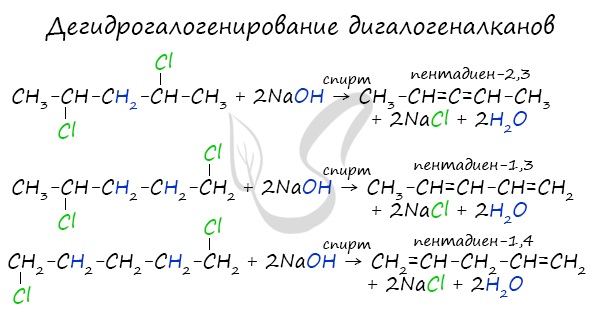
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи
получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из
этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O
+ H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и
способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит
при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
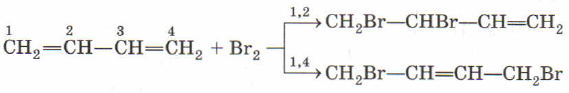
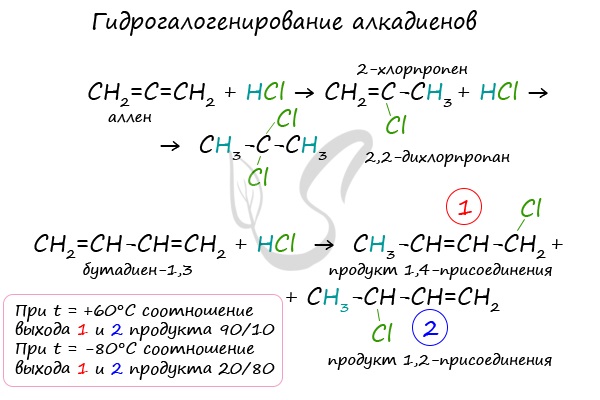
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3
при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.

Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С.
Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
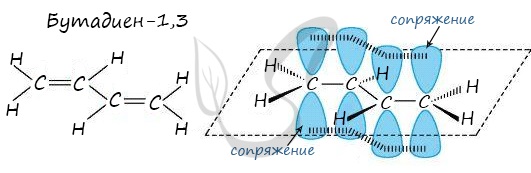
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 |
Гексадиен-2,4 |
 |
 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
 |
 |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей.
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода.
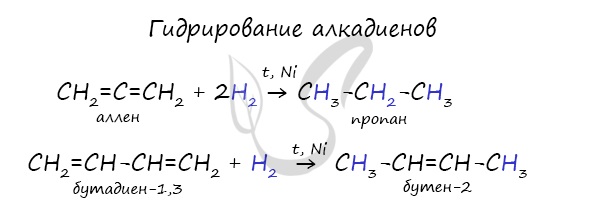
1.1. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2:
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
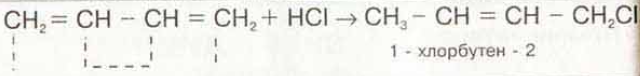
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
.
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
1.4. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
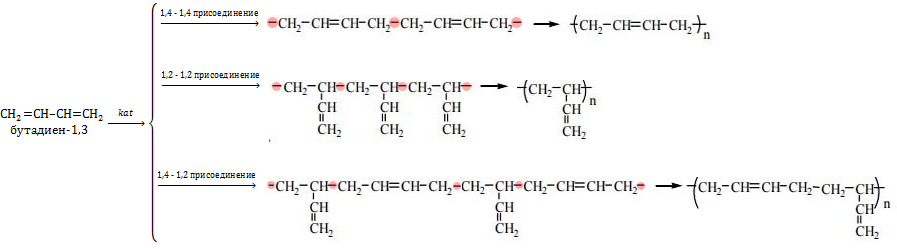
Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком.
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
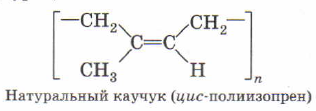
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
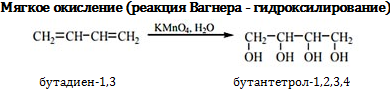
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь.
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания бутадиена:
2C4H6 + 11O2 → 8CO2 + 6H2O
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
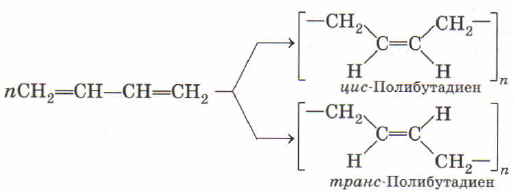
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{text»синтетический бутадиеновый каучук»}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Теперь мы переходим к рассмотрению химических свойств алкадиенов. В целом, для них возможны те же реакции, что и для алкенов, то есть реакции присоединения.
Первым в списке будет галогенирование, присоединение галогенов.
Здесь необходимо особо отметить, что такие реакции могут идти, во-первых, по двум направлениям, как 1,4-присоединение и как 1,2-присоединение. Обратите внимание, что в случае 1,4-присоединения кратная связь перемещается в центр молекулы, то есть во второе положение. В данном примере получается 1,4-дибромбутен-2.
Направление реакции зависит в первую очередь от температуры, но для нас это не так важно. Если подобное уравнение встретится в цепочках превращений, то по продукту реакции, указанному в цепочке, будет понятно, по какому направлению пошло присоединение.
И вторая важная особенность этих реакций то, что они могут протекать по двум ступеням — сначала присоединяется одна молекула реагента, затем вторая.
В таких случаях в цепочках обычно указывают над стрелкой, сколько моль реагента вступит в реакцию. Если один, то очевидно, что реакция пойдет только по одной ступени с сохранением одной двойной связи. Если будет указано два моля, то присоединение произойдет с разрушением обеих двойных связей.
Второе свойство — гидрогалогенирование, присоединение галогеноводородов.
Здесь также возможно 1,4- или 1,2-присоединение. Главное, на что надо обратить внимание — в случае 1,2-присоединения оно идет по правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода.
Третье свойство — гидрирование, присоединение водорода.
Здесь все просто — катализатор платина, продукт — предельный углеводород, в данном случае бутан.
Четвертое свойство, пожалуй, самое важное — полимеризация.
Полимеризацией бутадиена и изопрена получают материал каучук, являющийся основой резиновых изделий, например, автомобильных покрышек и камер.
Из бутадиена-1,3 получают полимер — полибутадиен, называемый бутадиеновый каучук.
Из изопрена получают изопреновый каучук, полиизопрен.
Обратите внимание, что в обоих случаях остается одна двойная связь и она перемещается в центр мономерного звена.
Вам нужно запомнить самое главное: бутадиеновый — синтетический каучук, изопреновый — природный, натуральный каучук. Этот вопрос может встретиться на ЕГЭ. Разумеется, в современной химической промышленности найдены способы получения изопренового каучука, не уступающего по качеству натуральному.
Качественный каучук имеет стереорегулярное строение, то есть образует цепи с цис-ориентацией, то есть цис-полиизопрен. Когда заместители расположены по одну сторону от двойных связей. Это обеспечивает характерную упругость резиновым изделиям, то есть способность возвращаться в первоначальную форму после деформации.
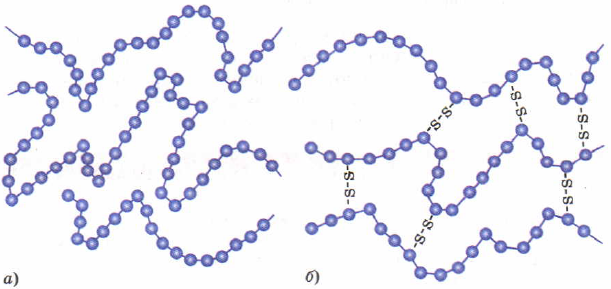
Для повышения прочности каучука проводят его вулканизацию, нагревание с серой. Сера создает мостики, между полимерными цепями, сшивая их между собой.
Строение каучука (а) и резины (б).
Вулканизированный каучук называется резиной. Чем больше будет таких дисульфидных мостиков, тем менее эластичным будет материал. В конце концов он станет твердым, такой материал называется эбонит. Помните из физики — эбонитовая палочка, потертая о шерсть, заряжается отрицательно?
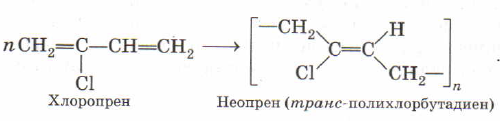
Дополнительно напомню про существование еще одного вида каучуков, который желательно помнить. Речь о хлоропреновом каучуке. Этот полимерный материал делается из 2-хлорбутадиена-1,3, имеющего тривиальное название хлоропрен.
Предлагаю вспомнить два уравнения реакции, которые приводят к получению хлоропрена.
Во-первых, это димеризация ацетилена.
Катализаторы — хлорид меди 1 и хлорид аммония. Чтобы вы не сильно боялись, отмечу, что знание этих катализаторов на экзамене у вас проверять не будут. Продукт реакции — винилацетилен, имеющий и двойную, и тройную связь в составе углеродной цепи.
Вторая реакция — присоединение хлороводорода к венилацетилену.
Здесь важным условием является наличие солей ртути. Напомню, что этот катализатор характерен для реакций гидрогалогенирования и гидратации для алкинов в целом.
В конце разговора о химических свойствах алкадиенов следует упомянуть о пятом свойстве в общем списке — это горение, полное окисление.
Как и все углеводороды, диены сгорают до воды и углекислого газа. Уравнение реакции сгорания в общем виде будет аналогично уравнению сгорания алкинов. Как оно выводится, вы можете посмотреть в видео, посвященном химическим свойствам алкинов.
Мы рассмотрели пять химических свойств алкадиенов, обсудили особенности присоединения по двойным связям, поговорили о бутадиеновом, синтетическом, и изопреновом, натуральном, каучуках.
12.03.2020
Химические свойства алкадиенов
Содержание
- 1 Химические свойства алкадиенов
- 1.1 Реакции алленов
- 1.2 Типичные реакции сопряженных алкадиенов
- 2 Качественные реакции (таблица)
Химические свойства алкадиенов
Характерные реакции диенов аналогичны взаимодействиям, в которых участвуют алкеновые углеводороды, однако из-за типологических различий, вызванных появлением второй связи С=С, диенам свойственны некоторые особенности.
Реакции алленов
Диены с кумулированными связями сходны по свойствам с алкенами и присоединяют водород, гидроксогруппу или галогены по обеим связям по донорно-акцепторному механизму:
Аллены – неустойчивые соединения. В щелочной или кислой среде они претерпевают молекулярные перегруппировки с образованием сопряженных диенов либо алкинов:
;
.
Типичные реакции сопряженных алкадиенов
При наличии сопряжения специфика протекания химических взаимодействий, в первую очередь присоединения, обусловлена резонансным, или мезомерным, эффектом. Он состоит в непрерывном смещении электронной плотности по сопряженной системе.
Реакции присоединения
Для алкадиенов с сопряжением характерно преимущественное присоединение к 1 и 4 позициям системы с появлением двойной связи между атомами 2 и 3. Реакция идет с промежуточной стадией, на которой возникает карбониевый ион – карбкатион:
Гидрирование
Так как в мезомерном карбониевом катионе существуют два реакционных центра, водород присоединяется и по 4, и по 2 положению:

Диены присоединяют водород и как свободный радикал. В этом случае гидрирование алкадиенов протекает главным образом по положению 1,4:
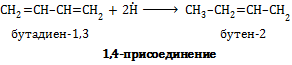
Галогенирование
Результатом процесса является смесь, в которой соотношение продуктов 1,2- и 1,4-присоединения определяют условия реакции (1:4 при -80℃ и 4:1 при +40℃):

Гидратация и гидрогалогенирование
Аналогично алкадиены присоединяют водород и галоген, водород и гидроксогруппу:

Полимеризация
Сопряженные диены полимеризуются присоединением по обеим связям С=С с образованием каучуков.
Промышленное значение имеет полимеризация алкадиенов в соответствии с первыми двумя типами присоединения.
Натуральный каучук синтезируется как цис-полимер 2-метилбутадиена (изопрена) в соке тропического растения гевея. Продукт транс-полимеризации изопрена – гуттаперча.
Важную роль играют процессы сополимеризации диенов с другими соединениями, позволяющие получать материалы с заданными свойствами:

Реакции окисления
Диены охотно окисляются. Состав продуктов окисления зависит от условий.
Мягкое окисление
В нейтральной среде на холоду раствор перманганата калия окисляет диены до четырехатомных спиртов. Процесс обусловлен распадом π-связей и не сопровождается разрушением углеродного скелета.
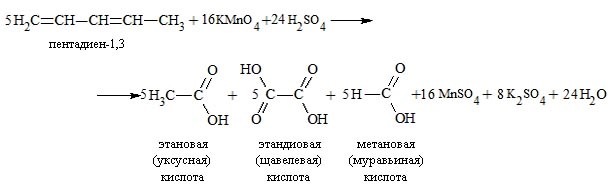
Жесткое окисление
В присутствии кислоты полностью распадаются связи С=С, а углеродные атомы 1, 2, 3, 4 соединяются с гидроксильными и кислородными радикалами:
Полное окисление
Процессы горения алкадиенов в зависимости от количества реагирующего кислорода происходят с образованием разных продуктов по общей схеме:

;
;
.
Это интересно:
Вещества и их свойства. Чистые вещества и смеси. Превращения веществ
Понятие химического элемента. Простые и сложные вещества
Качественные реакции (таблица)
Для установления класса органического соединения используются несколько характерных реакций. Поскольку главный признак алкадиенов – две связи типа С=С, методы ее обнаружения аналогичны качественным реакциям на прочие непредельные углеводороды – алкены и алкины.
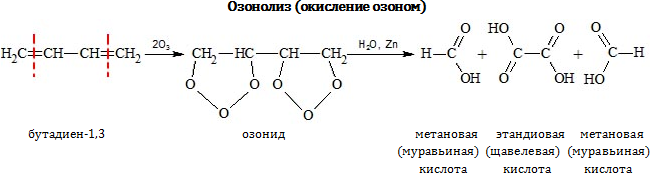
Существуют также методы, позволяющие определить, в каких позициях находятся двойные связи в исследуемом соединении. При разрушении связей С=С фрагменты углеродного скелета образуют новые соединения, состав которых дает возможность судить о структуре диена.
 |
 |
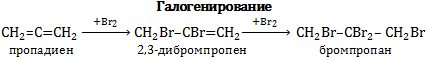 |
|
 |
 |
 |
|
 |
 |
 |
 |
 |
 |
Применение качественных реакций – первый этап исследования органического вещества. Точное установление его состава и структуры производится посредством физико-химических и физических методов анализа.
Оценка статьи:
Загрузка…
Краткое описание документа:
АЛКАДИЕНЫ.
Это углеводороды, содержащие две двойные связи. Первый член ряда – С3Н4 (пропадиен или аллен). В названии появляется суффикс – ДИЕН.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
АЛКАДИЕНЫ.
Это углеводороды, содержащие две двойные связи. Первый член ряда – С3Н4 (пропадиен или аллен). В названии появляется суффикс – ДИЕН.
|
СН2=СН –СН=СН2 бутадиен-1,3 (дивинил) |
СН2=С –СН=СН2 │ 2-метилбутадиен-1,3 СН3 (изопрен) |
Типы двойных связей в диенах:
|
1.Изолированные двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2. Диены этого типа проявляют свойства, характерные для алкенов. |
|
2. Кумулированные двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен) Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений. |
|
3.Сопряженные двойные связи разделены одной σ-связью: СН2=СН–СН=СН2 Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода. |
Изомерия диенов
|
1. Изомерия положения двойных связей: |
|
2. Изомерия углеродного скелета: |
|
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения: |
|
4. Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию. (1)Цис-изомер (2) Транс-изомер |
Электронное строение сопряженных диенов.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2—гибридизованном состоянии и имеет плоское строение.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
Кратность связей (число общих электронных пар) между атомами углерода имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
ХИМИЧЕСКИЕ СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
|
РЕАКЦИИ ПРИСОЕДИНЕНИЯ К СОПРЯЖЕННЫМ ДИЕНАМ. Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит по электрофильному механизму (как в алкенах). Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей: Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). |
|
1. Гидрирование. CН3-СН2-СН=СН2 (1,2-продукт) СН2=СН-СН=СН2 + Н2 СН3-СН=СН-СН3 (1,4-продукт) В присутствии катализатора Ni получается продукт полного гидрирования: CH2=CH-CH=CH2 + 2 H2 –(Ni,t)🡪 CH3-CH2-CH2-CH3 |
|
2. Галогенирование, гидрогалогенирование и гидратация 1,4-присоединение. 1,2-присоединение. При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана. |
|
3. Реакция полимеризации. Реакция протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком: nСН2=СН-СН=СН2 🡪 (-СН2-СН=СН-СН2-)nполимеризация изопрена: nCH2=C–CH=CH2 🡪( –CH2 –C =CH –CH2 –)n │ │ CH3 CH3 (полиизопрен) |
|
РЕАКЦИИ ОКИСЛЕНИЯ – мягкое, жесткое, а также горение. Протекают так же, как и в случае алкенов – мягкое окисление приводит к многоатомному спирту, а жесткое окисление – к смеси различных продуктов, зависящих от строения диена: СН2=СН –СН=СН2 + KMnO4 + H2O 🡪 СН2 – СН – СН – СН2 +MnO2 + KOH │ │ │ │ OH OH OH OH |
|
Алкадиены горят – до углекислого газа и воды. С4Н6 + 5,5О2 🡪 4СО2 + 3Н2О |
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
|
1. Каталитическое дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах: Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен: |
|
2. Синтез Лебедева: (катализатор – смесь оксидов Al2O3,MgO,ZnO 2 C2H5OH –( Al2O3,MgO,ZnO, 450˚C)🡪 CH2=CH-CH=CH2 + 2H2O + H2 |
|
3. Дегидратация двухатомных спиртов: |
|
4. Действие спиртового раствора щелочи на дигалогеналканы (дегидрогалогенирование): |