Алканы. Тематические тесты для подготовки к ЕГЭ.
Алканы. Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для метана:
1) является гомологом пентана
2) при нормальных условиях является жидкостью
3) может быть получен гидролизом карбида кальция
4) является основным компонентом природного газа
5) может быть получен сплавлением пропионата калия с твердой щелочью
Решение
Ответ: 14
Задание №2
Выберите два утверждения, которые справедливы и для этана, и для пентана:
1) являются изомерами друг друга
2) все атомы углерода в молекулах находятся в состоянии sp2— гибридизации
3) могут образоваться в результате взаимодействия моногалогеналканов с металлическим натрием
4) все связи в молекулах ковалентные
5) являются основными компонентами природного газа.
Решение
Ответ: 34
Задание №3
Выберите два свойства, которые характерны для всех алканов с длиной углеродной цепи менее 15 углеродных атомов:
1) не имеют запаха
2) встречаются в природе
3) имеют изомеры
4) имеют гомологи
5) общая формула CnH2n
Решение
Ответ: 24
Задание №4
Выберите два утверждения, которые не справедливы для этана
1) молекула имеет плоское строение
2) все атомы связаны только σ-связями
3) входит в состав природного газа
4) может быть получен из карбида алюминия
5) не имеет запаха
Решение
Ответ: 14
Задание №5
Выберите два утверждения, справедливые и для гексана, и для гептана:
1) являются жидкостями при нормальных условиях
2) входят в состав нефти
3) могут быть получены гидрированием циклогексана и метилциклогексана соответственно
4) являются изомерами друг друга
5) содержат σ и π-связи в молекуле.
Решение
Ответ: 12
Задание №6
Выберите два утверждения, которые справедливы для пропана:
1) может быть получен гидрированием пропилена
2) является изомером пентана
3) плохо растворим в воде
4) образуется при декарбоксилировании пропионата калия
5) используется для получения полиэтилена
Решение
Ответ: 13
Задание №7
Выберите два утверждения, справедливые как для пропана, так и для гексана
1) относятся к непредельным углеводородам
2) имеют линейное строение молекулы
3) все атомы углерода находятся в состоянии sp3-гибридизации.
4) при нормальных условиях жидкости
5) являются гомологами метана
Решение
Ответ: 35
Задание №8
Выберите два свойства, которые характерны для всех алканов:
1) невозможность геометрической изомерии
2) хорошая растворимость в воде
3) могут быть получены в реакциях дегидрирования
4) входят в состав нефти и природного газа
5) все связи в молекуле ковалентные полярные
Решение
Ответ: 14
Задание №9
Для алканов характерно
1) наличие межклассовых изомеров
2) плохая растворимость в воде
3) могут быть получены в реакции нитрования
4) не входят в состав нефти
5) имеют общую формулу гомологического ряда CnH2n+2
Решение
Ответ: 25
Задание №10
Из перечисленных способов выберите два таких, которыми может быть получен пропан:
1) взаимодействие хлорэтана с металлическим натрием
2) гидрирование циклопропана
3) электролиз водного раствора пропаноата калия
4) крекинг гептана
5) гидролиз карбида алюминия.
Решение
Ответ: 24
[adsp-pro-3]
Задание №11
Выберите два способа, которыми нельзя получить бутан:
1) взаимодействие хлорэтана с металлическим натрием
2) гидратация бутена-1
3) электролиз водного раствора пропаноата калия
4) крекинг гептана
5) сплавление пропионата калия с гидроксидом калия
Решение
Ответ: 25
Задание №12
Из предложенного перечня веществ выберите два таких, с которыми реагирует метан:
1) водород
2) натрий
3) азотная кислота
4) пропан
5) бром
Решение
Ответ: 35
Задание №13
Из предложенного перечня, выберите два таких типа реакций, в которые могут вступать все алканы:
1) горения
2) обмена
3) разложения
4) присоединения
5) изомеризации
Решение
Ответ: 13
Задание №14
Из предложенного перечня реакций, выберите две таких, в которые может вступать как метан, так и бутан:
1) окисление раствором перманганата калия
2) дегидрирование
3) изомеризация в присутствии AlCl3
4) горение на воздухе
5) гидролиз
Решение
Ответ: 24
Задание №15
Из предложенного перечня реакций, выберите две таких, в которые может вступать бутан:
1) гидролиз
2) крекинг
3) гидрирование
4) гидратация
5) изомеризация
Решение
Ответ: 25
Задание №16
Из предложенного перечня выберите две пары таких реагентов, с каждым из которых реагирует этан:
- 1. O2, KMnO4
- 2. Cl2, O2
- 3. HNO3, Br2
- 4. HCl, HNO3
- 5. Cl2, H2
Решение
Ответ: 23
Задание №17
Из предложенного перечня реакций выберите две такие, в которые может вступать гексан:
1) крекинг
2) присоединение
3) гидратация
4) дегидроциклизация
5) гидролиз
Решение
Ответ: 14
Задание №18
Реакция пропана с хлором является
1) экзотермической
2) замещения
3) эндотермической
4) каталитической
5) разложения
Решение
Ответ: 12
Задание №19
Из предложенного перечня выберите два утверждения справедливые для гептана:
1) при нормальных условиях является газом
2) при дегидроциклизации из него образуется толуол
3) присоединяет воду
4) не вступает в реакцию с раствором азотной кислоты
5) при нагревании подвергается крекингу
Решение
Ответ: 25
Задание №20
Как метан, так и бутан могут вступать в реакции
1) окисления раствором дихромата калия
2) гидрогалогенирования
3) изомеризации в присутствии AlCl3
4) замещения с азотной кислотой
5) каталитического окисления кислородом воздуха
Решение
Ответ: 45
[adsp-pro-3]
Задание №21
Из предложенного перечня утверждений, выберите два таких, которые справедливы для алканов:
1) алканы хорошо растворимы в воде
2) при ароматизации гексана образуется бензол
3) во всех реакциях разложения алканов получается сажа
4) алканы вступают в реакцию с бромной водой
5) алканы можно получить из алкенов
Решение
Ответ: 25
Задание №22
Выберите утверждения верные для пропана
1) входит в состав природного газа
2) может быть получен дегидрированием пропена
3) реагирует с бромоводородной кислотой
4) хорошо растворим в воде
5) может быть получен гидрированием циклопропана
Решение
Ответ: 15
Задание №23
Из предложенного перечня утверждений выберите два таких, которые справедливы для метана:
1) обесцвечивает водный раствор перманганата калия
2) является основным компонентом природного газа
3) степень окисления углерода в молекуле равна +4
4) температура разложения метана до простых веществ составляет 15000С
5) атомы углерода находятся в состоянии sp3-гибридизации.
Решение
Ответ: 25
Задание №24
Из предложенного перечня реакций выберите две такие, с помощью которых может быть получен алкан:
1) взаимодействие моногалогеналканов с щелочью
2) взаимодействие моногалогеналканов с натрием
3) взаимодействие алкадиенов с водородом
4) дегидратация этанола
5) дегидрирование циклогексана
Решение
Ответ: 23
Задание №25
Пропан в отличие от гексана
1) в обычных условиях представляет собой жидкость
2) является гомологом метана
3) не имеет изомеров
4) не вступает в реакции дегидроциклизации
5) вступает в реакцию с раствором азотной кислоты
Решение
Ответ: 34
Задание №26
Реакции галогенирования алканов протекают
1) при ярком освещении
2) в присутствии катализатора
3) в присутствии серной кислоты
4) с образованием только одного галогенпроизводного
5) по радикальному механизму
Решение
Ответ: 15
Задание №27
Гексан в отличие от пропана
1) реагирует с водородом
2) имеет запах
3) может быть в одну стадию превращен в бензол
4) вступает в реакцию замещения с хлором
5) горит на воздухе
Решение
Ответ: 23
Задание №28
Реакция бромирования пропана
1) относится к реакциям присоединения
2) может протекать при нагревании
3) относится к каталитическим процессам
4) протекает преимущественно с образованием 2-бромпропана
5) протекает преимущественно с образованием 1-бромпропана
Решение
Ответ: 24
Задание №29
Из предложенного перечня утверждений выберите два таких, которые справедливы и для бутана, и для этана:
1) растворимы в воде
2) могут быть получены крекингом алканов
3) вступают в реакцию обмена с хлором
4) вступают в реакцию гидратации
5) входят в состав природного газа
Решение
Ответ: 25
Задание №30
Метан в отличие от гексана
1) плохо растворим в воде
2) не имеет запаха
3) при каталитическом окислении образует метаналь
4) вступает в реакцию нитрования
5) имеет плоское строение молекул
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Реакция галогенирования пропана:
1) является реакцией замещения, протекает по ионному механизму
2) является реакцией замещения, протекает по радикальному механизму
3) является эндотермической
4) протекает в присутствии платины, как катализатора
5) приводит к образованию смеси галогенпроизводных
Решение
Ответ: 25
Задание №32
Метан в отличие от бутана
1) при каталитическом окислении образует метанол
2) при каталитическом окислении образует уксусную кислоту
3) сгорает с образованием углекислого газа и воды
4) имеет запах
5) является основным компонентом природного газа
Решение
Ответ: 15
Задание №33
Бутан, в отличие от этана
1) при нормальных условиях представляет собой жидкость
2) при дегидрировании способен образовывать как алкен, так и алкадиен
3) способен вступать в реакцию присоединения с хлором
4) может вступать в реакцию изомеризации
5) реагирует с гидроксидом натрия
Решение
Ответ: 24
Задание №34
Бутан, также как и этан
1) хорошо растворим в воде
2) может быть получен из моногалогеналкана его взаимодействием с активным металлом
3) вступает в реакцию присоединения с хлором
4) вступает в реакцию с разбавленной азотной кислотой при нагревании
5) реагирует с хлороводородом
Решение
Ответ: 24
Задание №35
Реакция бутана с хлором
1) относится к реакциям соединения
2) экзотермическая
3) начинается с разрыва связи в молекуле хлора
4) протекает в присутствии воды
5) протекает по ионному механизму
Решение
Ответ: 23
Задание №36
Для пропана характерны
1) реакция окисления подкисленным раствором дихромата калия
2) реакции отщепления водорода
3) реакция изомеризации
4) взаимодействие со спиртовым раствором щелочи
5) реакция с хлором при освещении
Решение
Ответ: 25
Задание №37
Для этана верны утверждения
1) газ с неприятным запахом
2) используется для получения этилена
3) образуется при электролизе водного раствора этаноата натрия
4) при его галогенировании образуется метилхлорид
5) обесцвечивает бромную воду
Решение
Ответ: 23
Задание №38
Гомологами этана являются
1) 2-метилпропан
2) метан
3) 2,2-диметилбутан
4) пентан
5) этен
Решение
Ответ: 24
Задание №39
При галогенировании этана, возможно образование продуктов
1) хлорэтан
2) хлорэтен
3) 1,1-дибромэтан
4) 2,2-дихлорэтан
5) хлорметан
Решение
Ответ: 13
Задание №40
Структурным изомером гептана является
1) метилциклогексан
2) 2,3-диметилпентан
3) 2,3-диметилбутен-2
4) 2,5-диметилгексан
5) 2-метилгексан
Решение
Ответ: 25
[adsp-pro-3]
Задание №41
Из предложенного перечня выберите два углеводорода, содержание которых в природном газе является наибольшим:
1) бутан
2) пентан
3) гексан
4) этан
5) этен
Решение
Ответ: 14
Задание №42
Из предложенного перечня веществ выберите два с наименьшей температурой кипения:
1) пентан
2) пропан
3) гексан
4) метан
5) октан
Решение
Ответ: 24
Задание №43
К реакции замещения относится
1) нитрование
2) дегидрирование
3) галогенирование алканов
4) пиролиз
5) крекинг
Решение
Ответ: 13
Задание №44
Бромэтан можно получить
1) взаимодействием этана с бромом на свету
2) взаимодействием этана с бромоводородной кислотой
3) реакцией этана с раствором бромной воды
4) реакцией гидрогалогенирования этена
5) взаимодейстием дибромэтана с раствором щелочи
Решение
Ответ: 14
Задание №45
Реакцией, приводящей к укорачиванию углеродной цепи является
1) реакция декарбоксилирования солей карбоновых кислот при сплавлении со щелочами
2) крекинг алканов
3) разложение солей карбоновых кислот и щелочноземельных металлов при нагревании
4) реакция нитрования
5) дегидрирование алканов
Решение
Ответ: 12
Задание №46
При дегидроциклизации октана могут образоваться
1) толуол
2) 1,2- диметилбензол
3) бутан и бутен
4) этилбензол
5) октен
Решение
Ответ: 24
Задание №47
Структурными изомерами н-гексана являются
1) пентан
2) 2,2-диметилбутан
3) 2,2-диметилпропан
4) гептан
5) 3-метилпентан
Решение
Ответ: 25
Задание №48
Выберите два утверждения, которые справедливы для характеристики реакции пропана с хлором:
1) приводит к преимущественному образованию 2-хлорпропана
2) начинается с разрыва связей в молекуле пропана
3) происходит в присутствии катализатора
4) протекает по ионному механизму
5) протекает по радикальному механизму
Решение
Ответ: 15
Задание №49
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) относится к реакциям соединения
2) единственным продуктом реакции является хлорметан
3) идет по радикальному механизму
4) при ярком освещении
5) является эндотермической
Решение
Ответ: 34
Задание №50
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) относится к реакциям разложения
2) протекает с образованием различных хлорпроизводных
3) идет по ионному механизму
4) реакция протекает и в темноте
5) является экзотермической
Решение
Ответ: 25
[adsp-pro-3]
Задание №51
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) начинается с разрыва связей в молекуле метана
2) протекает с образованием только хлорэтана
3) идет по ионному механизму
4) является не каталитическим процессом
5) начинается с разрыва связей в молекуле хлора
Решение
Ответ: 45
Задание №52
Выберите два утверждения, которые справедливы для характеристики реакции 2-метилпропана с хлором:
1) протекает по правилу Марковникова
2) с промежуточным образованием частицы карбкатиона (СН3-СН+-СН3)
3) включает последовательно стадии: начало, развитие и обрыв цепи
4) протекает при условии яркого освещения в начале реакции
5) протекает по правилу Зайцева
Решение
Ответ: 34
Задание №53
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) начинается с разрыва связи между атомами углерода
2) протекает по радикальному механизму
3) включает последовательно стадии: начало, развитие и разрыв цепи
4) является окислительно-восстановительной
5) является каталитической
Решение
Ответ: 24
Задание №54
Выберите два утверждения, в которых приведены реакции, протекающие по радикальному механизму:
1) метана и хлора
2) пропена и хлороводорода
3) этана и азотной кислоты
4) этена и бромной воды
5) дегидрирование этана
Решение
Ответ: 13
Задание №55
По радикальному механизму протекают реакции
1) С3Н6 + Н2O = С3Н7ОН
2) СН4 + Сl2 = СН3Сl + НСl
3) С2Н6 + HNO3 = C2H5NO2 + H2O
4) С2Н2 + Н2O = СН3СНО
5) С2Н6 → С2Н4 + Н2
Решение
Ответ: 23
Задание №56
Из предложенного перечня выберите соответственно стадии развития и обрыва цепи, протекающие при хлорировании метана:
1) Сl2 → 2Сl•
2) СН4 → СН3 + Н•
3) Сl• + СН4 → НСl + СН3•
4) СН4 → С + 4Н
5) СН3• + Cl• → СН3Сl
Решение
Ответ: 35
Задание №57
Из предложенного перечня выберите два процесса, которые не протекают при хлорировании метана:
1) СН4 → СН3• + Н•
2) Сl2 → 2Сl•
3) Сl• + СН4 → НСl + СН3•
4) СН4 → С + 4Н•
5) СН3• + Cl• → СН3Сl
Решение
Ответ: 14
Задание №58
В одну стадию бутан можно получить из
1) пропионата натрия
2) бутанола-2
3) циклобутана
4) масляной кислоты
5) ацетата натрия
Решение
Ответ: 13
Задание №59
Выберите два вещества, которые являются гомологами 2-метилбутана
1) пентан
2) 2-метилгептан
3) 2-метилпропан
4) 2,2-диметилпропен
5) 1,1-диметилциклопропан
Решение
Ответ: 23
Задание №60
Выберите два утверждения, которые верны для алканов:
1) не содержатся в природе
2) окисляются раствором перманганата калия
3) реагируют с бромом
4) вступают в реакции замещения по ионному механизму
5) вступают в реакции замещения по радикальному механизму
Решение
Ответ: 35
[adsp-pro-3]
Алканы. Задания на установление соответствия.
Задание №1
Установите соответствие между формулой алкана и его структурным изомером
| АЛКАН | ИЗОМЕР АЛКАНА |
|
А) пентан Б) 2-метилбутан В) 2,2,3-триметилбутан Г) пропан |
1) 2,3,4-триметилпентан 2) бутан 3) 2,2,3-триметилпентан 4) 2,2-диметилпропан 5) 2,2-диметилпентан 6) изомеры отсутствуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4456
Задание №2
Установите соответствие между формулой алкана и реакцией, в которой он может быть получен: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | СПОСОБ ПОЛУЧЕНИЯ |
|
А) метан Б) этан В) пентан |
1) декарбоксилирование бутаноата калия 2) электролиз раствора этаноата калия 3) кислотный гидролиз карбида алюминия 4) взаимодействие 1-хлорпропана и этилхлорида с натрием 5) гидрирование метилциклопропана |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 324
Задание №3
Установите соответствие между формулой алкана и основным продуктом его взаимодействия с хлором в молярном соотношении 1 к 2 соответственно: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) пропан Б) 2,2-диметилбутан В) этан Г) 2,3-диметилбутан |
1) 2,2-диметил-1,1-дихлорбутан 2) 2,2-дихлорпропан 3) 1,1-дихлорэтан 4) 3,3-диметил-2,2-дихлорбутан 5) 2,3-диметил-2,3-дихлорбутан 6) 1,2-дихлорэтан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2435
Задание №4
Установите соответствие между формулой алкана и основным продуктом его взаимодействия с раствором азотной кислоты: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) пропан 2) 2-метилпропан 3) 2,2-диметилпропан 4) 2,2-диметилбутан |
1) 2-нитро-3,3-диметилбутан 2) 1-нитро-2,2-диметилбутан 3) 2-нитро-2-метилпропан 4) 2-нитропропан 5) 1-нитропропан 6) 1-нитро-2,2-диметилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4361
Задание №5
Установите соответствие между формулой алкана и возможным продуктом его дегидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| АЛКАН | ПРОДУКТ ДЕГИДРИРОВАНИЯ |
|
А) гексан Б) 2-метилгексан В) гептан Г) этан |
1) этин 2) этилциклогексан 3) бензол 4) о-ксилол 5) этилен 6) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3665
[adsp-pro-3]
Задание №6
Установите соответствие между формулой алкана и возможным продуктом его дегидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ДЕГИДРИРОВАНИЯ |
|
А) метан Б) пропан В) гептан Г) бутан |
1) бутин-2 2) этин 3) бензол 4) пропен 5) дивинил 6) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2465
Задание №7
Установите соответствие между моногалогеналканом и продуктом его взаимодействия с металлическим натрием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ПРОДУКТ |
|
А) хлорэтан Б) 2-хлорпропан В) 2-хлор-2-метилпропан Г) 2-бромбутан |
1) гексан 2) бутан 3) 2,3-диметилбутан 4) октан 5) 3,4-диметилгексан 6) 2,2,3,3-тетраметилбутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2365
Задание №8
Установите соответствие между участниками реакции и органическим продуктом, образующимся в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УЧАСТНИКИ РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
А) хлорэтан + хлорметан + натрий Б) 2-хлорпропан + хлорметан + калий В) 1-хлорпропан +2-хлорпропан + калий Г) 2-бромбутан + этилбромид + натрий |
1) 2-метилбутан 2) 2,2-диметилпропан 3) 3-метилпентан 4) пропан 5) 2-метилпентан 6)2-метилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4653
Задание №9
Установите соответствие между формулой соли карбоновой кислоты и органическим продуктом, который образуется при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) ацетат калия Б) пропионат калия В) бутаноат натрия Г) 2-метилпропионат калия |
1) гексан 2) бутан 3) 2,3-диметилбутан 4) пропан 5) этан 6) 3,4-диметилгексан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5213
Задание №10
Установите соответствие между формулой соли карбоновой кислоты и продуктом, который образуется при сплавлении ее со щелочью: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) ацетат натрия Б) пропионат калия В) 2-метилпропионат калия Г) 2,2-диметилпропионат калия |
1) 2,2-диметилпропан 2) этан 3) бутан 4) пропан 5) метан 6) 2-метилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5246
[adsp-pro-3]
Задание №11
Установите соответствие между схемой реакции и органическим продуктом, который образуется в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ |
|
А) метан + 3моль Сl2 → Б) метан + О2 кат→ В) бутан + HNO3 (р-р) (to)→ Г) этан + HCl → |
1) метаналь 2) хлороформ 3) хлорметан 4) хлорэтан 5) 2-нитробутан 6) реакция не возможна |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2156
Задание №12
Установите соответствие между реакцией и органическим продуктом, который может быть в результате нее получен: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ПРОДУКТ РЕАКЦИИ |
|
А) дегидрирование бутана Б) неполный пиролиз метана В) каталитическое окисление бутана Г) крекинг бутана |
1) этан 2) ацетилен 3) этановая кислота 4) бутадиен-1,3 5) углерод 6) метановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4231
Задание №13
Установите соответствие между процессом и возможным продуктом, получаемым в результате него: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ПРОДУКТ |
|
А) паровая конверсия метана Б) дегидроциклизация гексана В) дегидрирование пропана Г) ароматизация октана |
1) бензол 2) циклопропан 3) синтез-газ 4) пропен 5) этилбензол 6) метилбензол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3145
Применение алканов. Задания с выбором трех вариантов ответа.
Задание №1
Из предложенного перечня областей применения веществ выберите три, не подходящих для метана.
1) синтез уксусной кислоты
2) получение синтез-газа
3) в реакциях синтеза полимеров
4) получение сажи
5) получение водорода
6) получение циклопропана
Решение
Ответ: 136
Задание №2
Из предложенного перечня веществ выберите три вещества, которые могут быть получены из метана в одну стадию:
1) хлороформ
2) этанол
3) формальдегид
4) этин
5) циклогексан
6) этановая кислота
Решение
Ответ: 134
Задание №3
Из предложенного перечня выберите три вещества, которые могут быть получены в одну стадию из бутана:
1) этанол
2) дивинил
3) изопрен
4) ацетилен
5) бутен
6) этановая кислота
Решение
Ответ: 256
Задание №4
Из предложенного перечня областей применения веществ выберите три, подходящих для метана.
1) синтез этановой кислоты
2) получение формальдегида
3) в реакциях синтеза каучуков
4) в качестве топлива
5) получение ацетилена
6) получение циклогексана
Решение
Ответ: 245
Цепочки на алканы.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
Al4C3 X1
X2
X3
X4
X5
X6
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
C2H6 X1
X2
X3
X4
X5
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
пропан 2-хлорпропан
2,3-диметилбутан
Решение
Ответ:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
н-бутан этан
бромэтан
бутан
изобутан
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
карбид алюминия метан
X1
X2
X3
C4H10
Решение
[adsp-pro-3]
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Решение
Задание №7
Навеску неизвестного углеводорода массой 5,8 г сожгли в избытке кислорода. В результате образовалось 17,6 г углекислого газа. Определите молекулярную формулу углеводорода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода:
n(CO2) = m/M = 17,6 л/44 г/моль = 0,4 моль.
Поскольку при горении углеводорода (CxHy) весь углерод переходит в углекислый газ, то n(CO2) = n(C) = 0,4 моль.
Вычислим массу углерода, входящего в состав углеводорода:
m(C) = M ⋅ n = 12 г/моль ⋅ 0,4 моль = 4,8 г.
Вычислим массу и количество вещества водорода, входящего в состав углеводорода:
m(H) = m(CxHy) — m(C) = 5,8 г — 4,8 г = 1 г, n(H) = 1 г/1 г/моль = 1 моль.
Количества углерода и водорода в молекуле углеводорода соотносятся между собой как 0,4 : 1 = 2 : 5. Поскольку в молекулу предельного углеводорода входит четное число атомов водорода, тогда индексы удваиваем и записываем молекулярную формулу углеводорода в виде C4H10.
Ответ: C4H10
Задание №8
При полном сгорании навески углеводорода образовалось 1,12 л углекислого газа (н.у.) и 1080 мг водяных паров. Определите молекулярную формулу углеводорода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода:
n(CO2) = V/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Поскольку при горении углеводорода (CxHy) весь углерод переходит в углекислый газ, то n(CO2) = n(C) = 0,05 моль.
Вычислим массу углерода, входящего в состав углеводорода:
m(C) = M ⋅ n = 12 г/моль ⋅ 0,05 моль = 0,6 г.
Вычислим массу и количество вещества водорода, входящего в состав воды:
m(H2O) = m/M = 1,08 г/18 г/моль = 0,06 моль. Тогда n(H) = 2n(H2O) = 2 ⋅ 0,06 моль = 0,12 моль.
Углерод и водород соотносятся между собой как x : y = 0,05 : 0,12 = 5 : 12. Молекулярную формулу искомого углеводорода записываем в виде C5H12.
Ответ: C5H12
Задание №9
При сжигании навески неизвестного углеводорода массой 4,3 г образовалось 6,3 г паров воды и углекислый газ. Определите молекулярную формулу углеводорода и его структуру, если известно, что его молекула содержит два третичных атома углерода.
Решение
Ответ:
Вычислим количество воды, образующейся при горении углеводорода:
n(H2O) = m/M = 6,3 г/18 г/моль = 0,35 моль.
Тогда количество и масса содержащегося в ней водорода составит n(H) = 2n(H2O) = 0,35 моль ⋅ 2 = 0,7 моль,
m(H) = 0,7 моль ⋅ 1 г/моль = 0,7 г.
Вычислим массу и количество вещества углерода, входящего в состав углеводорода:
m(C) = m(CxHy) — m(H) = 4,3 г — 0,7 г = 3,6 г,
n(C) = m/M = 3,6 г/12 г/моль = 0,3 моль.
Углерод и водород соотносятся между собой как x : y = 0,3 : 0,7 = 3 : 7. Поскольку в молекулу предельного углеводорода входит четное число атомов водорода, тогда индексы удваиваем и записываем молекулярную формулу углеводорода в виде C6H14.
Поскольку углеводород содержит 2 третичных атома углерода, то его структурой является 2,3-диметилбутан:
Ответ: C6H14
[adsp-pro-3]
Задание №10
Навеску неизвестного углеводорода массой 3,6 г сожгли в избытке кислорода и получили 5,6 л углекислого газа (н.у.) и пары воды. Определите молекулярную формулу углеводорода и его структуру, если известно, что его бромирование приводит к единственному монобромпроизводному.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода (CxHy):
n(CO2) = V/Vm = 5,6 л/22,4 л/моль = 0,25 моль.
При горении углеводорода весь содержащийся в нем углерод переходит в углекислый газ,
тогда n(C) = n(CO2) = 0,25 моль.
Вычислим массу углерода: m(C) = M ⋅ n = 12 г/моль ⋅ 0,25 моль = 3 г.
Масса и количество вещества водорода, входящего в структуру углеводорода, составляет:
m(H) = m(CxHy) — m (C) = 3,6 г — 3 г = 0,6 г, n(H) = 0,6 г/1 г/моль = 0,6 моль.
Углерод и водород соотносятся между собой как x : y = 0,25 : 0,6 = 5 : 12. Поскольку бромирование углеводорода приводит к единственному монобромпроизводному, то структурную формулу исходного углеводорода (2,2-диметилпропан — C5H12) представим в виде:
Ответ: C5H12
Задание №11
При сгорании навески неизвестного алкана образовалось 5,5 г углекислого газа и 2,7 г воды. Определите молекулярную формулу углеводорода и его структуру, если известно, что его молекула имеет разветвленный скелет и один вторичный атом углерода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода (CxHy):
n(CO2) = m/M = 5,5 г/44 г/моль = 0,125 моль.
При горении углеводорода весь содержащийся в нем углерод переходит в углекислый газ,
тогда n(C) = n(CO2) = 0,125 моль.
Количество вещества воды и водорода, входящего в структуру углеводорода, составляет:
n(H2O) = m/M = 2,7 г/18 г/моль = 0,15 моль,
тогда n(H) = 2n(H2O ) = 2 ⋅ 0,15 моль = 0,3 моль.
Углерод и водород соотносятся между собой как x : y = 0,125 : 0,3 = 5 : 12. Поскольку молекула углеводорода имеет разветвленный скелет и один вторичный атом углерода, то искомым углеводородом является 2-метилбутан, структурную формулу которого представим в виде:
Ответ: C5H12
[adsp-pro-10]
Пройти тестирование по 10 заданиям
Пройти тестирование по всем заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д18 № 92
Взаимодействие н-бутана с хлором протекает
1) с разрывом связей в молекуле бутана
2) через образование свободных радикалов
3) с преимущественным образованием 1-хлорбутана
4) с образованием нескольких монохлорпроизводных
5) с промежуточным образованием частицы
6) на свету или при нагревании
Ответ запишите цифрами без пробелов
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Задания Д18 № 135
Взаимодействие толуола с бромом на свету протекает
1) с разрывом π-связей в молекуле толуола
2) через образование свободных радикалов
3) как реакция присоединения
4) как реакция замещения
5) с промежуточным образованием частицы
6) по ионному механизму
Ответ запишите цифрами без пробелов
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Задания Д18 № 221
Этан может вступать в реакции
1) замещения
2) присоединения
3) изомеризации
4) разложения
5) горения
6) полимеризации
4
Задания Д18 № 264
По ионному механизму протекают реакции, уравнения которых:
1)
2)
3)
4)
5)
6)
5
Задания Д18 № 307
Для циклогексана справедливы утверждения:
1) при нагревании с катализатором образует толуол
2) реакция гидрирования протекает довольно легко
3) взаимодействует с бромом
4) все атомы углерода находятся в состоянии sp3-гибридизации
5) является изомером гексана
6) не растворяется в воде
Пройти тестирование по этим заданиям
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
— CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos —
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ЕГЭ по химии задание 12
План
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Основные способы получения углеводородов ( в лаборатории)
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Предельные углеводороды
Химические и физические свойства циклоалканов
Непредельные углеводороды
Химические и физические свойства диенов
Химические и физические свойства алкинов
Ароматические углеводороды
Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций.
По составу углеродного скелета делятся на:
ациклические (алифатические) – определяются по числу атомов, с которыми связан углерод; циклические – имеют замкнутую цепь:
- карбоциклические – в цикле присутствуют только атомы углерода, гетероциклические – присутствуют не только атому углерода.
- карбоциклические – в цикле присутствуют только атомы углерода,
- гетероциклические – присутствуют не только атому углерода.
По наличию кратных связей и открытости цепи:
предельные – не имеют кратных связей:
- алканы, циклоалканы. непредельные – имеют кратные связи: алкены, диены, алкины.
- алканы,
- циклоалканы. непредельные – имеют кратные связи:
- алкены,
- диены,
- алкины.
ароматические – имеют бензольное кольцо:
- бензол, гомологи бензола, арены.
- бензол,
- гомологи бензола,
- арены.
Химические свойства алканов
Алканы (парафины) – это соединения, для которых характерна sp 3 -гибридизация и наличие только σ-связи. Используются как источник энергии в промышленности и помощник в получении белка в микробиологии.
I. Реакции замещения
Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей.
- Галогенирование
В ходе взаимодействия с хлором или бромом получается взрывчатое вещество, имеющее практическое значение. Взаимодействие с фтором провоцирует взрыв, не имеющее промышленного отклика. А реакция с йодом протекает очень медленно, поэтому редко проводится.
Идет под воздействием света.
CnH2n+2 + Hal2 → CnH2n+1-Hal + HHal
Замещение водорода проходит у наименее гидрированного атома углерода.
2. Нитрование
1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ.
CnH2n+2 + HO-NO2 → CnH2n+1-NO2 + H2O
3. Сульфирование
CnH2n+2 + HO-SO3H → CnH2n+1-SO3H + H2O
4. Сульфахлорирование
CnH2n+2 + SO2 + Cl2 → CnH2n+1-SO2-Cl + HCl
Эту реакцию используют при мыловарении и в производстве синтетических моющих средств.
II. Реакции с разрывом углерод-углеродной связи
Энергия связи «углерод-углерод» высокая, поэтому она достаточно прочная. Реакций, сопровождающихся разрывом этой связи, немного и все они проходят в жестких условиях.
1. Окисление
При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия.
- Горение
- Горение
C n H 2n+2 + О 2 → СО 2 + Н 2 О
Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть.
- Медленное окисление
- Медленное окисление
Идет в присутствии катализатора.
2 CH 4 + O 2 → 2 СH 3 OH
4 C 4 H 10 + 5 O 2 → 4 CH 3 -COOH + 2 H 2 O
2. Крекинг
Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена.
С 7 Н 16 → СН 3 -СН 2 -СН 2 -СН 3 + СН 3 -СН=СН 2
Крекинг бывает: термическим; каталитическим.
Для каталитической реакции используются катализаторы и меньшие температуры.
III. Реакции с разрывом углерод-водородной связи
Алканы – это вещества, с помощью которых можно получить соединения с кратными связями.
1. Дегидрирование
Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах.
2 CH 4 → C 2 H 2 + 3 H 2
При дегидрировании алканов с длинными углеродными цепями образуются алкены.
СН 3 -СН 3 → СН 2 =СН 2 + Н 2 2. Дегидроциклизация
С 7 Н 16 → С 6 Н 5 -СН 3 + 4 Н 2 3. Изомеризация
Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом.
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3 )-CH 2 -CH 3
Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе.
Химические и физические свойства циклоалканов
Циклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах.
I. Реакции присоединения
Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы.
Галогенирование
Действие галогена различно в зависимости от условий.
- Малые циклы под действием света Малые циклы в нормальных условиях Средние циклы под воздействием света (реакция замещения)
- Малые циклы под действием света
- Малые циклы в нормальных условиях
- Средние циклы под воздействием света (реакция замещения)
2. Взаимодействие с галогеноводородами
Реакция протекает в водном растворе.
В случае несимметричных молекулах соблюдается правило Марковникова.
3. Гидрирование
Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина.
II. Дегидрирование
Высокие температуры (500°С) по-разному действуют на малые и большие циклы.
- Малые
- Большие
III. Горение
Устойчивость к окислителям повышается по гомологическому ряду.
C 6 H 12 + 9 O 2 → 6 CO 2 + 6 H 2 O + Q
Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений.
В природе они способны подвергаться микробиологическому окислению.
Непредельные углеводороды
Химические и физические свойства алкенов
Алкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах.
π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса.
I. Реакции присоединения
Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы.
1. Гидрирование
Реакция протекает под воздействием температуры и катализатора никеля.
CH 3 -CH=CH 2 + H 2 → CH 3 -CH 2 -CH 3
2. Гидрогалогенирование
CH 2 =CH 2 + HCl → CH 3 -CH 2 -Cl
Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее.
Правило имеет несколько исключений.
- Перекисный эффект Карыша.Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода. CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 -Br Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части. F 3 C-CH=CH 2 + HBr → F 3 C-CH 2 -CH 2 -Br
- Перекисный эффект Карыша.Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода.
- CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 -Br
- Присутствие в молекуле алкена электроно-акцепторных функциональных групп в sp 3 -части. F 3 C-CH=CH 2 + HBr → F 3 C-CH 2 -CH 2 -Br
3. Галогенирование
CH 2 =CH 2 + Br 2 → Br-CH 2 -CH 2 -Br 4. Гидратация
Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия.
CH 2 =CH 2 + HOH → CH 3 -CH 2 -OH
II. Реакции полимеризации
Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер.
n CH 2 =CH 2 → (-CH 2 -CH 2 -) n
n CH 3 -CH=CH 2 → (-CH 2 -CH(CH 3 )-) n
III. Реакции замещения (галогенирование)
Реакции замещения водорода могут проходить и у непредельных алкенов, но в их sp 3 -части. Проходят при жестких условиях – температура свыше 500°С.
CH 3 -CH 2 -CH 2 =CH 2 + Cl 2 → CH 3 -CH(Cl)-CH=CH 2 + HCl
IV. Окисление
Идет легко и образует разные продукты в зависимости от условий.
1. Горение
Алкены горят желтым светящимся пламенем.
C n H 2n + O 2 → CO 2 + H 2 O 2. Неполное окисление
Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи.
3CH 2 =CH 2 +4H 2 O + 2KMnO 4 → 3HO-CH 2 -CH 2 -OH + 2MnO 2 + 2KOH
Жесткое окисление
Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ.
5 CH 2 =CH 2 +18 H 2 SO 4 + 12 KMnO 4 → 10 CO 2 + 12 MnSO 4 + 6 K 2 SO 4 + 28 H 2 O CH 3 -CH=CH 2 + 3 H 2 SO 4 + 2 KMnO 4 → CH 3 -COOH + CO 2 + 2 MnSO 4 + K 2 SO 4 + 4 H 2 O
В симметричной молекуле алкена образуется две молекулы одной и той же кислоты.
Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона.
5 (CH 3 ) 2 -C=CH-CH 3 + 8 KMnO 4 + 9 H 2 SO 4 → 5 CH 3 -COOH + 5 CH 3 -C(O)-CH 3 + 6 MnSO 4 + 3 K 2 SO 4 + 9 H 2 O
Жесткое окисление проходит и в щелочной среде.
CH 3 -CH=CH 2 + 10 KMnO 4 + 13 KOH → CH 3 -COOH + K 2 SO 4 + 10 K 2 MnO 4 + 8 H 2 O
Те же реакции проходят в присутствии дихромата калия.
Алкены – это исходный продукт в производстве полимеров и других органических веществ.
Химические и физические свойства диенов
Алкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
с кумулированными связями – примыкают к одному углеродному атому — СН 2 =С=СН 2;
с изолированными связями – разделены одном атомом углерода – СН 2 =СН-СН 2 -СН-СН 2 ;
с конъюгированными связями – разделены одной одинарной связью – СН 2 =СН-СН-СН 2 .
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии.
I. Реакции присоединения
У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения.
1. Гидрирование
CH2=CH-CH=CH2 + H2 → CH3-CH=CH-CH3
2. Галогенирование
CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода.
3. Гидрогалогенирование
Реакция идет при нагревании в 60°С.
CH2=CH-CH=CH2 + HBr → Br-CH2-CH=CH-CH3
II. Полимеризация
В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия.
CH 2 =CH-CH=CH 2 → (-CH 2 -CH=CH-CH 2 -) n
Алкадиены могут обесцвечивать раствор перманганата калия.
Из диенов получают каучуки, из которых производят резину различных марок.
Химические и физические свойства алкинов
Алкины – это органические соединения, имеющие одну тройную связь. По гомологическому ряду температура плавления и кипения увеличивается. В нормальных условиях этин, пропин, бутин – газы, с пентина по гексадецентин – это жидкости, а далее, по увеличению молекулярной массы, — твердые вещества. Температуры кипения у алкинов выше, чем у соответствующих алкенов. Плохо растворяются в воде, хорошо – в органических растворителях.
I. Реакции присоединения
В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения.
Электрофильное присоединение
1. Гидрирование
Идет под действием катализатора никеля.
CH≡CH + H 2 → CH 2 =CH 2 CH 2 =CH 2 + H 2 → CH 3 -CH 3
2. Галогенирование
CH≡CH + Cl 2 → Cl-CH=CH-Cl Cl-CH=CH-Cl + Cl 2 → Cl-CH(Cl)-CH(Cl)-Cl 3. Гидрогалогенирование
CH≡CH + HCl → CH 2 =CH-Cl CH 2 =CH-Cl + HCl → CH 3 -CH(Cl)-Cl 4. Гидратация (реакция Кучерова)
Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути.
CH≡CH + H 2 O → CH 3 -CHO
Нуклеофильное присоединение
1. Присоединение синильной кислоты
Проходит в присутствии меди в аммиачном растворе.
CH≡CH + HCN → CH 2 -CH-CN
2. Присоединение уксусной кислоты
CH≡CH + CH 3 -COOH → CH 3 -C(O)-O-CH=CH 2
3. Присоединение спиртов
CH≡CH + R-OH → CH 2 =CH-O-R
III. Реакции замещения
Замещение происходи у водорода, стоящего при углероде с кратной связью.
1. Взаимодействие с амидом натрия
CH≡CH + NaNH 2 → NaC≡CH + NH 3 2. Взаимодействие с аммикатами серебра или одновалентной медью
CH≡CH + Ag 2 O → Ag-C≡C-Ag + H 2 O CH≡CH + 2 [Ag(NH 3 ) 2 ]OH → CH 3 -C≡C-Ag + 4 NH 3 + 2 H 2 O CH≡C-CH 3 + [Cu(NH 3 ) 2 ]OH → CH 3 -C≡C-Cu + 2 NH 3 + 2 H 2 O
Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.
IV. Окисление
1. Горение
Этин горит с большим выделением тепла.
2 CH≡CH + 5 O 2 → 4 CO 2 + 2 H 2 O + Q
2. Неполное окисление
В нейтральной и слабощелочной средах образуются соли щавелевой кислоты , а окисление гомологов провоцирует разрыв тройной связи с образование солей карбоновых кислот.
3 CH≡CH + 8 KMnO 4 → 3 KOOC-COOK + 8MnO 2 + 2 KOH + 2 H 2 O
3 CH 3 — C≡CH + 8 KMnO 4 → CH 3 -COOK + 8 MnO 2 + 2 K 2 SO 4 + KHCO 3 + H 2 O
В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот.
CH≡CH + 2 KMnO 4 + 3 H 2 SO 4 → 2 CO 2 + 2 MnSO 4 + 4 H 2 O + K 2 SO 4 5 CH≡CH + 8 KMnO 4 + 12 H 2 SO 4 → 5 HOOC-COOH+ 8 MnSO 4 + 12 H 2 O + 4 K 2 SO 4 5 CH 3 — C≡CH + 8 KMnO 4 + 5 H 2 SO 4 → 5 CH 3 -COOH + 5 CO 2 + 8 MnSO 4 + 2 K 2 SO 4 + 12 H 2 O
Только ацетилен используется в промышленности, и именно он является важным химическим сырьем.
Ароматические углеводороды
Химические и физические свойства бензола
Наличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения.
Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси.
I. Реакции замещения
Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения.
II. Реакции присоединения
Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты.
Гидрирование
Идет под воздействием температуры и катализаторов в виде платины.
Галогенирование
под воздействием света
Окисление
При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С.
Химические и физические свойства гомологов бензола
У гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи.
- Электрофильное замещение
Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях.
1. Галогенирование в ядро
Катализатор – хлорид алюминия.
2. Нитрование в ядро
3. Сульфирование в ядро
4. Алкилирование в ядро
II. Реакции по боковой цепи
1. Галогенирование
Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов.
C 6 H 5 -CH 3 + Cl 2 → C 6 H 5 -CH 2 -Cl + HCl
2. Окисление
В отличие от бензола его гомологи способны вступать в реакции окисления.
C 6 H 5 -CH 3 + [O] → C 6 H 5 -COOH + H 2 O C 6 H 5 -CH 2 -CH 3 + [O] → C 6 H 5 -COOH + CO 2
Окисление дизамещенных гомологов происходит по такому же принципу.
3. Получение непредельных соединений
Реакция проходит под действием оксида цинка.
C 6 H 5 -CH 2 -CH 3 → C 6 H 5 -CH=CH 2
Химические и физические свойства стирола
Стирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях.
I. Реакции присоединения
1. Гидрогалогенирование
C 6 H 5 -CH=CH 2 + HCl → C 6 H 5 -C(Cl)-CH 3 2. Галогенирование
Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе.
C 6 H 5 -CH=CH 2 + Br 2 → C 6 H 5 -CH(Br)-CH2-Br
II. Полимеризация
В ходе реакции образуется полистирол – твердая стекловидная масса.
n C 6 H 5 -CH=CH 2 → (-CH 2 -CH-(C 6 H 5 )-) n
При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики.
Основные способы получения углеводородов
Крекинг алканов с бoльшей длиной цепи
Процесс, который используется в промышленности и протекает:
в присутствии катализатора при t 450-500 o C
в отсутствие катализатора при t 500-700 o C
можно выразить общей формулой:
C n H 2n+ 2 = C m H 2m+ 2 + C m –n +C 2(n – m)
I. Получение алканов
Парафины линейного строения. C n H 2n+2
1. Гидрирование. Гидрирование каменного угля проводят при повышенном нагревании и давления, в качестве катализатора следует брать никель. Конечным продуктом является метан.
2. Гидрирование непредельных углеводородов.
3. Крекинг с длинной цепью. Такой способ повсеместно используется в лабораторном получении алканов и алкенов. Крекинг проходит в присутствии катализатора при нагревании около 500 o C или при около 600 o C и больше без него.
4. Декарбоксилирование солей карбоновых кислот. Метод Дюма. Проводят сплав твёрдых карбоновых кислот с твёрдыми щёлочами.
5. Реакция Вюрца. Данная способ используется для удлинения углеродной цепи, протекает при воздействии мет-го натрия на галогеналкан при нормальных условиях.
6. Реакция Фишера-Тропша. Этот способ используется для получения парафинов линейного строения. Синтез-газ (CO+H 2 ) под воздействие высокого нагревания пропускают через катализатор.
7. Гидролиз карбида алюминия. Получение метана.Способ получения CH 4 путём реакции между Al 4 C 3 (карбид алюминия (III)) c H 2 O.
Аl 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4 ↑
Аl 4 C 3 + 12HCl = 4AlCl 3 + 3CH 4 ↑
II. Получение алкенов. C n H 2n
1. Дегидрирование алканов.
Парафины пропускают над никелем, палладием, или платиной при нагревании от 400 до 600 о С. В результате от наименее насыщенных водородом углеродных атомов в цепи отрываются два водорода. Реакцию можно продолжить и получить алкин.
2. Дегидрогалогенирование галогеналканов.
Данная реакция происходит при воздействии спиртового рас-ра щёлочи на галогеналкан и при дальнейшем нагревании смеси.
3. Крекинг алканов.
Данная реакция проходит при катализаторе от 450 до 500 o C или от 500 до 700 o C без.
4. Дегалогенирование вицинальных дигалогеналканов.
Винициальными называют те галогеналканы, в которых атомы галогена присоединены к рядом стоящим атомам углерода.
Суть метода во взаимодействии на дигалогеналкан цинком или магнием.
5.Дегидратация спиртов.
Реакция происходит при нагревании спирта около 140-160 O С в присутствии H 2 SO 4 .
III. Получение алкинов. C n H 2n-2
Ацетилен
1. Пиролиз CH 4 .
Две молекулы метанаCH4 нагревают до 1500 О С в результате происходит его дегидрирование и удвоение углеродной цепи.
2. Дегидрогалогенирование галогеналканов.
Реакция происходит при взаимодействии дигалогеналкана со спиртовым раствором щёлочи.
CH 3 —CHCl 2 + 2KOH (спирт.р-р) → CH≡CH + 2KCl + 2H 2 O
CH 2 Cl—CHCl + 2KOH (спирт.р-р) → CH≡CH + 2KCl + 2H 2 O
3. Гидролиз карбида кальция.
Реакция воздействия водой или бескислородных кислот на карбиды щелoчных и щелочноземельных металлов.
CaC 2 + 2H 2 O → C 2 H 2 ↑ + Ca(OH) 2
CaC 2 + 2HCl (р-р) → C 2 H 2 ↑ + CaСl 2
Гомологи ацетилена.
1. Дегидрирование.
Реакция происходит при нагревании от 400 до 600 0 С в присутствии катализатора (никеля или палладия).
2. Дегидрогалогенирование.
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.
IV. Получение алкадиенов. C n H 2n-2
- Метoд Лебедева.
Пoлучение бутадиена -1,3 из этанола.
2. Дегидрогалогенирование алканов.
Реакция происходит при действии на дигалогеналкан спиртовым раствором щёлочи.
3. Дегидрирование бутана и бутена-1.
Получение дивинила. Для получения дивинила (бутадиен-1,3) в промышленном производстве проводят реакции по методу каталитического дегидрирования бутана и бутена-1. Реакция происходит при температуре от 500 до 600 о С в присутствии катализатора Cr 2 O 3 .
4. Получение изопрена.
Изопрен — мономер для производства синтетического каучука. В присутствии катализаторов (оксида хрома (III) и оксида алюминия (III)) изопентан под высоким давлением нагревают до 150-160 0 С.
V. Получение ароматических углеводородов. C n H 2n-6
1. Тримеризация ацетилена. Реакцию проводят с катализатором в виде активированного угля при нагревании до 400 О С.
2. Тримеризация пропилена. Реакция происходит при тех же условиях, что и тримеризация ацетилена, но в результате получается не бензол, а мезиэтилен (1,3,5-триметилбензол).
3. Алкилирование. Реакция образования гомологов бензола при его взаимодействии с галогеналканами, алкенами и спиртами при нагревании с разными катализаторами.
4. Декарбоксилирование солей ароматических карбоновых кислот. Способ заключается в сплавлении соли ароматической кислоты с твёрдой щёлочью. В результате образуется арен с меньшим количеством углеродных атомов.
5. Дегидроциклизация. Реакция получения аренов из углеводородов линейного строения с условием наличия в цепи от шести углеродных атомов. Реакцию проводят при сильном нагревании в присутствии катализатора (платина, палладий, никель).
6. Дегидрирование циклогексана. Реакция образования ароматического соединения с таким же количеством атомов углерода в цепи из циклического углеводорода. Реакцию проводят при повышенной температуре при воздействии катализатора (никель, палладий).
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Ионный механизм
Правило Владимира Васильевича Марковникова
Радикальный механизм
Органическая химия вызывает страх при виде формул из этого раздела, но давайте перестанем бояться и углубимся в изучение взаимодействия веществ. Что же из себя представляют механизмы реакций?
Это детальное разъяснение процесса перехода субстрата в продукт. В органике выделяются два типа механизмов химических реакций, ионный и радикальный.
Ионный механизм
Происходит разрыв связи, во время которого, общая пара электронов остается у одного атома, что приводит к возникновению заряженных частиц — ионов (катионов и анионов). Будучи гетероциклическим, этот разрыв возможен при ковалентной связи.
В ходе получаются:
Нуклеофил – обладающая парой электронов на своем внешнем энергетическом уровне частица, которая образует новые ковалентные связи. Примерами могут послужить: SCN — ,Br — , CN — , Cl — ,I — , OH — и другие анионы и соединения с неподеленной электронной парой. Электрофил – обладающая незаполненной на внешнем энергетическом уровне электронную орбиталь частица, являющаяся электронным акцептором. Например: H 3 O + , CH 3 CO + , AlCl 3 ,BF 3 , катионы, карбокатионы, электронодефицитные нейтральные молекулы, а так же молекулы с сильнополяризованной связью.
Типичными представителями ионных реакций отмечают взаимодействия электролитов в растворах, которые знакомы нам с первых шагов познания неорганической химии, реакции присоединения к непредельным углеводородам, дегидрирование спиртов и замещение гидроксильной группы в спиртах.
Правило Владимира Васильевича Марковникова
Формулировка гласит следующим образом: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена:
Но также существуют и исключения из этого правила, когда заместитель при двойной связи оттягивает электронную плотность на себя,
или при присоединении в присутствии пероксидов
Радикальный механизм
Происходит деление общей пары электронов между атомами, приводя к образованию нейтрально заряженных частиц (радикалов), которые имеют неспаренные электроны. Будучи гомолитическим, такой разрыв возможен при малополярной ковалентной связи.
Реакции, проходящие по этому механизму, происходят в газовой фазе с огромной скоростью, зачастую сопровождаясь взрывом. Сами радикальные взаимодействия возникают между образовавшимися в ходе взаимодействия нейтрально заряженными частицами и молекулами.
Весьма немалое количество органических реакций протекают по радикальному механизму, например: галогенирование алканов, полимеризация этилена и синтез аммиака.
Задания для подготовки к егэ
Свойства углеводородов. Получение углеводородов
Из предложенного перечня выберите все вещества, которые могут реагировать с каждым из веществ: водой, бромоводородом, водородом.
1) пропан
2) этилен
3) бутен-1
4) этан
5) хлорметан
Ответ: 23.
Пояснение
Из представленных веществ только бутен-1 и этилен имеют кратную (двойную) связь и способны присоединить к себе и воду, и бромоводород, и водород. Алканы (пропан и этан) и галогеналканы (хлорметан) в подобные реакции не вступают.
Задания для подготовки к егэ
Свойства кислородосодержащих соединений. Получение кислородосодержащих соединений
Из предложенного перечня выберите две кислоты, которые будут реагировать с водородом, бромом и бромоводородом.
1) акриловая
2) уксусная
3) пропионовая
4) стеариновая
5) олеиновая
Ответ: 15.
Пояснение
Олеиновая кислота и акриловая кислота — это непредельные кислоты, поэтому для них характерны реакции непредельных углеводородов.
Домашняя работа
Вариант № 5509622
Ссылка — https:// chem-ege.sdamgia.ru/test?id=5509622
АЛКАНЫ (ПАРАФИНЫ) – это углеводороды, в которых все связи одинарные. Их называют НАСЫЩЕННЫМИ в отличие от углеводородов с кратными связями.
|
Общая формула CnH2n+2 |
Все атомы углерода в алканах имеют sp3— гибридизацию. |
Физические свойства: Первые четыре члена гомологического ряда С1 – С4 – бесцветные газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней. С увеличением длины цепочки увеличиваются температуры кипения и плавления. У алканов с разветвленным углеродным скелетом температуры кипения и плавления ниже, чем у неразветвленных с таким же числом атомов углерода в молекуле. |
Типы атомов углерода
вторичный третичный
С
│
С–С–С–С–С первичный
│ │
С С
четвертичный
Гомологический ряд – это совокупность органических соединений, отличающихся друг от друга по составу на одну или несколько СН2-групп (гомологическая разность).
Представители одного гомологического ряда называются гомологами.
Первые пять членов ряда алканов:
СН4 – метан
С2Н6 – этан
С3Н8 – пропан
С4Н10 – бутан
С5Н12 – пентан
Виды изомерии у алканов и галогеналканов.
1) Для алканов возможна только структурная изомерия углеродного скелета (начиная с С4)
2) Для галогеналканов, нитроалканов характерна также изомерия положения заместителей – галогенов, нитрогрупп (начиная с С3)
СН3-СН2-СН2-Сl 1-хлорпропан СН3-СН-СН3 2-хлорпропан
׀
Cl
Получение алканов:
|
1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов: 2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 +2NaBr Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов. |
|
2) Декарбоксилирование солей карбоновых кислот (реакция Дюма): сплавление со щелочами солей карбоновых кислот. Так получают метан при нагревании ацетата натрия с гидроксидом натрия. CH3COONa + NaOH —t CH4 + Na2CO3 |
2CH3COONa + 2H2O –(эл.ток) 2СО2 + Н2 + С2Н6 + 2NaOH катод: идёт разрядка воды 2Н2О + 2е Н2 + 2ОН—
|
|
4) Метан также можно получить гидролизом карбида алюминия. Al4C3 + 12H2O 3CH4 + 4Al(OH)3 |
|
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля). R–CH=CH–R’ + H2 —kat R–CH2–CH2–R’
|
|
6) Предельные углеводороды от C1 до C11 выделяют фракционной перегонкой нефти, природного газа или смесей углеводородов, получаемых гидрированием угля. |
|
7) Гидрирование угля, оксида углерода в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре: n C + (n+1) H2 –400С,p CnH2n+2 n CO + (2n+1) H2 –200С,Ni CnH2n+2+ n H2O |
Химические свойства алканов.
Алканы не взаимодействуют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой. Не вступают в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
|
1)Галогенирова-ние: радикальное замещение. Газообразные хлор и бром на свету. |
А) хлорирование: неизбирательно, образуется смесь продуктов: СН3-СН2-СН3 + Cl2–(свет) CH3-CH2-CH2Cl + CH3-CHCl-CH3 + HCl Б) бромирование: CH3 CH3 │ │ СН3-СН2-СН-СН3 +Br2 –(свет)СН3-СН2-С-СН3 + HBr │ Избирательность бромирования: Br третичный > вторичный > первичный атом углерода. |
|
2) Нитрование (реакция М.И. Коновалова): |
нагревание до 1400С с разбавленной (10%-ной) азотной кислотой: CH3 CH3 │ │ СН3-СН2-СН-СН3 + HNO3 СН3-СН2-С-СН3 + H2O │ Избирательность нитрования: NO2 третичный > вторичный > первичный атом углерода. |
|
3) Крекинг |
а) CH3–CH2–CH2–CH3 —400°C CH3-CH3 + CH2=CH2 б) длительное нагревание метана: CH4 —1500°C C+ 2H2 в) мгновенное нагревание (пиролиз метана) 2CH4 —1500°C H–C≡C–H + 3H2 |
|
4) Изомеризация: при нагревании с катализатором. |
СН3-СН2-СН2-СН3 -(100о, AlCl3) CH3-CH-CH3 │ CH3 |
|
5) Горение |
CH4 + 2O2 CO2 + 2H2O |
|
6) Дегидрирование и циклизация. |
СН3-СН3 –(кат, t) CH2=CH2 + Н2 В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно. СН3-СН2-СН2-СН2-СН2-СН3 –(кат, t) |
|
7) Окисление |
2CH4 + O2 —t, кат 2СН3ОН CH4 + [O] —t, кат НСООН CH4 + [O] —t, кат НСНО 2С4Н10 + 5O2 —t, кат 2СН3СООН + 2Н2О |
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
— предельные циклические углеводороды. Общая формула гомологического ряда CnH2n.
|
|
|
|
|
|
Циклопропан |
Циклобутан |
Циклопентан |
Циклогексан |
|
Малые циклы |
Большие циклы |
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ-связи в циклопропане называют «банановыми». По свойствам они напоминают p-связи.
Поэтому циклопропан способен вступать в реакции присоединения (с разрывом цикла).
Большие циклы очень устойчивы и не склонны к разрыву. Так, молекула циклогексана не является плоским многоугольником и принимает различные конформации.
a б
Конформации шестичленного цикла: а — кресло: 6 — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1. Структурная изомерия, связанная:
a) с числом углеродных атомов в кольце – например, (этилциклопропан),
(метилциклобутан);
b) с числом углеродных атомов в заместителях – (1-метил-2-пропилциклопентан),
(1,2-диэтилциклопентан)
c) с положением заместителя в кольце – (1,1-диметилциклогексан),
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам (с С3Н6).
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
цис-изомер транс-изомер
Получение.
1. Отщепление двух атомов галогена от дигалогеналканов (синтез Густавсона):
Вместо магния может использоваться цинк.
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,р,Ni
C6H6 + 3H2 → C6H12.
Химические свойства
|
1) Гидрирование. При каталитическом гидрировании трех-, четырех- и пятичленные циклы разрываются с образованием алканов. |
Пятичленный цикл разрывается только при высоких температурах. |
|||
|
2) Галогенирование. Циклопропан и циклобутан при галогенировании разрываются, присоединяя атомы галогена |
|
|||
|
Циклопарафины с пяти- и шестичленными циклами вступают при галогенировании в обычные для парафинов реакции замещения. |
|
|||
|
3)Гидрогалоге-нирование. Циклопропан и циклобутан взаимодействуют с галогеноводородами с разрывом цикла. |
Реакция осуществляется в соответствии с правилом Марковникова. Другие циклопарафины с галогеноводородами не реагируют. |
|||
|
4) Дегидрирование. |
Производные циклогексана дегидрируются в производные бензола: C6H12 –(Pt, t°C) C6H6 + 3H2 |
|||
|
5) Нитрование. |
Для больших циклов характерны реакции замещения, как для алканов: галогенирование на свету, нитрование. Циклопентан + HNO3 нитроциклопентан + вода. |
|||
|
6) Горение |
С3Н6 + О2 = СО2 + Н2О |
В органической химии, встречающейся в ЕГЭ есть своя система, знания которой может облегчить понимание этой сложной науки. Начнем с алканов.
Алканы(парафины) — это предельные алифатические углеводороды, в которых все связи одинарные(сигма-связь).
Характерный тип реакций: свободнорадикальное замещение(SR).
В какие реакции вступают: замещение, изомеризация, окисление(метан, бутан), дегидрирование, крекинг, горение.
Именные реакции:
- Реакция Кольбе: R-COO-Na + H2O → Алкан + CO2↑ + NaOH + H2↑
- Реакция Вюрца: 2Галогеналкан + 2Na → Алкан + 2NaCl
- Реакция Фишера -Тропша: n(CO + H2) → Алкан + nH2O
- Реакция Дюма: R-COO-Na + NaOH → Алкан + Na2CO3
- Реакция Коновалова: Алкан + HNO3 → Нитроалкан + H2O
- Реакция Семенова: Алкан + Cl2 → Хлоралкан + HCl
Какие классы веществ можно получить из алканов:
— алкены, алкины, циклоалканы, арены(дегидрирование);
— одноатомные предельные спирты, альдегиды, карбоновые кислоты(окисление метана и бутана).
Как обнаружить алканы в растворе: качественных реакций для алканов нет, так как они не окисляются, не меняют окраску индикаторов, поэтому применяют путь исключения других углеводородов.
Специфические реакции:
Так как алканы — предельные CH(углеводороды), для них НЕ свойственны реакции окисления, присоединения и полимеризации. Однако, метан способен к окислению при высоких температурах образуя метанол(475 С, Cu), метаналь(300 C, Cu), метановую кислоту путем прямого окисления(+O2).
Бутан окисляется до уксусной кислоты: C4H10 + 5O2 → 4CH3COOH + 2H2O.
Метан вступает в реакции дегидрирования(отщепления водорода), причем при разных температурах образуются представители разных классов CH:
CH4 (600 C) → этилен(C2H4)
CH4 (1000 C) → уголь(C)
CH4 (1500 C) → ацетилен(C2H2).
Сжигание метана с образованием этина называется пиролиз.
Особыми свойствами метана является образование угарного газа:
CH4 + H2O → CO + 3H2
CH4 + CO2 → 2CO + 2H2
Остальные алканы также могут вступать в реакции дегидрирования с образованием алкенов(на первой стадии).
Важно: Суть органической химии заключается в том, что зная список химических реакций одного класса, можно выполнять их для всех представителей гомологического ряда этого класса.
Крекинг — это процесс термического разложения алканов, имеющих длинную углеродную цепь с образованием углеводородов с более короткой цепью.
В плане алканов это процесс кратного уменьшения алкана с образованием двух соединений — алкана и алкена, имеющих одинаковое количество С:
C8H18 → C4H10 + C4H8
Для алканов характерна реакция изомеризации(не считая метана, этана, пропана) с получением изомеров; основа реакции — катализатор хлорид алюминия(AlCl3).
Специфическими реакциями получения метана являются синтез из простых веществ и гидролиз карбида алюминия:
C + 2H2 → CH4
Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3↓
Важно: ацетилен можно получить аналогичной реакцией гидролиза карбида кальция(принцип тот же).
Гексан обладает двумя необычными свойствами — дегидроциклизацией(отщепление H2 с образованием цикла) с получением циклогексана и ароматизацией с получением бензола.
Суть реакции: отщепление водорода под влиянием катализатора Pt.
Важно: алканы по главным химическим свойствам схожи с аренами(ароматическими углеводородами):
- характерны реакции замещения, а не присоединения;
- реагируют при облучении с галогенами;
- реагируют с азотной кислотой с получением нитросоединения;
- не взаимодействуют с окислителями(KMnO4, K2Cr2O7, Br2(бромная вода), O2(при окислении))
- не растворяются в воде.
Реакции из цепочек ЕГЭ 2021(задание №33):
1) CH3ꟷCH2ꟷCH3 + Cl2 → CH3ꟷCH(Cl)ꟷCH3 + HCl
Рассмотрим этот процесс: это реакция Семенова, замещение водорода в молекуле алкана на галоген при облучении; почему атом хлора ушел ко второму атому С, а не к первому? Ответ прост — галоген отходит к наименее гидрированному атому С.
2) CH3ꟷCH(Cl)ꟷCH2ꟷCH3 + NaOH(водный р-р)→ CH3ꟷCH(OH)ꟷCH2ꟷCH3 + NaCl
В случае добавления щелочи к алкилгалогенидам мы можем наблюдать два процесса:
— если дан водный раствор щелочи, получаем спирт;
— если дан спиртовой раствор щелочи, получаем алкен(если 1 галоген) или алкин(если 2 галогена).
В нашем случае использован водный раствор щелочи, что приводит к образованию одноатомного спирта.
3) CH2(Cl)ꟷCH2(Cl) + 2KOH(спиртовый р-р) → CH≡CH + 2KCl + 2H2O
Эта реакция является примером того, как спиртовой раствор щелочи превращает дигалогеналкан в ацетилен.
4) CH3ꟷCH2ꟷCH3 → CH3ꟷCH═CH2 + H2
Если До стрелки дан один алкан,то это типичная реакция отщепления водорода, или дегидрирование, с образованием алкена с соответствующим количеством атомов С в молекуле.
5) CH2(Cl)ꟷ CH2ꟷCH(Cl)ꟷCH3 + Zn → ▲ꟷCH3 + ZnCl2
Эта реакция является типичной для получения циклоалканов или их гомологов(как правило, с цинком); в итоге мы получаем метилциклопропан.
6) CH3ꟷCH2ꟷCH2ꟷCH2ꟷCH2ꟷCH2ꟷCH3 → C6H5ꟷCH3 + 4H2
Процесс образования аренов и их гомологов происходит так: под влиянием катализатора платины(Pt) и температуры конечные атомы С в цепи соединяются друг с другом, образуя цикл; в итоге, отщепляются 8 атомов водорода с образованием толуола(C6H5ꟷCH3) в данном случае. Если до стрелки будет 6 атомов С в общей цепи,то мы получим бензол(C6H6).
Заключение:
Алканы вступают в реакции замещения, при этом замещается один атом водорода на другой одновалентный радикал.
Алканы имеют общую формулу класса CnH2n+2, не имеют межклассовых изомеров, гибридизация — sp3.
Парафины не растворяются в воде. Главные химические свойства: дегидрирование, изомеризация, крекинг.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СВОЙСТВА АЛКАНОВ
АЛКА́НЫ (парафины)- (насыщенные углеводороды, парафины, алифатические соединения)
Общая формула — CnH2n+2 ( n — число атомов углерода в молекуле)
sр3-гибридизация (все атомы углерода)
все σ-связи
длина связи С-С — 0,154 нм
угол между связями С-C составляет 109°28‘ (поэтому молекулы имеют зигзагообразное строение (зигзаг).
По номенклатуре ИЮПАК в названии — суффикс –ан.
ФИЗИЧЕСКИЕ СВОЙСТВА:
С1 – С4 – бесцветные газы,
C5–C17 – жидкости,
C18 – твердые вещества.
Легче воды, не растворимы в воде и не смешиваются с ней. С увеличением длины цепочки увеличиваются температуры кипения и плавления.
У алканов с разветвленным углеродным скелетом температуры кипения и плавления ниже, чем у неразветвленных с таким же числом атомов углерода в молекуле.
ХИМИЧЕСКИЕ СВОЙСТВА
Насыщенные (предельные) углеводороды не вступают В РЕАКЦИИ ПРИСОЕДИНЕНИЯ.
ДЛЯ НИХ СВОЙСТВЕННЫ:
1.Реакции замещения;
2. Расщепления;
3. Дегидрирования;
4. Изомеризации;
5. окисления.
Эти реакции протекают при нагревании, на свету или с применением катализатора.
АЛКАНЫ НЕ РЕАГИРУЮТ:
1.С концентрированными кислотами,
2. щелочами,
3. перманганатом калия,
4. бромной водой.
РЕАКЦИИ ЗАМЕЩЕНИЯ.
1. Галогенирование — хлор и бром на свету или при нагревании.
(радикальное замещение).
а) хлорирование (Н.Н.Семенов):
процесс быстрый, поэтому протекает не избирательно, образуется смесь продуктов замещения:
б) бромирование:
Бромирование – более медленный и избирательный процесс. Бром замещает водород у менее гидрогенезированного углерода.
Избирательность бромирования:
третичный → вторичный → первичный атом углерода.
Механизм радикального замещения: Цепной свободнорадикальный.
Свободный радикал R∙ – это ОЧЕНЬ АКТИВНАЯ частица, несущая на себе один неспаренный электрон и стремящаяся образовать связь с каким-либо другим атомом.
1) Инициирование цепи (запуск):
молекула хлора под действием кванта света разрывается на два радикала Cl·
2) Развитие цепи: радикал хлора отрывает от алкана атом водорода.
При этом образуется промежуточная частица — алкильный радикал, который в свою очередь отрывает атом хлора от молекулы Cl2.
При этом вновь получается радикал хлора и процесс повторяется – идёт продолжение цепи:
3) Обрыв цепи:
соединение двух радикалов в молекулу.
2) Нитрование (реакция М.И. Коновалова):
Механизм реакции также радикальный. Нагревание до 140 — 150° С с разбавленной (10%-ной) азотной кислотой:
Избирательность нитрования:
третичный > вторичный > первичный атом углерода.
3.Сульфирование
При действии серной кислоты образуются сульфокислоты:
РАСЩЕПЛЕНИЕ
1) Крекинг — (англ. cracking, от crack — расщеплять), переработка нефти и её фракций, протекающая с распадом тяжёлых углеводородов. Наряду с распадом при крекинге, происходят изомеризация, циклизация, полимеризация и конденсация.
а) Для алканов с длинными цепями при крекинге получается алкан и алкен.
Причём при длине больше 5 атомов С получится смесь углеводородов разной длины.
б) Пиролиз метана (разложение на простые вещества):
длительное нагревание метана → углерод и водород:
2. мгновенное нагревание до 1500 градусов и охлаждение → ацетилен
3. Нагревание до 600 градусов в присутствии катализатора никеля → этилен
ДЕГИДРИРОВАНИЕ — отщепление молекул водорода
Условия протекания: 400 – 600 0C, катализаторы — Pt, Ni, Al2O3, Cr2O3
Короткие алканы дегидрируются в алкены или диены:
АРОМАТИЗАЦИЯ ГЕКСАНА И ГЕПТАНА
В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
ИЗОМЕРИЗАЦИЯ
перестройка углеродного скелета с образованием других изомеров: при нагревании с катализатором AlCl3.
ОКИСЛЕНИЕ
1) Горение: образуется углекислый газ и вода
При недостатке кислорода горение метана происходит по уравнениям:
2)Каталитическое окисление метана:
При мягком окислении СН4 (катализатор, кислород, 200 °C) могут образоваться:метиловый спирт:
2) Каталитическое окисление бутана
При каталитическом окислении бутана образуется уксусная кислота
2)
Каталитическое окисление гомологов алканов
При частичном окислении других
гомологов алкана в присутствии катализатора
образуются карбоновые кислоты
ОСОБЫЕ СЛУЧАИ
1)Конверсия метана (взаимодействие с водой)
В присутствии никелевого катализатора и 800⁰С протекает реакция:
2)Взаимодействие с оксидом углерода
13(Б) Тесты ЕГЭ ФИПИ 2015 Свойства алканов























![III. Реакции замещения Замещение происходи у водорода, стоящего при углероде с кратной связью. 1. Взаимодействие с амидом натрия CH≡CH + NaNH 2 → NaC≡CH + NH 3 2. Взаимодействие с аммикатами серебра или одновалентной медью CH≡CH + Ag 2 O → Ag-C≡C-Ag + H 2 O CH≡CH + 2 [Ag(NH 3 ) 2 ]OH → CH 3 -C≡C-Ag + 4 NH 3 + 2 H 2 O CH≡C-CH 3 + [Cu(NH 3 ) 2 ]OH → CH 3 -C≡C-Cu + 2 NH 3 + 2 H 2 O Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img22.jpg)




![II. Реакции по боковой цепи 1. Галогенирование Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов. C 6 H 5 -CH 3 + Cl 2 → C 6 H 5 -CH 2 -Cl + HCl 2. Окисление В отличие от бензола его гомологи способны вступать в реакции окисления. C 6 H 5 -CH 3 + [O] → C 6 H 5 -COOH + H 2 O C 6 H 5 -CH 2 -CH 3 + [O] → C 6 H 5 -COOH + CO 2 Окисление дизамещенных гомологов происходит по такому же принципу. 3. Получение непредельных соединений Реакция проходит под действием оксида цинка. C 6 H 5 -CH 2 -CH 3 → C 6 H 5 -CH=CH 2](https://fsd.multiurok.ru/html/2022/07/15/s_62d112673bf6d/img27.jpg)








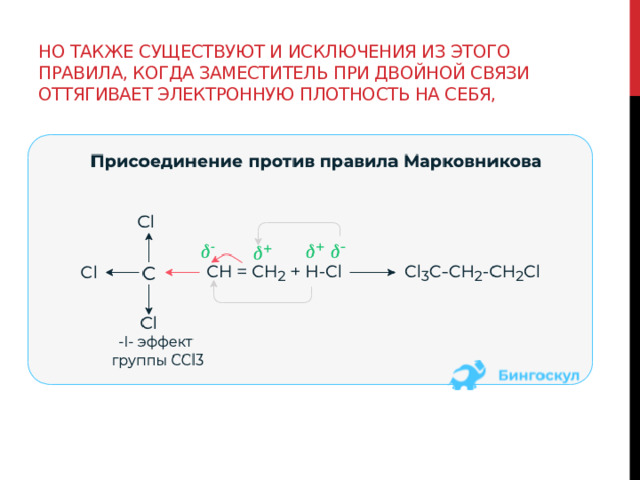









![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
























