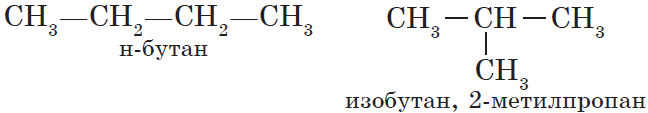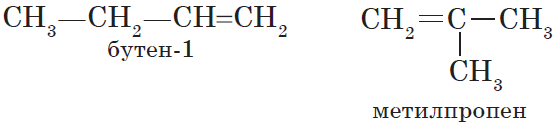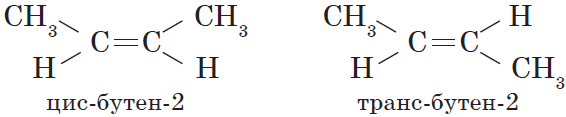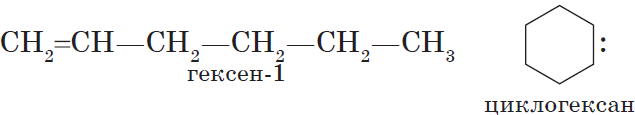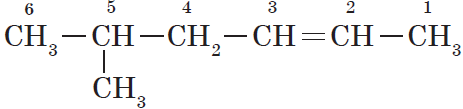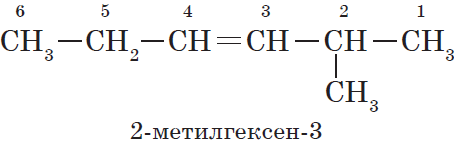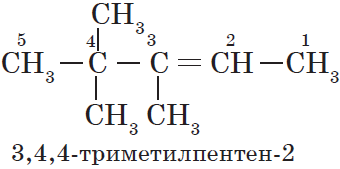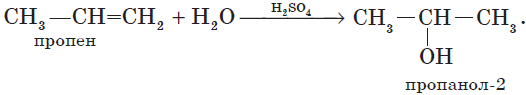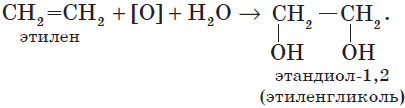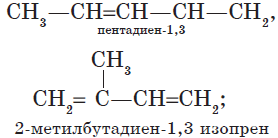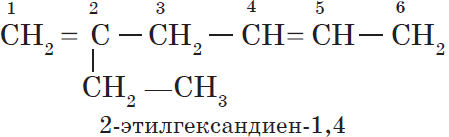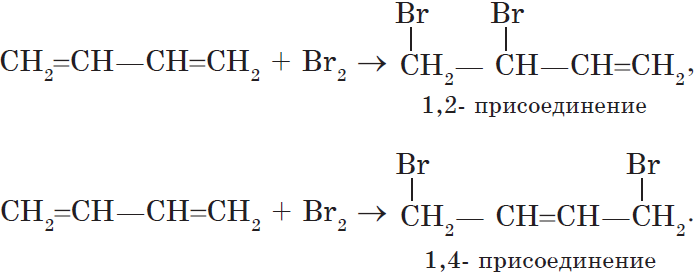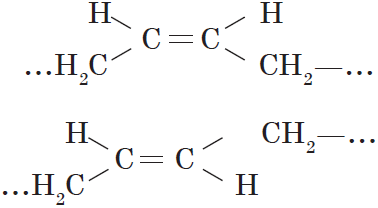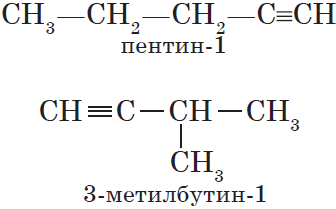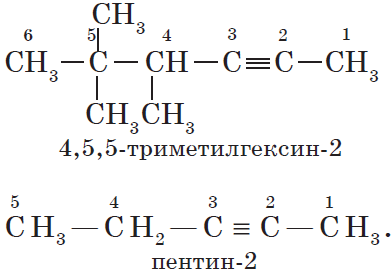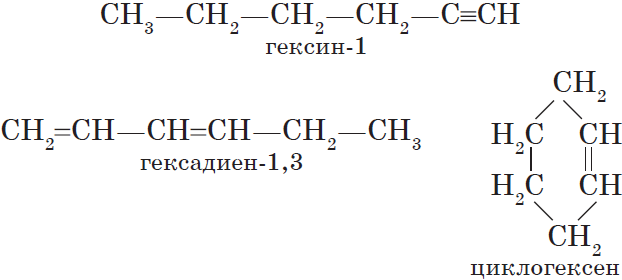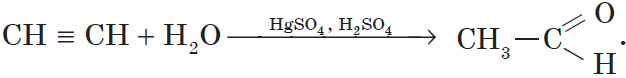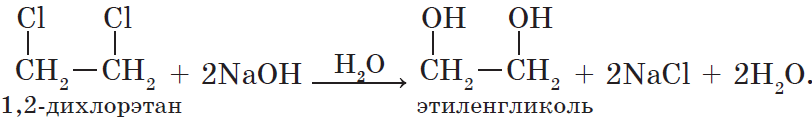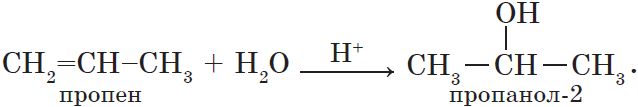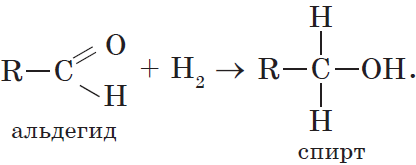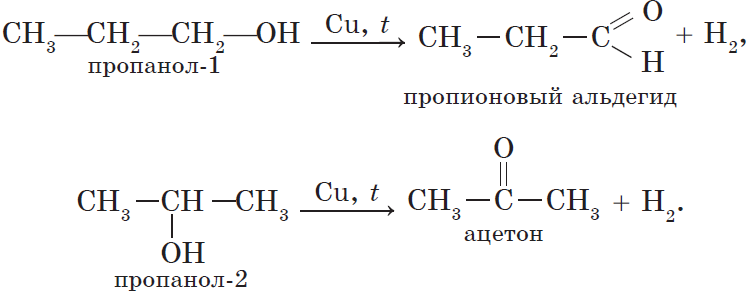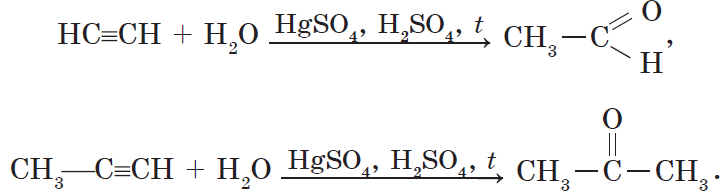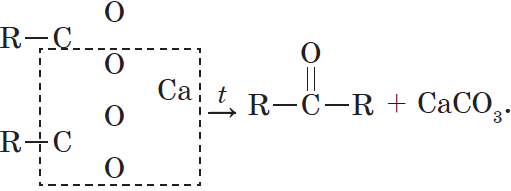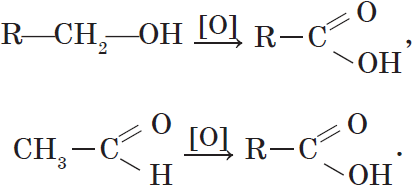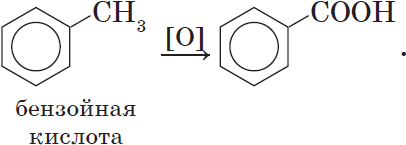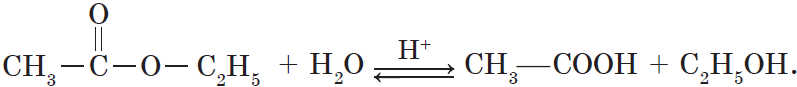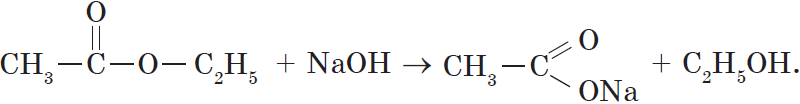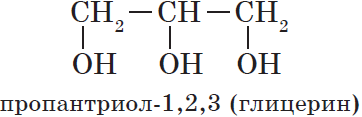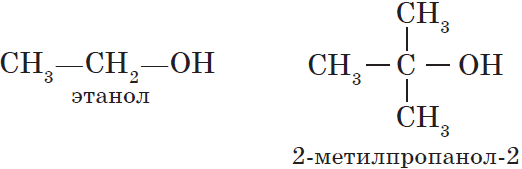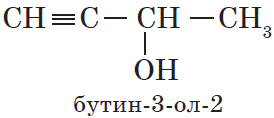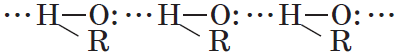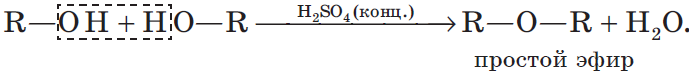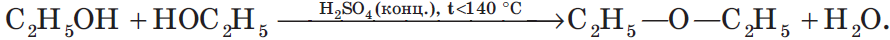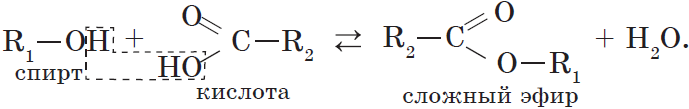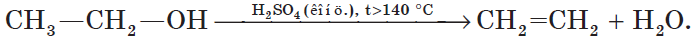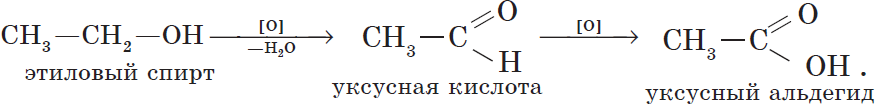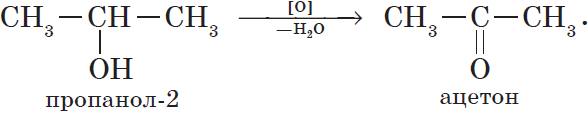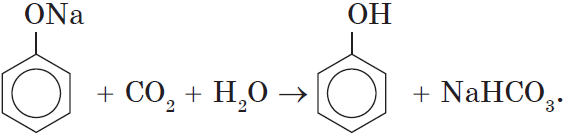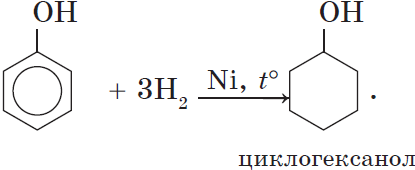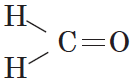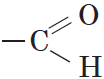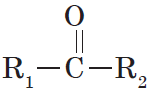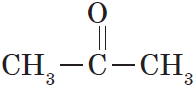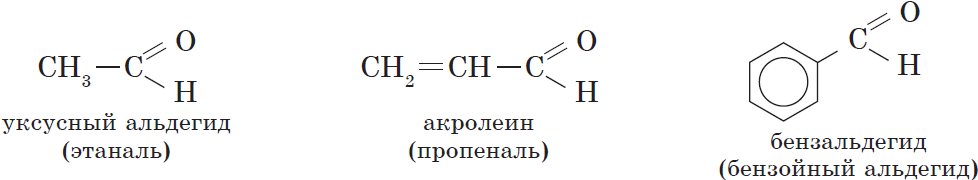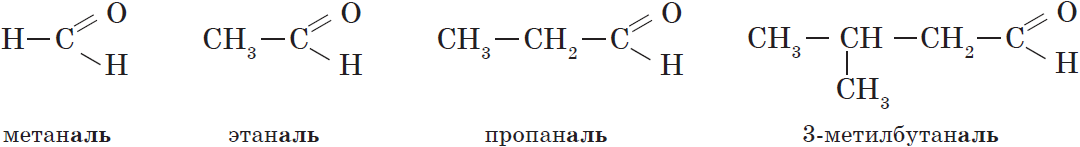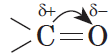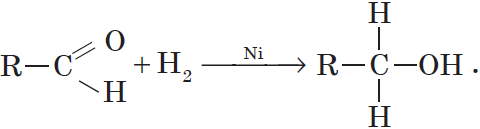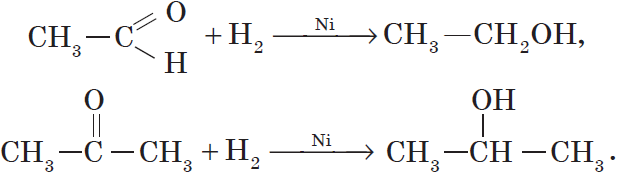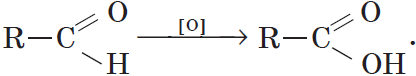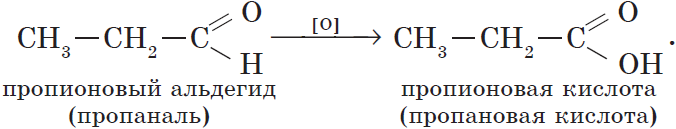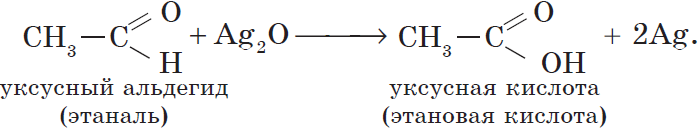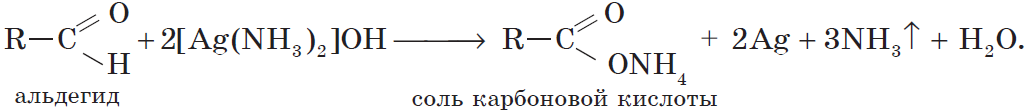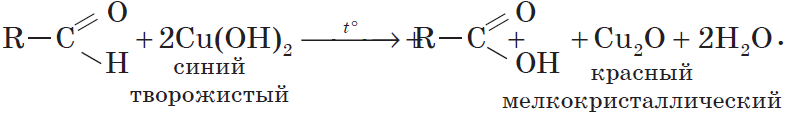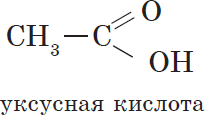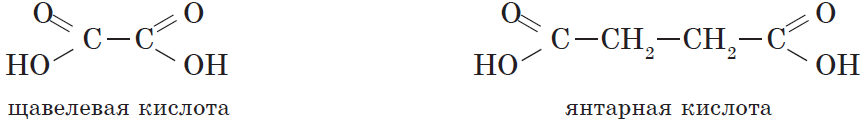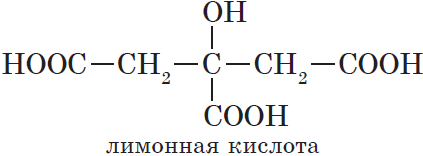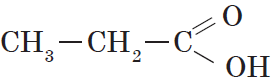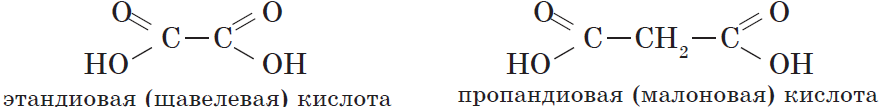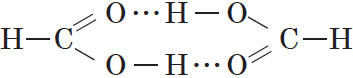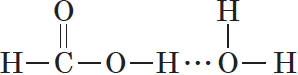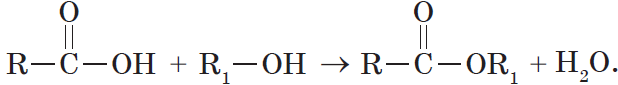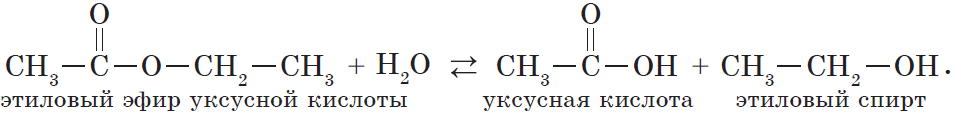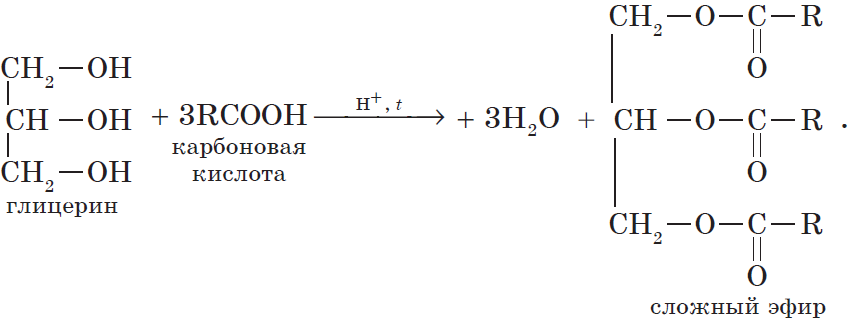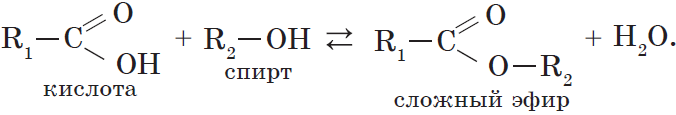Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
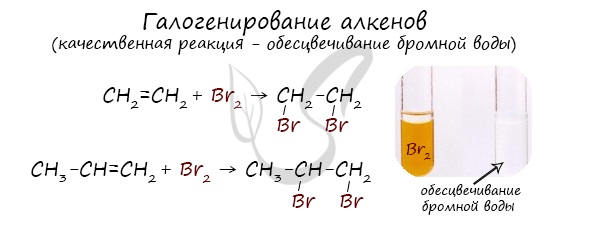
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
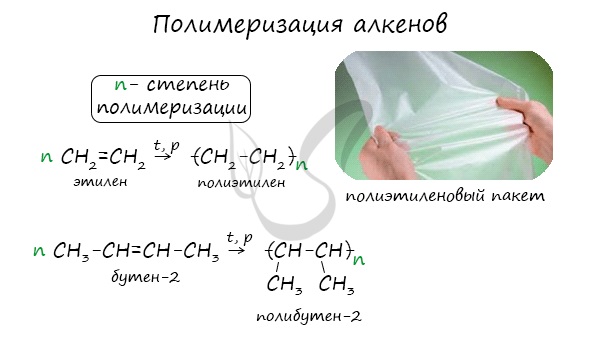
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
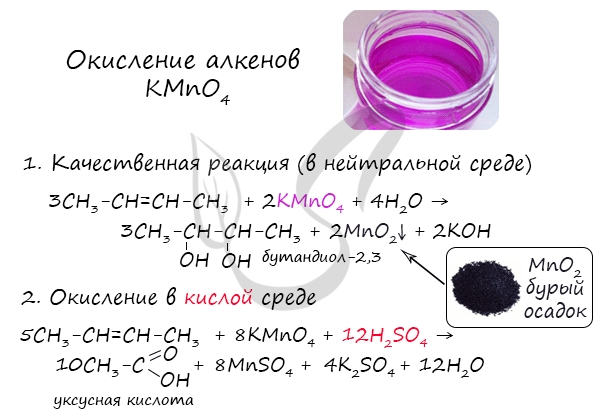
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит
одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2.
Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
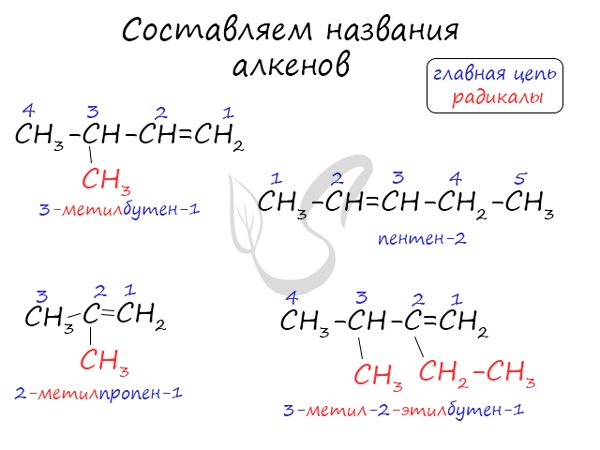
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом:
этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию
атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
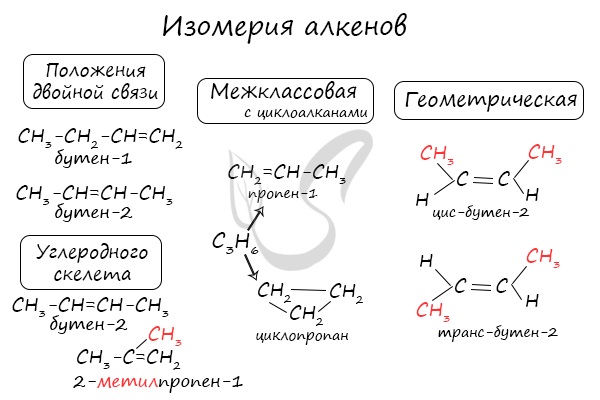
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко
водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород
отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные
рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими
свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода,
гидроксогруппа — к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном
окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные
углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной
связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
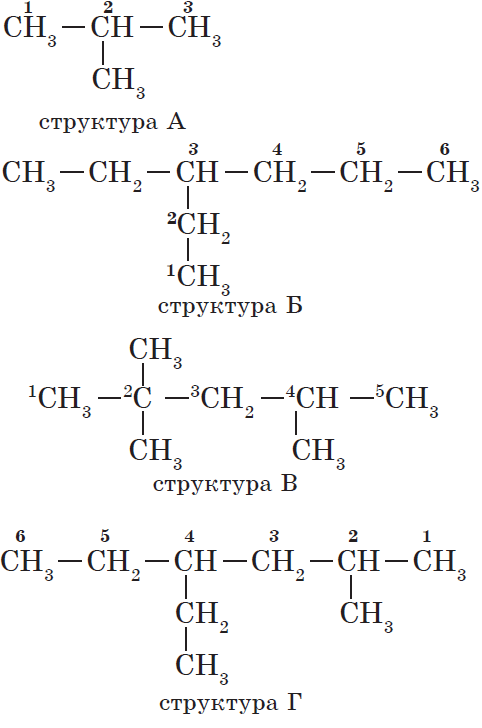
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text»дихлорметан(хлористый метилен)»}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text»трихлорметан(хлороформ)»}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text»тетрахлорметан(четыреххлористый углерод)»}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
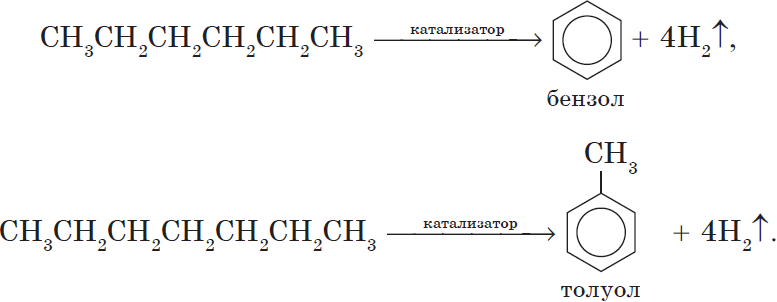
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)n}↙{text»синтетический бутадиеновый каучук»}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
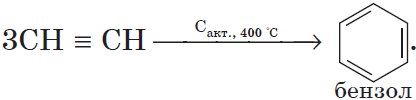
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text»бутен-1-ин-3(винилацетилен)»}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Реакции, характеризующие основные способы получения кислородсодержащих соединений
1. Гидролиз галогеналканов. Вы уже знаете, что образование галокеналканов при взаимодействии спиртов с галогеноводородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
$R-Cl+NaOH{→}↖{H_2O}R-OH+NaCl+H_2O$
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
2. Гидратация алкенов — присоединение воды по $π$-связи молекулы алкена — уже знакома вам, например:
${CH_2=CH_2}↙{этен}+H_2O{→}↖{H^{+}}{C_2H_5OH}↙{этанол}$
Гидратация пропена приводит, в соответствии с правилом Марковникова, к образованию вторичного спирта — пропанола-2:
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена):
$CH_2=CH_2+[O]+H_2O{→}↖{KMnO_4}HO-CH_2-CH_2-OH$
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
$CO+2H_2{→}↖{t,p,ZnO}CH_3-OH$
Необходимую для этой реакции смесь угарного газа и водорода, называемую также синтез-газом ($СО + nН_2О$), получают при пропускании паров воды над раскаленным углем:
$C+H_2O{→}↖{t}CO+H_2-Q$
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен:
${C_6H{12}O_6}↙{глюкоза}{→}↖{дрожжи}2C_2H_5OH+2CO_2$
Способы получения альдегидов и кетонов
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:
Реакция Кучерова. Из ацетилена в результате реакции гидратации получается уксусный альдегид, из гомологов ацетилена — кетоны:
При нагревании кальциевых или бариевых солей карбоновых кислот образуются кетон и карбонат металла:
Способы получения карбоновых кислот
Карбоновые кислоты могут быть получены окислением первичных спиртов альдегидов:
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
Гидролиз различных производных карбоновых кислот также приводит к получению кислот. Так, при гидролизе сложного эфира образуются спирт и карбоновая кислота. Как уже говорилось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щелочи протекает необратимо, в этом случае из сложного эфира образуется не кислота, а ее соль:
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
— одноатомные, например:
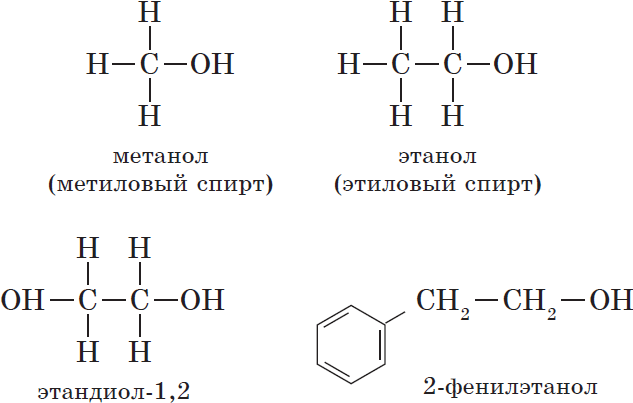
${CH_3-OH}↙{метанол(метиловый спирт)}$ ${CH_3-CH_2-OH}↙{этанол(этиловый спирт)}$
— двухатомные (гликоли), например:
${OH-CH_2-CH_2-OH}↙{этандиол-1,2(этиленгликоль)}$
${HO-CH_2-CH_2-CH_2-OH}↙{пропандиол-1,3}$
— трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
— непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
${CH_2=CH-CH_2-OH}↙{пропен-2-ол-1 (аллиловый спирт)}$
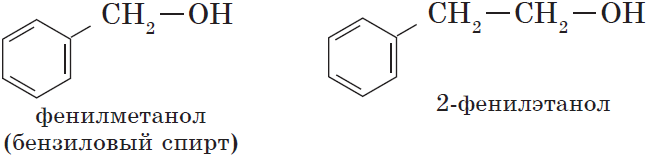
— ароматические, т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
${CH_3-CH_2-OH}↙{этанол}$ ${CH_3-O-CH_3}↙{диметиловый эфир}$
Физические и химические свойства спиртов
Физические свойства.
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_{12}Н_{25}ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
$2Na+2H_2O=2NaOH+H_2↑$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2↑$,
$2Na+2ROH=2RONa+H_2↑$.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
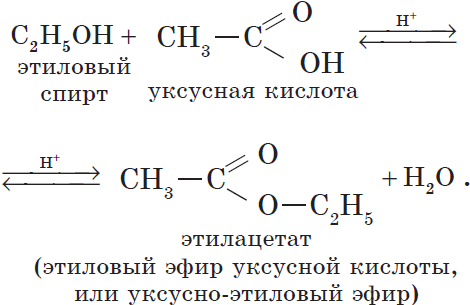
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
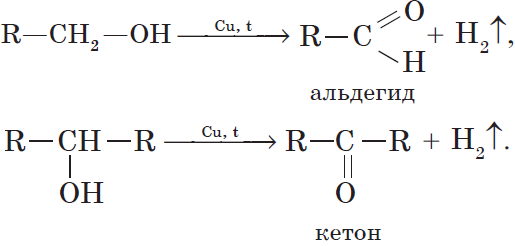
7. Дегидрирование спиртов. При пропускании паров спирта при $200–300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
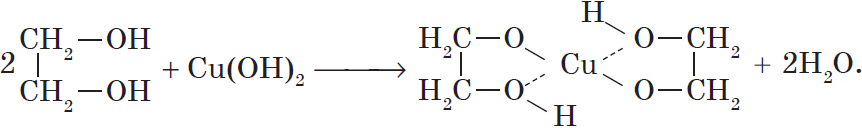
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Фенол
Строение фенолов
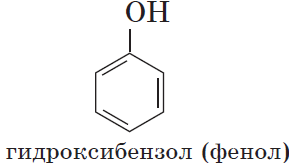
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
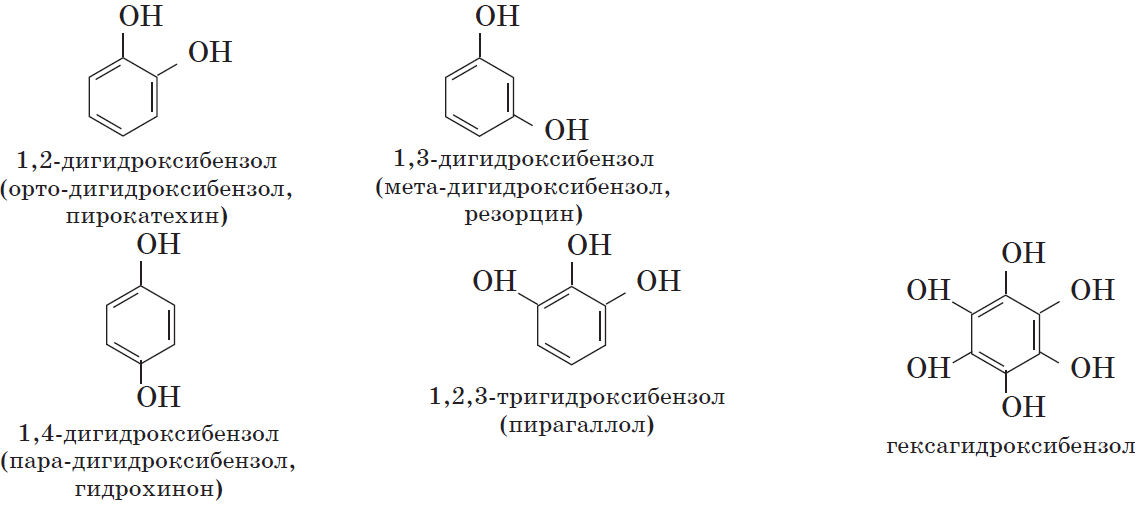
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
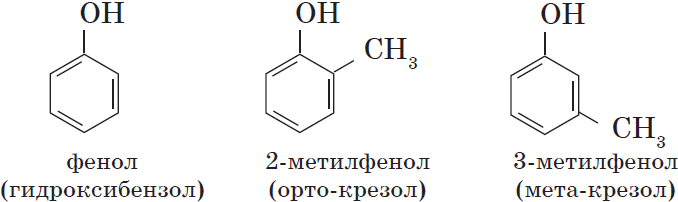
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства.
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°{пл.}=43°С, t°{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
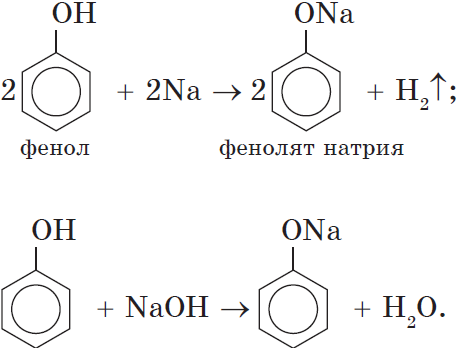
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
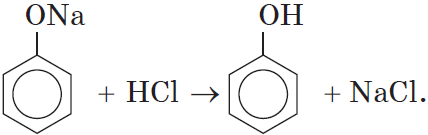
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца.
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
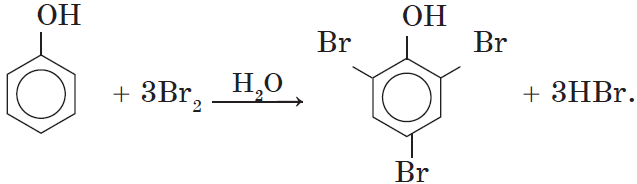
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
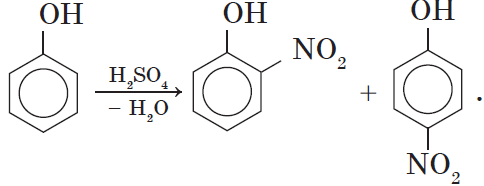
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
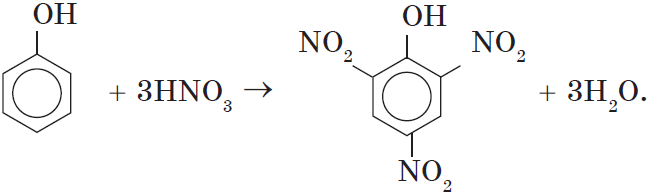
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
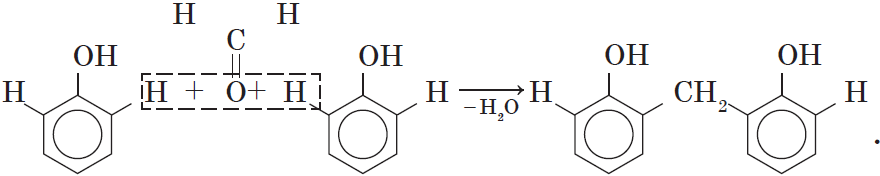
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
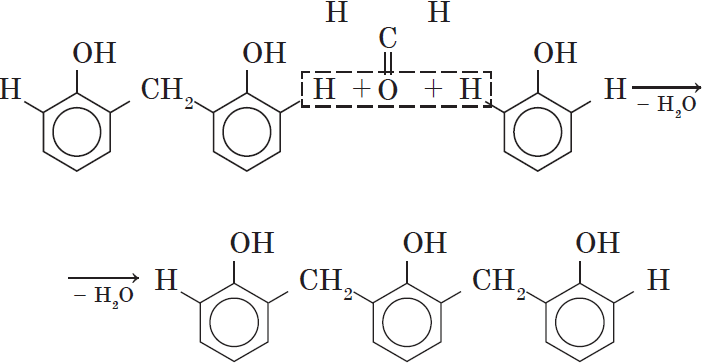
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
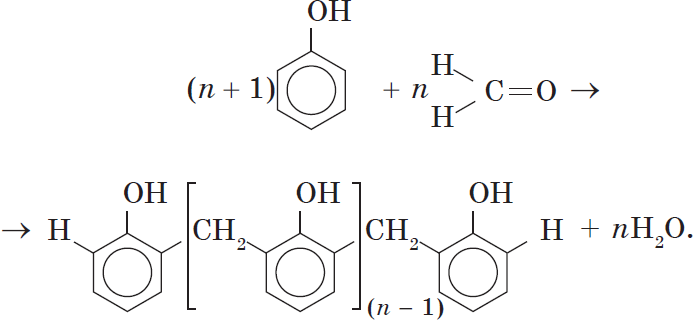
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны
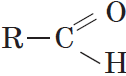
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 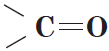
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
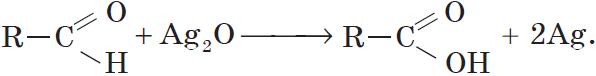
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Карбоновые кислоты
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 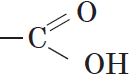
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
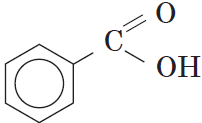
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
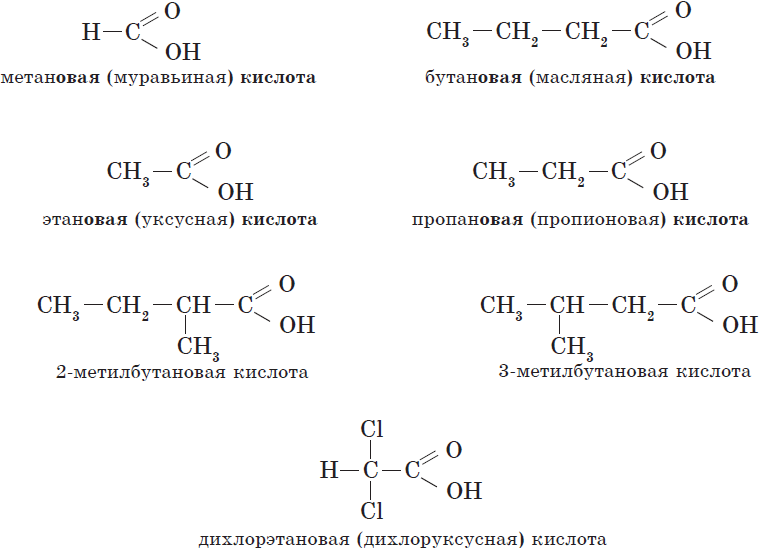
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100.8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100.8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 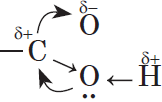
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{text»олеиновая кислота»}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{text»стеариновая кислота»}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{text»акриловая(пропеновая)кислота»}→{CH_2Br—CHBr—COOH}↙{text»2,3-дибромпропановая кислота»}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{text»хлоруксусная кислота»}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{text»дихлоруксусная кислота»}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{text»трихлоруксусная кислота»}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
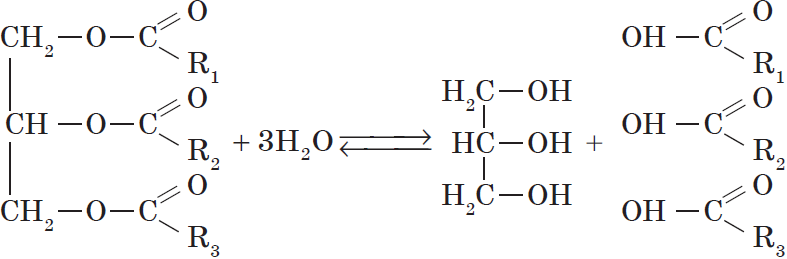
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
Алкены: получение.
1.Крекинг нефтепродуктов СnH2n+2→СnH2n+2 + СnH2n получаются
углеводороды с более короткой углеродной цепь.
2.Дегидрирование алканов. СnH2n+2→ СnH2n + Н2
(кат Pt, Ni, Cr2O3, t 400-6000)
3. Дегидратация спиртов (H2SO4
конц, Al2O3, 140-1800)
Атом водорода отщепляется преимущественно по правилу Зайцева: от менее
гидрогенизированного атома углерода. CH3 — CH3 — CHОН – CH2 — CH3 → CH3 — CН = CH — CH3 + H2O
4.Дегидрогалогенирование (отщепление
галогеноводорода) при нагревании со спиртовым раствором щелочи. Атом водорода
отщепляется преимущественно по правилу Зайцева: от менее гидрогенизированного
атома углерода.
СН3
– СНГ – СН2 — СН3 + NаОН (спирт) → СН3 – СН =
СН — СН3 + NаГ + H2O
5.Дегалогенирование (цинк или магний
с дигалогеналканом, атомы галогенов располагаются у соседних атомов углерода)
СН3
– СНГ – СНГ — СН3 + Zn → ZnГ2 + СН3 – СН = СН
— СН3
Алкены: химические
свойства.
Реакции
присоединения.
1.Гидрирование
алкенов. СnH2n + Н2
(кат Pt, Ni, Pd; P, T) → СnH2n+2
2.Галогенирование алкенов. СnH2n + Г2→
СnH2nГ2 дигалогеналкан
(присоединение идет по двойной связи, качественная реакция на непредельный
характер – обесцвечивание бромной воды.
3.Гидрогалогенирование алкенов CH2 = CH — CH3 + НГ → CH3 — CHГ — CH3 (
присоединение происходит по правилу Марковникова – к более гидрогенизированному
атому углерода при двойной связи присоединяется водород, к менее
гидрогенизированному атому углерода – галоген ,происходит по ионному механизму)
4.Гидратация алкенов. CH2 = CH — CH3 + Н-ОН →
CH3 — CHОН — CH3 (
образуется предельный одноатомный спирт, присоединение по правилу Марковникова,
происходит по ионному механизму)
5.Полимеризация. по радикальному
механизму, образуется полимер
nCH2 = CH2 → (CH2 — CH2 )n (этилен
→ полиэтилен)
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (пропилен
→ полипропилен)
│ │
CH3 CH3
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (хлорэтен,
винилхлорид → поливинилхлорид)
│ │
Cl Cl
мономер
структурное звено
nCH2 = CH →
(CH2 — CH) n (винилбензол,
стирол → полистирол)
│ │
C6H5
C6H5
мономер
структурное звено
nCH2 = CH →
(-CH2 — CH-) n (винилацетат
→ поливинилацетат)
│ │
ОСОСН3 ОСОСН3
мономер
структурное звено
nC(СН3)
= CH2 → (C(СН3)
= CH2) n
(метилметакрилат →полиметилметакрилат)
│
│
СООСН3
СООСН3
Мономер структурное звено
Химические
свойства алкенов. Реакции окисления.
А)Мягкое
окисление
по Вагнеру (окисление водным раствором перманганата калия в нейтральной среде)
качественная реакция на непредельный характер – обесцвечивание перманганата
калия.
3СН 2 =
СН2 + 2КМnО4 + 4Н2О →3СН 2
— СН2 +2МnО2 +2 КОН
│ │
ОН ОН
Б)Жесткое
окисление
алкенов проводят сильными окислителями при нагревании в кислой
среде (обычно используют H2SO4),
цепь алкена разрывается по месту двойной связи, образуется два продукта,
строение которых зависит от строения исходной цепи. Возможны несколько случаев:
1. Двойная связь при вторичном
углероде, R–СН= звено окисляется до карбоксильной
группы
R–СOOH,
образуется карбоновая кислота:
5 Н3С –
СН = СН – СН2 – СН3 + 8 КМnО4 + 12Н2SO4 →
5СН3СООН
+
5НООС —
СН2 – СН3 +4К2SO4 + 8МnSO4 + 12 Н2О
2.Реакция с симметричным алкеном:
Н3С –
СН = СН – СН3 + 8 КМnО4 + 12Н2SO4 → 10СН3СООН + 4К2SO4 + 8МnSO4 + 12 Н2О
3. Двойная
связь при звене H2C=
окисляется до углекислого газа и воды. Звено = СН – СН3
окисляется до уксусной кислоты:
СН2 =
СН – СН3 + 2КМnО4 + 3Н2SO4 →СН3СООН + СО2 + К2SO4 + 2МnSO4 + 4Н2О
4. Двойная
связь при третичном углероде, R’RC=. Звено
окисляется до кетона R’–CO–R, другой
фрагмент окисляется до кислоты:
5Н3С –
С(СН3) = СН – СН3 + 6КМnО4 + 9Н2SO4 →
5СН3СООН
+5Н3С
– С(О) — СН3 + 3К2SO4 + 6МnSO4 + 9Н2О
Или 5Н3С
– С(СН3) = СН2 + 8КМnО4 + 12Н2SO4 →
5СО2
+5Н3С
– С(О) — СН3 + 4К2SO4 + 8МnSO4 + 17Н2О
В)Жесткое
окисление алкенов в нейтральной среде при нагревании.
1. Двойная связь
при вторичном углероде, R–СН=.
Звено окисляется до группы R–СOOK,
образуется соль карбоновой кислоты:
3Н3С –
СН = СН – СН2 – СН3 + 8 КМnО4 →
3СН3СООК
+
3КООС —
СН2 – СН3 +2КОН + 8МnO2 + 2Н2О
2. Двойная
связь при звене H2C=.
Звено окисляется до карбоната калия:
3СН2 =
СН – СН3 + 10КМnО4 → 3СН3СООК + 3К2СО3 + 10МnO2 + 4Н2О
+ КОН
3. Двойная
связь при третичном углероде, R’RC=.
Звено окисляется до кетона R’—CO–R:
Н3С –
С(СН3) = СН – СН3 + 2КМnО4 →
СН3СООК +Н3С
– С(О) — СН3 +2МnO2 + КОН
Г)Каталитическое
окисление алкенов (катализатор хлорид палладия)
2СН2 =
СН2 + О2 → 2СН3СООН
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются
алкены, алкины, алкадиены (полиены)
. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (
циклоалкены
), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены
— ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СнН2н. Свое второе название —
олефины
— алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии ср
2
-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Строение этилена

Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (
этилена
): С
2
Н
4
— этен, С
3
Н
6
— пропен, С
4
Н
8
— бутен, С
5
Н
10
— пентен, С
6
Н
12
— гексен, С
7
Н
14
— гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или
цис- и транс-
изомерии
.
Цис-изомеры
отличаются от
транс-изомеров
пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия.
В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс
-ен
, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения
. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму
электрофильного присоединения
.
1. Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов)
. Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3.
Гидрогалогенирование (присоединение галогеноводорода)
.
Эта реакция подчиняется
правилу Марковникова
:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются
вторичные спирты
.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация.
Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение.
Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах.
В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
RH + XY → RX + HY
или
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
CH4 + 2O2 = CO2 + 2H2O
Б) неполное сгорание при недостатке кислорода:
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 оС) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
2CH4 → C2H2 + 3H2
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
СН4 → С + 2Н2
При дегидрировании остальных алканов образуются алкены:
C2H6 → C2H4 + H2
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь. Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
СnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3,
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
СН3-C≡CН + NaNН2 → СН3-C≡CNa + NН3
СН3-C≡CNa + CH3Br → СН3-C≡C-СН3 + NaBr
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Гидрирование
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Горение
2С6Н6 + 15О2 = 12СО2 + 6Н2О+Q
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Деление заместителей в бензольном кольце на два типа:
Рассмотрим химические свойства гомологов бензола на примере толуола.
Химические свойства толуола
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частности, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогруппу при нитровании толуола смесью концентрированных азотной и серной кислот приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано, метильный радикал является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С6Н5СН3 + 9O2 → 7СO2 + 4Н2O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль: