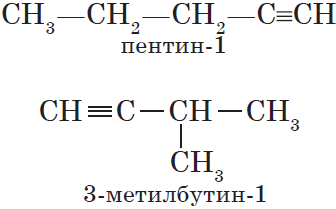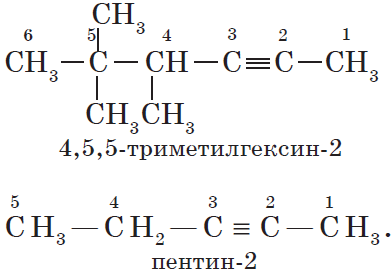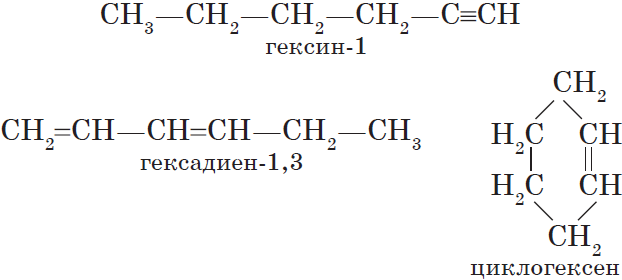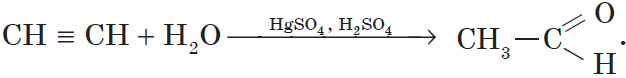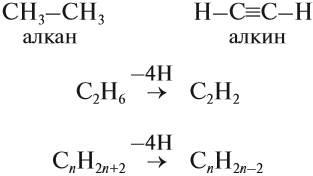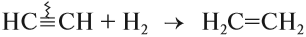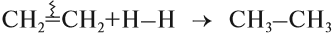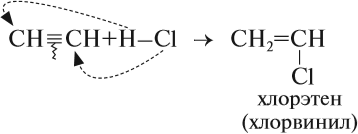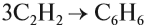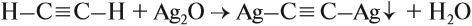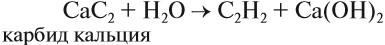Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен).
Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация
атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых
начинается тройная связь.

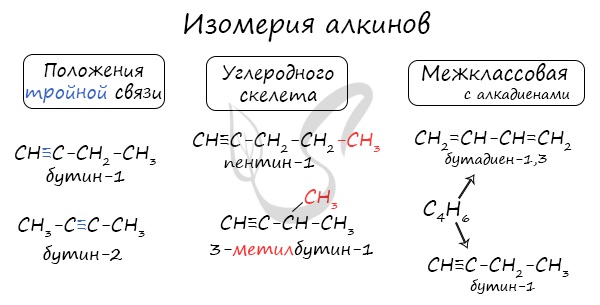
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи,
соединен только с одним единственным заместителем.
Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
- Синтез Бертло
- Разложение карбида кальция
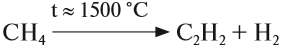
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
2CH4 → (t) CH≡CH + 3H2
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
CaC2 + 2H2O → CH≡CH + Ca(OH)2
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена
расположены у одного атома углерода или у двух соседних атомов.

Химические свойства алкинов
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Реакция Кучерова
- Окисление
- Реакция Н.Д. Зелинского (тримеризация ацетилена)
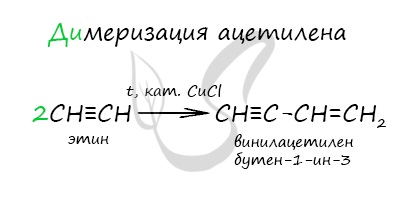
- Димеризация ацетилена
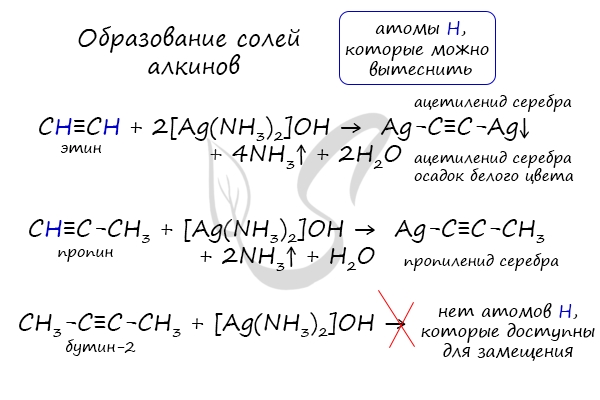
- Образование солей алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH2=CH-CH3 + H2 → (t, Ni) CH3-CH2-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.

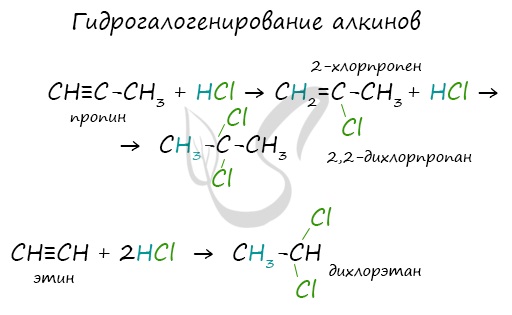
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским
химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg2+.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются
кетоны.

При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
2CH≡CH + 5O2 → 4CO2 + 2H2O
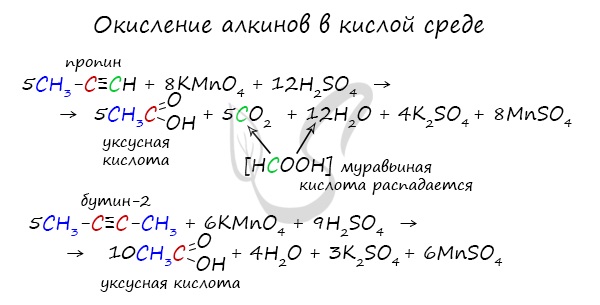
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на
углекислый газ и воду.
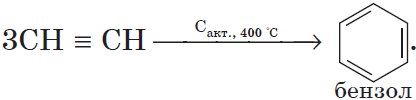
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.

Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются,
образуя винилацетилен.
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла.
Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь.
Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан.
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан.
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен.
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид.
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
Например, при гидратации пропина образуется пропанон (ацентон).
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
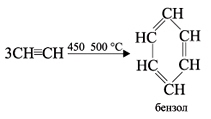
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации ацетилена образуется полимер линейного или циклического строения.
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания пропина:
C3H4 + 4O2 → 3CO2 + 2H2O
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов.
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия.
Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия.
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы.
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
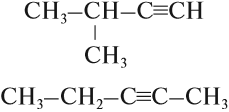
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
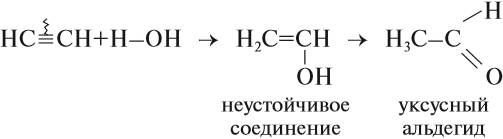
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text»бутен-1-ин-3(винилацетилен)»}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Чтобы поделиться, нажимайте
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы.
При обычных условиях алкины С2Н2 — С4Н6 – газы, С5Н8 — С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов.Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их
ненасыщенностью. Некоторые различия определяются следующими факторами.
- p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
- p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
- Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2— 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н+. Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли.
I. Реакции присоединения
1). Галогенирование – стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2—CHBr2 (1,1,2,2-тетрабромэтан)
2). Гидрогалогенирование
(труднее, чем у алкенов) – стадийно:
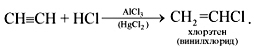
* CH3-C≡CH + HBr AlBr3→ CH3-CBr=CH2
2-бромпропен
* — используется правило Морковникова
3). Гидратация – ( р. М.Г. Кучерова)
CH≡CH + H2O Hg2+,H+→ [CH2=CH-OH] → CH3-CH=O (уксусный альдегид )
непредельный спирт – енол
протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида.
4). Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
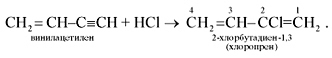
II. Реакции окисления и восстановления
1). Горение – пламя сильно коптящее
CnH2n-2 + (3n-1)/2O2 t → nCO2 + (n-1)H2O + Q
2). Окисление
Протекание реакции и её продукты определяются средой!
А) в кислой среде при нагревании образуются карбоновые кислоты, при концевой кратной связи — CO2:
5CH3 – CH2 – C ≡ C – CH3 + 6KMnO4 + 9H2SO4 → 5CH3 – CH2COOH + 5CH3COOH + 6MnSO4 + 3K2SO4 + 4H2O
5CH3 – C ≡ CH + 8KMnO4 + 12H2SO4 → 5CO2 + 5CH3COOH + 8MnSO4 + 4K2SO4+12H2O
Б) в нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот; ацетилен окисляется до оксалатов (солей щавелевой кислоты):
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
(Качественная реакция — обесцвечивают раствор марганцовки)
CH3 – C ≡ C – CH3 + 2KMnO4 → 2CH3 – COOK + 2MnO2
3CH ≡ C – CH3 + 8KMnO4 → 3CH3 – COOK + 2K2CO3 + KHCO3 + 8MnO2 + H2O
3). Восстановление ( kat – Ni,Pd или Pt)
C2H2 + H2 t,kat→ C2H4
C2H2 + 2H2 t,kat→ C2H6
III. Реакции замещения
1). Кислотные свойства
(в отличие от алкенов, образуют соли – ацетилениды)
R—C≡C—H + NaH → R—C≡C—Na + H2↑
Качественные реакции на алкины с тройной связью в конце цепи:
R—C≡CH + [Ag(NH3)2]OH → R—C≡C—Ag↓ +2NH3 + H2O
серо-белый осадок
R—C≡C—H + [Cu(NH3)2]Cl → R—C≡C—Cu↓ + NH4Cl +NH3
красный осадок
Ацетилениды серебра и меди (I)- разлагаются соляной кислотой:
R—C≡C—Cu↓ +HCl → R—C≡C—H + CuCl
Ацетилениды металлов – взрывчатые вещества!
АЛКИНЫ —углеводороды, содержащие в молекуле одну ТРОЙНУЮ связь.
Общая формула алкинов: CnH2n-2
Тройная связь является комбинацией из одной σ- и двух π-связей, образуемых двумя sp-гибридизованными атомами углерода. σ-Cвязи, образуемые sp-гибридными орбиталями углерода, располагаются на одной прямой (под углом 1800 друг к другу).
Поэтому молекула ацетилена имеет линейное строение:
Номенклатура алкинов.
Первый член гомологического ряда – этин имеет историческое название:
НС≡СН ацетилен.
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин:
H-C≡C-H — этИН СН3-С≡С-Н – пропИН и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной).
Виды изомерии алкинов.
1.Изомерия положения тройной связи (начиная с С4Н6):
HC≡C-CH2-CH3 H3C-C≡C-CH3
бутин-1 бутин-2
2.Изомерия углеродного скелета (начиная с С5Н8):
НС≡С-СН2-СН2-СН3 НС≡С-СН-СН3
∣
СН3
3.Межклассовая изомерия с алкадиенами ( начиная с С3Н4) и циклоалкенами (начиная с С4Н6):
HC≡C-CH2-CH3 СН2=СН-СН=СН2 СН=СН
бутин-1 бутадиен ∣ ∣ циклобутен
СН2-СН2
ПОЛУЧЕНИЕ АЛКИНОВ.
|
1.Пиролиз метана: |
2СН4 —(1500ºС)🡪 C2H2 + 3H2 Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1-0,01 секунды. Столь малое время нагревания обусловлено тем, что ацетилен при такой температуре может разлагаться на углерод и водород. |
|
2.Гидролиз карбида кальция: |
СаО + С -(t)🡪 СаС2 + СО СаС2 + Н2О 🡪 Са(ОН)2 + С2Н2 Карбид кальция образуется при нагревании оксида кальция СаО (жженой извести) и кокса до 2500ºС. При дальнейшем гидролизе выделяется ацетилен. |
|
3. Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке). |
R-CH2-CBr2-R + 2KOH —(спирт)🡪 R-C≡C-R + 2H2O + 2 KBr R-CHBr-CHBr-R + 2KOH —(спирт)🡪 R-C≡C-R + 2H2O + 2 KBr |
|
4. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами. |
R-C≡CNa + Br-R’ 🡪 R-C≡C-R’ + NaBr |
СВОЙСТВА АЛКИНОВ
Особенности алкинов:
- π-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью).
- Поэтому реакции ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ к алкинам протекают медленнее, чем к алкенам.
- Алкины с концевой тройной связью (алкины-1) проявляют КИСЛОТНЫЕ СВОЙСТВА и способны, вступая в реакции с активными металлами, образовывать соли.
1. Реакции присоединения.
А. Гидрирование:
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):
При использовании менее активного катализатора [Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
Б. Галогенирование:
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Алкины обесцвечивают бромную воду (качественная реакция).
В. Гидрогалогенирование.
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
Г. Гидратация (реакция Кучерова):
Присоединение воды в присутствии катализатора соли ртути (II) идет через образование неустойчивого енола, который изомеризуется в альдегид или кетон.
Если гидратации подвергается АЦЕТИЛЕН, то образуется уксусный альдегид.
Из всех остальных алкинов при гидратации образуются кетоны (так как присоединение протекает по правилу Марковникова).
2. Димеризация и тримеризация алкинов.
1) Димеризация под действием водно-аммиачного раствора CuCl:
2) Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
3. Кислотные свойства алкинов с концевой тройной связью.
Образование солей: концевые атомы водорода у ацетилена и алкинов-1 могут замещаться атомами металла. При этом образуются соли – ацетилениды:
СН3-С≡С-Н + NaNH2 🡪 СН3-С≡С-Na + NH3
амид натрия ацетиленид натрия
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
HC≡CH + 2[Cu(NH3)2]OH 🡪 CuC≡CCu + 4NH3 + 2H2O
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого — ацетиленида меди) служит качественной реакцией на концевую тройную связь.
AgC≡CAg + Н2О – реакция не идет
AgC≡CAg + 2НСl 🡪 НC≡CН + 2АgCl
- Окисление алкинов:
Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
1) Ацетилен окисляется раствором перманганата калия до соли щавелевой кислоты – оксалата калия (в нейтральной среде) или до щавелевой кислоты (кислая среда):
3НС≡СН + 8KMnO4 + 4H2O 🡪 3НООС-СООН + 8MnO2↓+ 8KOH
щавелевая кислота
3НС≡СН + 8KMnO4 🡪 2K2C2O4 + 8MnO2 ↓+ 2KOH + 2H2O
оксалат калия
2) Алкины окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
5С2Н2 + 8KMnO4 + 12Н2SО4 🡪 5НООС-СООН + 8MnSO4 + 4K2SO4 + 12H2O
5R-C≡СН + 8KMnO4 + 12Н2SО4 🡪 5R-СООН + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
5R-C≡С-R1 + 6KMnO4 + 9Н2SО4 🡪 5R-СООН + 5R1-COOH +6MnSO4 +3K2SO4 + 4H2O
Алкины
— ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле С
п
Н
2
n
-2
.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии ср — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π — связи. Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости л-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (
ацетилена
): С
2
Н
2
—
этин
, С
3
Н
4
—
пропин
, С
4
Н
6
—
бутин
, С
5
Н
8
—
пентин
, С
6
Н
10
—
гексин
и т. д.
Изомерия
и номенклатура
алкинов
Для алкинов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (
цис-,
транс-
) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом
— ин
, а ее положение в цепи — номером атома углерода. Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С
6
Н
10
имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений. Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства алкинов
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
1) p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2) Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2- 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н+.
Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли
Получение алкинов
Применение алкинов
Наибольшее практическое значение имеют ацетилен и винилацетилен. Ацетилен используется для получения самых разнообразных веществ: уксусной кислоты, поливинилхлорида, синтетического каучука. Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука.
Содержание
- Определение. Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алкинов
- Физические свойства
- Химические свойства
- Получение и применение ацетилена
- Выводы
Определение. Гомологический ряд, номенклатура, изомерия
Алкины — это нециклические углеводороды, в молекулах которых есть одна тройная связь, а остальные связи простые.
Алкины относят к группе непредельных ненасыщенных углеводородов. Для того чтобы вывести общую формулу гомологического ряда алкинов, сравним состав алканов и алкинов:
Таким образом, алкины образуют гомологический ряд, общая формула которого
Вопрос. Какие ещё углеводороды имеют такую же общую формулу гомологического ряда?
Значит, алкины и алкадиены с одинаковым числом атомов углерода являются изомерами.
Первый член гомологического ряда С2Н2 называется ацетилен. Поэтому алкины относятся к ацетиленовым углеводородам.
Вопрос. Почему в названиях ацетиленовых углеводородов появился суффикс ИН? (См. урок 17.7.)
Задание 20.1. Составьте молекулярную и графическую формулы алкина с n = 4.
Выполнив последнее задание, вы убедитесь, что для этого алкина можно составить две графические формулы:
Значит, изомерия алкинов связана с положением тройной связи в молекуле. Кроме того, изомерия связана со строением углеводородного радикала:
Задание 20.2. Составьте молекулярные формулы этих соединений и убедитесь, что это изомеры. Назовите эти вещества.
Запомните:
- названия алкинов составляют, используя суффикс ИН;
- нумерацию основной цепи ведут с того конца, к которому ближе тройная связь.
Строение молекул
В состав молекулы любого алкина входит одна тройная связь, поэтому особенности свойств этих соединений будут связаны с особенностями тройной связи. Это сложная, неоднородная связь. Её составляют одна простая σ-связь и две π-связи.
Вопрос. Какая из этих связей легче разрушается в химических реакциях? Почему?
Значит, как и у алкенов, в химических реакциях будет прежде всего разрушаться менее прочная π-связь. Алкины тоже легко вступают в химические реакции, но, в отличие от алкенов, большинство реакций за счёт π-связи идут в две стадии: сначала разрывается одна π-связь, потом вторая π-связь. Характерной реакцией является реакций присоединения, хотя возможны и другие типы реакций.
Свойства алкинов
Физические свойства
По физическим свойствам алкины мало отличаются от алкенов и алканов. Так, простейший алкин ацетилен — газ без вкуса и запаха, плохо растворимый в воде. Среди гомологов ацетилена есть и жидкие, и твёрдые вещества: чем больше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Они идут в две стадии:
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция присоединения для полученного вещества? Почему?
Таким образом, в результате реакции гидрирования из ацетилена можно получить и этилен, и этан. Всё зависит от условия процесса и от соотношения исходных веществ. Например, реакцию присоединения хлороводорода к ацетилену часто прерывают на первой стадии:
Дело в том, что хлорвинил применяется для получения полимера полихлорвинила.
Задание 20.3. Составьте уравнения реакции полимеризации хлорвинила.
Изделия из полихлорвинила (–СНСl–СН2–)n имеют разнообразное применение.
Так, полихлорвинил (ПХВ, или ПВХ) является основой для получения искусственной кожи, различной посуды одноразового пользования, полимерной тары, клеёнок, отделочных материалов и т. д. Многие пластмассовые изделия, которые мы используем каждый день, обивка салонов автомобилей, вагонов, самолётов, — сделаны из ПВХ. Он также используется для электроизоляции проводов.
Аналогично идут и другие реакции присоединения. Например, ацетилен, как и этилен, обесцвечивает бромную воду. Кроме того, он обесцвечивает и раствор перманганата калия, т. е. вступает в реакции окисления.
Задание 20.4. Составьте уравнения реакции ацетилена с бромом.
Таким образом, ацетилен тоже даёт качественные реакции на π-связь. Поэтому правильнее говорить, что реакции обесцвечивания бромной воды и перманганата калия — это качественные реакции на кратную связь. Другими словами, при помощи этих реакций можно обнаружить непредельные соединения, содержащие кратную связь, которая содержит π-связь.
Большое практическое значение имеет реакция присоединения воды к ацетилену — гидратация ацетилена. Поскольку эту реакцию открыл и изучил российский ученый М. Г. Кучеров*, она носит название «реакция Кучерова»:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик. Открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
Уксусный альдегид нужен для получения уксусной кислоты. Ацетилен горит.
Задание 20.5. Составьте уравнение реакции горения ацетилена.
Газообразные углеводороды можно различить по характеру пламени. Так, метан горит бесцветным пламенем, этилен — светящимся, а ацетилен — коптящим, т. е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В токе кислорода ацетилен горит ослепительно-голубым пламенем с выделением большого количества теплоты (температура пламени превышает 3000 °C!). Поэтому эта реакция используется для газовой сварки и резки металлов.
При неполном окислении ацетилена (раствором перманганата калия) образуется смесь кислот.
Для ацетилена возможна реакция полимеризации, причём в эту реакцию может вступать небольшое число молекул. Так, при тримеризации ацетилена (соединяются три молекулы) образуется циклическое соединение — бензол:
Для алкинов характерна подвижность атомов водорода у тройной связи. За счёт этих атомов происходят реакции замещения таких атомов водорода:
Аналогичная реакция замещения происходит и с оксидом меди (I), и со щелочными металлами. В результате обеих реакций выделяется осадок, поэтому их считают качественными реакциями на алкины, в молекулах которых имеется атом водорода у тройной связи. Такая же реакция замещения происходит и со щелочными металлами.
Получение и применение ацетилена
Ацетилен в небольших количествах входит в состав природных газов. Его получают крекингом метана:
В небольших количествах, например для сварки металлов и в лаборатории, его получают из карбида кальция:
Ацетилен, полученный карбидным способом, используется для сварки и резки металлов, поскольку температура пламени автогена (горение ацетилена в кислороде) достигает 3000 °C.
Ацетилен и его производные используются для получения пластмасс, каучуков, уксусной кислоты, растворителей.
Выводы
Алкины — это непредельные углеводороды, содержащие тройную связь. Для таких веществ характерны реакции:
- присоединения;
- окисления;
- полимеризации. Все они происходят за счёт разрыва π-связи, которая входит в состав тройной связи;
- замещения атома водорода у тройной связи.