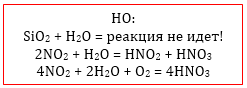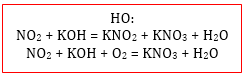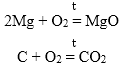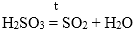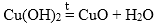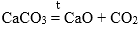Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Химические свойства амфотерных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
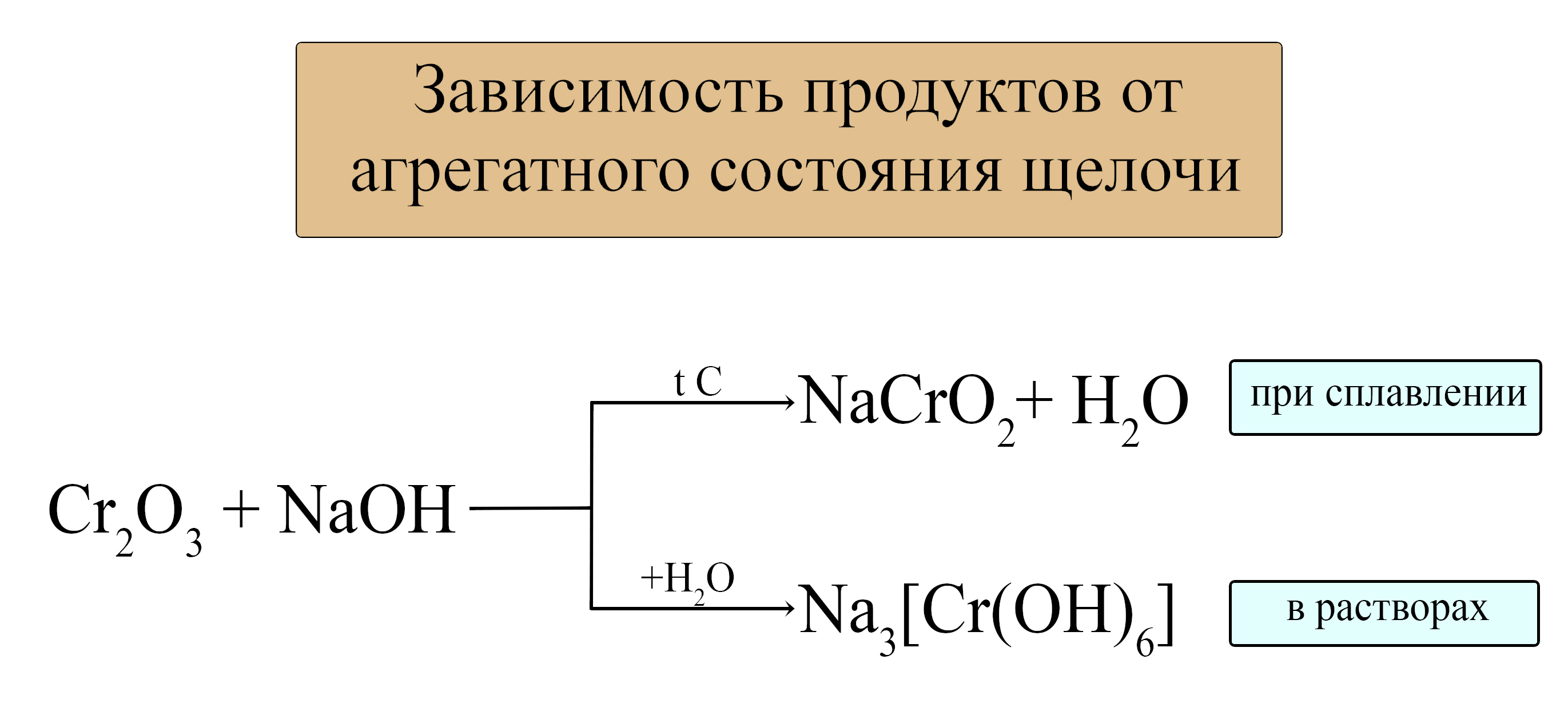
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
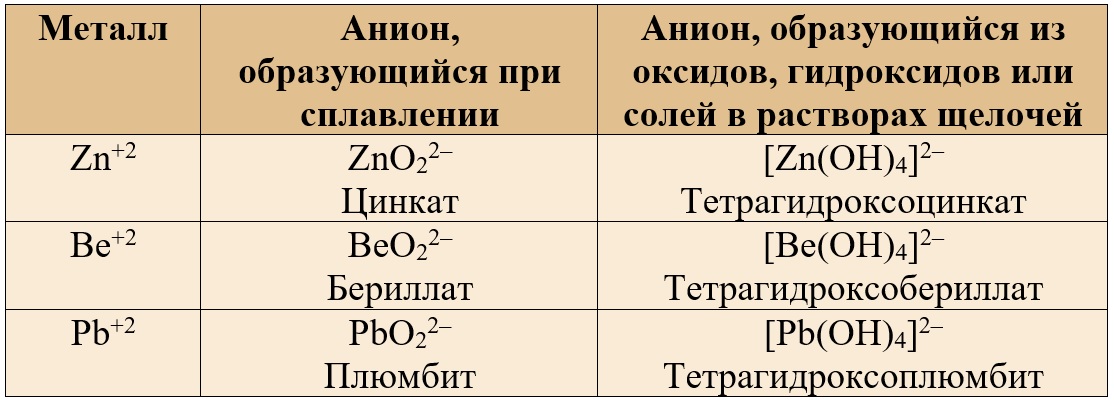
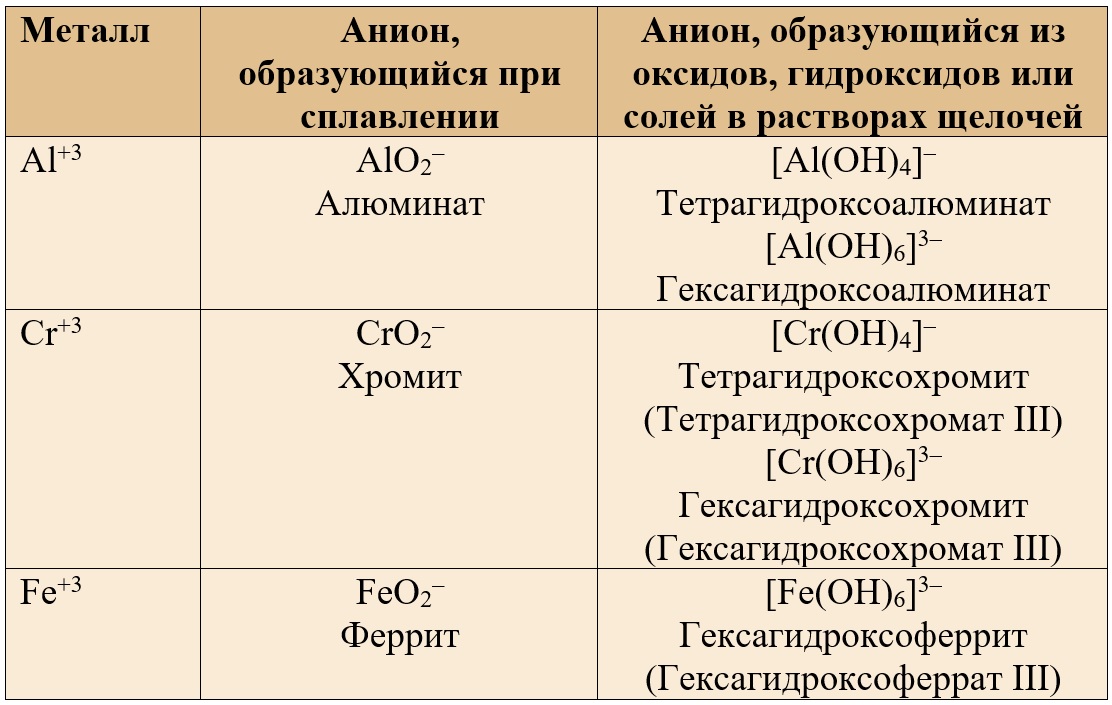
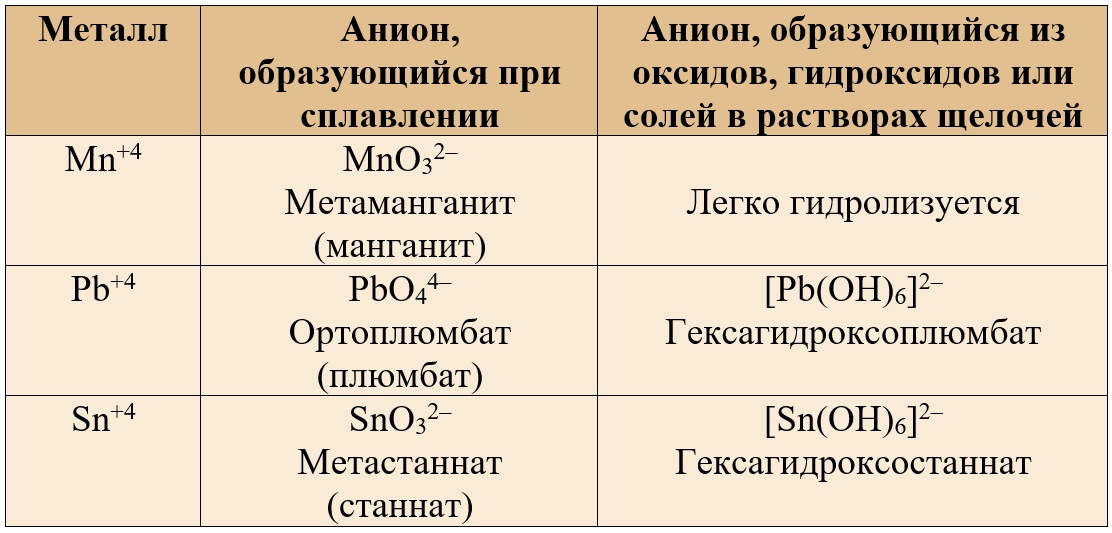
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
|
Степень окисле-ния +2 (Zn, Sn, Be) |
Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Химические свойства амфотерных соединений
Правило 1. Амфотерными соединениями являются оксиды и гироксиды, имеющие в своем составе металл в степении окисения +3 или +4, а также оксиды и гидроксиды Zn, Be и Pb, например:
| ZnO | BeO | Al2O3 | Fe2O3* | Cr2O3* |
| Zn(OH)2 | Be(OH)2 | Al(OH)3 | Fe(OH)3 | Cr(OH)3 |
| PbO | PbO2 | SnO | SnO2 | |
| Pb(OH)2 | Pb(OH)4** | Sn(OH)2 | Sn(OH)4** |
*Оксиды железа и хрома реагируют с щелочами только при сплавлении.
**Представляют собой гидратированные диоксиды МO2 • хH2O.
Знание свойств соединений свинца и олова на ЕГЭ не проверяется.
Правило 2. В реакциях с растворами щелочей образуются комплексные соединения:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al(OH)3 + NaOH → Na[Al(OH)4]
Fe2O3 + NaOH → реакция не идет
Cr2O3 + NaOH → реакция не идет
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] (гексагидроксохромат натрия)
Правило 3. В реакциях сплавления с твердыми щелочами образуются соли соответствующих кислот (H2ZnO2, HAlO2 и др.):
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (условно, кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (условно, кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (условно, кислота: HAlO2)
Cr2O3 + 2NaOH → 2NaCrO2 + H2O (хромит натрия)
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
Cr(OH)3 + NaOH → NaCrO2 + 2H2O (условно, кислота HCrO2)
Fe2O3 + 2KOH → 2KFeO2 + H2O (феррит калия)
Fe(OH)3 + KOH → KFeO2 + 2H2O(условно, кислота HFeO2)
Правило 4. При сплавлении с карбонатами выделяется CO2:
2Al(OH)3 + Na2CO3 → 2NaAlO2 + 3H2O + CO2
Правило 5. Амфотерные оксиды взаимодействуют с карбонатами и сульфитами Na и K с выделением более летучего оксида:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Правило 6. Соли соединений Zn, Be и Al разлагаются водой, кислотами, хлоридом аммония:
NaAlO2 + 2H2O → Na[Al(OH)4]
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O (в избытке HCl)
NaAlO2 + HCl + H2O → NaCl + Al(OH)3 (в недостатке HCl)
NaAlO2 + NH4Cl + H2O → Al(OH)3 + NaCl + NH3.
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
Материал по химии
Оглавление
- Какие оксиды называют амфотерными?
- Химические свойства амфотерных оксидов
- Получение амфотерных оксидов
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Какие оксиды называют амфотерными?
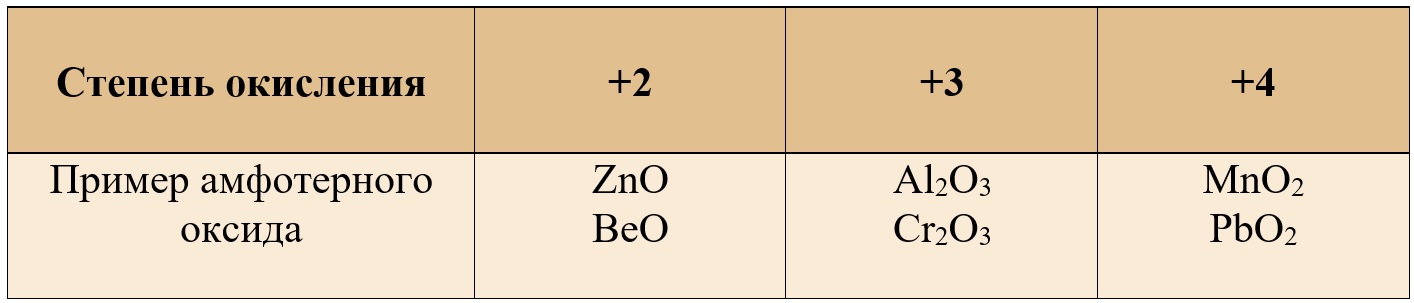
К амфотерным относят в основном оксиды металлов +3 и +4 степени окисления, но также можно встретить амфотерные оксиды и в степени окисления «+2».
Таблица 1. – Примеры амфотерных оксидов в различных степенях окисления
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
Примеры амфотерных оксидов
В таблице представлены лишь самые популярные примеры оксидов, встречающихся на ЕГЭ, многие другие оксиды при различных условиях реагируют как со щелочами, так и с кислотами.
Подробнее о классификации оксидов можно узнать в статье Классификация оксидов
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Химические свойства амфотерных оксидов
- Амфотерные оксиды проявляют свойств основных оксидов в реакции с кислотами:
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
BeO + 2HBr = BeBr2 + H2O
- Амфотерные оксиды проявляют основность при реакции с кислотными оксидами:
ZnO + SO3 = ZnSO4
BeO + N2O5 = Be(NO3)2
- Амфотерные оксиды проявляют свойства кислотных оксидов при взаимодействии со щелочами (растворимыми основаниями). При этом реакция осуществима как в растворах с концентрированными щелочами, так и при сплавлении.
В растворах:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Полученную соль называют тетрагидроксоцинкат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Полученную соль называют тетрагидроксоалюминат натрия.
Формула полученной соли зависит от количества воды и щелочи, вступивших в реакцию, так в избытке щелочи образуется гексагидроксоалюминат, а не тетрагидроксоалюминат:
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]
При сплавлении:
ZnO + 2NaOH = Na2ZnO2 + H2O
Полученная соль называется цинкат натрия.
Al2O3 + KOH = KAlO2 + H2O
Полученная соль называется алюминатом калия (метаалюминат)
В следующих таблицах приведены некоторые средние и комплексные анионы, в состав которых входят амфотерные металлы.
Таблица 2. – Анионы, содержащие амфотерные металлы в валентности II.
Таблица 3. – Анионы, содержащие амфотерные металлы в валентности III.
Соли с координационным числом «6» образуются в сильном избытке щелочи.
Таблица 4. – Наиболее распространенные ионы, содержащие амфотерные металлы в валентности IV.
Пользуясь данными таблицами, можно назвать многие соли, например, средние соли:
KAlO2 – алюминат калия
Ca(AlO2)2 – алюминат кальция
NaAlO2 – алюминат натрия
K2ZnO2 – цинкат калия
BaZnO2 – цинкат бария
Na2BeO2 – бериллат натрия
CaBeO2 – бериллат кальция
K2PbO2 – плюмбит калия, содержит свинец (II)
BaPbO2 – плюмбит бария
K4PbO4 – плюмбат (ортоплюмбат) калия, содержит свинец (IV)
Ca2PbO4 – плюмбат кальция
Na2SnO3 – станнат натрия
KCrO2 – хромит калия
NaFeO2 – феррит натрия
И комплексные соли:
K[Al(OH)4] – тетрагидроксоалюминат калия
K3[Al(OH)6] – гексагидроксоалюминат калия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Ca[Zn(OH)4] – тетрагидроксоцинкат кальция
K2[Be(OH)4] – тетрагидроксобериллат калия
Ba[Be(OH)4] – тетрагидроксобериллат бария
Na2[Pb(OH)4] – тетрагидроксоплюмбит натрия
Na2[Pb(OH)6] – гексагидроксоплюмбат натрия
Ca[Sn(OH)6] – гексагидроксостаннат кальция
Na[Cr(OH)4] – тетрагидроксохромит натрия
K3[Cr(OH)6] – гексагидроксохромит калия
Ca3[Cr(OH)6] – гексагидроксохромит кальция
Na3[Fe(OH)6] – гексагидроксоферрит натрия
Как составлять формулы безводных солей?
Например, в реакции участвовал оксид свинца IV и оксид кальция:
PbO2 + CaO = ?
В первую очередь необходимо знать остатки соответствующих кислот, следовательно и формулы кислот, содержащих амфотерный металл. И хоть многие из них не выделены, теоретически мы можем установить их формулы. Для амфотерных металлов в III и IV валентности можно установить орто- и мета-формулы кислот. Для металлов в II валентности выделяют только одну форму кислоты, поэтому для них не указывают уточняющую приставку «орто-» или «мета-», а вывод формулы соответствует выводу как орто- так и мета-формул кислот и их остатков у металлов в III и IV валентности.
Орто-формула соответствует гидроксиду амфотерного металла с учетом того, что в кислоте порядок элементов меняется (водород должен стоять на первом месте).
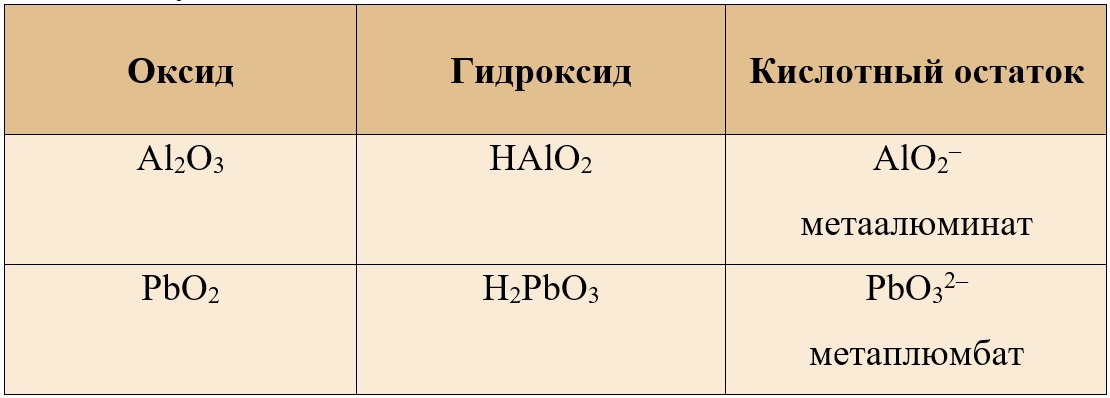
Таблица 5. – Амфотерные оксиды и кислотные остатки, соответствующие им
Для амфотерных металлов в III валентности можно выделить общую формулу орто-кислоты и орто-аниона: H3MeO3 и MeO33-.
Для амфотерных металлов в IV валентности можно выделить общую формулу орто-кислоты и орто-аниона: H4MeO4 и MeO44-.
Таким образом, в реакции оксида свинца IV и оксида кальция можно получить ортоплюмбат кальция:
PbO2 + 2CaO = Ca2PbO4 (ортоплюмбат кальция)
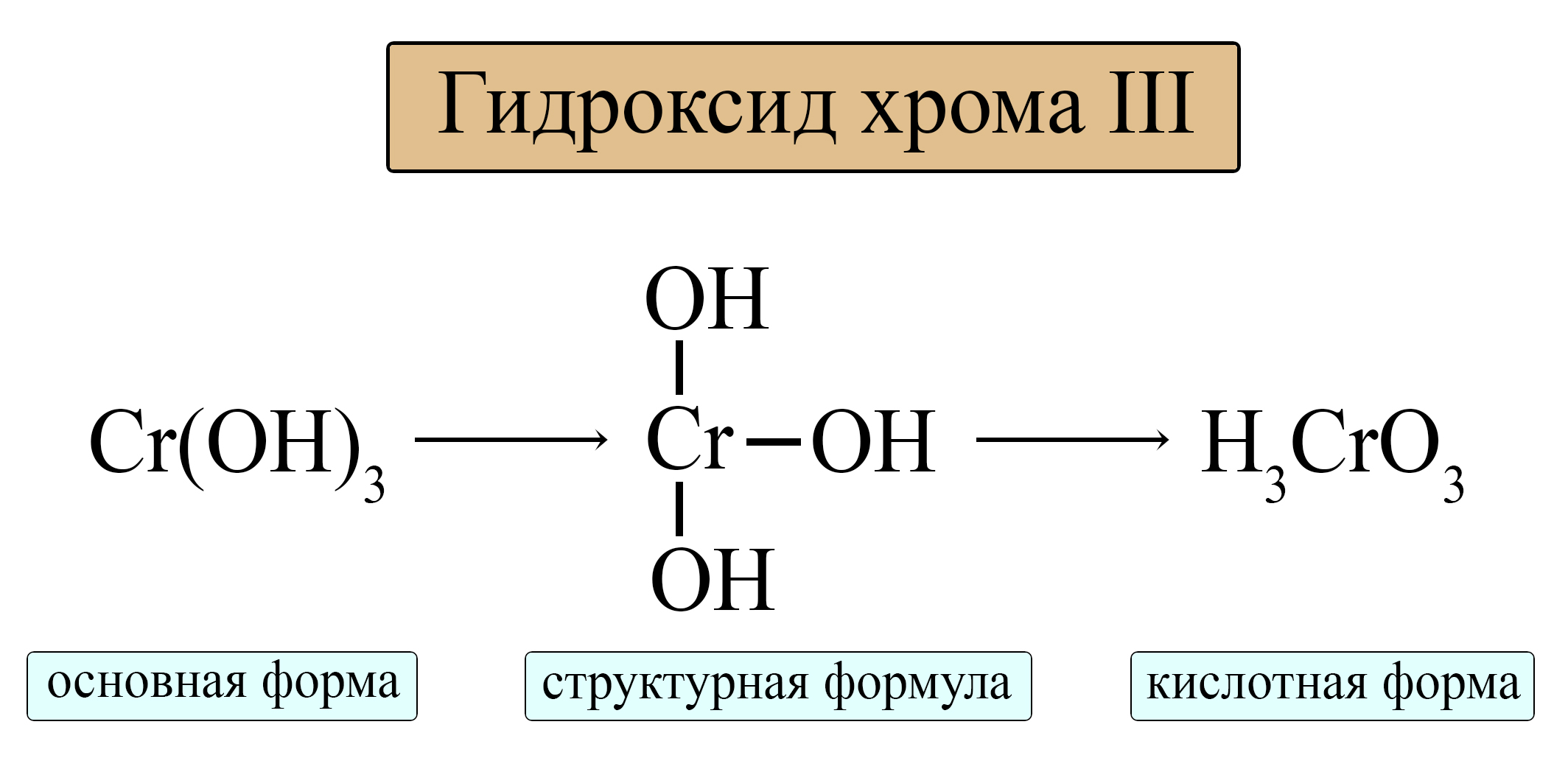
Для этих же металлов можно вывести мета-формулы кислот и их остатков, для этого при образовании формулы используются наименьшие значения индексов. Так, формула орто-хромистой кислоты, как и любого другого гидроксида в кислотной форме, начинается с водорода, а заканчивается кислородом, степень окисления хрома «+3» учитывается при установке индексов:
Подробнее о таком способе можно прочитать в статье Свойства кислотных оксидов
Таким образом, оксиду алюминия и оксиду свинца IV соответствуют следующие мета-формулы:
Таблица 6. – Амфотерные оксиды и кислотные остатки, соответствующие им
Поэтому в реакции между оксидом кальция и диоксидом свинца может образоваться и метаплюмбат кальция.
PbO2 + CaO = CaPbO3
- Амфотерные оксиды проявляют свойства кислотных в реакциях с основными оксидами. Реакция происходит при сплавлении:
ZnO + CaO = CaZnO2 – цинкат кальция
Fe2O3 + BaO = Ba(FeO2)2 — феррит бария
Al2O3 + SrO = Sr(AlO2)2 – алюминат (метаалюминат) стронция
- Амфотерные оксиды способны вытеснять летучие оксиды из солей:
ZnO + K2CO3 = K2ZnO2 + CO2↑
Al2O3 + Na2SO3 = NaAlO2 + SO2↑
- Как и многие другие нерастворимые оксиды, амфотерные оксиды реагируют с восстановителями (C, CO, H2, NH3, CH4, более активные металлы). Реакции идут только при нагревании.
ZnO + C = Zn + CO↑
Cr2O3 + Al = Al2O3 + Cr
Fe2O3 + Mg = MgO + Fe
Получение амфотерных оксидов
- Термическое разложение амфотерных гидроксидов:
2Al(OH)3 = Al2O3 + 3H2O
Zn(OH)2 = ZnO + H2O
- Прямым взаимодействием металла с кислородом:
2Be + O2 = 2BeO
2Zn + O2 = 2ZnO
4Al + 3O2 = 2Al2O3
Данная реакция не подходит для получения оксида железа III, так как при окислении железа образуется двойной оксид Fe3O4.
- Термическим разложением нитратов. Причем, если в состав катиона входит металл с переменной степенью окисления, в продукте его степень окисления может измениться:
4Fe(NO3)2 = 2Fe2O3 + 8NO2↑ + O2↑
4Cr(NO3)2 = 2Cr2O3 + 8NO2↑ + O2↑
Оксиды хрома и железа в III валентности разлагаются без изменения степени окисления металла:
4Fe(NO3)3 = 2Fe2O3 + 12NO2↑ + 3O2↑
4Cr(NO3)3 = 2Cr2O3 + 12NO2↑ + 3O2↑
- Окислением оксидов с более низкой степенью окисления:
FeO + O2 = Fe2O3
CrO + O2 = Cr2O3
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Прежде чем начать говорить про химические свойства оксидов, нужно вспомнить о том, что все оксиды делятся на 4 типа, а именно основные, кислотные, амфотерные и несолеобразующие. Для того чтобы определить тип какого-либо оксида, прежде всего нужно понять — оксид металла или неметалла перед вами, а затем воспользоваться алгоритмом (его надо выучить!), представленным в следующей таблице:
| Оксид неметалла | Оксид металла |
| 1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла +1 или +2 Вывод: оксид металла — основный Исключение: BeO, ZnO и PbO не относятся к основным оксидам |
| 2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3 или +4 Вывод: оксид амфотерный Исключение: BeO, ZnO и PbO амфотерны, несмотря на степень окисления +2 у металлов 3) Степень окисления металла +5, +6, +7 Вывод: оксид кислотный |
Помимо типов оксидов, указанных выше, введем также еще два подтипа основных оксидов, исходя из их химической активности, а именно активные основные оксиды и малоактивные основные оксиды.
- К активным основным оксидам отнесем оксиды щелочных и щелочноземельных металлов (все элементы IA и IIA групп, кроме водорода H, бериллия Be и магния Mg). Например, Na2O, CaO, Rb2O, SrO и т.д.
- К малоактивным основным оксидам отнесем все основные оксиды, которые не попали в список активных основных оксидов. Например, FeO, CuO, CrO и т.д.
Логично предположить, что активные основные оксиды часто вступают в те реакции, в которые не вступают малоактивные.
Следует отметить, что несмотря на то что фактически вода является оксидом неметалла (H2O), обычно ее свойства рассматривают в отрыве от свойств иных оксидов. Обусловлено это ее специфически огромным распространением в окружающем нас мире, в связи с чем в большинстве случаев вода является не реагентом, а средой, в которой может осуществляться бесчисленное множество химических реакций. Однако нередко она принимает и непосредственное участие в различных превращениях, в частности, некоторые группы оксидов с ней реагируют.
Какие оксиды реагируют с водой?
Из всех оксидов с водой реагируют только:
1) все активные основные оксиды (оксиды ЩМ и ЩЗМ);
2) все кислотные оксиды, кроме диоксида кремния (SiO2);
т.е. из вышесказанного следует, что с водой точно не реагируют:
1) все малоактивные основные оксиды;
2) все амфотерные оксиды;
3) несолеобразующие оксиды (NO, N2O, CO, SiO).
Примечание:
Оксид магния медленно реагирует с водой при кипячении. Без сильного нагревания реакция MgO с H2O не протекает.
Способность определить то, какие оксиды могут реагировать с водой даже без умения писать соответствующие уравнения реакций, уже позволяет получить баллы за некоторые вопросы тестовой части ЕГЭ.
Теперь давайте разберемся, как же все-таки те или иные оксиды реагируют с водой, т.е. научимся писать соответствующие уравнения реакций.
Активные основные оксиды, реагируя с водой, образуют соответствующие им гидроксиды. Напомним, что соответствующим оксиду металла является такой гидроксид, который содержит металл в той же степени окисления, что и оксид. Так, например, при реакции с водой активных основных оксидов K+12O и Ba+2O образуются соответствующие им гидроксиды K+1OH и Ba+2(OH)2:
K2O + H2O = 2KOH – гидроксид калия
BaO + H2O = Ba(OH)2 – гидроксид бария
Все гидроксиды, соответствующие активным основным оксидам (оксидам ЩМ и ЩЗМ), относятся к щелочам. Щелочами называют все хорошо растворимые в воде гидроксиды металлов, а также малорастворимый гидроксид кальция Ca(OH)2 (как исключение).
Взаимодействие кислотных оксидов с водой так же, как и реакция активных основных оксидов с водой, приводит к образованию соответствующих гидроксидов. Только в случае кислотных оксидов им соответствуют не основные, а кислотные гидроксиды, чаще называемые кислородсодержащими кислотами. Напомним, что соответствующей кислотному оксиду является такая кислородсодержащая кислота, которая содержит кислотообразующий элемент в той же степени окисления, что и в оксиде.
Таким образом, если мы, например, хотим записать уравнение взаимодействия кислотного оксида SO3 с водой, прежде всего мы должны вспомнить основные, изучаемые в рамках школьной программы, серосодержащие кислоты. Таковыми являются сероводородная H2S, сернистая H2SO3 и серная H2SO4 кислоты. Cероводородная кислота H2S, как легко заметить, не является кислородсодержащей, поэтому ее образование при взаимодействии SO3 с водой можно сразу исключить. Из кислот H2SO3 и H2SO4 серу в степени окисления +6, как в оксиде SO3, содержит только серная кислота H2SO4. Поэтому именно она и будет образовываться в реакции SO3 с водой:
H2O + SO3 = H2SO4
Аналогично оксид N2O5, содержащий азот в степени окисления +5, реагируя с водой, образует азотную кислоту HNO3, но ни в коем случае не азотистую HNO2, поскольку в азотной кислоте степень окисления азота, как и в N2O5, равна +5, а в азотистой — +3:
N+52O5 + H2O = 2HN+5O3
Исключение:
Оксид азота (IV) (NO2) является оксидом неметалла в степени окисления +4, т.е. в соответствии с алгоритмом, описанным в таблице в самом начале данной главы, его нужно отнести к кислотным оксидам. Однако не существует такой кислоты, которая содержала бы азот в степени окисления +4.
В случае оксида NO2 принято считать, что ему соответствуют сразу две кислоты, поскольку его взаимодействие с водой приводит к одновременному образованию двух кислот:
2NO2 + H2O = HNO2 + HNO3
Взаимодействие оксидов друг с другом
Прежде всего нужно четко усвоить тот факт, что среди солеобразующих оксидов (кислотных, основных, амфотерных) практически никогда не протекают реакции между оксидами одного класса, т.е. в подавляющем большинстве случаев невозможно взаимодействие:
1) основный оксид + основный оксид ≠
2) кислотный оксид + кислотный оксид ≠
3) амфотерный оксид + амфотерный оксид ≠
В то время, как практически всегда возможно взаимодействие между оксидами, относящимися к разным типам, т.е. практически всегда протекают реакции между:
1) основным оксидом и кислотным оксидом;
2) амфотерным оксидом и кислотным оксидом;
3) амфотерным оксидом и основным оксидом.
В результате всех таких взаимодействий всегда продуктом является средняя (нормальная) соль.
Рассмотрим все указанные пары взаимодействий более детально.
В результате взаимодействия:
MexOy + кислотный оксид, где MexOy – оксид металла (основный или амфотерный)
образуется соль, состоящая из катиона металла Me (из исходного MexOy) и кислотного остатка кислоты, соответствующей кислотному оксиду.
Для примера попробуем записать уравнения взаимодействия следующих пар реагентов:
Na2O + P2O5 и Al2O3 + SO3
В первой паре реагентов мы видим основный оксид (Na2O) и кислотный оксид (P2O5). Во второй – амфотерный оксид (Al2O3) и кислотный оксид (SO3).
Как уже было сказано, в результате взаимодействия основного/амфотерного оксида с кислотным образуется соль, состоящая из катиона металла (из исходного основного/амфотерного оксида) и кислотного остатка кислоты, соответствующей исходному кислотному оксиду.
Таким образом, при взаимодействии Na2O и P2O5 должна образоваться соль, состоящая из катионов Na+ (из Na2O) и кислотного остатка PO43-, поскольку оксиду P+52O5 соответствует кислота H3P+5O4. Т.е. в результате такого взаимодействия образуется фосфат натрия:
3Na2O + P2O5 = 2Na3PO4 — фосфат натрия
В свою очередь, при взаимодействии Al2O3 и SO3 должна образоваться соль, состоящая из катионов Al3+ (из Al2O3) и кислотного остатка SO42-, поскольку оксиду S+6O3 соответствует кислота H2S+6O4. Таким образом, в результате данной реакции получается сульфат алюминия:
Al2O3 + 3SO3 = Al2(SO4)3 — сульфат алюминия
Более специфическим является взаимодействие между амфотерными и основными оксидами. Данные реакции осуществляют при высоких температурах, и их протекание возможно благодаря тому, что амфотерный оксид фактически берет на себя роль кислотного. В результате такого взаимодействия образуется соль специфического состава, состоящая из катиона металла, образующего исходный основный оксид и «кислотного остатка»/аниона, в состав которого входит металл из амфотерного оксида. Формулу такого «кислотного остатка»/аниона в общем виде можно записать как MeO2x—, где Me – металл из амфотерного оксида, а х = 2 в случае амфотерных оксидов с общей формулой вида Me+2O (ZnO, BeO, PbO) и x = 1 – для амфотерных оксидов с общей формулой вида Me+32O3 (например, Al2O3, Cr2O3 и Fe2O3).
Попробуем записать в качестве примера уравнения взаимодействия
ZnO + Na2O и Al2O3 + BaO
В первом случае ZnO является амфотерным оксидом с общей формулой Me+2O, а Na2O – типичный основный оксид. Согласно сказанному выше, в результате их взаимодействия должна образоваться соль, состоящая из катиона металла, образующего основный оксид, т.е. в нашем случае Na+ (из Na2O) и «кислотного остатка»/аниона c формулой ZnO22-, поскольку амфотерный оксид имеет общую формулу вида Me+2O. Таким образом, формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Na2ZnO2:
ZnO + Na2O =to=> Na2ZnO2
В случае взаимодействующей пары реагентов Al2O3 и BaO первое вещество является амфотерным оксидом с общей формулой вида Me+32O3, а второе — типичным основным оксидом. В этом случае образуется соль, содержащая катион металла из основного оксида, т.е. Ba2+ (из BaO) и «кислотного остатка»/аниона AlO2—. Т.е. формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Ba(AlO2)2, а само уравнение взаимодействия запишется как:
Al2O3 + BaO =to=> Ba(AlO2)2
Как мы уже писали выше, практически всегда протекает реакция:
MexOy + кислотный оксид,
где MexOy – либо основный, либо амфотерный оксид металла.
Однако следует запомнить два «привередливых» кислотных оксида – углекислый газ (CO2) и сернистый газ (SO2). «Привередливость» их заключается в том, что несмотря на явные кислотные свойства, активности CO2 и SO2 недостаточно для их взаимодействия с малоактивными основными и амфотерными оксидами. Из оксидов металлов они реагируют только с активными основными оксидами (оксидами ЩМ и ЩЗМ). Так, например, Na2O и BaO, являясь активными основными оксидами, могут с ними реагировать:
CO2 + Na2O = Na2CO3
SO2 + BaO = BaSO3
В то время, как оксиды CuO и Al2O3, не относящиеся к активным основным оксидам, в реакцию с CO2 и SO2 не вступают:
CO2 + CuO ≠
CO2 + Al2O3 ≠
SO2 + CuO ≠
SO2 + Al2O3 ≠
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H2SO4 = FeSO4 + H2O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO2 + 6HF = H2[SiF6] + 2H2O,
а в случае недостатка HF:
SiO2 + 4HF = SiF4 + 2H2O
2) SO2, будучи кислотным оксидом, легко реагирует с сероводородной кислотой H2S по типу сопропорционирования:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
3) Оксид фосфора (III) P2O3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P2O3 | + | 2H2SO4 | + | H2O | =to=> | 2SO2 | + | 2H3PO4 |
| (конц.) |
| 3P2O3 | + | 4HNO3 | + | 7H2O | =to=> | 4NO↑ | + | 6H3PO4 |
| (разб.) |
| P2O3 | + | 4HNO3 | + | H2O | =to=> | 2H3PO4 | + | 4NO2↑ |
| (конц.) |
4) Оксид серы (IV) SO2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO3 | + | SO2 | =to=> | H2SO4 | + | 2NO2↑ |
| (конц.) |
| 2HNO3 | + | 3SO2 | + | 2H2O | =to=> | 3H2SO4 | + | 2NO↑ |
| (разб.) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO3 + 2NaOH = Na2SO4 + H2O
Кислотные оксиды, которым соответствуют многоосновные кислоты, с щелочами могут образовывать как нормальные, так и кислые соли:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH = NaHCO3
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 4KOH = 2K2HPO4 + H2O
P2O5 + 2KOH + H2O = 2KH2PO4
«Привередливые» оксиды CO2 и SO2, активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только основные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH)2 + CO2 = (ZnOH)2CO3 + H2O (в растворе)
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH)3, Cr(OH)3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO2 =to=> Na2SiO3 + H2O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] — тетрагидроксоалюминат натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO2x—, где x = 2 в случае амфотерного оксида типа Me+2O и x = 1 для амфотерного оксида вида Me2+2O3:
ZnO + 2NaOH =to=> Na2ZnO2 + H2O
BeO + 2NaOH =to=> Na2BeO2 + H2O
Al2O3 + 2NaOH =to=> 2NaAlO2 + H2O
Cr2O3 + 2NaOH =to=> 2NaCrO2 + H2O
Fe2O3 + 2NaOH =to=> 2NaFeO2 + H2O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na2[Zn(OH)4] =to=> Na2ZnO2 + 2H2O
Na[Al(OH)4] =to=> NaAlO2 + 2H2O
Взаимодействие оксидов со средними солями
Чаще всего средние соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO2) и углекислый (CO2) газы соответственно. Например:
Al2O3 + Na2CO3 =to=> 2NaAlO2 + CO2
SiO2 + K2SO3 =to=> K2SiO3 + SO2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K2СO3 + SO2 = K2SO3 + CO2
ОВР с участием оксидов
Восстановление оксидов металлов и неметаллов
Аналогично тому, как металлы могут реагировать с растворами солей менее активных металлов, вытесняя последние в свободном виде, оксиды металлов при нагревании также способны реагировать с более активными металлами.
Напомним, что сравнить активность металлов можно либо используя ряд активности металлов, либо, если одного или сразу двух металлов нет в ряду активности, по их положению относительно друг друга в таблице Менделеева: чем ниже и левее металл, тем он более активен. Также полезно помнить, что любой металл из семейства ЩМ и ЩЗМ будет всегда активнее металла, не являющегося представителем ЩМ или ЩЗМ.
В частности, на взаимодействии металла с оксидом менее активного металла основан метод алюмотермии, используемый в промышленности для получения таких трудновосстанавливаемых металлов, как хром и ванадий:
Cr2O3 + 2Al =to=> Al2O3 + 2Cr
При протекании процесса алюмотермии образуется колоссальное количество тепла, а температура реакционной смеси может достигать более 2000oC.
Также оксиды практически всех металлов, находящихся в ряду активности правее алюминия, могут быть восстановлены до свободных металлов водородом (H2), углеродом (C) и угарным газом (CO) при нагревании. Например:
Fe2O3 + 3CO =to=> 2Fe + 3CO2
CuO + C =to=> Cu + CO
FeO + H2 =to=> Fe + H2O
Следует отметить, что в случае, если металл может иметь несколько степеней окисления, при недостатке используемого восстановителя возможно также неполное восстановление оксидов. Например:
Fe2O3 + CO =to=> 2FeO + CO2
4CuO + C =to=> 2Cu2O + CO2
Оксиды активных металлов (щелочных, щелочноземельных, магния и алюминия) с водородом и угарным газом не реагируют.
Однако оксиды активных металлов реагируют с углеродом, но иначе, чем оксиды менее активных металлов.
В рамках программы ЕГЭ, чтобы не путаться, следует считать, что в результате реакции оксидов активных металлов (до Al включительно) с углеродом образование свободного ЩМ, ЩЗМ, Mg, а также Al невозможно. В таких случаях происходит образование карбида металла и угарного газа. Например:
2Al2O3 + 9C =to=> Al4C3 + 6CO
CaO + 3C =to=> CaC2 + CO
Оксиды неметаллов нередко могут быть восстановлены металлами до свободных неметаллов. Так, например, оксиды углерода и кремния при нагревании реагируют с щелочными, щелочноземельными металлами и магнием:
CO2 + 2Mg =to=> 2MgO + C
SiO2 + 2Mg =to=> Si + 2MgO
При избытке магния последнее взаимодействие может приводить также к образованию силицида магния Mg2Si:
SiO2 + 4Mg =to=> Mg2Si + 2MgO
Оксиды азота могут быть относительно легко восстановлены даже менее активными металлами, например, цинком или медью:
Zn + 2NO =to=> ZnO + N2
2NO2 + 4Cu =to=> 4CuO + N2
Взаимодействие оксидов с кислородом
Для того чтобы в заданиях реального ЕГЭ суметь ответить на вопрос, реагирует ли какой-либо оксид с кислородом (O2), прежде всего нужно запомнить, что оксиды, способные реагировать с кислородом (из тех, что могут попасться вам на самом экзамене) могут образовать только химические элементы из списка:
углерод С, кремний Si, фосфор P, сера S, медь Cu, марганец Mn, железо Fe, хром Cr, азот N
Встречающиеся в реальном ЕГЭ оксиды любых других химических элементов с кислородом реагировать не будут (!).
Для более наглядного удобного запоминания перечисленных выше списка элементов, на мой взгляд, удобна следующая иллюстрация:
В первую очередь, среди перечисленных элементов следует рассмотреть азот N, т.к. отношение его оксидов к кислороду заметно отличается от оксидов остальных элементов приведенного выше списка.
Следует четко запомнить тот факт, что всего азот способен образовать пять оксидов, а именно:
Из всех оксидов азота с кислородом может реагировать только NO. Данная реакция протекает очень легко при смешении NO как с чистым кислородом, так и с воздухом. При этом наблюдается быстрое изменение окраски газа с бесцветной (NO) на бурую (NO2):
| 2NO | + | O2 | = | 2NO2 |
| бесцветный | бурый |
Для того чтобы дать ответ на вопрос — реагирует ли с кислородом какой-либо оксид любого другого из перечисленных выше химических элементов (т.е. С, Si, P, S, Cu, Mn, Fe, Cr) — прежде всего обязательно нужно запомнить их основные степени окисления (СО). Вот они:
| элемент | С | Si | P | S | Cu | Cr | Mn | Fe |
| его основные положительные СО | +2, +4 | +2, +4 | +3, +5 | +4, +6 | +1, +2 | +2, +3, +6 | +2, +4, +6, +7 | +2, +3, +6 |
Далее нужно запомнить тот факт, что из возможных оксидов указанных выше химических элементов, с кислородом будут реагировать только те, которые содержат элемент в минимальной, среди указанных выше, степени окисления. При этом степень окисления элемента повышается до ближайшего положительного значения из возможных:
| элемент |
Отношение его оксидов к кислороду |
| С |
Минимальная среди основных положительных степеней окисления углерода равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов C+2O и C+4O2 реагирует только CO. При этом протекает реакция: 2C+2O + O2 =to=> 2C+4O2 CO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления углерода. |
| Si |
Минимальная среди основных положительных степеней окисления кремния равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов Si+2O и Si+4O2 реагирует только SiO. Из-за некоторых особенностей оксидов SiO и SiO2 возможно окисление лишь части атомов кремния в оксиде Si+2O. Т.е. в результате его взаимодействия с кислородом, образуется смешанный оксид, содержащий как кремний в степени окисления +2, так и кремний в степени окисления +4, а именно Si2O3 (Si+2O·Si+4O2): 4Si+2O + O2 =to=> 2Si+2,+42O3 (Si+2O·Si+4O2) SiO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления кремния. |
| P |
Минимальная среди основных положительных степеней окисления фосфора равна +3, а ближайшая к нему положительная — +5. Таким образом, с кислородом из оксидов P+32O3 и P+52O5 реагирует только P2O3. При этом протекает реакция доокисления фосфора кислородом от степени окисления +3 до степени окисления +5: P+32O3 + O2 =to=> P+52O5 P+52O5 + O2 ≠ — реакция невозможна в принципе, т.к. +5 – высшая степень окисления фосфора. |
| S |
Минимальная среди основных положительных степеней окисления серы равна +4, а ближайшая к ней по значению положительная — +6. Таким образом, с кислородом из оксидов S+4O2, S+6O3 реагирует только SO2. При этом протекает реакция: 2S+4O2 + O2 =to=> 2S+6O3 2S+6O3 + O2 ≠ — реакция невозможна в принципе, т.к. +6 – высшая степень окисления серы. |
| Cu |
Минимальная среди положительных степеней окисления меди равна +1, а ближайшая к ней по значению — положительная (и единственная) +2. Таким образом, с кислородом из оксидов Cu+12O, Cu+2O реагирует только Cu2O. При этом протекает реакция: 2Cu+12O + O2 =to=> 4Cu+2O CuO + O2 ≠ — реакция невозможна в принципе, т.к. +2 – высшая степень окисления меди. |
| Cr |
Минимальная среди основных положительных степеней окисления хрома равна +2, а ближайшая к ней по значению положительная равна +3. Таким образом, с кислородом из оксидов Cr+2O, Cr+32O3 и Cr+6O3 реагирует только CrO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +3: 4Cr+2O + O2 =to=> 2Cr+32O3 Cr+32O3 + O2 ≠ — реакция не протекает, несмотря на то что существует оксид хрома и в большей, чем +3, степени окисления (Cr+6O3). Невозможность протекания данной реакции связана с тем, что требуемый для ее гипотетического осуществления нагрев сильно превышает температуру разложения оксида CrO3. Cr+6O3 + O2 ≠ — данная реакция не может протекать в принципе, т.к. +6 – высшая степень окисления хрома. |
| Mn |
Минимальная среди основных положительных степеней окисления марганца равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из возможных оксидов Mn+2O, Mn+4O2, Mn+6O3 и Mn+72O7 реагирует только MnO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +4: 2Mn+2O + O2 =to=> 2Mn+4O2 в то время, как: Mn+4O2 + O2 ≠ и Mn+6O3 + O2 ≠ — реакции не протекают, несмотря на то что существует оксид марганца Mn2O7, содержащий Mn в большей, чем +4 и +6, степени окисления. Связанно это с тем, что требуемый для дальнейшего гипотетического окисления оксидов Mn+4O2 и Mn+6O3 нагрев существенно превышает температуру разложения получаемых оксидов MnO3 и Mn2O7. Mn+72O7 + O2 ≠ — данная реакция невозможна в принципе, т.к. +7 – высшая степень окисления марганца. |
| Fe |
Минимальная среди основных положительных степеней окисления железа равна +2, а ближайшая к ней среди возможных — +3. Несмотря на то что для железа существует степень окисления +6, кислотного оксида FeO3, впрочем, как и соответствующей ему «железной» кислоты не существует. Таким образом, из оксидов железа с кислородом могут реагировать только те оксиды, которые содержат Fe в степени окисления +2. Это либо оксид Fe+2O, либо смешанный оксид железа Fe+2,+33O4 (железная окалина): 4Fe+2O + O2 =to=> 2Fe+32O3 или 6Fe+2O + O2 =to=> 2Fe+2,+33O4 смешанный оксид Fe+2,+33O4 может быть доокислен до Fe+32O3: 4Fe+2,+33O4 + O2 =to=> 6Fe+32O3 Fe+32O3 + O2≠ — протекание данной реакции невозможно в принципе, т.к. оксидов, содержащих железо в степени окисления выше, чем +3, не существует. |
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ХИМИЧЕСКИЕ СВОЙСТВА НЕСОЛЕОБРАЗУЮЩИХ ОКСИДОВ
Несолеобразующие оксиды не реагируют с растворами щелочей и с кислотами.
1. ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА:
Несолеобразующие оксиды могут реагировать с водородом.
Например, смеси оксидов азота (I) и (II) с водородом взрывают.
N2O + H2 = N2 + H2O 2NO + 2H2 = N2 + 2H2O
Смесь угарного газа с водородом называется синтез-газом, ее применяют для получения ряда органических соединений, например, метанола.
2. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА:
Реагируют с кислородом, например, угарный газ CO горит при поджигании голубым пламенем.
2CO + O2 = 2CO2
Бесцветный оксид азота (II) окисляется на воздухе при обычных условиях до оксида азота (IV) — газообразного вещества, имеющего бурую окраску.
2NO + O2 = 2NO2
При взаимодействии угарного газа с хлором при нагревании над активированным углем образуется фосген, который применяют для производства пластмасс.
2CO + Cl2 = 2COCl2
Оксид азота (I) — термодинамически нестабильное соединение и при нагревании разлагается.
2N2O = 2N2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. ОСНОВНЫЙ ОКСИД + КИСЛОТА + СОЛЬ + ВОДА
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ H2O,
NiO + H2SO4 = NiSO4 + H2O
2. ОСНОВНЫЙ ОКСИД (IА группа, CaO, SrO, BaO) + ВОДА = ЩЕЛОЧЬ
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
3. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. РЕАКЦИИ ОСНОВНЫХ ОКСИДОВ С ВОССТАНОВИТЕЛЯМИ
(СО, С, водород, алюминий, магний).
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
FeO + H2 = Fe + H2O (при нагревании)
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
5. ОКИСЛЕНИЕ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+5, +6, +7), например, CrO3, Mn2O7.
По агрегатному состоянию:
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. КИСЛОТНЫЙ ОКСИД + ВОДА = КИСЛОТА
Не реагирует с водой только SiO2.
N2O3 + H2O = 2HNO2
SO2 + H2O = H2SO3
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
2.КИСЛОТНЫЙ ОКСИД + ОСНОВНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
CO2 + CaO = CaCO3
N2O5 + ZnO = Zn(NO3)2
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
P4O10 + 6FeO = 2Fe3(PO4)2 (при нагревании)
3.КИСЛОТНЫЙ ОКСИД + ОСНОВАНИЕ = СОЛЬ + ВОДА
Реакция возможна только со щелочами, но оксиды сильных кислот
SO3, CrO3, N2O5, Cl2O7 реагируют и с нерастворимыми основаниями.
CO2 + Ca(OH) 2 = CaCO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O (при нагревании),
SO3 + 2NaOH = Na2SO4 + H2O,
N2O5 + 2KOH = 2KNO3 + H2O.
4.КИСЛОТНЫЙ ОКСИД + СОЛЬ БОЛЕЕ ЛЕТУЧЕЙ КИСЛОТЫ = СОЛЬ + ЛЕТУЧИЙ ОКСИД
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании)
5.ОКИСЛЕНИЕ ОКСИДОВ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ:
Для элементов, которые образуют несколько оксидов с разной степенью окисления.
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, Cr2O3, PbO и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1.ОКСИД + КИСЛОТА = СОЛЬ + ВОДА
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + HNO3 = Al(NO3)3 +H2O
2.КИСЛОТНЫЙ ОКСИД + АМФОТЕРНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. ПРИ СПЛАВЛЕНИИ С ОКСИДАМИ ОБРАЗУЕТ СРЕДНИЕ СОЛИ.
ZnO2(2-) — цинкат
BeO2(2-) — бериллат
AlO2(-) — алюминат
CrO2(-) — хромат
ZnO + Na₂O = Na₂ZnO2.
2.АМФОТЕРНЫЙ ОКСИД + РАСПЛАВ ЩЕЛОЧИ + СОЛЬ
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + H2O (при нагревании)
ZnO + 2KOH =K2ZnO2 + H2O (при нагревании)
3.АМФОТЕРНЫЙ ОКСИД + РАСТВОР ЩЕЛОЧИ = РАСТВОР ГИДРОКСОКОМПЛЕКСА
[Zn(OH)4 ](2-) — тетрагидроксоцинкат
[Be(OH)4](2-) — тетрагидроксобериллат
[Al(OH)4](-) — тетрагидроксоалюминат
[Cr(OH)4](-) — тетрагидроксохромат
Al2O3 + 2KOH +3H2O = 2K[Al(OH)4]
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2
4.АМФОТЕРНЫЙ ОКСИД + КАРБОНАТЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ = СОЛЬ + ГАЗ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = NaAlO2 (или Na3AlO3) + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5.ВЗАИМОДЕЙСТВИЕ С СИЛЬНЫМИ ВОССТАНОВИТЕЛЯМИ
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2
ПОЛУЧЕНИЕ МЕТАЛЛОВ
1 . МЕТАЛЛЫ И НЕМЕТАЛЛЫ С КИСЛОРОДОМ →
Реагируют все металлы, кроме золота, платины. Натрий, калий, рубидий, цезий сразу образуют пероксиды и надпероксиды. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив.
4Cr + 3О2 = 2Cr2О3
C+ O₂ (нед) = CO
2. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ:
Неактивные металлы реагируют с водой только в раскаленном состоянии , образуя оксиды (железо – железную окалину)
Zn + Н2O = ZnO + H2 ↑ 3Fe + 4HOH = Fe3O4 + 4H2↑
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ОКСИДАМИ (оксидами неметаллов и менее активных металлов)
Металлы (Al, Mg,Са ), восстанавливают при высокой температуре неметаллы или менее активные металлы из их оксидов → неметалл или малоактивный металл и оксид (кальцийтермия, магнийтермия, алюминотермия)
2Al + Cr2O3 = 2Cr + Al2O3
ЗСа + Cr₂O₃ = ЗСаО + 2Cr (800 °C)
Металлы железо и хром реагируют со оксидами, уменьшая степень окисления
Cr + Cr2⁺³O3 = 3Cr⁺²O
4. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ПЕРОКСИДАМИ
Щелочные металлы при взаимодействии с пероксидами переводят их в оксиды
2Na + Na2O2 = 2Na2O
3K+ KO2 = 2K2O
5.ВЗАИМОДЕЙСТВИЕ УГЛЕРОДА С ОКСИДАМИ
2ZnO + C = 2Zn + CO
4С + Fe₃O₄ = 3Fe + 4CO
6.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С НИЗШИМИ С ОКСИДАМИ
окисляет низшие оксиды до высших:
2Fe⁺²O + O2 = Fe2⁺³O3;
2C⁺²O + O2 = 2C⁺⁴O2
7.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С КИСЛОТАМИ
Безводные бескислородные кислоты (бинарные соединения) сгорают в атмосфере кислорода
2H2S + 3O2 = 2SO2 + 2H2O
8.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С СОЛЯМИ И БИНАРНЫМИ СОЕДИНЕНИЯМИ
Горение
4FeS2 +11O2 = 2Fe2O3 + 8SO2
CH4 + 2O2 = CO2 + 2H2O
Каталитическое окисление
NH3 + O2 = NO + H2O
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 —-АМФОТЕРНЫЙ с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С
Реагирует с солями
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Взаимодействует с водным растворoм аммиака.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + H2O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2NH3 = ЗСu + N2↑ + 3H2О
II ГРУППА Б ОКСИД ЦИНКА (II)
Твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + H2O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VI ГРУППА Б ОКСИДЫ ХРОМА.
ОКСИД ХРОМА (II) имеют основный характер. Красные кристаллы или черный пирофорный порошок.
ОКСИД ХРОМА (III) Cr₂O₃ АМФОТЕРНЫЙ
зелёный, нерастворимый в воде порошок.
Получают при прокаливании гидроксида хрома (III), дихроматов калия и аммония или окислении оксида (II):
2Cr(OH)₃= Cr₂O₃ + 3H₂O
4K₂Cr₂O₇ = 2Cr₂O₃ + 4K₂CrO₄(хромат калия) + 3O₂↑
(NH ₄)₂Cr₂O₇ = Cr₂O₃ + N₂↑ + 4H₂O
1. При сплавлении Cr₂O₃ с оксидами, щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + FeO = Fe(CrO2)2
Cr₂O₃ + 2NaOH = 2NaCrO₂ (хромит натрия) + H₂O
Cr₂O₃ + Na₂CO₃ = 2NaCrO₂ + CO₂↑
Cr₂O₃ + 6KHSO₄ = Cr₂(SO₄)₃ + 3K₂SO₄ + 3H₂O
2. При сплавлении со смесью щёлочи и окислителя проявляют свойства восстановителя, получают соединения хрома в
степени окисления (+6):
2Cr₂O₃ + 4KOH + KClO₃ = 2K₂Cr₂O₇(дихромат калия) + KCl + 2H₂O
Сг2O3 + KClO₃ + 2К2СO3 = 2К₂CrO4 + КС1 + 2CO2↑
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2↑
Cr2O3 + 3KNO3 + 4KOH = 2Na2CrO4 + 3KNO2 + 2H₂O
5Cr2O3 + 6NaBrO3 + 3H2SO4 + 2H2O = 5H2Cr2O7 + 3Br2 + 3Na2SO4
ОКСИД ХРОМА (VI) CrO₃ — кислотный оксид,
кристаллическое вещество тёмно-красного цвета, сильный окислитель.
Взаимодействует с водой → хромовая или двухромовая кислота
CrО3 + Н2О = Н2СrО4
2. основными оксидами и основаниями
CrО3 + CaO = СаСrО4
CrО3 + 2NaOH = Na2СrО4 + H2О
3. Сильный окислитель: окисляет неорганические и органические вещества
4CrО3 + 3S = 3SО2↑ + 2Cr2О3
4CrО3 + C2H5OH + 6H2SО4 = 2Cr2(SО4)3 + 2CО2↑ + 9H2О
4. Разлагается при нагревании
4CrО3 = 2Cr2О3 + 3О2↑
Получают из хромата (или дихромата) калия и H₂SO₄(конц.).
K₂CrO₄ + H₂SO₄ →CrO₃ + K₂SO₄ + H₂O
K₂Cr₂O₇ + H₂SO₄ →2CrO₃ + K₂SO₄ + H₂O
VII ГРУППА Б ОКСИДЫ МАРГАНЦА
ОКСИД МАРГАНЦА(II) MnO ОСНОВНЫЙ
Твердое вещество зеленого цвета, не растворимое в воде
ОКСИД МАРГАНЦА (III) Mn2O3 ОСНОВНЫЙ
Твердое вещество бурого цвета цвета, не растворимое в воде
Обладает окислительными свойствами
Mn2O3 + H2 = 2MnO + H2O
Обладает восстановительными свойствами, реагируя с разбавленной серной кислотой:
2Mn2O3 + 4H2SO4 = 2MnO2 + Mn2(SO4)3 + SO2 + 4H2O
ОКСИД МАРГАНЦА (VI) MnO3
В свободном состоянии не выделен
ОКСИД МАРГАНЦА (VII) Mn₂O₇ КИСЛОТНЫЙ
тёмно-зелёная жидкость, растворяется в воде, неустойчив.
Получают действием концентрированной серной кислоты на кристаллический KMnO₄ (марганцевая кислота HMnO₄ нестабильна):
2KMnO₄ + H₂SO₄ → Mn₂O₇ + + K₂SO₄ + H₂O
1. При растворении в щелочах образует перманганаты:
Mn₂O₇ + 2KOH → 2KMnO₄ + H₂O
2. При ударе и слабом нагревании разлагается со взрывом до MnO2:
2Mn₂O₇ → 2MnO2 + 3HO₂↑
VIII ГРУППА Б ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II) FeO ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5H2O.
ОКСИД ЖЕЛЕЗА (III) Fe₂O₃ АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV ГРУППА А ОКСИДЫ УГЛЕРОДА.
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит.
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
1) реагирует с водородом, в зависимости от условий образуются
разные продукты:
СО + Н2 = СН4↑ (метан) + Н2О СО + Н2 = СН3ОН (метанол)
2) под давлением реагирует со щелочью, образуя формиат – соль муравьиной кислоты:
CO + NaOH = HCOONa (формиат натрия)
CO2 -КИСЛОТНЫЙ О=С=О
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
С аммиаком образует мочевину :
CO2 + 2NH3 → NH2-CO-NH2 + H2O
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем, без цвета, без запаха, единственный из кислотных нерастворимый в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF (р-р)= H2[SiF6] + 2H2O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
1. Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2 2NO + Cl2 = 2NOCl (хлористый нитрозил)
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т.п.
2NO + 2H2 =N2 + 2H2O
2NO + 2SO2 =2SO3 + N2
N2O3 ОКСИД АЗОТА (III), АЗОТИСТЫЙ АНГИДРИД
темно-синяя жидкость (при низких температурах). КИСЛОТНЫЙ
Получение:NO2 + NO ⇄ N2O3 (при охлаждении)
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует две кислоты сразу с водой:
2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +H2O
3. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
3. Димеризация:
2NO2(бурый газ)⇄ N2O4(бесцветная жидкость) – димер.
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД
кристаллическое вещество, легко плавится (40°С) КИСЛОТНЫЙ
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
ОКСИДЫ ФОСФОРА
P2O3 — ФОСФОРИСТЫЙ АНГИДРИД (оксид фосфора (III). КИСЛОТНЫЙ
Белые кристаллы, в парах состоит из молекул димера P4O6.
1. Взаимодействие с водой:
P2O3 + 3H2O = 2H3PO3
2. Взаимодействие с основаниями
P2O3+ 4NaOH = 2Na2HPO3+ H2O
2. Сильный восстановитель:
O2 + P2O3 = P2O5
P2O5 (ОКСИД ФОСФОРА (V) КИСЛОТНЫЙ ФОСФОРНЫЙ АНГИДРИД).
Белые кристаллы. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O =H4P2O7 (пирофосфорная кислота)
P2O5 +3H2O = 2H3PO4 (ортофосфорная кислота)
2) Сильное водоотнимающее средство, можно использовать для получения ангидридов сильных кислот:
P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
1) Реакции окисления S⁺⁴ – 2ē = S⁺⁶
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 +2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2) Реакции восстановления S ⁺⁴ + 4ē = S⁰
SO2 + С = S + СO2
SO2 + 2H2S = 3S + 2H2O
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
SO3 + H2SO4 = H2S2O7
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
Большинство оксидов галогенов неустойчивы и получаются косвенным путем, так как галогены с кислородом не взаимодействуют.
ОКСИД ХЛОРА(I) Cl2O — ядовитый газообразный газ желтого цвета, с резким запахом, хорошо растворим в воде.
Соединение крайне неустойчиво, при повышенной температуре разлагается со взрывом.
Cl2O хорошо растворим в воде, его водный раствор проявляет свойства слабой кислоты:
H2O + Cl2O = 2HClO (хлорноватистая кислота).
ОКСИД БРОМА (I) Br2O напоминает по свойствам и методу синтеза Cl2O.
ДИОКСИД ХЛОРА ClO2 . КИСЛОТНЫЙ
Газ красно-желтого цвета. Используется как отбеливающее вещество.
Взрывается газ от внезапного механического воздействия, введения в систему восстановителя (резиновая пробка).
В щелочной среде ClO2 диспропорционирует
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
ДИОКСИД БРОМА BrO2. КИСЛОТНЫЙ
BrO2- неустойчивый оксид, при повышении температуры разлагается.
BrO2 →2Br2O + 2Br2↑ + 7O2↑
ОКСИД ХЛОРА (VI) Cl2O6 КИСЛОТНЫЙ
красная маслообразная жидкость, взрывоопасная, легко разлагается на ClO2 и O2.
Является смешанным ангидридом кислот HClO3 и HClO4.
Cl2O6 + H2O = HClO3 + HClO4.
ОКСИД ИОДА (V) I2O5 КИСЛОТНЫЙ
белое твердое вещество, единственный термодинамически устойчивый из оксидов галогенов.
I2O5 используется как окислитель в количественном анализе для определения СО:
5СО + I2O5 → I2 + 5CO2.
ОКСИД ХЛОРА (VII) Cl2O7 КИСЛОТНЫЙ
маслянистая бесцветная жидкость, легко взрывается.
Cl2O7 — ангидрид хлорной кислоты HClO4.
Получают дегидратацией концентрированной хлорной кислоты с помощью P2O5 с последующей осторожной перегонкой в вакууме:
6HClO4 + P2O5 → 3Cl2O7 + 2H3PO4.
8(Б), 31(П), 37(В) Перекиси и другие бинарные соединения (теоретический курс)
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства основных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства амфотерных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства кислотных оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления –2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Классификация оксидов, которую мы ещё раз с вами повторим:
- основные: металл в степени окисления +1 и +2;
- амфотерные: металл в степени окисления +3 и +4. Исключения: ZnO, BeO, SnO, PbO;
- кислотные: все неметаллы и металлы в степенях окисления +5, +6 и +7;
- несолеобразующие: NO, N2O, CO, SiO.
Физические свойства оксидов.
- По агрегатному состоянию оксиды делятся на три группы: твердые (K2O, Al2O3, P2O5), жидкие (SO3, Mn2O7), и газообразные (CO2, NO2, SO2).
- По растворимости в воде оксиды делятся на растворимые (SO2, CO2, K2O) и нерастворимые (CuO, FeO, SiO2, Al2O3). Все кислотные оксиды, кроме SiO2, растворимы в воде. Среди основных оксидо растворимыми являются только оксиды щелочных металлов и щелочноземельных металлов. Амфотерные оксиды не растворяются в воде.
Химические свойства основных оксидов
1. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей:
Оксид + H2O = Щелочь;
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Оксид + кислота = соль + H2O
CaO + H2SO4 = CaSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
3. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей:
Основные оксид + кислотный оксид = Соль
3СaO + P2O5 = Ca3(PO4)2
BaO + CO2 = BaCO3
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Кислотный оксид + H2O = кислота
P2O5 + 3H2O = 2H3PO4
N2O5 + H2O = 2HNO3
2. Общим свойством всех кислотных оксидов является их способность взаимодействовать с овнованиями с образованием соли и воды:
кислотный оксид + основание = соль + H2O
P2O5 + 6NaOH = 2Na3PO4 + 6H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
3. Кислотные оксиды взаимодействую с основными оксидами с образованием солей (при нагревании)
Ксилотный оксид + основные оксид = соль;
3CaO + P2O5 = Ca3(PO4)2
CrO3 + CaO = CaCrO4
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды — проявляют свойства основных оксидов.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды — проявляют свойства ксилотных оксидов.
Амфотерный оксид + щелочь = соль + H2O
ZnO + KOH = K2ZnO2 + H2O
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + основный оксид = соль
ZnO + Na2O = Na2ZnO2
Получение оксидов
1. Взаимодействие простых веществ с кислородом:
Металл или неметалл + O2 = Оксид
2. Разложение некоторых оксокислот:
Оксокислота = кислотный оксид + H2O
3. Разложение нерастворимых основний:
Нерастворимое основание = основный оксид + H2O;
4. Разложение некоторых солей:
Соль = основный оксид + кислотный оксид
Амфотерные оксиды
обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами.
К числу амфотерных оксидов относятся:
-
оксид алюминия Аl
2
О
3
-
оксид хрома (III) Сr
2
О
3
, - оксид бериллия ВеО,
- оксид цинка ZnО,
-
оксид железа (III) Fe
2
О
3
и ряд других.
Как основные оксиды
— взаимодействуют с кислотами
Al
2
O
3
+ 3H
2
SO
4
= Al
2
(SO
4
)
3
+ 3H
2
O,Al
2
O
3
+ 6H
+
= 2Al
3+
+ 3H
2
O.
— взаимодействуют с кислотными оксидами
Al
2
O
3
+ SO
3
= 2Al
2
(SO
4
)
3
.
Как кислотные оксиды
— взаимодействуют со щелочами
В растворе образуется комплексное соединение – тетрагидроксоалюминат натрия:
Al
2
O
3
+ 2NaOH + 3H
2
O = 2Na[Al(OH)
4
],Al
2
O
3
+ 2OH
—
+ 3H
2
O = 2[Al(OH)
4
]
—
При сплавлении образуется соль – алюминат натрия:
Al
2
O
3
+ 2NaOH = 2NaAlO
2
+ H
2
O.
-взаимодействие с основными оксидами
Al
2
O
3
+ Na
2
O = 2NaAlO
2
— взаимодействуют с солями слабых и летучих кислот
Al
2
O
3
+ Na
2
CO
3
= 2NaAlO
2
+ CO
2
,




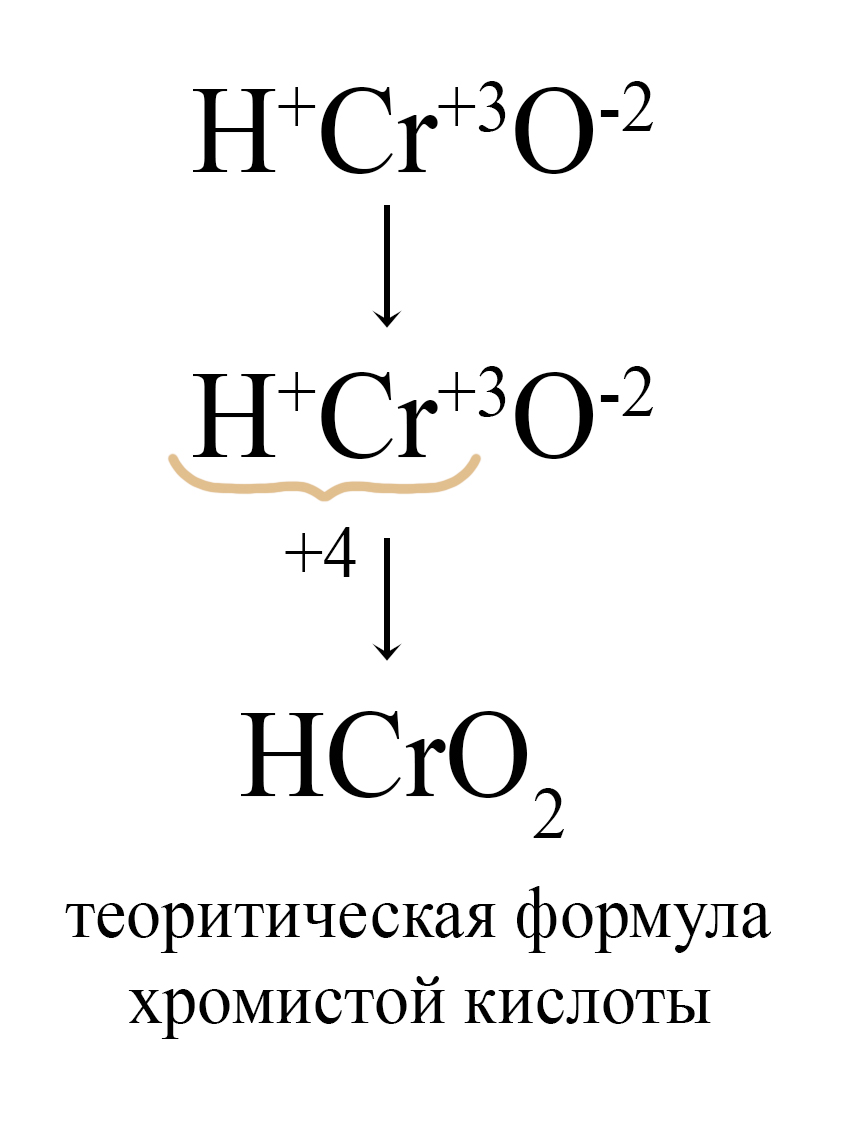
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)