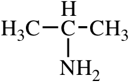
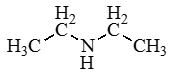
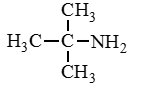
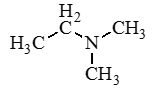
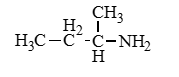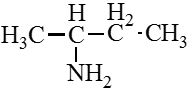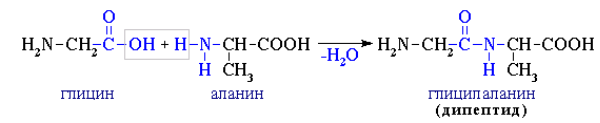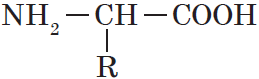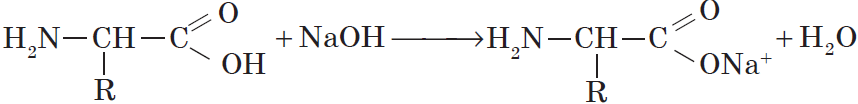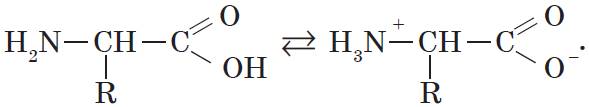Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин
NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | 
цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) | NH2-CH(CH2C6H5)-COOH
фенилаланин _________________________________ тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH
глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH
лизин |
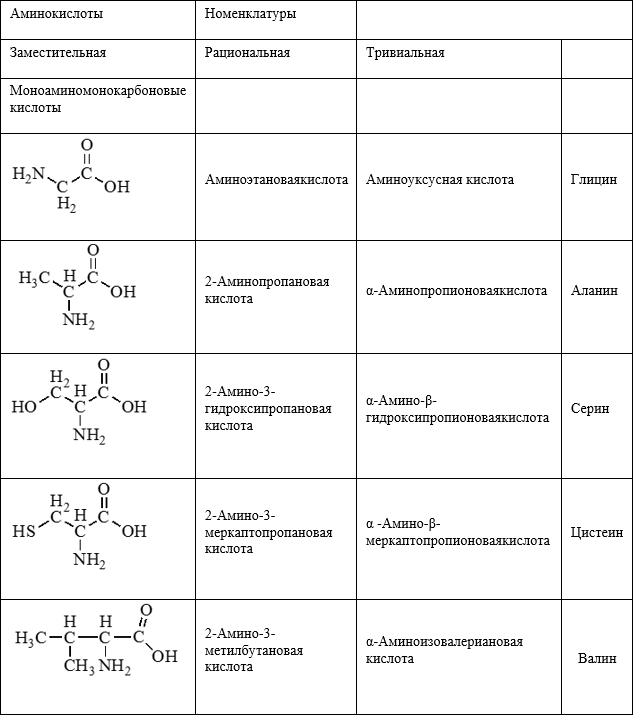
Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
Химические свойства аминокислот
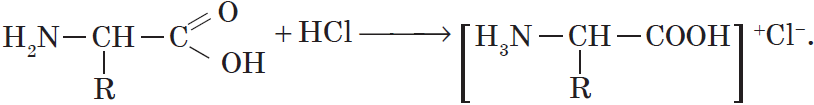
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
Например, глицин разлагается при нагревании:
6. Межмолекулярное взаимодействие аминокислот
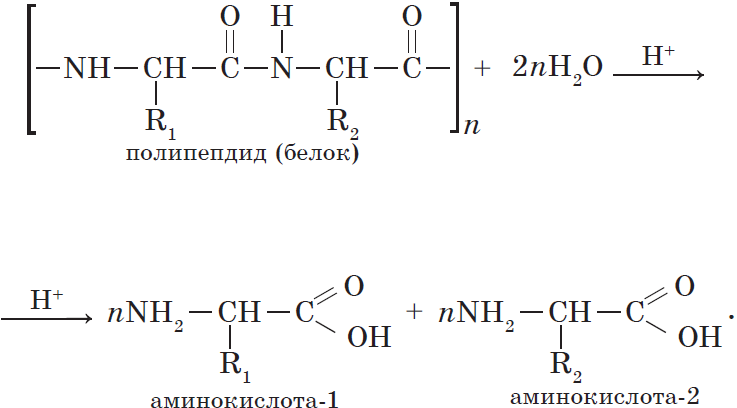
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Белки (син. протеины) — высокомолекулярные органические вещества, построенные из остатков аминокислот. По
своему биологическому значению принадлежат к числу важнейших составных частей организма.
Несомненно, белки абсолютно необходимы для жизни растений, животных и грибов. Именно вследствие такого
большого значения белки получили названия протеинов (греч. protos — первый, главный).

Качественной реакцией на белки служит ксантопротеиновая реакция. Ее проводят путем добавления к раствору белка HNO3(конц.) до
тех пор, пока не прекратится выпадение осадка. Осадок окрашивается в характерный желтый цвет.

Аминокислота
Аминокислота — органическая кислота, содержащая, по меньшей мере, одну карбоксильную группу (COOH) и одну аминогруппу (NH2).
Аминокислоты являются основной составляющей всех белков.
В построении белков участвуют 20 наиболее распространенных аминокислот. На данном этапе учить их наизусть не обязательно, эта
задача настигнет вас на кафедре биохимии 
И все же для успешного изучения данной темы мы возьмем за основу две аминокислоты: глицин и аланин.

Я хочу вас обрадовать (надеюсь, что обрадую)). Если вы успешно изучили темы: карбоновые кислоты, амины — то вы уже знаете химические
свойства аминокислот!
Они напоминают амфотерные соединения: по аминогруппе вступают в реакции с кислотами, по карбоксильной — с основаниями. Мы разберем их подробнее чуть
ниже.
Получение аминокислот
Аминокислоты можно получить в реакции аммиака с галогенкарбоновыми кислотами.

Химические свойства аминокислот
- Основные свойства
- Кислотные свойства
- Пептидные связи
За счет наличия аминогруппы, аминокислоты проявляют основные свойства. Реагируют с кислотами.

По карбоксильной группе аминокислоты способны вступать в реакции с металлами, основными оксидами, основаниями и солями более слабых кислот.

Аминокислоты способны вступать в реакцию этерификации, образуя сложные эфиры.

В молекуле белка аминокислоты связаны друг с другом пептидной связью. Она образуется между карбоксильной группой одной аминокислоты и
аминогруппой другой аминокислоты.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
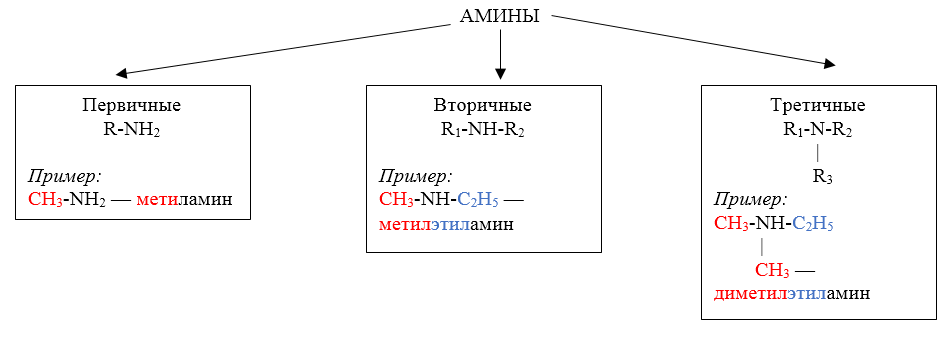
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
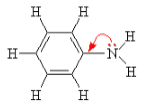
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
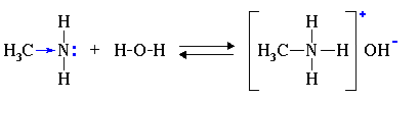
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Амины — это производные аммиака (NH3), в молекуле которого один, два или три атома водорода замещены углеводородными радикалами.
Классификация аминов
Номенклатура первичных аминов
|
Радикально-функциональная |
Заместительная |
|
|
CH3-NH2 |
Метиламин |
Аминометан |
|
|
Изопропиламин |
2-аминопропан |
Изомерия
Рассмотрим все виды изомерии на примере C4H11N
|
Изомерия цепи |
Изомерия положения функциональной группы |
Изомерия между типами аминов |
|
|
CH3-CH2-CH2-CH2-NH2 |
|
|
|
|
|
Физические свойства:
Низшие предельные первичные амины — газообразные вещества, имеют запах аммиака, хорошо растворяются в воды. Амины с большей относительной молекулярной массой — жидкости или твердые вещества, растворимость из в воде с увеличением молекулярной массы уменьшается.
Химические свойства аминов
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины — более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:
При нагревании щелочи вытесняют из них амины:
[CH3NH3]+Cl— + NaOH = CH3NH2 + NaCl + H2O
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 = 4CO2 + 10H2O + 2N2
Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 — неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl = НNO2 + KCl
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
-
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 = R-OH + N2 + H2O
-
Вторичные амины (алифатические и ароматические) под действием HNO2
превращаются в нитрозосоединения (вещества с характерным запахом).
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Анилин – простейший представитель первичных ароматических аминов.
Физические свойства:
Бесцветная масляниста жидкость с характерным запахом, малорастворим в воде, ядовит.
Применение анилина:
1. Взрывчатые вещества.
2. Пластмассы.
3. Фотореактивы.
4. Красители.
5. Лекарственные вещества.
Аминокислоты
Аминокислоты — это производные углеводородов, содержащие аминогруппы (-NH2) и карбоксильные группы (-COOH).
Общая формула: (NH2)mR(COOH)n, где m и n чаще всего равны 1 или 2.
Классификация аминокислот:
По числу функциональных групп:
1. моноаминомонокарбоновые кислоты;
2. диаминомонокарбоновые кислоты;
3. моноаминодикарбоновые кислоты.
По положению аминогрупп:
1. α — аминокислоты;
2. β — аминокислоты;
3. γ — аминокислоты.
Формулы и названия некоторых α — аминокислот, остатки которых входят в состав белков.
Аминокислоты организма:
1. Заменимые (Синтезируются в организме человек. К ним относятся глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота, тирозин, цистеин).
2. Незаменимые (Не синтезируются в организме человека, поступают с пищей. К ним относятся валин, лизин, фенилаланин).
Физические свойства аминокислот:
Аминокислоты — бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230-300. Многие α-аминокислоты имеют сладкий вкус.
Химические свойства аминокислот:
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa -натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации):
NH2-CH2-COOH + CH3OH → NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 — метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]+Cl—
или HOOC — CH2 — NH2* HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу $—NH_2$ и карбоксильную группу $—СООН$, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа $—NH_2$ определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа $—СООН$ (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты:
С сильными кислотами — как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше $200°С$. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала $R—$ они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около $150$) выделяют протеиногенные аминокислоты (около $20$), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки $—NH—CO—$, например:
${nNH_2—(CH_2)_5—COOH}↙{text»аминокапроновая кислота»}→{(…—NH—(CH_2)_5—COO—…)_n}↙{text»капрон»}+(n+1)H_2O$.
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением аминои карбоксильной групп на концах молекул.
Полиамиды $α$-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы $—NH—CO—$ называют пептидными.
Некоторые аминокислоты, входящие в состав белков.
| Название аминокислоты | Формула |
| Глицин (аминоуксусная) | $NH_2-CH_2-COOH$ |
| Аланин ($α$-аминопропионовая) | 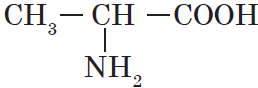 |
| Цистеин ($α$-амино-$β$меркаптопропионовая) | 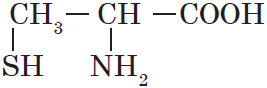 |
| Лизин ($α$, $ε$-диаминокапроновая) | 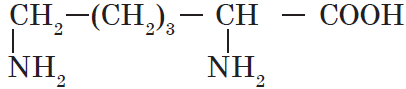 |
| Фенилаланин ($α$-амино-$β$фенилпропионовая) | 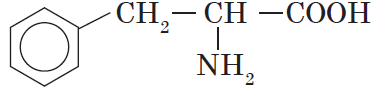 |
Белки
Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьируется от $5–10$ тыс. до $1$ млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (от греч. protos — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей, присущей ему, по следовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т.е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
Все белки образованы двадцатью разными $α$-аминокислотами, общую формулу которых можно представить в виде
$R-CHNH_2-COOH$
где радикал R может иметь самое разнообразное строение.
Белки представляют собой полимерные цепи, состоящие из десятков тысяч, миллионов и более остатков $α$-аминокислот, связанных между собой пептидными связями. Последовательность аминокислотных остатков в молекуле белка называют его первичной структурой.
Для белковых тел характерны огромные молекулярные массы (до миллиарда) и почти макроразмеры молекул. Такая длинная молекула не может быть строго линейной, поэтому ее участки изгибаются и сворачиваются, что приводит к образованию водородных связей с участием атомов азота и кислорода. Образуется регулярная спиралевидная структура, которую называют вторичной структурой.
В белковой молекуле могут возникать ионные взаимодействия между карбоксильными и аминогруппами различных аминокислотных остатков и образование дисульфидных мостиков. Эти взаимодействия приводят к появлению третичной структуры.
Белки с $M_r > 50000$ состоят, как правило, из нескольких полипептидных цепей, каждая из которых уже имеет первичную, вторичную и третичную структуры. Говорят, что такие белки обладают четвертичной структурой.
Свойства белков
Белки — амфотерные электролиты. При определенном значении $рН$ среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково.
Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные ($—СО—NH—$, пептидная связь), аминные ($—NH_2$) и карбоксильные ($—СООН$) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении $рН$ среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму.
Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет важную роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием протеаз-ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции. Используют следующие реакции:
— ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами $Cu^{2+}$ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Если проанализировать термин «аминокислоты», то можно прийти к выводу, что так должны называться соединения, содержащие в молекулах две функциональные группы: карбоксильную группу —СООН, определяющую кислотные свойства, и основную аминогруппу —NH2. Вывести общую формулу аминокислот нетрудно:
Органические вещества, содержащие в молекуле карбоксильную группу —СООН и аминогруппу —NH2, называют аминокислотами.
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Способы получения и химические свойства аминокислот
В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.
Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:
В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках
Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:
Между двумя остатками аминокислот образуется пептидная связь:
Связь, возникающую между карбоксильной группой —СООН одной молекулы аминокислоты и аминогруппой —NH2 другой молекулы аминокислоты, называют пептидной связью.
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Белки — это природные полимеры, образованные остатками аминокислот, связанными между собой пептидными связями.
Структура и функции белков
В состав природных белков входит около 20 аминокислот, а разновидностей белков великое множество. Каким же образом эти 20 аминокислот создают такое многообразие белков? Дело в том, что аминокислотные остатки в белковой молекуле повторяются, а их последовательность, называемая первичной структурой белка, уникальна. Подобным образом из 33 букв русского алфавита состоят десятки тысяч различных слов, различающихся порядком чередования букв («первичная структура» слова) и, как следствие, значением.
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.
В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.
Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Именно такой процесс протекает при переваривании белковой пищи. Образующиеся аминокислоты попадают в кровь, затем транспортируются в каждую клетку организма, где из них синтезируются белковые молекулы, характерные именно для этого вида живых организмов. Теперь вы понимаете, почему белки, наряду с жирами и углеводами, — основной компонент пищи. Недостаток белка в питании человека может вызвать тяжёлые заболевания. При несбалансированном питании у людей отмечается плохое самочувствие, быстрая утомляемость, снижение иммунитета. Многие юноши и девушки вашего возраста изнуряют себя разными диетами с целью похудеть, а то и вовсе отказываются от еды. Такая «коррекция фигуры» может привести к непоправимым проблемам со здоровьем.
При относительно небольшом нагревании или действии химических реагентов нарушается структура белка, т. е. происходит его денатурация (от лат. denaturatus; de- — приставка, означающая «отделение, удаление», +nature — природа). Для живых организмов денатурация белка — это гибель. Однако в пищевой промышленности тепловая денатурация белков — один из обычных технологических процессов. Варка и обжаривание продуктов, выпечка хлеба, производство макаронных изделий, приготовление творога — все эти операции связаны с денатурацией белков.
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.
Справочная таблица «Аминокислоты»
Конспект урока по химии «Аминокислоты. Белки». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии