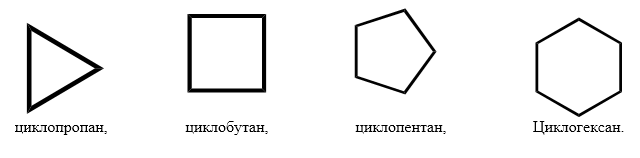
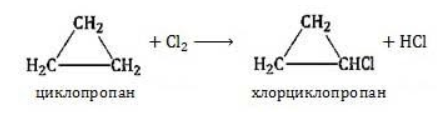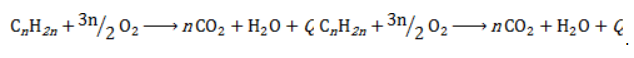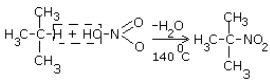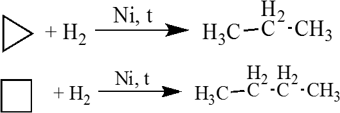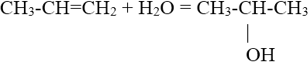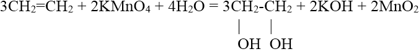Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
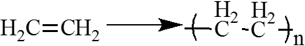
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Строение циклоалканов
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна»
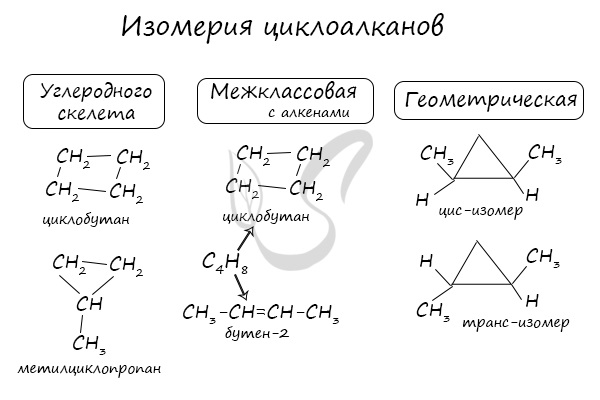
Изомерия циклоалканов
Структурная изомерия
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
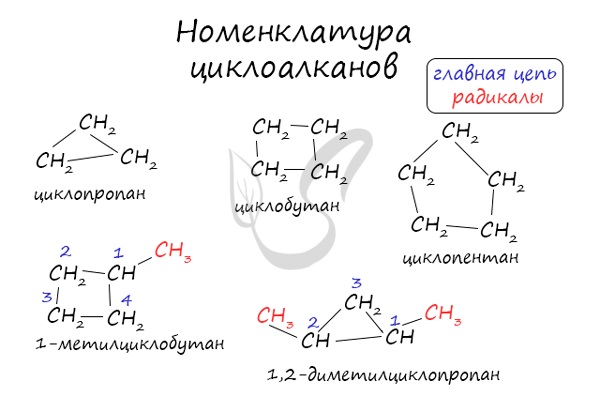
Номенклатура циклоалканов
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Химические свойства циклоалканов
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
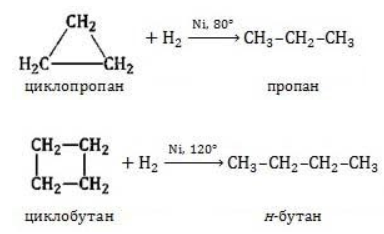
1.1. Гидрирование циклоалканов
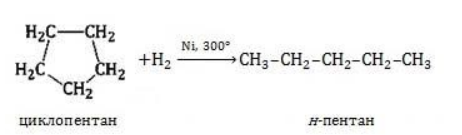
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
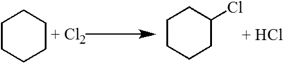
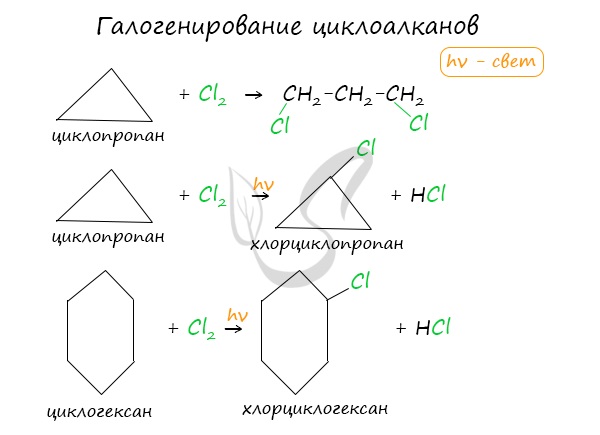
1.2. Галогенирование циклоалканов
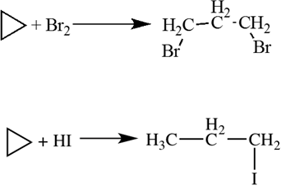
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:
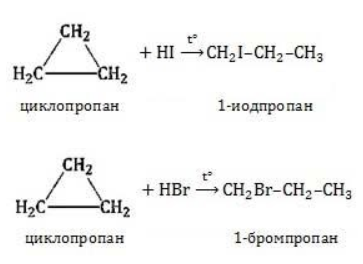
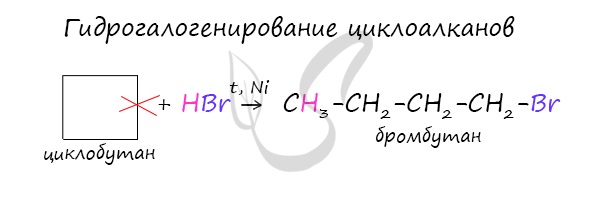
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.
Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан
2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
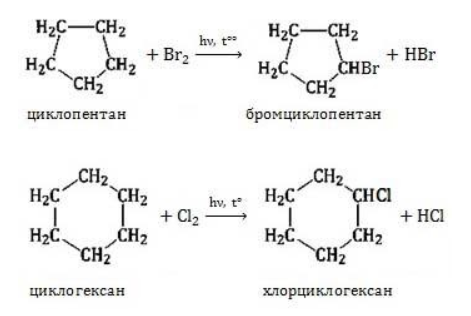
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
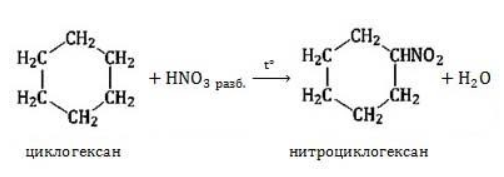
2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.
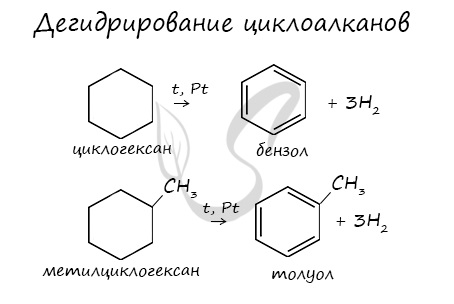
2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
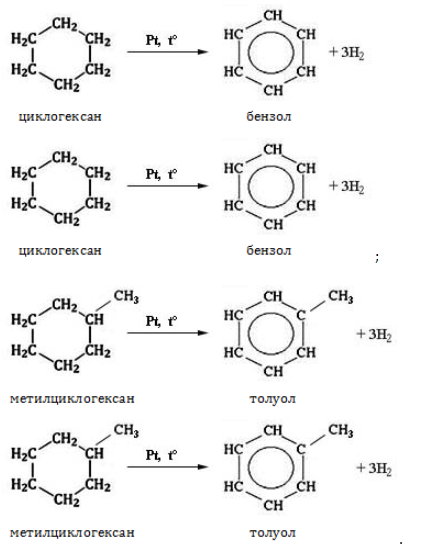
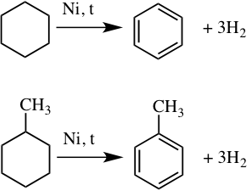
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.
Например, при отщеплении водорода от метилциклогексана образуется толуол.
3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
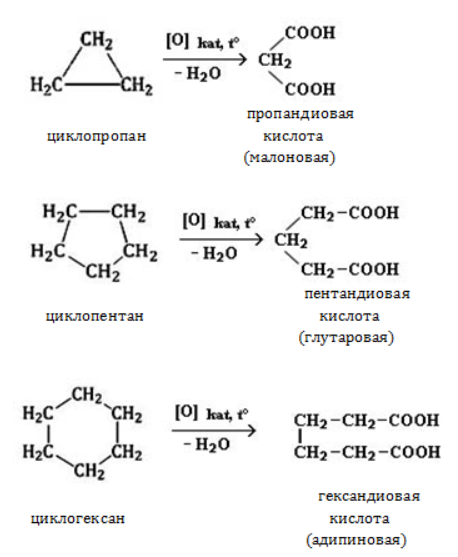
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов
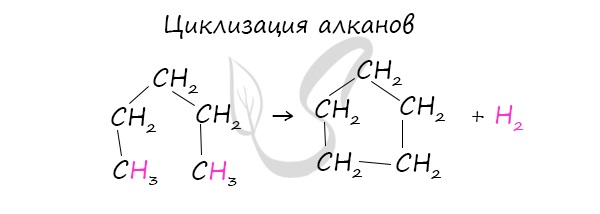
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
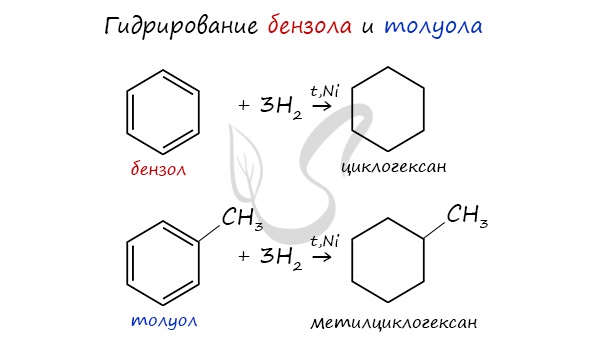
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
При гидрировании толуола образуется метилциклогексан:
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только
простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их
гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом:
циклопропан, циклобутан и т.д.
Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде
существования цис- и транс-изомеров.
Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана
реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ — не вступают, но на самом деле эти реакции идут, просто крайне затруднены).

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция
идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола.
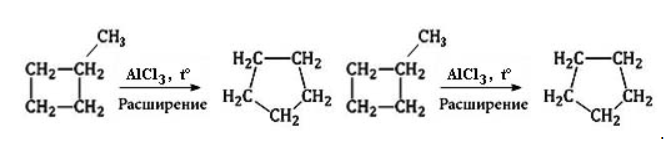
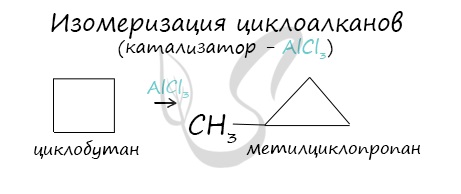
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ
При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С11) — жидкости, начиная с С12 — твёрдые вещества.
Температуры кипения и плавленияциклоалканов выше, чем у соответствующих алканов
Циклоалканы в воде практически не растворяются.
При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ
Циклоалканы проявляют свойства и алканов, и алкенов.
Циклопропан и циклобутан – имеют напряженные связи, угол отличается от 109°28´,
цикл разрывается и они легко вступают в реакции присоединения с H₂, Cl₂, Br₂,HCl, растворами окислителей, присоединяя по месту разрыва связи.
ПРИСОЕДИНЕНИЕ
1. Гидрирование.
При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.
Циклопентан и циклогексан с трудом присоединяют водород:
2) Галогенирование.
Циклопропан и циклобутан разрываются, присоединяя атомы галогена, превращаясь в галогеналкан
3)Гидрогалогенирование.
Замещенные циклопропаны тоже взаимодействуют с галогеноводородами и другими соединениями с разрывом цикла.
ЗАМЕЩЕНИЕ
Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя как алканы, вступая в реакции замещения :
1) Галогенирование:
циклопентан и циклогексан реагируют с галогенами на свету, вступая в реакцию замещения.
ДЕГИДРИРОВАНИЕ
Производные циклогексана дегидрируются в производные бензола:
ГОРЕНИЕ
Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл.
Высшие арены – твердые вещества. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях.
Огнеопасны.
Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
ХИМИЧЕСКИЕ СВОЙСТВА.
Свойственны:
1. Реакции присоединения (мало характерны из-за наличия делокализованой (электронная пара рассредоточена между несколькими ядрами атомов). системы аренам реакции присоединения или окисления, которые ведут к нарушению ароматичности.
2. Реакции замещения в бензольном кольце
3. Реакции замещения в боковой цепи
Реакции окисления
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Гидрирование → циклопарафины
Условия: повышенная температура, давление, металлические катализаторы (350⁰С, Pt или Ni).
2. Радикальное хлорирование → галогенпроизводное циклоалканов
Из бензола образуется гексахлорциклогексан (гексахлоран — средство борьбы с вредными насекомыми).
РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование → галогенпроизводные аренов + HCl.
У бензола замещение одного атома водорода, у толуола при малом количестве галогена замещение присходит в положении орто- и пара-, при избытке галогена в положении 2,4,6-
Условия: нагревание, наличие катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование бензола → нитросоединения аренов + H₂O
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
Нитрование толуола
При нитровании толуола С6Н5-CH3, в зависимости от количества азотной кислоты, могут образовываться разные продукты реакции
3. Сульфирование → моносульфокислота.
Осуществляется концентрированной серной кислотой (олеум – это раствор серного ангидрида в безводной серной кислоте)
4. Взаимодействие с галогенопроизводными алканов → гомологи бензола с боковой цепью (реакция Фриделя— Крафтса)
5. Взаимодействие с непредельными углеводородами — гомологи бензола с боковой цепью
ЗАМЕЩЕНИЕ В БОКОВОЙ ЦЕПИ
При действии хлора на свету или при нагревании на гомологи бензола происходит реакция радикального замещения в боковой цепи:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромзамещающих соединений.
РЕАКЦИИ ОКИСЛЕНИЯ АРЕНОВ
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.), поэтому используется как инертный растворитель при окислении других органических соединений.
1. Горение бензола
Бензол содержит около 92% углерода, при неполном сгорании бензола образуется много копоти (C). При горении бензола образуются углекислый газ и водяные пары.
Бензол не подвергается окислению
2. Окисление оксидом марганца
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
3. Окисление перманганатом калия в кислой среде
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
3) Окисление перманганатом калия в нейтральной среде при нагревании — образуется соль бензойной кислоты и карбонаты:
СТИРОЛ (винилбензол) С8Н8
производное
бензола, которое имеет в своём составе двойную связь в боковом заместителе,
поэтому он НЕ
относится к гомологическому ряду аренов.
Проявляются все свойства
непредельных углеводородов.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
протекают в боковой цепи в соответствии с правилом Марковникова, например:
РЕАКЦИИ ОКИСЛЕНИЯ
1. Мягкое окисление стирола:
в нейтральной среде → многоатомный спирт
2. Жесткое окисление (t°) стирола:
в кислой среде → бензойная кислота,
в нейтральной при нагревании → бензоаты
3. Полимеризация полистирола (по боковой цепи):
→ полистирол.
Полистирол — полимер широкого применения
Содержание
- 1 Реакции присоединения
- 1.1 Гидрирование
- 1.2 Галогенирование
- 1.3 Гидрогалогенирование
- 2 Реакции замещения
- 2.1 Галогенирование
- 2.2 Нитрование
- 3 Окисление циклоалканов
- 3.1 Мягкое окисление
- 3.2 Жесткое окисление
- 3.3 Полное окисление (горение)
- 4 Реакция отщепления
- 5 Изомеризация
- 6 Заключение
Количество углеродных атомов в цикле, образующем молекулу, влияет на свойства циклоалканов, проявляемые в различных видах химических взаимодействий. Соединения с малыми циклами, в которых существенную роль играет угловое напряжение, отличаются неустойчивостью и близки по свойствам к непредельным углеводородам. Чем больше звеньев в цикле, тем сильнее проявляются свойства, присущие алканам.
Реакции присоединения
Участие в процессах этого типа, связанных с разрывом замкнутого участка молекулы, свойственно циклопропану и циклобутану
, обладающим малыми циклами.
Гидрирование
Условиями реакции являются нагревание и присутствие катализатора. Цикл размыкается с образованием алкана:
Для вступления в реакцию циклопентана требуются более жесткие условия:
Это единственная реакция присоединения, в которую способен вступать циклопентан. Сходство химических свойств циклоалканов с более высоким углеродным числом обусловливает их неучастие в реакциях присоединения.
Галогенирование
Продуктом этой реакции становится дигалогеналкан:
Гидрогалогенирование
Циклопропан реагирует в водном растворе с галогенводородами:
Присоединять галогенводород способны и гомологи циклопропана с углеводородным радикалом и трехчленным циклом. В процессах гидрогалогенирования циклоалканов соблюдается правило Марковникова, согласно которому водород присоединяется к максимально гидрогенизированному атому углерода:
Реакции замещения
Для циклоалканов со слабо напряженным или ненапряженным циклом () характерно замещение водорода без разрушения цикла.
Галогенирование
В результате реакции образуется галогенциклоалкан:
Хлорирование малого цикла также может происходить без его разрыва, если температура реакции не превысит 100° C:
Нитрование
Азотная кислота должна быть разбавленной. Продукт взаимодействия – нитроциклоалкан:
Это интересно:
Гомологический ряд алканов
Галогенирование алканов на примере пропана
Окисление циклоалканов
Реакции окисления одинаково свойственны всем циклоалканам. Аналогично предельным незамкнутым углеводородам, они не реагируют с водным раствором , но подвергаются каталитическому окислению и горят, как все углеводороды.
Мягкое окисление
При мягком окислении воздухом на хлориде кобальта получают алициклические кислородсодержащие соединения (кетон и спирт):
Жесткое окисление
С использованием катализатора воздействие сильного окислителя (например, разбавленной азотной кислоты) на циклоалкан приводит к образованию двухосновных кислот. Реакция протекает в жестких условиях:
Полное окисление (горение)
В общем виде уравнение горения циклоалканов записывается:
Инициирует реакцию контакт с открытым пламенем.
Реакция отщепления
Нагревание в присутствии металлического катализатора приводит к дегидрированию циклоалканов – отщеплению водорода и образованию ароматического соединения бензольного ряда:
Изомеризация
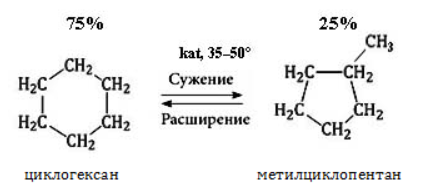
Циклоалканы способны изомеризоваться с перегруппировкой атомов в углеродном скелете. Процесс протекает на платине, хлориде или бромиде алюминия и сопровождается сужением либо расширением цикла. Образование средних циклов происходит легче, и они отличаются большей устойчивостью:
Реакция идет в обоих направлениях до установления равновесия.
Для низших циклоалканов предпочтительной оказывается изомеризация с расширением цикла, так как она ведет к ослаблению углового напряжения в молекуле. Так, метилциклобутан переходит в циклопентан необратимо:
Заключение
Циклоалканы, находящиеся в начале гомологического ряда, сочетают в своих химических взаимодействиях свойства предельных и непредельных углеводородов линейного строения. Комбинация свойств вызвана, с одной стороны, особыми условиями образования непрочных изогнутых связей в простейших циклах, и, с другой стороны, насыщенностью соединений.
Высшие циклоалканы практически не отличаются по химическим свойствам от алканов, так как их макроциклы не оказывают деформирующего влияния на строение химических связей.
…
Циклоалканы (циклопарафины) – органические насыщенные соединения, атомы углерода в молекулах которых, соединяясь образуют циклы. Общая формула – CnH2n . Строение, получение и свойства циклоалканов отличаются от свойств нормальных алканов с тем же числом углеродных атомов.
Строение циклоалканов
В молекулах циклоалканов углеродные атомы связаны между собой σ – связями. Устойчивость циклопарафинов, т.е. прочность С-С связей возрастает с увеличением количества атомов углерода, образующих цикл. Циклы делят на малые (С3, С4) и обычные (C5 – С7).
В качестве представителя малого цикла рассмотрим циклопропан:
- Молекула циклопропана представляет собой плоский цикл, образованный тремя атомами углерода; атомы водорода при этом расположены вне его плоскости и занимают энергетически невыгодное («заслоненное») положение, что способствует увеличению «напряженности» цикла и его неустойчивости.
- Валентные углы в плоском равностороннем треугольнике принимают значение равное 60°. А для sp3-гибридизованного атома углерода это значение соответствует 109,5°. В случае молекулы циклопропана, sp3-гибридизованные орбитали атомов углерода перекрываются между собой вне прямой, соединяющей ядра атомов. Образующиеся σ-связи с подобным способом перекрывания называют «банановыми». Их свойства обладают сходными чертами с π-связями, например, вступают в реакции присоединения.
В отличие от трехчленных циклов, устойчивость пяти- и шестичленных циклических алканов на столько высока, что они не способны к разрыву.
В качестве представителя обычного цикла рассмотрим циклогексан.
Для молекулы циклогексана не характерно плоское строение, напротив — ей присуще несколько форм — конформаций. Наиболее выгодной с энергетической точки зрения являются конформации кресла (более устойчива) и ванны. Валентные углы образованные гибридными орбиталями атомов углерода в цикле равны 109,5°, атомы водорода у соседних атомов углерода расположены относительно друг друга в положении энергетически выгодном.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей устойчивости обычных циклов по сравнению с малыми. Для них возможны реакции замещения и невозможны реакции присоединения.
Физические свойства циклоалканов
При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами. С увеличением размера цикла, температуры кипения и плавления растут. Циклоалканы С3 — С4 представляют собой газы, С5 — С16 — жидкости, C17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка.
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:
- Реакция пиролиза солей дикарбоновых кислот.
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.
- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:
Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
1. Реакции присоединения
- Галогенирование:
- Гидрогалогенирование:
- Гидрирование:
- Расщепление серной кислотой:
- Взаимодействие с сильными карбоновыми кислотами:
2. Реакции замещения (радикальный механизм)
- Галогенирование при действии ультрафиолета:
- Нитрование:
3. Реакция дегидрирования
В присутствии катализатора ведет к образованию бензола:
4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
5. Перегруппировка (сужение или расширение цикла)
Применение циклоалканов
Алканы и циклоалканы
Алканы (предельные или насыщенные углеводороды, парафины) — углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2. Соотношение числа атомов водорода и углерода в молекулах алканов максимально по сравнению с молекулами углеводородов других классов.
|
Алканы |
Ряд метана |
|
Формула |
Название |
|
СН4 |
Метан |
|
С2Н6 |
Этан |
|
С3Н8 |
Пропан |
|
С4Н10 |
Бутан |
|
С5Н12 |
Пентан |
|
С6Н14 |
Гексан |
|
С7Н16 |
Гептан |
|
С8Н18 |
Октан |
|
С9Н20 |
Нонан |
|
С10Н22 |
Декан |
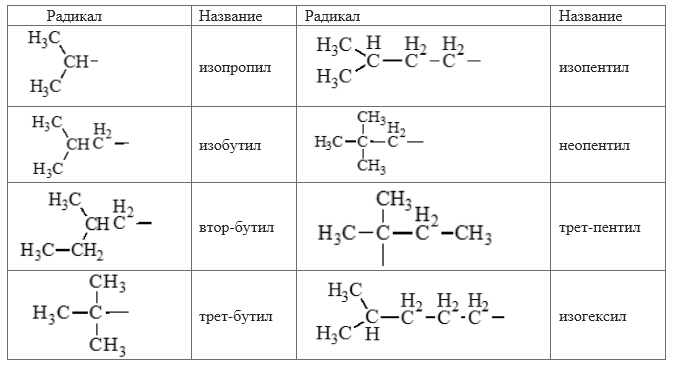
Таблица изомеров и название радикалов
При замыкании углеводородной цепи в цикл с потерей двух атомов водорода образуются моноциклоалканы с общей формулой CnH2n. Циклизация начинается с C3, названия образуются от Cn с префиксом цикло–:
Изомерия алканов и циклоалканов:
1. Углеродного скелета
Пространственные изомеры могут быть у циклоалканов:
Конформеры находятся в динамическом равновесии и превращаются друг в друга через нестабильные формы. Неустойчивость плоских циклов вызвана значительной деформацией валентных углов. При сохранении тетраэдрических валентных углов для циклогексана C6H12 возможны две устойчивые конформации: в форме кресла и в форме ванны:
Химические cвойства алканов:
1. Галогенирование:
СH4+Cl2=CH3Cl+HCl
2. Нитрование:
3. Реакции горения:
С5H12+8O2=5CO2+6H2O
4. Сульфохлорирование:
CH3(CH2)10CH3+SO2+Cl2→CH3(CH2)10CH2— SO2Cl+HCl
CH3(CH2)10CH2— SO2Cl+2NaOH→CH3(CH2)10— CH2SO3Na+NaCl
Это свойство используется при получении синтетических моющих средств.
Химические свойства циклоалканов:
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
1. Малые циклы (С3 — С4) довольно легко вступают в реакции гидрирования:
Циклопропан и его производные присоединяют галогены и галогеноводороды:
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
2. Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
3. Окисление циклоалканов (циклогексан).
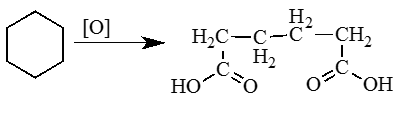
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
Алкены
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
|
Алкены |
Ряд этилена |
|
Формула |
Название |
|
С2Н4 |
Этен |
|
С3Н6 |
Пропен |
|
С4Н8 |
Бутен |
|
С5Н10 |
Пентен |
|
С6Н12 |
Гексен |
|
С7Н14 |
Гептен |
|
С8Н16 |
Октен |
|
С9Н18 |
Нонен |
|
С10Н20 |
Декен |
Виды изомерии:
Помимо изомерии, связанной со строением углеродной цепи, в ряду олефинов наблюдается изомерия положения двойной связи. Кроме того, у олефинов имеет место пространственная (геометрическая) или цис-транс-изомерия.
Для изучения материала по названному виду изомерии необходимо просмотреть анимационный фильм “Цис-транс-изомерия в ряду алкенов”. Обращаем внимание на то, что текст, сопровождающий этот фильм. в полном объеме перенесен в данный подраздел и ниже следует.
Цис-транс-изомерия в ряду алкенов
Наряду с изомерией, связанной со строением углеродного скелета и положением двойной связи, в ряду алкенов имеет место геометрическая или цис-транс-изомерия. Ее существование обусловлено отсутствием свободного вращения атомов, связанных двойной связью.
Метильные группы в приведенных примерах могут располагаться как по одну сторону двойной связи (такой изомер называется цис-изомером), так и по разные стороны (такой изомер называется транс-изомером). Названия упомянутых изомеров происходят от латинского cis — на этой стороне и trans- через, на другой стороне. Превращение изомеров друг в друга невозможно без разрыва двойной связи”.
Химические свойства алкенов:
1. Присоединение галогенов.
CH2=CH-CH3+Cl2→CH2Cl-CHCl-CH3
2. Присоединение водорода.
CH2 = CH-CH3+Н2→CH3-CH2-CH3
3. Присоединение галогенводородов.
CH2 = CH-CH3+НCl→CH3-CHCl-CH3
Присоединение протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Присоединение воды.
5. Окисление перманганатом калия в нейтральной или слабощелочной среде (реакция Вагнера).
6. Полимеризация алкенов.
Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
RH + XY → RX + HY
или
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
CH4 + 2O2 = CO2 + 2H2O
Б) неполное сгорание при недостатке кислорода:
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 оС) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
2CH4 → C2H2 + 3H2
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
СН4 → С + 2Н2
При дегидрировании остальных алканов образуются алкены:
C2H6 → C2H4 + H2
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Дегидроциклизация
Изомеризация
Химические свойства циклоалканов
Химические свойства циклоалканов с числом атомов углерода в циклах больше четырех, в целом практически идентичны свойствам алканов. Для циклопропана и циклобутана, как ни странно, характерны реакции присоединения. Это обусловлено большим напряжением внутри цикла, которое приводит к тому, что данные циклы стремятся разорваться. Так циклопропан и циклобутан легко присоединяют бром, водород или хлороводород:
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Химические свойства алкадиенов
Реакции присоединения
Например, присоединение галогенов:
Бромная вода обесцвечивается.
В обычных условиях присоединение атомов галогена происходит по концам молекулы бутадиена-1,3, при этом π-связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют новую π-связь. Таким образом, как бы происходит «перемещение» двойной связи. При избытке брома может быть присоединена еще одна его молекула по месту образовавшейся двойной связи.
Реакции полимеризации
Химические свойства алкинов
Алкины являются ненасыщенными (непредельными) углеводородами в связи с чем способны вступать в реакции присоединения. Среди реакци присоединения для алкинов наиболее распространено электрофильное присоединение.
Галогенирование
Поскольку тройная связь молекул алкинов состоит из одной более прочной сигма-связи и двух менее прочных пи-связей они способны присоединять как одну, так и две молекулы галогена. Присоединение одной молекулой алкина двух молекул галогена протекает по электрофильному механизму последовательно в две стадии:
Гидрогалогенирование
Присоединение молекул галогеноводорода, также протекает по электрофильному механизму и в две стадии. В обоих стадиях присоединение идет в соответствии с правилом Марковникова:
Гидратация
Присоединение воды к алкинами происходит в присутсвии солей рути в кислой среде и называется реакцией Кучерова.
В результате гидратации присоединения воды к ацетилену ообразуется ацетальдегид (укусный альдегид):
Для гомологов ацетилена присоединение воды приводит к образованию кетонов:
Гидрирование алкинов
Алкины реагируют с водородом в две ступени. В качестве катализаторов используют такие металлы как платина, палладий, никель:
Тримеризация алкинов
При пропускании ацетилена над активированным углем при высокой температуре из него образуется смесь различных продуктов, основным из которых является бензол – продукт тримеризации ацетилена:
Димеризация алкинов
Также ацетилен вступать в реакцию димеризации. Процесс протекает в присутствии солей меди как катализаторов:
Окисление алкинов
Алкины сгорают в кислороде:
СnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
Взаимодействие алкинов с основаниями
Алкины с тройной C≡C на конце молекулы, в отличие от остальных алкинов, способны вступать в реакции, в которых атом водорода при тройной связи замещается металл. Например, ацетилен реагирует с амидом натрия в жидком аммиаке:
HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3,
а также с аммиачным раствором оксида серебра, образуя нерастворимые солеподобные вещества называемые ацетиленидами:
Благодаря такой реакции можно распознать алкины с концевой тройной связью, а также выделить такой алкин из смеси с другими алкинами.
Следует отметить, что все ацетилениды серебра и меди являются взрывоопасными веществами.
Ацетилениды способны реагировать с галогенпроизводными, что используется при синтезе более сложных органических соединений с тройной связью:
СН3-C≡CН + NaNН2 → СН3-C≡CNa + NН3
СН3-C≡CNa + CH3Br → СН3-C≡C-СН3 + NaBr
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Гидрирование
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Горение
2С6Н6 + 15О2 = 12СО2 + 6Н2О+Q
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Деление заместителей в бензольном кольце на два типа:
Рассмотрим химические свойства гомологов бензола на примере толуола.
Химические свойства толуола
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частности, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогруппу при нитровании толуола смесью концентрированных азотной и серной кислот приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано, метильный радикал является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С6Н5СН3 + 9O2 → 7СO2 + 4Н2O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль:
























![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)