Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
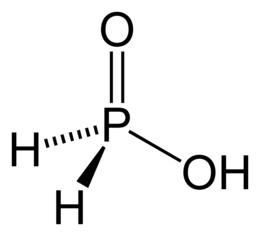
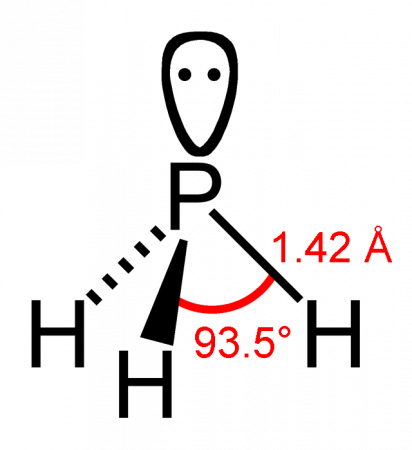
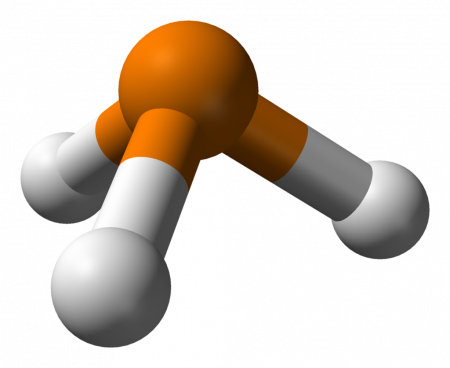
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
…
Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
- Реакция диспропорционирования фосфора в щелочах:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI+ PH3↑
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами –
окислителями:
PH3 + 8H2SO4(конц) = H3PO4 + 8SO2↑ + 3H2O
PH3 + 8HNO3(конц. гор) = H3PO4 + 8NO2↑ + 4H2O
- С безводными кислотами образует соли:
HI+ PH3↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 + 2О2 = P2O5 + H2O (Н3РО4)
Практического значения фосфин не имеет.
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
P + 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия
фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
4Р + 3О2 = 2Р2О3
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде
димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Р2О3 + ЗН2О =2H3PO3
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3вгорячей воде:
2Р2О3 + 6Н2О = РН3 + ЗH3PO4
- При взаимодействии Р2О3 с щелочами образуются соли фосфористой кислоты:
Р2О3 + 4NaOH = 2Na2HPO3 + Н2О
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Р2О3 + О2 = Р2О5
Окисление галогенами:
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р + 5О2 = 2Р2О5
Физические свойства фосфорного ангидрида
При комнатной
температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде
димеров Р4О10.
Очень гигроскопична, при
соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и
водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 + Н2О = 2HPO3 метафосфорная
Р2О5 + 2Н2О = Н4Р2О7 пирофосфориая
(дифосфорная)
Р2О5 + ЗН2О = 2H3PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 + ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О
Р2О5 + 4NaOH = 2Na2HPO4 + Н2О
Р2О5 + 2NaOH = 2NaH2PO4 + Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 + 2HNО3 = 2HPO3 + N2О5
Р2О5 + 2НСlО4 = 2HPO3 + Сl2О7
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
Видеоопыт Взаимодействие оксида фосфора с водой
Фосфорные кислоты
Фосфор
образует только 2 устойчивых оксида, в которых он находится в степенях
окисления +5 и +3. Однако существует большое число кислот, в которых фосфор
имеет валентность равную V (пять ковалентных связей) и степени окисления +5,
+4, +3, +1.
Строение
наиболее известных кислот выражается следующими формулами:
Наибольшее
практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая
(фосфористая) кислоты.
Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Реакция Р2О3 с водой:
Р2О3 + ЗН2О =2H3PO3
- Гидролиз галогенидов фосфора (III):
PCl3 + ЗН2О = H3PO3+ 3HCl
- Окисление белого фосфора хлором:
2Р + 3Cl2 + 6Н2О = 2H3PO3+ 6HCl
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой
таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной
температуре H3PO3 –
кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора
в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является
слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
H2HPO3 + H2HPO3 = H3PO4 + PH3
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
H3PO3 + Cl2 + Н2О = H3PO4 + 2HCl
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
- Реагируют с более слабыми окислителями:
H3PO3 + 2AgNO3 + Н2О = H3PO4 + 2Ag↓ + 2HNO3
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
H2HPO3 + 3Zn + 3H2SO4 = 3ZnSO4 + PH3 + 3Н2О
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
H3PO3 + Н2О = H3PO4 + Н2
Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] + NaOH = NaH[HРО3] + Н2О
Н2[НРО3] + 2NaOH = Na2[HРО3] + 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] + Ca = Ca[HРО3] + Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] + CaO = Ca[HРО3] + Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 + 8NaOH(конц) + 4H2O = Na2[HРО3] + 6H2
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 + 5NaOH(разб) = Na2[HРО3] + 3NaCl + 2H2O
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо
растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты
плохо растворимы.
Химические свойства фосфитов
Имеют
химические свойства, характерные для солей
Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 + 3H2SO4 = 2Н3РO4 + 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР + 5HNO3 + 2Н2О = ЗН3РO4 + 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 + ЗН2О = 2H3PO4
Физические свойства, строение фосфорной кислоты
При обычной
температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С)
кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с
водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует
сиропообразную, вязкую жидкость.
Степень
окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При
нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в
метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При
добавлении AgNO3 к кислотам образуются осадки
различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видео Качественная реакция на фосфат-ион
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы
и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н+ + Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно
малой степени:
Н2РO4— → Н+ + НРO42-
НРO42- → Н+ + РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 + 6Na = 2Na3РO4 + 3H2
- с основными оксидами:
2Н3РO4 + ЗСаО = Са3(РO4)2 + ЗН2О
2H3PO4 + 3MgO = Mg3(PO4)2 + 3H2O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 + NaOH = NaH2PO4 + Н2О
Н3РO4 + 2NaOH = Na2HPO4 + 2Н2О
Н3РO4 + 3NaOH = Na3PO4 + ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 + NH3 = NH4H2PO4
Н3РO4 + 2NH3 = (NH4)2HPO4
- Вытесняет более слабые кислоты из их солей
(карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
В отличие от
аниона NO3— в азотной
кислоте, анион РO43- окисляющим
действием не обладает.
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают
кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства
ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
Na3РO4 + Н2О = Na2HPO4 + NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 + H2O
Na2HPO4 = Na4P2O7 +
H2O
(NH4)3PO4 = 3NH3 + H2O
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество,
легко воспламеняющееся и светящееся.

Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит

Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 + SiO2 + C → (t) CaSiO3 + P + CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
- Реакции с неметаллами
- Реакции с металлами
- Реакция с водой
- Реакция с щелочами
- Восстановительные свойства
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
4P + 3O2 → 2P2O3 (недостаток кислорода)
4P+ 5O2 → 2P2O5 (избыток кислорода)
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
P + S → P2S3
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое
отравляющее вещество.
Ca3P2 + H2O → Ca(OH)2 + PH3↑

2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество
является и окислителем, и восстановителем).
P + H2O → (t) PH3 + H3PO4
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
P + LiOH + H2O → LiH2PO2 + PH3↑ (LiH2PO2 — гипофосфит лития)
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
KClO3 + P → KCl + P2O5

Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P + O2 → P2O5
Химические свойства
- Кислотные свойства
- Дегидратационные свойства
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
P2O5 + 3H2O = 2H3PO4
P2O5 + H2O = HPO3 (при недостатке воды)
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного
оксида/основания и кислотного оксида.
P2O5 + Na2O → Na3PO4
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
HClO4 + P2O5 → HPO3 + Cl2O7 (HPO3 — метафосфорная кислота)
HNO3 + P2O5 → HPO3 + N2O5
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3—)
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2— )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 + H3PO2 + H2O → Cu + H2SO4 + H3PO4
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 + H2SO4 → CaSO4 + H3PO4
P2O5 + H2O → H3PO4
PCl5 + H2O → H3PO4 + HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P + HNO3 + H2O → H3PO4 + NO

Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O + H3PO4 = 2K3PO4 + 3H2O
3KOH + H3PO4 = K3PO4 + 3H2O
2KOH + H3PO4 = K2HPO4 + H2O
KOH + H3PO4 = KH2PO4 + H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 + H3PO4 → Ag3PO4 + HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 + H3PO4 → K3PO4 + H2O + CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg + H3PO4 → Mg3(PO4)2 + H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 + H2O
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
4. Химические свойства соединений фосфора с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 4.1. P2O5 активно отнимает воду, поэтому используется для получения оксидов:
P2O5 + 2HNO3 → N2O5 + 2HPO3
P2O5 + 2HClO4 → Cl2O7 + 2HPO3
Правило 4.2. Соединения P+3 легко окисляются до P+5 :
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
3P2O3 + 2HClO3 + 9H2O → 6H3PO4 + 2HCl
3P2O3 + 2NaClO3 → 3P2O5 + 2NaCl
3PCl3 + 2HNO3 + 8H2O → 3H3PO4 + 2NO + 9HCl
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O или
15H3PO3 + 6KMnO4 + 3H2SO4 → 11H3PO4 + 3K2SO4 + 2Mn3(PO4)2
Правило 4.3. Галогениды фосфора гидролизуются водой или раствором щелочи:
PCl3 + 3H2O → H3PO3 + 3HCl
PCl5 + 4H2O → H3PO4 + 5HCl
PI3 + 3H2O → H3PO3 + 3HI
PCl5 + 8KOH → K3PO4 + 5KCl + 4H2O
Правило 4.4. Фосфин, как правило, окисляется до P+5 :
2PH3 + 4O2 → P2O5 + 3H2O или PH3 + 2O2 → H3PO4
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
5PH3 + 8KMnO4 + 12H2SO4 → 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
PH3 + 8AgNO3 + 4H2O → 8Ag + H3PO4 + 8HNO3
PH3 + 4HClO → H3PO4 + 4HCl
8HNO3(конц., гор.) + PH3 → H3PO4 + 8NO2
Правило 4.5. Фосфиды металлов разлагаются водой или кислотами, образуя фосфин:
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
Mg3P2 + 6H2O → 3Mg(OH)2 +2PH3
Правило 4.6. Кислые соли фосфорной кислоты разлагаются при нагревании:
2Na2HPO4 → Na4P2O7 + H2O
Правило 4.7. В таблице ниже представлены формулы и строение различных кислот фосфора.
По словам составителей экзамена основность и строение кислот H3PO3 H3PO2 на ЕГЭ проверяться не будет. Но они могут встретиться тестовой части, например, в задании 5, т.е. необходимо знать класс этих соединений (кислоты).
Такие кислоты как фосфористая H3PO3 и фосфорноватистая H3PO2 образуют только соли, содержащие один и два атома водорода. Это происходит из-за того, что в этих кислотах есть атомы водорода, соединененные непосредствено с атомом фосфора, а они на металл не заменяются. Например:
P4 + 3KOH + 3H2O → PH3 + 3KH2PO2 (гипофосфит калия)
|
Степень окисления P |
Формула кислоты |
Название кислоты |
Название солей |
Строение кислоты |
|
P+5 (V) |
HPO3 |
Метафосфорная |
Метафосфаты, PO3– |
|
|
H4P2O7 |
Пирофосфорная |
Пирофосфаты, P2O74– |
|
|
|
H3PO4 |
Ортофосфорная |
(Орто)фосфаты, PO43– |
|
|
|
P+3 (V) |
H3PO3 |
Фосфористая (фосфоновая) |
Фосфиты, HPO32– (фосфонаты) |
|
|
P+1 (V) |
H3PO2 |
Фосфорноватистая (фосфиновая) |
Гипофосфиты, H2PO2– (фосфинаты) |
|
Фосфин – это газ, который вырабатывается как промышленностью, так и в процессе жизнедеятельности организмов. Обладает целым рядом интересных свойств. Например, он является причиной суеверий, связанных с ночными огоньками на болотах, используется в исследовании космоса и является одной из причин глобального потепления. Фосфин – это ядовитый газ. Рассмотрим свойства фосфина, применение это газа, симптомы отравления и первую помощь.
Содержание
- Что такое фосфин, формула вещества
- Физические свойства фосфина, внешний вид
- Химические свойства фосфина
- Производство и получение фосфина
- Получение фосфина в промышленности
- Применение фосфина
- Применение фосфина в сельском хозяйстве как пестицида
- В космической науке
- Опасность фосфина, токсичность, меры предосторожности
- Симптомы отравления фосфином и первая помощь
- Где купить и сколько стоит
- Заключение
Что такое фосфин, формула вещества
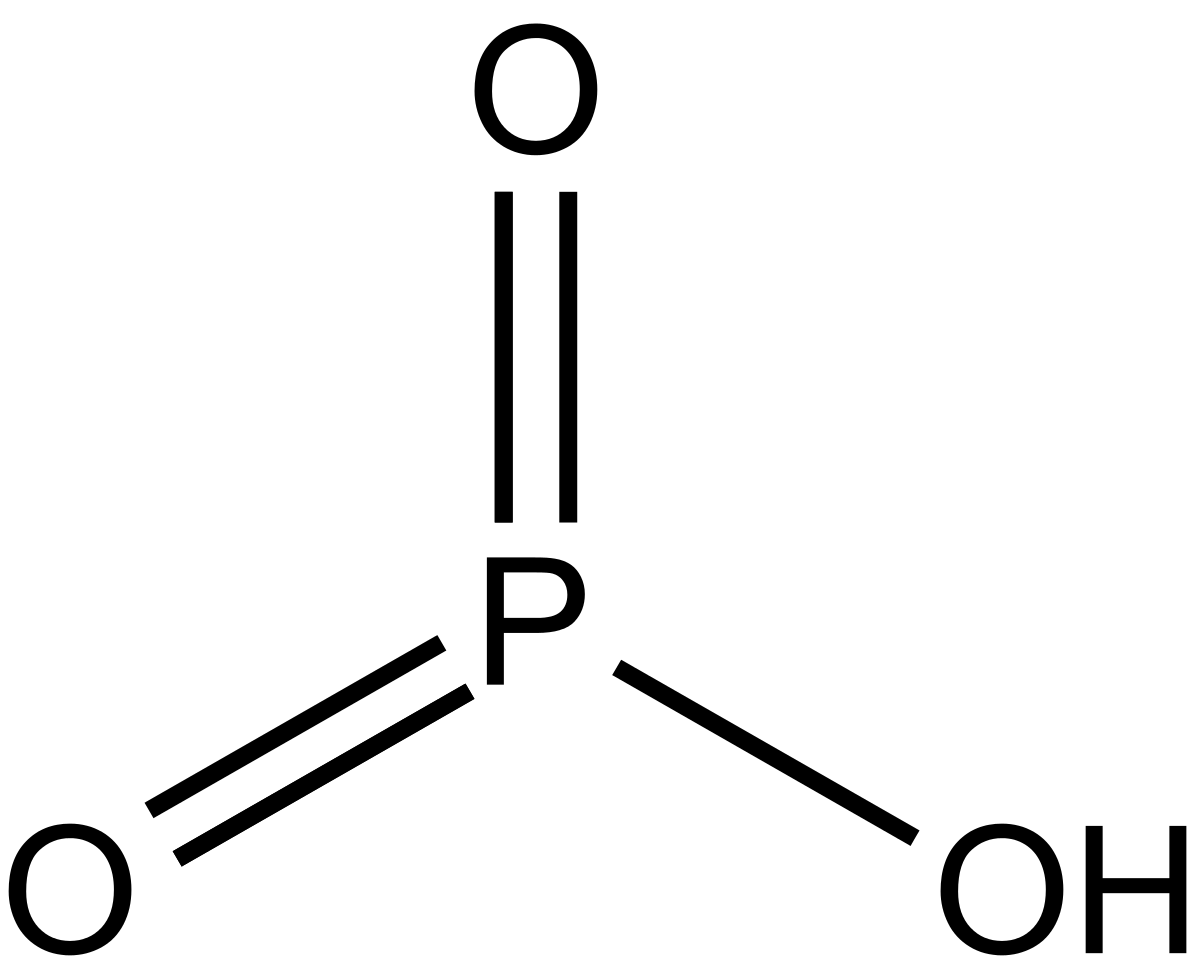
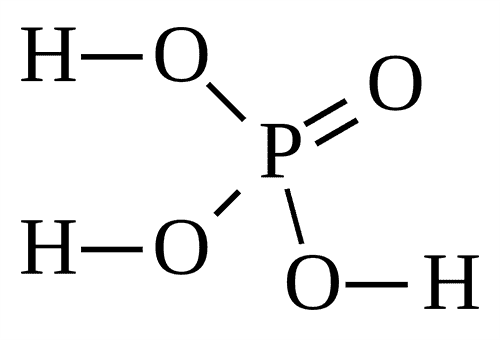
Фосфин — это соединение фосфора и водорода. Химическая формула фосфина имеет вид:
PH3
Как показывает формула фосфина, он состоит из трёх атомов водорода и одного атома фосфора. В природе встречается только в виде газа. В промышленных условиях может сжижаться и даже переходить в твёрдое состояние в виде кристаллов. Растворяется в воде, получается в ходе жизнедеятельности анаэробных бактерий, в некотором количестве выделяется из почвы.
Структурная формула фосфина и его молекула
Фосфин – это ядовитое соединение.
Физические свойства фосфина, внешний вид
Рассмотрим подробно физические свойства фосфина:
- Молекулярная масса – 34.3;
- Плотность в нормальных условиях – 1.529 кг/м3
- Температура кристаллизации – 133.5°C;
- Температура плавления – 133.8°C;
- Переход в газ при температуре 87.5°C;
- Растворим в воде, крови. Предельная растворимость при 20°C составляет 27мл/100г.
- Горит. Минимальная концентрация самовозгорания около 26 г/л.
Молекула фосфина имеет форму тетраэдра, вершиной которого является молекула фосфора, и от неё отходят в одну сторону три молекулы водорода. Угол между водородными связями при этом составляет 93.5 градусов. Затвердевая, образует кубическую кристаллическую решётку. Обладает слабо выраженными щелочными свойствами как в водном растворе, так и в сжиженном виде. Растворим в диэтиловом эфире, сероуглероде, бензоле.
В чистом виде фосфин – это бесцветный газ, без выраженного запаха. Так как при промышленном получении обычно содержит ряд примесей, то его присутствие в воздухе можно определить, почувствовав запах тухлой рыбы, жареного чеснока, лука. Чистый и сухой фосфин не воспламеняется в обычной воздушной среде, такое возможно только при температуре выше 100°C. Однако при его образовании при взаимодействии соединений фосфора и воды в составе газа образуется значительная доля дифосфина, P2H2. Благодаря этой примеси он может самовоспламеняться при комнатной температуре.
С этой особенностью связан ряд суеверий. Например, болотные огни, имеющие вид свечи и располагающиеся в ночное время примерно на высоте двух с половиной метров, обязаны своим появлением именно фосфину и его соединениям. Появляются они обычно в августе. Наши предки связывали их с неупокоенными душами утопленников, которые расстались с жизнью на болотах, которые могут как помочь, так и навредить человеку.
Химические свойства фосфина
Рассмотрим химические свойства фосфина, как он взаимодействует с другими веществами.
Реакция горения фосфина:
2O2 + PH3 = H3PO4 + T или
2PH3 + 4O2 = P2O5 + 3H2O + T
При большой концентрации фосфина реакция идёт преимущественно по второму типу.
Реакция разложения фосфина при нагреве:
2PH3 + T = 2P + 3H2↑
Реакция фосфина с серной кислотой:
PH3 + 4H2SO4 (конц.)+ T =H3PO4+4SO2+H2O
Реакция проходит при температуре. Без нагрева образуется не ортофосфорная, а фосфористая кислота H3PO3.
Реакция фосфина с кислотой — проявление основных свойств, образование солей фосфония:
PH3 + HCl = PH4Cl
Соединение слабое, разлагается в присутствии воды. Является одной из форм хранения фосфина — реакция легко обратимая. Используется для хранения фосфина в целях фумигации — уничтожения насекомых в зернохранилищах.
Производство и получение фосфина
Получение фосфина в лабораторных условиях реакцией кислоты с дифосфидами металлов:
Mg3P2 + 6HCl + T = 3MgCl2 + 2PH3↑
Данная реакция относится к реакциям гидролиза. Вместо дифосфида магния может выступать другое соединение с щелочноземельными металлами, например, кальция. Во время реакции более электроотрицательные атомы хлора замещают ионы фосфора, которые, в свою очередь, соединяются с ионами водорода. При этом происходит еще и образование некоторого количества P2H2, упомянутого ранее.
Более сложная реакция – диспропорционирование, когда используемый белый фосфор выступает и в качестве окислителя, и в качестве восстановителя:
4P + 3KOH + 3H2O + T = 3KH2PO2 + PH3↑
Здесь электроположительный калий вступает в реакцию с фосфором и водой. Из-за своих выраженных щелочных свойств он образует гипофосфит, остатки фосфора вступают в реакцию с образовавшимися ионами водорода и выделяются в виде газа из раствора.
Получение фосфина в промышленности
В основном используется описанная выше реакция белого фосфора с горячей щёлочью. Еще применяется реакция восстановления фосфоновой кислоты:
H3PO3 + 3 Zn + 6HCl = PH3↑ + 3ZnCl2 + 3H2O
Применение фосфина
Таблетки фосфида алюминия из которых выделяют фосфин
Применение фосфина в сельском хозяйстве как пестицида
Фосфин – это эффективный пестицид. Газ чрезвычайно ядовит и сильно воздействует на насекомых, которые вредят урожаю. Хорошо действует и на грызунов.
В чистом виде как газ из баллонов не используется. Чаще всего используется описанная выше реакция PH3 + HCl = PH4Cl в своём обратимом виде, разложение PH4Cl в присутствии воды. Также применяют реакцию воды с фосфидом магния. В результате её при взаимодействии с влагой из воздуха образуется фосфин. Выделение идёт достаточно активно.
P2Mg3 + 6H2O →2PH3 + 3Mg(OH)2
Резистентность и эффективность фосфина в качестве пестицида
У некоторых видов насекомых, в частности, у кожеедов, отмечается выработка резистентности к фосфину. У других видов она слабо выражена, повторные обработки бывают так же эффективны, как и первая. При борьбе с грызунами резистентности не отмечено. Однако отмечается, что большинство грызунов всё-таки в процессе обработки успевают выйти из опасной зоны и поражение их не затрагивает. В этом плане фосфин менее эффективен, чем яды, применяющиеся в составе приманок.
Влияние фосфина на продукты питания
По заключениям специалистов, применение фосфина в качестве пестицида или фумигатора никак не влияет на качество продуктов питания, которые им обработаны. Газ не оставляет каких-то ядовитых следов на поверхности плодов, зерна или в муке.
В космической науке
Считается, что пары фосфина в атмосфере могут появляться в результате деятельности анаэробных бактерий. Если в спектре излучения атмосферы телескопы находят такие следы, то это может свидетельствовать о наличии жизни.
Опасность фосфина, токсичность, меры предосторожности
Фосфин – это сильный яд нервно-паралитического действия. При работе с ним необходимо соблюдать меры предосторожности:
- Использовать противогаз со специальной гильзой, предназначенной для работы с фосфином;
- Одевать костюм химической защиты;
- Применять защитные перчатки.
Нельзя находиться в помещении, где проходит обработка фосфином. При наличии симптомов отравления необходимо оказать помощь.
Симптомы отравления фосфином и первая помощь
Симптомами отравления являются:
- В лёгких случаях: тошнота, головокружение, боль в области диафрагмы и средней части спины;
- В тяжёлых случаях: головокружение, сильная головная боль, конвульсии, потеря сознания.
При обнаружении симптомов отравления фосфином первая помощь при отравлении состоит в том, чтобы человек покинул зону обработки, затем немедленно вызывают врача. При наличии сознания и пульса необходимо его освободить от одежды и уложить — иногда одежда содержит в складках газ, который можно вдохнуть. При отсутствии сознания и наличии пульса пострадавшего выносят из зоны поражения, раздевают и укладывают в горизонтальное положение. При отсутствии пульса проводят реанимацию до приезда врача.
Где купить и сколько стоит
В небольшом количестве его легче всего приобрести в специализированных магазинах в виде таблеток фосфида магния. Они при реакции с влагой выделяют газ фосфин. Возможна продажа таблеток фосфида алюминия, они менее интенсивно выделяют фосфин при реакции с водой, но достаточно для нормальной обработки помещения. Цена за 1 килограмм таблеток — около 2500-3000 рублей, при оптовой закупке цена существенно ниже.
Заключение
Фосфин – это вещество, которое нашло основное применение в сельском хозяйстве, а также некоторых областях науки. Некоторые исследователи считают, что его выделение на болотах в России в связи с глобальным потеплением и таянием вечной мерзлоты способно сильно ускорить эти процессы. При обращении с ним нужно соблюдать осторожность — это сильный и опасный яд.
Читайте также:
- Азотная кислота: свойства, применение, реакции
- Нитрат кальция (кальциевая селитра): описание, применение
- Хлорид фосфора: свойства, получение, реакции, применение, опасность
- Сульфат калия: свойства, формула, применение
Загрузка…
| Фосфин | ||
|---|---|---|
|
||
| Систематическое наименование |
Фосфин | |
| Хим. формула | PH3 | |
| Состояние | газ | |
| Молярная масса | 34,00 г/моль | |
| Плотность | 1,379 г/л, газ (25 °C) | |
| Энергия ионизации | 9,96 ± 0,01 эВ | |
| Температура | ||
| • плавления | −133,8 °C | |
| • кипения | −87,8 °C | |
| Пределы взрываемости | 1,79 ± 0,01 об.% | |
| Энтальпия | ||
| • образования | 5,4 кДж/моль | |
| Давление пара | 41,3 ± 0,1 атм | |
| Растворимость | ||
| • в воде | 31,2 мг/100 мл (17 °C) | |
| Рег. номер CAS | [7803-51-2] | |
| PubChem | 24404 | |
| Рег. номер EINECS | 232-260-8 | |
| SMILES |
P |
|
| InChI |
1S/H3P/h1H3 XYFCBTPGUUZFHI-UHFFFAOYSA-N |
|
| RTECS | SY7525000 | |
| ChEBI | 30278 | |
| Номер ООН | 2199 | |
| ChemSpider | 22814 | |
| Токсичность | Чрезвычайно токсичен, СДЯВ | |
| Пиктограммы ECB |  |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора, по номенклатуре IUPAC — фосфан) PH3 — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы (чеснока).
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Самовозгорание
- 5 Токсичность
- 6 Применение
Физические свойства
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства.
При низких температурах образует твёрдый клатрат 8 PH3·46 H2O. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому по сравнению с аммиаком, фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
- 2 P4 + 3 Ca(OH)2 + 6 H2O →70∘C 2 PH3 ↑ + 3 Ca(H2PO2)2
- P4 + 3 KOH + 3 H2O →70∘C 3 KH2PO2 + PH3 ↑
Также его можно получить воздействием воды или кислот на фосфиды:
- Ca3P2 + 6 H2O → 2 PH3 ↑ + 3 Ca(OH)2
- Mg3P2 + 6 HCl → 2 PH3 ↑ + 3 MgCl2
Хлористый водород при нагревании взаимодействует с белым фосфором:
- P4 + 6 HCl →300∘C 2 PH3 + 2 PCl3
Разложение йодида фосфония:
- PH4I →>80∘C PH3 + HI
- PH4I + H2O ⇄ PH3 ↑ + H3O+ + I−
- PH4I + NaOH ⇄ PH3 ↑ + NaI + H2O
Разложение фосфоновой кислоты:
- 4 H2(PHO3) →170−200∘C PH3 ↑ + 3 H3PO4
или её восстановление:
- H3PO3 + 3 Zn + 6 HCl → PH3 ↑ + 3 ZnCl2 + 3 H2O
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
- 2 PH3 →t 2 P + 3 H2
На воздухе горит согласно уравнению:
- PH3 + 2 O2 → H3PO4
Проявляет сильные восстановительные свойства:
- PH3 + 3 H2SO4 → H2(PHO2) + 3 SO2 ↑ + 3 H2O
- PH3 + 8 HNO3 → H3PO4 + 8 NO2 ↑ + 4 H2O
- PH3 + 2 I2 + 2 H2O → H(PH2O2) + 4 HI
В связи с тем, что:
- 4 H2(PHO3) →170−200∘C PH3 ↑ + 3 H3PO4
то возможно протекание следующей реакции:
- PH3 + 4 H2SO4 →200∘C H3PO4 + 4 SO2 ↑ + 4 H2O
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
- PH3 + HCl →30∘C PH4Cl
- PH3 + HI → PH4I
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Самовозгорание
Абсолютно чистый и сухой фосфин не способен к самовоспламенению на воздухе и загорается только при температуре 100-150°.
Однако фосфин, получающийся, например, при взаимодействии фосфидов с водой всегда имеет примесь дифосфина P2H4, который на воздухе самовоспламеняется. В частности, таким образом могут появляться «блуждающие огни».
Токсичность
Фосфин очень ядовит. Поражает в первую очередь нервную систему, нарушает обмен веществ; также действует на кровеносные сосуды, органы дыхания, печень, почки.
Запах фосфина ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ может привести к летальному исходу. ПДК — 0,1 мг/м³.
При остром отравлении фосфином в лёгких случаях беспокоит боль в области диафрагмы, чувство холода, впоследствии может развиться бронхит. При среднетяжёлом отравлении — чувство страха, озноб, рвота, стеснение в груди, удушье, боль за грудиной. В тяжёлых случаях на первый план выходят неврологические симптомы — оглушение, неверная походка, подёргивания в конечностях, мидриаз; cмерть от паралича дыхания или сердечной мышцы может наступить через нескольно дней, а при высоких концентрациях — мгновенно.
Хроническое отравление может привести к расстройству зрения, походки, речи, пищеварения, бронхиту, болезням крови и жировому перерождению печени.
Применение
В 2019 году фосфин был предложен в качестве биосигнатурного газа для поиска жизни на землеподобных экзопланетах, поскольку на Земле он производится анаэробными экосистемами. Слабой стороной фосфина для этой цели является его высокая реакционная способность, что требует большой интенсивности производства этого газа для его детектирования. Для его обнаружения в атмосфере экзопланеты потребуются десятки часов наблюдения телескопа «Джеймс Уэбб».