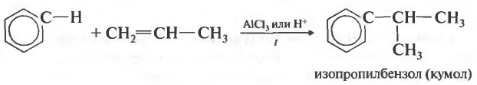Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец.
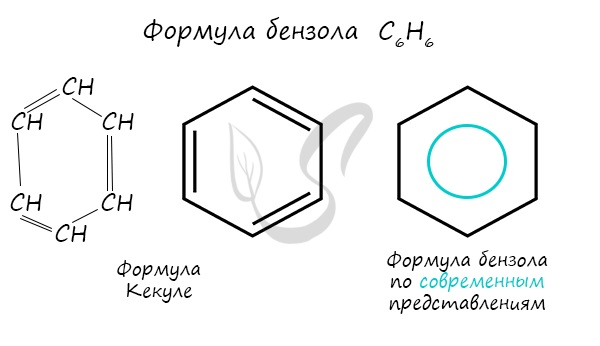
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6.
Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
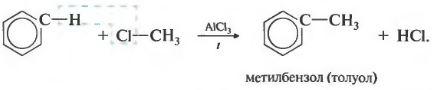
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
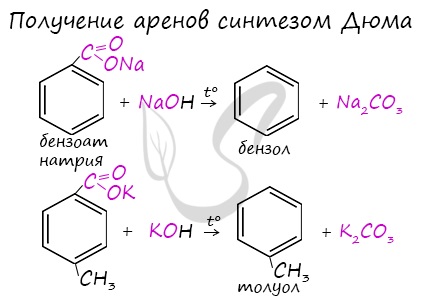
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород — бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
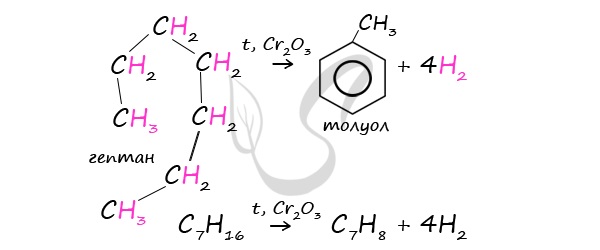
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

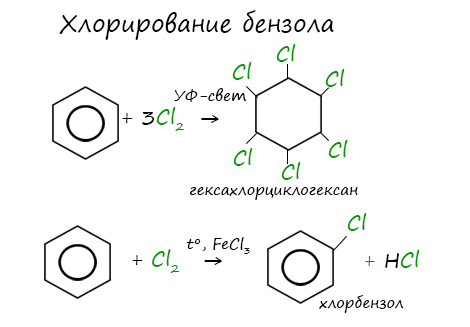
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
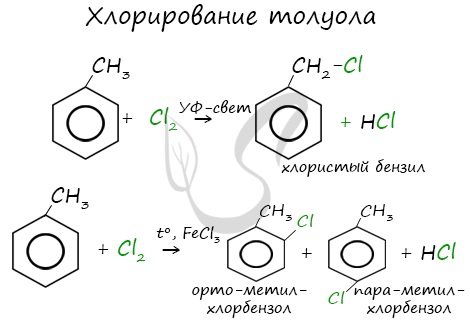
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
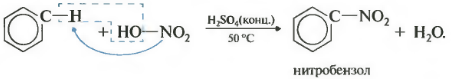
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
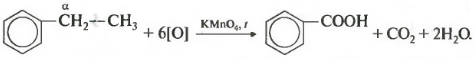
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
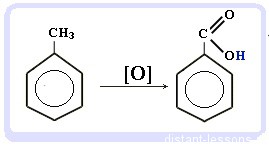
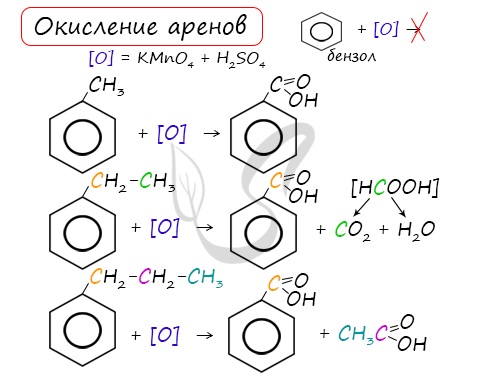
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
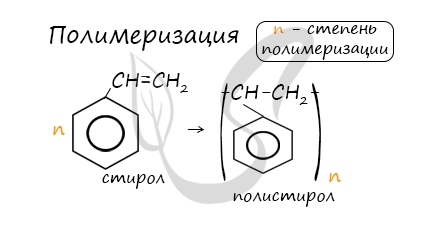
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
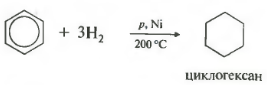
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
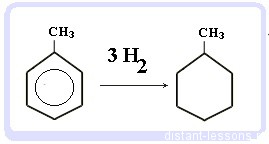
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
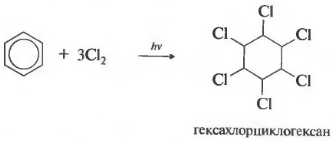
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
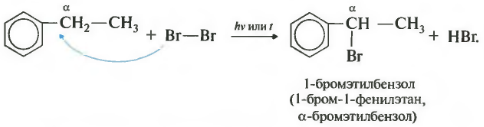
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
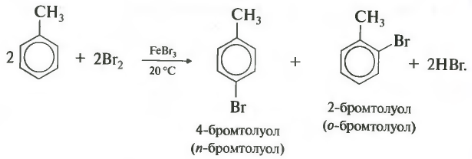
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
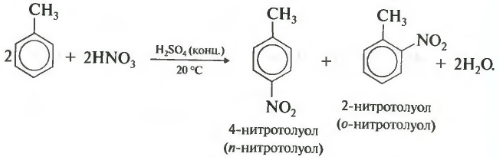
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
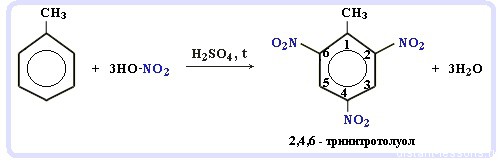
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
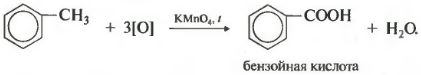
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
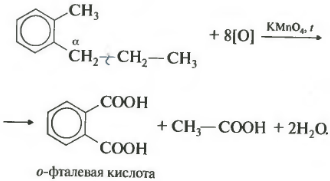
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Химические свойства бензола
06-Дек-2012 | комментариев 5 | Лолита Окольнова
Химические свойства бензола
В лекции о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор…
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов. По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
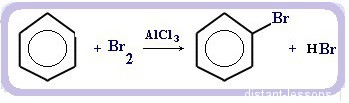
Реакция галогенирования бензола (взаимодействие с бромом — качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr
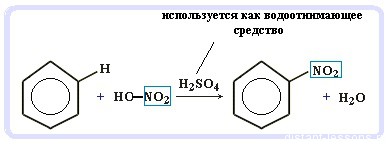
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + H2O
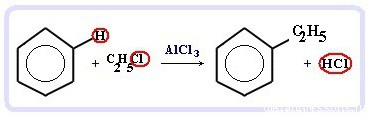
Химические свойства бензола — Алкилирование— получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
во-первых, гомологи бензола более ракционноспособны — легче вступают в реакции,
во-вторых, эти реакции идут немного по-другому:
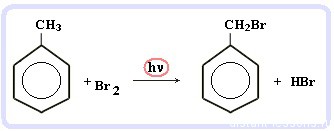
Галогенирование алкилбензолов:
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)2 O2 → nCO2 + (n-3)H2O
[TESTME 45]
Категории:
|
Обсуждение: «Химические свойства бензола»
(Правила комментирования)
1. Реакции замещения в бензольном кольце
Первая группа реакций — реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство — галогенирование. Замещение атома водорода на атом галогена — хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.
Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство — нитрование бензола, введение нитрогруппы в бензольное кольцо.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля — нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство — алкилирование бензола галогеналканами.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство — алкилирование бензола алкенами.
Таким способом можно получить, например, кумол или же этилбензол. Катализатор — хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций — реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке — гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство — хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола — это замещение в боковой цепи.
Седьмое свойство в общем списке — галогенирование по альфа-атому углерода в боковой цепи.
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций — окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия — не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам — окисляется углерод, находящийся в альфа-положении.
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
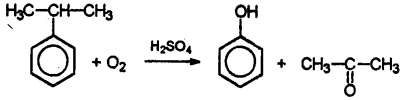
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство — горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же — 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Гомологам бензола также характерны реакции замещения, присоединения и окисления (горение, реакции с перманганатом калия и другими окислителями).
Реакции замещения в бензольном кольце для гомологов протекают легче, чем для бензола. Но с растворами брома гомологи бензола тоже не реагируют.
В присутствии катализатора (соли железа или алюминия) арены взаимодействуют с хлором и бромом. В бензольном кольце один из атомов водорода замещается на атом галогена:
C6H5−CH3+Br2⟶AlBr3C6H4Br−CH3+HBr.
В реакции образуется смесь (2)-бром-(1)-метилбензол (орто-бромтолуол) или (4)-бром-(1)-метилбензол (пара-бромтолуол).
|
|
|
|
Орто-бромтолуол |
Пара-бромтолуол |
В этой реакции проявляется направляющее действие метильного радикала, из-за которого замещение атома водорода легче происходит в положениях (2), (4) и (6) (орто- и пара-).
Если реакция с галогеном идёт при освещении, то замещение происходит в боковом радикале. Например, в реакции толуола с хлором на свету образуется бензилхлорид:
C6H5−CH3+Cl2⟶hvC6H5−CH2Cl+HCl.
Нитрование
При нитровании толуола также образуются два продукта: (2)-нитро-(1)-метилбензол (орто-нитротолуол) или (4)-нитро-(1)-метилбензол (пара-нитротолуол):
C6H5−CH3+HNO3⟶H2SO4C6H4NO2−CH3+H2O.
Структурные формулы о-нитротолуола и п-нитротолуола представлены ниже.
|
|
|
|
О-нитротолуол |
П-нитротолуол |
При избытке нитрующей смеси может образоваться также (2),(4),(6)-тринитро-(1)-метилбензол (тринитротолуол):
C6H5−CH3+3HNO3⟶H2SO4C6H2(NO2)3−CH3+3H2O.
Структурная формула (2),(4),(6)-тринитротолуола представлена ниже.

В присутствии катализатора в реакции гомологов бензола с водородом образуются гомологи циклогексана. Так, при гидрировании толуола получается метилциклогексан:
C6H5−CH3+3H2⟶Pt,tC6H11−CH3.
Арены горят коптящим пламенем:
CnH2n−6+(1,5n−1,5)O2→nCO2+(n−3)H2O.
Гомологи бензола окисляются по боковым радикалам. Например, в реакции толуола с раствором перманганата калия в присутствии кислоты образуется бензойная кислота:
5C6H5−CH3+6KMnO4+9H2SO4→5C6H5COOH+6MnSO4+3K2SO4+14H2O.
Химия, Биология, подготовка к ГИА и ЕГЭ
Химические свойства бензола
В лекции о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор…
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов. По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
Реакция галогенирования бензола (взаимодействие с бромом — качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + H2O
Химические свойства бензола — Алкилирование — получение гомологов бензола, алкилбензолов (катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
во-первых, гомологи бензола более ракционноспособны — легче вступают в реакции,
во-вторых, эти реакции идут немного по-другому:
Галогенирование алкилбензолов:
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
Химические свойства аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2 + :
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Бензол и его гомологи
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
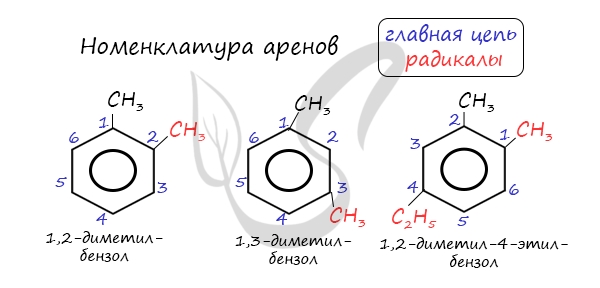
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
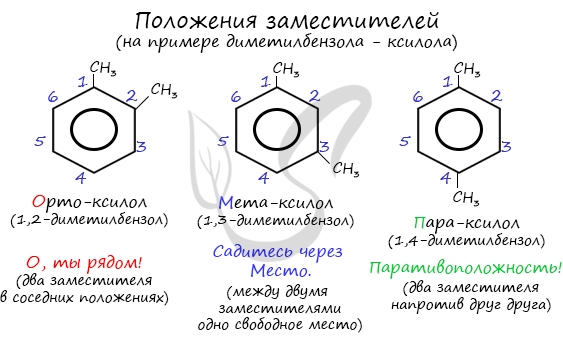
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
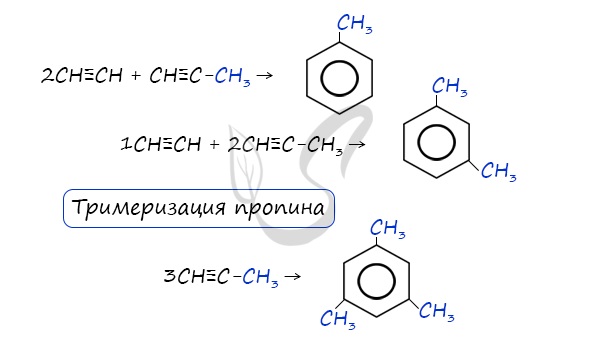
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
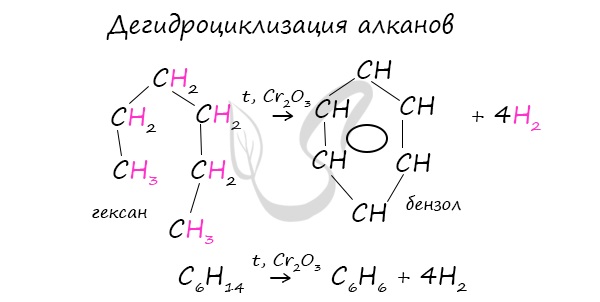
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
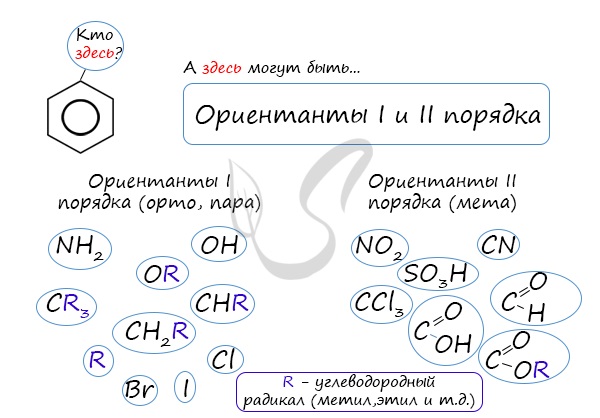
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
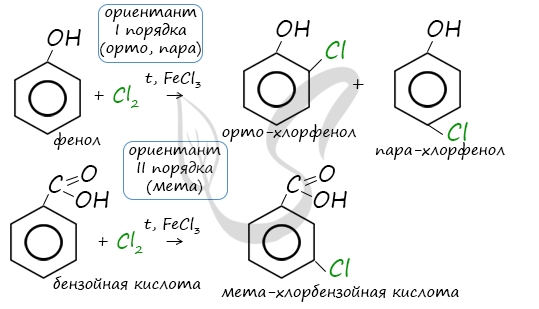
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
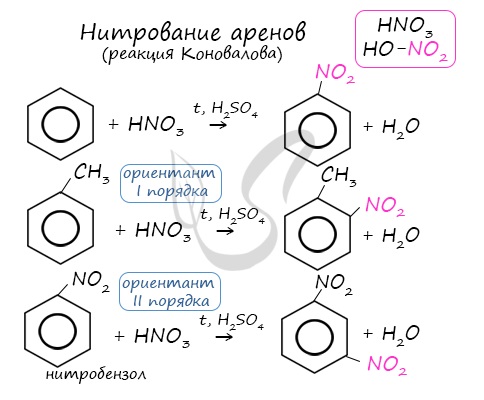
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
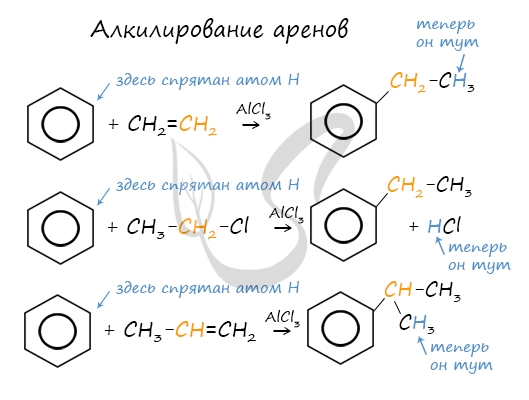
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
источники:
http://chemege.ru/ximicheskie-svojstva-areny/
http://studarium.ru/article/186
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
Это циклические углеводороды с тремя двойными сопряженными связями в цикле.
Бензол С6Н6 – родоначальник ароматических углеводородов. Впервые выделен Фарадеем в 1825г из светильного газа.
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 1200.
Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
р-Электроны всех атомов углерода образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между одинарной и двойной.

Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
Вещество
Название по номенклатуре
Историческое название
С6Н5-СН3
метилбензол
Толуол
С6Н5-СН2-СН3
этилбензол
—
СН3-С6Н4-СН3
диметилбензол
ксилол
С6Н5-СН(СН3)2
изопропилбензол
кумол

Для дизамещенных бензолов
R-C6H4-R’
используется также другой способ построения названий:
орто— (о-) заместители у соседних атомов углерода кольца, 1,2-;
мета— (м-) заместители через один атом углерода (1,3-);
пара-(п-) заместители на противоположных сторонах кольца(1,4-).
Изомерия у аренов.
Определяется числом заместителей, их расположением в бензольном кольце и возможностью изомерии углеродного скелета в заместителях, содержащих более трёх атомов углерода.

ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
1. Дегидрирование циклоалканов
2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора
3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом, с плотностью менее 1 г/мл. Огнеопасны. Нерастворимы в воде, но хорошо растворимы в неполярных растворителях. Бензол и толуол ядовиты (поражают почки, печень, костный мозг, кровь).
Высшие арены – твердые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за наличия делокализованой -системы арены мало характерны реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции электрофильного замещения атомов водорода, связанных с циклом — SЕ.
1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ К АРЕНАМ
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
а. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
б. Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан — «гексахлоран» (средство борьбы с вредными насекомыми).
2. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ АТОМОВ ВОДОРОДА В БОКОВОЙ ЦЕПИ:
В случае гомологов бензола при действии хлора на свету или при нагревании происходит реакция радикального замещения в боковой цепи:
3. Реакции окисления аренов
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи, при этом от боковой цепи остаётся карбоксильная группа, а остальное – переходит в углекислый газ:
5С6Н5—СН3 +6КМnO4+9H2SO4 5C6H5—COOH +6MnSO4+3K2SO4+14H2O
5С6Н5—CH2—CH3 +12КМnO4+18H2SO45C6H5—COOH +5СО2+12MnSO4+6K2SO4+28H2O
Если окисление идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты и карбонат калия:
С6Н5—СН2—СН3+4KMnO4C6H5 – COOK+K2CO3+4MnO2+KOH+2H2O
4.РЕАКЦИИ ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п.:
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов в присутствии катализаторов AlCl3, FeBr3или алкенов в присутствии фосфорной кислоты:
ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5-CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола, причём в орто- и пара- положениях:
ОРИЕНТИРУЮЩЕЕ ДЕЙСТВИЕ ЗАМЕСТИТЕЛЕЙ
В БЕНЗОЛЬНОМ КОЛЬЦЕ.
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные (первого рода) и электроноакцепторные (второго рода).
ЭЛЕКТРОНОДОНОРНЫЕ ЗАМЕСТИТЕЛИ проявляют повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:
Алкильные группы не могут участвовать в сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара— положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:
ЭЛЕКТРОНОАКЦЕПТОРНЫЕ ЗАМЕСТИТЕЛИ снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, но меньше всего она уменьшается в мета-положениях:
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
СТИРОЛ (винилбензол) С8Н8
– производное бензола, которое имеет в своём составе двойную связь в боковом заместителе, поэтому он НЕ относится к гомологическому ряду аренов.
Получение стирола:
-
Дегидрирование этилбензола: С6Н5-СН2-СН3 -(t,кат) C6H5—CH=CH2 + H2
-
Дегидрогалогенирование фенилбромэтана:
C6H5-CH-CH3 +KOH –(спирт) C6H5-CH=CH2 +KBr +H2O
│
Br
Свойства стирола:
Стирол проявляет свойства, характерные для алкенов – реакции присоединения, окисления, полимеризации.
Реакции присоединения к стиролу: протекают в соответствии с правилом Марковникова.
С6Н5-СН=СН2 +Н2О С6Н5-СН-СН3
│
ОН
Мягкое окисление стирола:
3С6Н5-СН=СН2 +2 KMnO4 + 4Н2О 3 С6Н5-СН-СН2 + 2MnO2 + 2KOH
│ │
OH OH фенилэтиленгликоль
Жесткое окисление стирола:
С6Н5-СН=СН2 + 2KMnO4 + 3Н2SO4 С6Н5-СOOН + CO2 + 2MnSO4 + K2SO4 + 4H2O
бензойная кислота
3С6Н5-СН=СН2 + 10KMnO4 —to 3С6Н5-СOOК + 3К2CO3 + 10MnO2 + KOH+ 4Н2О
бензоат калия
Полимеризация стирола: в результате получают полистирол.