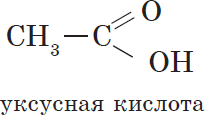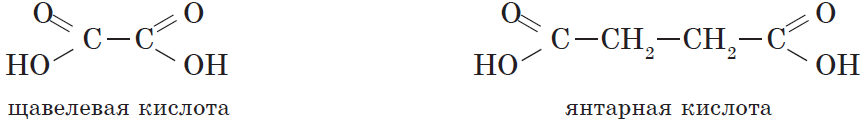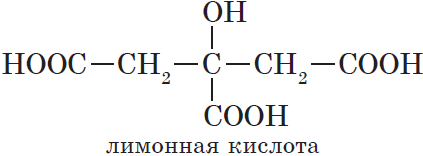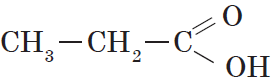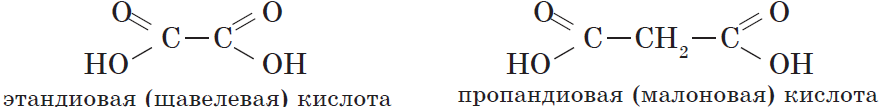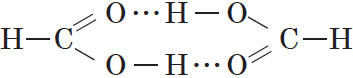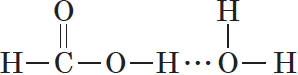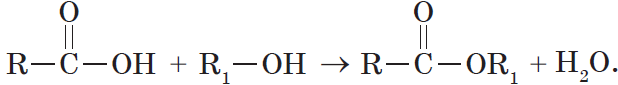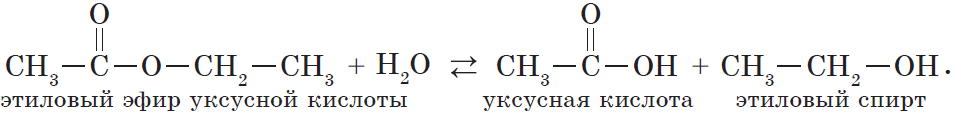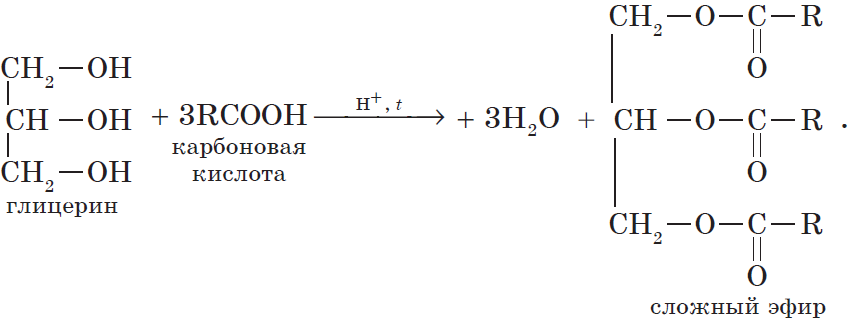Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Химические свойства карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
4.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
3CH2=CH-COOH + 2KMnO4 + 3H2O = 3CH2(OH)-CH(OH)-COOK + KOH + 2MnO2
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
Номенклатура и изомерия карбоновых кислот
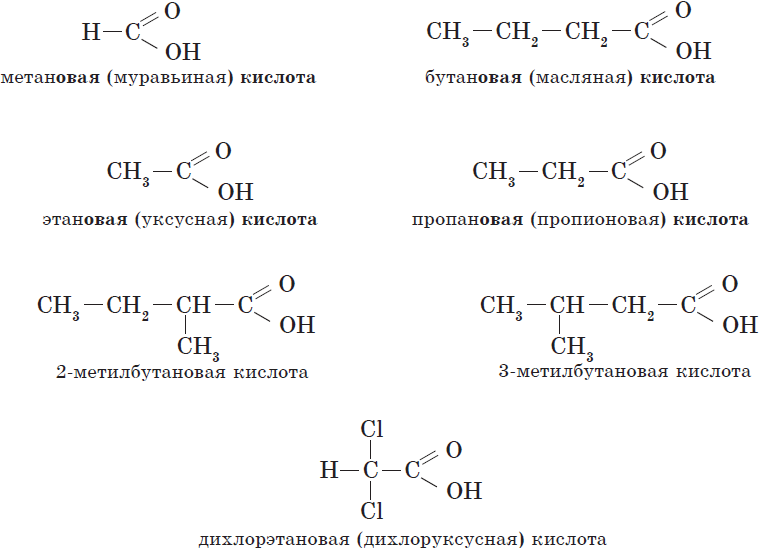
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.

Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)

Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 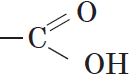
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
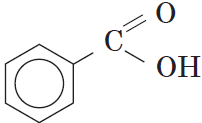
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 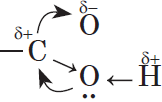
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{text»олеиновая кислота»}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{text»стеариновая кислота»}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{text»акриловая(пропеновая)кислота»}→{CH_2Br—CHBr—COOH}↙{text»2,3-дибромпропановая кислота»}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{text»хлоруксусная кислота»}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{text»дихлоруксусная кислота»}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{text»трихлоруксусная кислота»}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
КАРБОНОВЫЕ КИСЛОТЫ.
Карбоновыми
кислотами называются производные углеводородов, в молекуле которых содержится
одна или несколько карбоксильных групп
Общая формула предельных
одноосновных карбоновых кислот: СnH2nO2
Классификация карбоновых кислот.
1. По числу
карбоксильных групп:
— одноосновные (монокарбоновые)
— многоосновные (дикарбоновые, трикарбоновые и
т.д.).
- По характеру углеводородного радикала:
— предельные CH3-CH2-CH2-COOH;
бутановая кислота.
— непредельные CH2=CH-CH2-COOH;
бутен-3-овая кислота.
— ароматические
пара-метилбензойная
кислота
НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ.
|
Название |
Формула кислоты |
||
|
кислоты |
её соли и (эфиры) |
||
|
муравьиная |
метановая |
формиат |
HCOOH |
|
уксусная |
этановая |
ацетат |
CH3COOH |
|
пропионовая |
пропановая |
пропионат |
CH3CH2COOH |
|
масляная |
бутановая |
бутират |
CH3(CH2)2COOH |
|
валериановая |
пентановая |
валерат |
CH3(CH2)3COOH |
|
капроновая |
гексановая |
гексанат |
CH3(CH2)4COOH |
|
пальмитиновая |
гексадекановая |
пальмитат |
С15Н31СООН |
|
стеариновая |
октадекановая |
стеарат |
С17Н35СООН |
|
акриловая |
пропеновая |
акрилат |
CH2=CH–COOH |
|
олеиновая |
цис-9-октадеценовая |
олеат |
СН3(СН2)7СН=СН(СН2)7СООН |
|
бензойная |
бензойная |
бензоат |
C6H5 -COOH |
|
щавелевая |
этандиовая |
оксалат |
НООС — COOH |
ИЗОМЕРИЯ
КАРБОНОВЫХ КИСЛОТ.
1. Изомерия
углеродной цепи. Начинается с бутановой кислоты (С3Н7СООН), которая существует в виде
двух изомеров: масляной (бутановой) и изомасляной (2-метилпропановой)
кислот.
2. Изомерия
положения кратной связи в непредельных кислотах, например:
СН2=СН—СН2—СООН
СН3—СН=СН—СООН
Бутен-3-овая кислота
Бутен-2-овая кислота
(винилуксусная кислота)
(кротоновая кислота)
3. Цис-,
транс-изомерия в непредельных кислотах, например:
4. Межклассовая
изомерия: Карбоновые кислоты изомерны сложным
эфирам:
Уксусная кислота СН3-СООН
и метилформиат Н-СООСН3
5. Изомерия положения функциональных групп у гетерофункционалъных
кислот.
Например,
существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и
4-хлорбутановая.
СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ.

группа сочетает в себе две функциональные группы – карбонил и гидроксил,
взаимно влияющие друг на друга
Кислотные
свойства карбоновых кислот обусловлены смещением электронной плотности к
карбонильному кислороду и вызванной этим дополнительной (по сравнению со
спиртами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты
диссоциируют на ионы:
Растворимость в воде и высокие температуры
кипения кислот обусловлены образованием межмолекулярных водородных
связей. С увеличением молекулярной массы растворимость кислот в воде
уменьшается.
ПРОИЗВОДНЫЕ
КАРБОНОВЫХ КИСЛОТ – в них
гидроксогруппа замещена на некоторые другие группы. Все они при гидролизе
образуют карбоновые кислоты.
|
Соли |
Сложные эфиры |
Галогенангидриды |
Ангидриды |
Амиды. |
|
|
|
|
|
|
ПОЛУЧЕНИЕ
КАРБОНОВЫХ КИСЛОТ.
|
1. Окисление |
|
|
2.Окисление |
|
|
3. Щелочной |
R-CCl3 + 3NaOH à [R-C(OH)3] неустойчивое [R—C(OH)3] à RCOOH + H2O |
|
4. Гидролиз сложных |
R-COOR1 + KOH à RCOOK + HCl à |
|
5. Гидролиз |
1)нитрил: R—CN + 2H2O –(H+)à 2)ангидрид: (R—COO)2O + H2O 3)натриевая соль: R—COONa+HClàR—COOH + NaCl |
|
6. Взаимодействие |
R-MgBr + CO2 à R-COO-MgBr -(+H2O)à R-COOH +Mg(OH)Br |
|
7. Муравьиную кислоту получают нагреванием оксида углерода (II) с гидроксидом натрия |
NaOH + CO –(200oC,p)à HCOONa 2HCOONa+ H2SO4à2HCOOH + Na2SO4 |
|
8. Уксусную кислоту получают каталитическим окислением |
2C4H10 + 5O2 à 4CH3-COOH + 2H2O |
|
9. Для получения бензойной |
5C6H5–CH3+6KMnO4+9H2SO4à5C6H5-COOH+3K2SO4 |
ХИМИЧЕСКИЕ
СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1. Кислотные свойства
– замещение атома Н в карбоксильной группе на металл или ион аммония.
|
1.Взаимодействие с металлами |
2CH3COOH+Ca à(CH3COO)2Ca+H2 ацетат кальция |
|
2.Взаимодействие с оксидами металлов |
2CH3COOH+BaO à(CH3COO)2Ba+H2O |
|
3.Реакция нейтрализации с гидроксидами |
2CH3COOH+Cu(OH)2 |
|
4.Взаимодействие с солями более слабых и |
2CH3COOH+CaCO3 |
|
4*. Качественная В 2CH3COOH+Na2CO3 à |
|
|
2. Замещение |
|
|
5.Реакция этерификации |
|
|
6.Образование галоген-ангидридов – с |
|
|
7. Образование амидов: |
|
|
8. Получение ангидридов. |
С помощью Р2О5 2СН3 – СООН + |
|
3. Замещение атома |
|
|
9.Галогенирование |
CH3-COOH+Br2 –(Ркр)à |
|
Особенности |
|
|
1. Разложение при |
Н—СООН –(H2SO4конц,t)à CO + H2O |
|
2. Реакция |
Н-COOH+2[Ag(NH3)2]OHà(NH4)2СО3+2Ag+2NH3+H2O H-COOH + Cu(OH)2 |
|
3. Окисление хлором |
H-COOH + Cl2 à |
|
Особенности бензойной |
|
|
1. Разложение при |
-(t)à + CO2 |
|
2. Реакции |
+ HNO3 –(H2SO4)à +H2O |
|
Особенности щавелевой |
|
|
1. Разложение при |
|
|
2. Окисление |
|
|
Особенности |
|
|
1. Реакции |
Присоединение воды и бромоводорода к СН2=СН—СООН + НBr à Также к непредельным кислотам можно С17Н33-СООН+H2à C17H35—COOH(стеариновая) |
|
2. Реакции |
При мягком окислении акриловой кислоты 3СН2=СН-СООН+2KMnO4+2H2O |
Свойства
солей карбоновых кислот.
|
1. Обменные реакции с более |
CH3-COONa + HCl à (CH3-COO)2Cu |
|
2. Термическое |
(CH3-COO)2Ca ǁ |
|
3. Сплавление солей |
CH3-COONa + NaOH -(t)à |
|
4. Электролиз водных |
2CH3—COONa +2Н2О -(эл.ток)à à C2H6 +2CO2 анод |
Свойства
галогенангидридов
|
1. Гидролиз – получается |
CH3-COCl + H2O |
|
2. Реакции ацилирования |
|
|
3. Получение амидов и |
CH3-COCl + NH3 С6Н5—ОNa+ C2H5-C=O -(t)à NaCl + C6H5-O-C=O Cl C2H5 |
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 456 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Верны ли следующие утверждения о свойствах карбоновых кислот?
А. Карбоновые кислоты образуются при окислении первичных спиртов и альдегидов.
Б. Для карбоновых кислот характерна реакция гидролиза.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о свойствах альдегидов и карбоновых кислот?
А. Альдегиды вступают как в реакции окисления, так и в реакции восстановления.
Б. При взаимодействии карбоновых кислот со спиртами образуются сложные эфиры.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Из предложенного перечня выберите все органические соединения, свойства которых способна проявлять муравьиная кислота.
1) алкан
2) спирт
3) карбоновая кислота
4) альдегид
5) алкен
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Задания Д19 № 566
Для насыщенных карбоновых кислот характерна (ы):
1) реакции со спиртами
2) реакции с металлами, стоящими левее водорода в ряду напряжений металлов
3) реакция с перманганатом натрия
4) реакция с гидроксидом калия
5) реакции с металлами, стоящими правее водорода в ряду напряжений металлов
6) реакция с бромной водой
Верны ли следующие суждения о свойствах альдегидов?
А. При окислении альдегиды превращаются в карбоновые кислоты.
Б. Альдегиды вступают в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Из предложенного перечня выберите все вещества, реагирующие с карбоновыми кислотами, но не реагирующие со спиртами.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210302.
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в кислой среде образуется карбоновая кислота.
1) гексен-1
2) бензол
3) метилбензол
4) метилэтиловый эфир
5) уксусный альдегид
Запишите номера выбранных ответов.
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2023 по химии
Верны ли следующие суждения о свойствах предельных карбоновых кислот.
А. Все кислоты являются жидкостями при нормальных условиях.
Б. При взаимодействии со спиртами образуют сложные эфиры.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Для пропаналя характерна(-о):
1) sр-гибридизация атомов углерода
2) изменение окраски индикатора
3) восстановительные свойства
4) взаимодействие с гидроксидом меди (II)
5) взаимодействие с аммиачным раствором оксида серебра (I)
6) взаимодействие с карбоновыми кислотами
Задания Д19 № 738
Муравьиная кислота взаимодействует с
1) оксидом кремния (IV)
2) углеродом
3) карбонатом натрия
4) хлороводородом
5) этанолом
6) оксидом серебра (аммиачный раствор)
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензойная кислота и раствор гидроксида натрия
Б) бензойная кислота и избыток твёрдого гидроксида натрия (при нагревании)
В) бензойная кислота и этанол (в присутствии серной кислоты)
Г) бензойная кислота и азотная кислота (в присутствии серной кислоты)
ОРГАНИЧЕСКИЙ ПРОДУКТ
РЕАКЦИИ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этилат натрия и вода
Б) этанол и бромоводород
В) уксусная кислота и натрий
Г) уксусная кислота и бром
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бромуксусная кислота
2) формиат натрия
3) этанол
4) бромэтан
5) бромацетат
6) ацетат натрия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) уксусная кислота и этанол
Б) уксусная кислота и гидроксид меди (II)
В) уксусная кислота и карбонат натрия
Г) уксусная кислота и хлорангидрид уксусной кислоты
ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ
1) уксусный ангидрид
2) этилат натрия
3) ацетат натрия
4) ацетат меди (II)
5) этилацетат
6) этаналь
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Задания Д19 № 437
Муравьиная кислота взаимодействует с
1) оксидом углерода (IV)
2) азотом
3) карбонатом кальция
4) хлороводородом
5) пропанолом-1
6) оксидом серебра (аммиачный раствор)
Задания Д19 № 867
Муравьиная кислота взаимодействует с
1) оксидом кремния (IV)
2) углеродом
3) карбонатом натрия
4) хлороводородом
5) этанолом
6) оксидом серебра (аммиачный раствор)
Муравьиная кислота взаимодействует с
1) оксидом азота (II)
2) серой
3) аммиаком
4) хлоридом алюминия
5) водородом
6) гидроксидом меди (II)
Установите соответствие между реагирующими веществами и углеродосодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди
2) гликолят меди
3) формиат меди
4) фенолформальдегидная смола
5) муравьиная кислота
6) фенол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Из предложенного перечня выберите все вещества, которые образуются при окислении ацетальдегида в кислой среде.
1) этилен
2) ацетат натрия
3) уксусная кислота
4) вода
5) этиловый спирт
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми взаимодействует муравьиная кислота.
1) хлорид натрия
2) карбонат калия
3) гидросульфат натрия
4) аммиачный раствор оксида серебра
5) оксид азота (II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, которые реагируют с бромной водой.
1) пропанол-1
2) ацетон
3) этаналь
4) диметиловый эфир
5) пропионовая кислота
Запишите номера выбранных ответов в порядке возрастания.
Всего: 456 1–20 | 21–40 | 41–60 | 61–80 …
КАРБОНОВЫЕ КИСЛОТЫ.
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ.
1. По числу карбоксильных групп:
— одноосновные (монокарбоновые)
— многоосновные (дикарбоновые, трикарбоновые и т.д.).
- По характеру углеводородного радикала:
— предельные CH3-CH2-CH2-COOH; бутановая кислота.
— непредельные CH2=CH-CH2-COOH; бутен-3-овая кислота.
— ароматические
пара-метилбензойная кислота
НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ.
|
Название |
Формула кислоты |
||
|
кислоты |
её соли и (эфиры) |
||
|
муравьиная |
метановая |
формиат |
HCOOH |
|
уксусная |
этановая |
ацетат |
CH3COOH |
|
пропионовая |
пропановая |
пропионат |
CH3CH2COOH |
|
масляная |
бутановая |
бутират |
CH3(CH2)2COOH |
|
валериановая |
пентановая |
валерат |
CH3(CH2)3COOH |
|
капроновая |
гексановая |
гексанат |
CH3(CH2)4COOH |
|
пальмитиновая |
гексадекановая |
пальмитат |
С15Н31СООН |
|
стеариновая |
октадекановая |
стеарат |
С17Н35СООН |
|
акриловая |
пропеновая |
акрилат |
CH2=CH–COOH |
|
олеиновая |
цис-9-октадеценовая |
олеат |
СН3(СН2)7СН=СН(СН2)7СООН |
|
бензойная |
бензойная |
бензоат |
C6H5 -COOH |
|
щавелевая |
этандиовая |
оксалат |
НООС — COOH |
ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ.
1. Изомерия углеродной цепи. Начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров: масляной (бутановой) и изомасляной (2-метилпропановой) кислот.
2. Изомерия положения кратной связи в непредельных кислотах, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия в непредельных кислотах, например:
4. Межклассовая изомерия: Карбоновые кислоты изомерны сложным эфирам:
Уксусная кислота СН3-СООН и метилформиат Н-СООСН3
5. Изомерия положения функциональных групп у гетерофункционалъных кислот.
Например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая.
СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ – в них гидроксогруппа замещена на некоторые другие группы. Все они при гидролизе образуют карбоновые кислоты.
|
Соли |
Сложные эфиры |
Галогенангидриды |
Ангидриды |
Амиды. |
|
|
|
|
|
|
ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ.
|
1. Окисление спиртов в жестких условиях – раствором перманганата или дихромата калия в кислой среде при нагревании. |
|
|
2.Окисление альдегидов: раствором перманганата или дихромата калия в кислой среде при нагревании, реакцией серебряного зеркала, гидроксидом меди при нагревании. |
|
|
3. Щелочной гидролиз трихлоридов: |
R-CCl3 + 3NaOH 🡪 [R-C(OH)3] + 3NaCl неустойчивое вещество [R-C(OH)3] 🡪 RCOOH + H2O |
|
4. Гидролиз сложных эфиров. |
R-COOR1 + KOH 🡪 RCOOK + R1OH RCOOK + HCl 🡪 R-COOH + KCl |
|
5. Гидролиз нитрилов, ангидридов, солей. |
1)нитрил: R-CN + 2H2O –(H+)🡪 RCOOH 2)ангидрид: (R-COO)2O + H2O 🡪 2RCOOH 3)натриевая соль: R-COONa+HCl🡪R-COOH + NaCl |
|
6. Взаимодействие реактива Гриньяра с СО2: |
R-MgBr + CO2 🡪 R-COO-MgBr R-COO-MgBr -(+H2O)🡪 R-COOH +Mg(OH)Br |
|
7. Муравьиную кислоту получают нагреванием оксида углерода (II) с гидроксидом натрия под давлением: |
NaOH + CO –(200oC,p)🡪 HCOONa 2HCOONa+ H2SO4🡪2HCOOH + Na2SO4 |
|
8. Уксусную кислоту получают каталитическим окислением бутана: |
2C4H10 + 5O2 🡪 4CH3-COOH + 2H2O |
|
9. Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия: |
5C6H5–CH3+6KMnO4+9H2SO4🡪5C6H5-COOH+3K2SO4 + MnSO4 + 14H2O |
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1. Кислотные свойства – замещение атома Н в карбоксильной группе на металл или ион аммония.
|
1.Взаимодействие с металлами |
2CH3COOH+Ca 🡪(CH3COO)2Ca+H2 ацетат кальция |
|
2.Взаимодействие с оксидами металлов |
2CH3COOH+BaO 🡪(CH3COO)2Ba+H2O |
|
3.Реакция нейтрализации с гидроксидами металлов |
2CH3COOH+Cu(OH)2 🡪 (CH3COO)2Cu + 2H2O |
|
4.Взаимодействие с солями более слабых и летучих (или нерастворимых) кислот |
2CH3COOH+CaCO3 🡪 (CH3COO)2Ca + H2O + CO2 |
|
4*. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими карбонатами и гидрокарбонатами. В результате наблюдается выделение углекислого газа. 2CH3COOH+Na2CO3 🡪 2CH3COONa+H2O+CO2↑ |
|
|
2. Замещение гидроксильной группы: |
|
|
5.Реакция этерификации |
|
|
6.Образование галоген-ангидридов – с помощью хлоридов фосфора (III) и (V). |
|
|
7. Образование амидов: |
|
|
8. Получение ангидридов. |
С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид. 2СН3 – СООН + Р2О5 🡪 (СН3СО)2О + НРО3 |
|
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе ( α-углеродный атом) |
|
|
9.Галогенирование кислот – реакция идёт в присутствии красного фосфора или на свету. |
CH3-COOH+Br2 –(Ркр)🡪 CH2-COOH + НВr ⎮ Br |
|
Особенности муравьиной кислоты. |
|
|
1. Разложение при нагревании. |
Н-СООН –(H2SO4конц,t)🡪 CO + H2O |
|
2. Реакция серебряного зеркала и с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов. |
Н-COOH+2[Ag(NH3)2]OH🡪(NH4)2СО3+2Ag+2NH3+H2O H-COOH + Cu(OH)2 –t🡪 CO2 + Cu2O + H2O |
|
3. Окисление хлором и бромом, а также азотной кислотой. |
H-COOH + Cl2 🡪 CO2 + 2HCl |
|
Особенности бензойной кислоты. |
|
|
1. Разложение при нагревании – декарбоксилирование. |
При нагревании бензойной кислоты она разлагается на бензол и углекислый газ: -(t)🡪 + CO2 |
|
2. Реакции замещения в ароматическом кольце. |
Карбоксильная группа является электроноакцепторной, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. + HNO3 –(H2SO4)🡪 +H2O |
|
Особенности щавелевой кислоты. |
|
|
1. Разложение при нагревании |
|
|
2. Окисление перманганатом калия. |
|
|
Особенности непредельных кислот (акриловой и олеиновой). |
|
|
1. Реакции присоединения. |
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной: СН2=СН-СООН + НBr 🡪 Br-CH2-CH2-COOH Также к непредельным кислотам можно присоединять галогены и водород: С17Н33-СООН+H2🡪 C17H35-COOH(стеариновая) |
|
2. Реакции окисления |
При мягком окислении акриловой кислоты образуется 2 гидроксогруппы: 3СН2=СН-СООН+2KMnO4+2H2O 🡪2CH2(OH)-CH(OH)-COOК + CH2(OH)-CH(OH)-COOH +2MnO2 |
Свойства солей карбоновых кислот.
|
1. Обменные реакции с более сильными кислотами и со щелочами. |
CH3-COONa + HCl 🡪 CH3-COOH + NaCl (CH3-COO)2Cu + KOH 🡪 Cu(OH)2 ↓+ CH3COOK |
|
2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария)- образуются кетоны. |
(CH3-COO)2Ca -(t)🡪 CaCO3 + CH3-C-CH3 ǁ O |
|
3. Сплавление солей щелочных металлов со щелочью (реакция Дюма)- получаются алканы. |
CH3-COONa + NaOH -(t)🡪 CH4 + Na2CO3 |
|
4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе). |
2CH3-COONa +2Н2О -(эл.ток)🡪 🡪 C2H6 +2CO2 + H2+2NaOH анод катод |
Свойства галогенангидридов
|
1. Гидролиз – получается кислота. |
CH3-COCl + H2O 🡪 CH3-COOH + HCl |
|
2. Реакции ацилирования бензола, аминов, солей фенола. |
CH3-COCl+ -(AlCl3)🡪HCl+ |
|
3. Получение амидов и сложных эфиров |
CH3-COCl + NH3 🡪 CH3-CONH2 + NH4Cl С6Н5-ОNa+ C2H5-C=O -(t)🡪 NaCl + C6H5-O-C=O
Cl C2H5 |