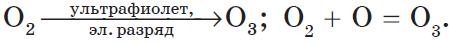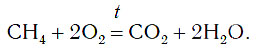1. Положение кислорода в периодической системе химических элементов
2. Электронное строение кислорода
3. Физические свойства кислорода и нахождение в природе
4. Способы получения кислорода
5. Химические свойства кислорода
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с металлами
5.1.6. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
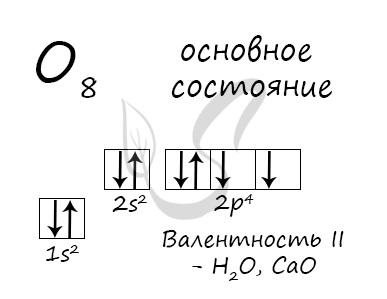
Электронная конфигурация кислорода в основном состоянии:
+8O 1s22s22p4 1s 2s
2p
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183оС.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение бертолетовой соли в присутствии катализатора MnO2:
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O + O2
2HgO → 2Hg + O2
2KNO3 → 2KNO2 + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Соединения кислорода:
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2
Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O
Оксиды металлов и неметаллов Na2O, SO2 и др. Кислородсодержащие кислоты Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
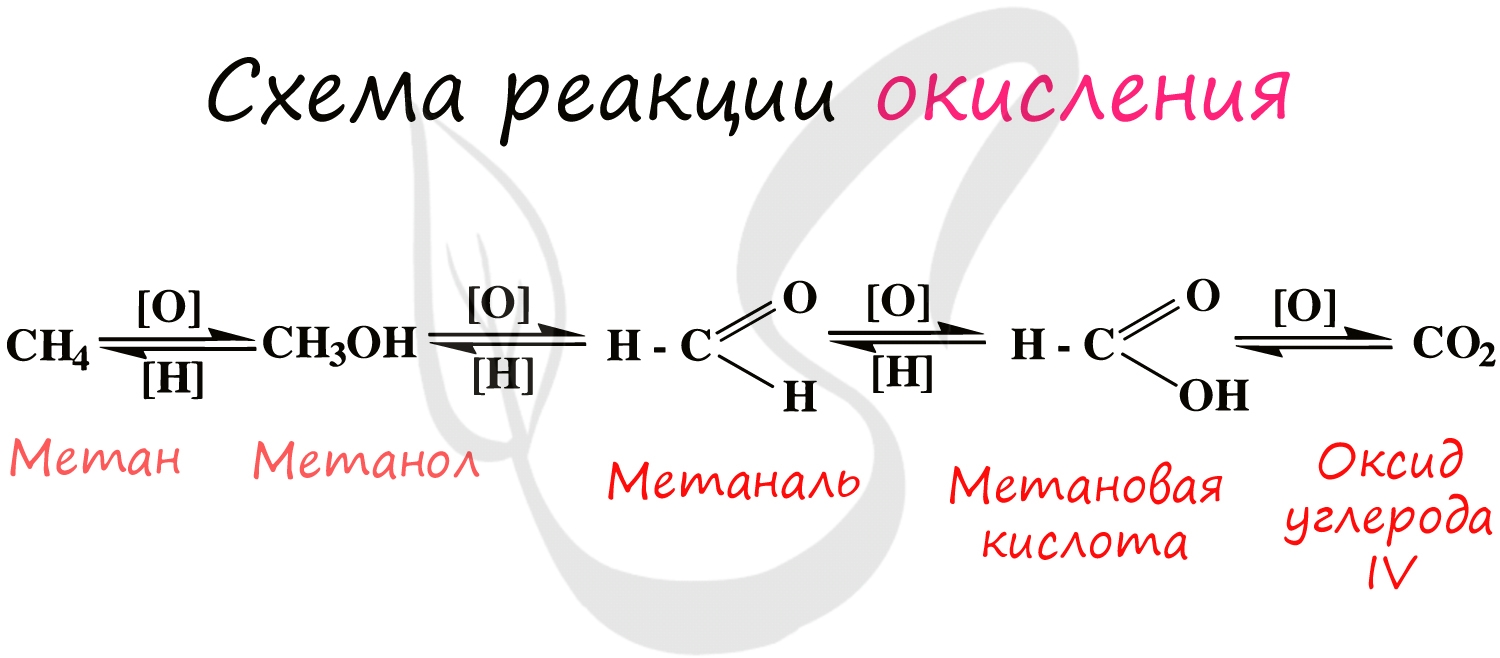
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 + O2 → 2CH3-CH=O
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
2.3.2. Химические свойства кислорода и серы.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
PbS + 4O3 = PbSO4 + 4O2
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
2Ag + O3 = Ag2O + O2
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична:  Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
…
К элементам главной подгруппы VI группы периодической таблицы Менделеева относятся:
- Кислород O
- Сера S
- Селен Se
- Теллур Te
- Полоний Po
Общая характеристика элементов 6 группы главной подгруппы
От O к Po (сверху вниз в
периодической таблице)
Увеличивается
- атомного радиуса,
- металлических, основных,
восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации
у данных элементов схожи, все они содержат 6 электронов на внешнем слое ns2np4:
O – 2s2 2p4;
S – 3s23p4;
Se – 4s2 4p4;
Te – 5s2 5p4;
Po – 6s2 6p4
Электронное строение кислорода и серы
Нахождение в природе кислорода и серы
Кислород занимает первое место среди элементов по
распространенности в земной коре. Содержится
он главным образом в силикатах и составляет около 47 % массы твёрдой земной
коры. В больших количествах связанного кислорода содержится в воде — 85,82 % по
массе. Также кислород содержится более, чем в 1500 соединений земной коры. В атмосфере доля свободного кислорода
составляет 20,95 % по объёму и 23,10 % по массе.
Сера встречается в виде самородной серы, сульфатов (CaSO4∙2H2O, CaSO4∙H2O, Na2SO4∙10H2O, MgSO4∙7H2O), сульфидов (FeS2, CuS, CuFeS2, PbS, ZnS, HgS) и в промышленных газах.
Самородная сера встречается в местах
вулканической активности совместно с сернистыми фумаролами и сернистыми водами
(с содержанием > 25 %).
Аллотропные модификации серы
Кислород
Способы получения кислорода
В
природе
Кислород образуется в процессе фотосинтеза:
mCО2 + nH2O → mO2 + Сm(H2O)n
Промышленный способ
- Разделение жидкого воздуха на О2 и N2 (ректификация);
- электролиз воды:
2H2O → 2Н2↑ + О2↑
Лабораторный
способ
- термическое окислительно-восстановительное разложение солей:
2КСlO3 = 3О2↑ + 2KCI
2КМпO4 = О2↑ + МпО2 + К2МпО4↑
2KNO3 = О2↑ + 2KNО2
2Cu(NO3)O2 = О2↑ + 4NО2↑ + 2CuO
2AgNO3 = О2↑ + 2NО2↑ +2Ag
2H2O2 = 2H2O + O2 (kt — MnO2)
2HgO = 2Hg + O2
- Для автономного дыхания кислород получают в герметически замкнутых помещениях и в аппаратах при помощи реакции:
2Na2O2 + 2СO2 = О2↑ + 2Na2CO3
Физические свойства кислорода
При обычных условиях молекулярный кислород O2 – это малорастворимый в воде газ без цвета, запаха
и вкуса.
При сильном охлаждении под давлением переходит в бледно — голубую жидкость с Ткип = — 183°С. При Т = -219°С образует сине — голубые кристаллы.
Химические свойства кислорода
Кислород — сильный окислитель, уступающий по химической активности только фтору.
Вступает во
взаимодействия со всеми элементами, кроме инертных газов (Не, Ne и Аг). Со
многими простыми веществами реагирует непосредственно при обычных условиях или
при нагревании или в присутствии катализаторов (кроме Au, Pt, Hal2, благородные газы).
Большинство реакций с участием О2 экзотермичны, часто часто сопровождаются горением, иногда — взрывом.
Взаимодействие с простыми веществами
С металлами
- Кислород взаимодействует с металлами, с образованием оксидов металлов:
Me + О2 = МеxOy оксиды
- С щелочными металлами в результате реакций образуются различные кислородсодержащие продукты:
4Li + О2 = 2Li2O оксид лития
2Na + О2 = Na2О2 пероксид натрия
К + О2 = КО2 супероксид калия
- С железом образуется смесь оксидов:
3Fe + 2O2 =
Fe3O4 (Fe2O3*FeO)
- С марганцем образуется диоксид марганца:
Mn + O2 = MnO2
С неметаллами
При
взаимодействии с неметаллами (кроме фтора и инертных газов) образуются оксиды,
со степенью окисления кислорода – 2:
Si + O2 = SiO2 (t=400-5000С)
С + О2(изб) = СО2; С + О2(нед) =
СО
N2 +О2 = 2NO — Q
S + О2 = SО2;
4Р + 5О2 = 2Р2О5
Окисление сложных веществ
Горение сульфидов
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Горение водородных соединений
4HI + О2 = 2I2 + 2Н2O
2H2S + 3O2 = 2SO2 +
2H2O
CH4 +
2O2 = CO2 + 2H2O
Окисление
оксидов
Кислород окисляет
входящие в оксид элементы до более высокой степени окисления:
4FeO + О2 = 2Fe2О3
2SО2 + О2 = 2SО3
4NО2 + О2 + 2H2O = 4HNО3
Окисление гидроксидов и солей
Окисление гидроксидов и солей в водных растворах происходит, если исходное вещество неустойчиво на воздухе:
2HNO2 + O2 = 2HNO3
4Fe(OH)2 + O2 + 2H2O
= 4Fe(OH)3
Окисление аммиака
В отсутствие катализатора при окислении аммиака кислородом образуется азот, а в присутствии катализатора — оксида азота(II):
4NH3 + 3О2 =2N2 + 6Н2O
4NH3 + 5О2 = 4NO + 6Н2O
Окисление
фосфина
На
воздухе самопроизвольно воспламеняется:
2PH3 + 4О2 = P2О5 + 3Н2O
Окисление
силана
На воздухе он самовоспламеняется (часто
со взрывом) с образованием SiO2 и H2O:
SiH4 + 2О2 = SiО2 + 2Н2O
Окисление органических веществ
- Все органические соединения горят, окисляясь кислородом воздуха полностью:
CxHy + О2 = CО2 + Н2O
Продукты
окисления различных элементов, входящих в молекулы органических соединений:
С → CO2
Н → Н2O
Hal → Hal2
N → N2
P → P2O5
S → SO2
Например:
2C2H5 + 4О2 = 4CО2 + 5Н2O
C2H5Сl + 3О2 = 2CО2 + 2Н2O + HCl
2C2H5NH2 + 8,5О2 = 4CО2 + 7Н2O + N2
Кроме горения возможны также реакции неполного окисления:
- каталитическое окисление алканов, с образованием спиртов или кислот:
СН3-СН2-СН2-СН3 + 3O2 → 2СН3-СOOH + 2H2O
- каталитическое окисление алкенов, с образованием окиси этилена:
- окисление первичных спиртов до альдегидов, вторичных – до кетонов:
- окисление альдегидов до кислот:
Сера
Способы получения серы
Промышленный способ
- Извлечение самородной серы из ее месторождений или
вулканов - Получение серы из серной руды с помощью пароводяного,
фильтрационного, термического, центрифугального и экстракционного методов. - Переработка природных газов, содержащих H2S и их окисление при недостатке О2.
Лабораторный
способ
- Взаимодействие SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
- Неполное окисление сероводорода:
2H2S + SO2 → 3S + 2H2O
Физические свойства серы
Сера — твердое хрупкое
вещество желтого цвета. Не смачивается водой и практически нерастворимо в ней.
Имеет несколько аллотропных модификаций. См. аллотропные модификации серы.
Химические свойства серы
При
обычных температуре и давлении химическая активность серы небольшая. При
нагревании сера довольно активна, и проявляет свойства как окислителя, так и восстановителя.
Свойства окислителя сера проявляет при взаимодействии с элементами, расположенными ниже и левее в Периодической системе, а свойства восстановителя — с элементами, расположенными выше и правее в Периодической системе.
Непосредственно сера не взаимодействует с азотом и йодом.
Взаимодействие с простыми веществами
С
кислородом
Горение серы на воздухе с образованием оксида серы (IV):
S + O2 → SO2
В присутствии
катализаторов:
2S + 3O2 = 2SO3
С водородом
С водородом сера вступает
в реакцию при нагревании, образуя сероводород:
S + H2 → H2S
С
галогенами
При
взаимодействии со всеми галогенами, кроме йода образуются галогениды:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
С
фосфором
Взаимодействие серы с фосфором приводит к образованию сульфидов фосфора
2P + 3S → P2S3
2P + 5S → P2S5
С углеродом
В реакции серы с углеродом образуется сероуглерод:
2S + C → CS2
С металлами
При
взаимодействии с металлами сера выступает
в качестве окислителя, образуя сульфиды.
Щелочные металлы реагируют с серой без нагревания, остальные металлы (кроме золота Au и платины Pt) –при нагревании:
S + Fe → FeS
S + Hg → HgS
3S + 2Al → Al2S3
S + Сu = CuS
S + 2Ag = Ag2S
Взаимодействие со сложными веществами
С водой
Сера вступает в реакцию диспропорционирования
с перегретым паром:
S + H2O (пар) → 2H2S + SO2
С окислителями
В реакциях с окислителями сера окисляется до оксида серы (IV) SO2 или до серной кислоты H2SO4 при протекании реакции в растворе:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) → H2SO4 + 6NO2↑ + 2H2O
S + 2H2SO4(конц.)→ 3SO2↑ + 2H2O
S + 2KClO3 → 3SO2↑ + 2KCl
S + К2Сr2O7 = Сr2O3 + K2SO4
S + Na2SO3 → Na2S2O3
С щелочами
При взаимодействии с щелочами сера диспропорционирует до сульфита и сульфида:
S + NaOH → Na2SO3 + Na2S + H2O
Кислород: химические свойства
Ключевые слова конспекта: химические свойства простых веществ-неметаллов, характеристика элемента? простое вещество — кислород O2, получение кислорода.
Характеристика элемента кислорода
Кислород О – элемент № 8, 2-й период, VIA группа. Электронная конфигурация атома кислорода 1s22s22p4.
Валентные возможности кислорода – II и III (с учётом возможности образования связи по донорно–акцепторному механизму, например в ионе гидроксония Н3О+). Возможные степени окисления кислорода:
+2 – в соединении со фтором OF2;
+1 – в соединении со фтором О2F2;
0 – в простых веществах O2 (кислород), O3 (озон);
–1 – в пероксидах (Н2O2, Na2O2);
–2 – во всех остальных соединениях кислорода (кроме супероксидов).
Кислород – самый распространённый элемент в земной коре. Кислороду присуща аллотропия, элемент кислород образует два простых вещества – киcлород O2 и озон O3.
Кислород – простое вещество O2
Кислород является молекулярным веществом, молекула двухатомна. В молекуле кислорода связь ковалентная неполярная.
При обычных условиях кислoрoд – газ без цвета и запаха, тяжелее воздуха, плохо растворим в воде (несколько лучше, чем азот). В жидком состоянии кислород светло-голубого, в твёрдом – синего цвета.
Кислород является хорошим окислителем. Реагирует практически со всеми простыми веществами (кроме инертных газов, галогенов, благородных металлов). Так, например, киcлород окисляет металлы:
O2 + 2Zn = 2ZnO
3O2 + 4Al = 2Al2O3
O2 + 2Cu = 2CuO
2O2 + 3Fe = Fe3O4
Кислорoд является также окислителем многих неметаллов. В некоторых случаях, для того чтобы началась реакция, требуется нагревание:
O2 + C = CO2
O2 + S = SO2
5O2 + 4Р = 2Р2O5
O2 + 2Н2 = 2Н2O
Кислoрод реагирует с азотом в электрической дуге (реакция обратима, идёт с небольшим выходом NO):
В кислороде сгорают многие горючие вещества, практически все органические вещества:
2O2 + СН4 = СO2 + 2Н20
2Н2S + 3O2 = 2SO2 + 2Н20
Кислoрoд окисляет многие сложные вещества – как неорганические, так и органические:
O2 + 4Fe(OH)2 + 2Н20 = 4Fe(OH)3
O2 + 2СН3СНО = СН3СООН.
В промышленности кислород получают перегонкой воздуха. Способ основан на том, что у азота и кислорода разные температуры кипения. В лаборатории киcлорoд получают:
а) электролизом воды:
б) разложением пероксида водорода под действием катализатора:
в) разложением перманганата калия при нагревании:
г) разложением хлората калия (бертолетовой соли) при нагревании:
д) разложением нитратов щелочных металлов при нагревании:
Вся информация о кислороде в одной таблице
Конспект урока «Кислород: химические свойства».
Следующая тема: «».
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Содержание
- Физические свойства
- Химические свойства
- Реакции горения
- Горение веществ на воздухе и в кислороде
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
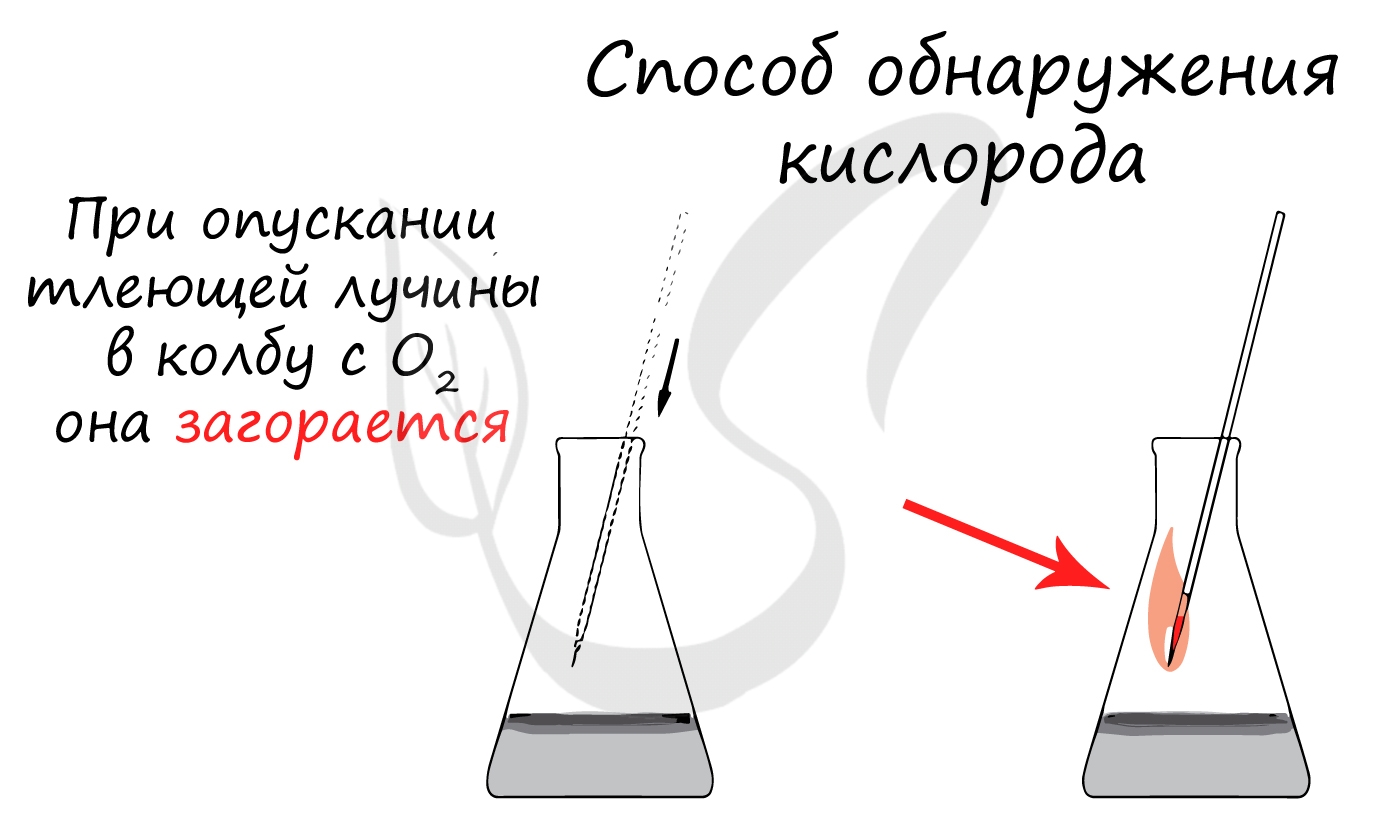
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку: При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.