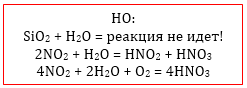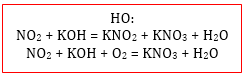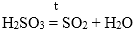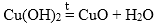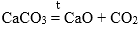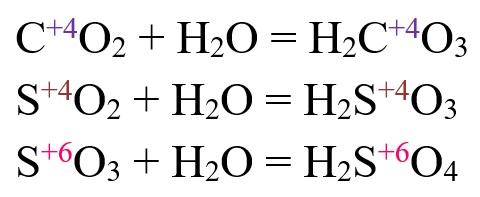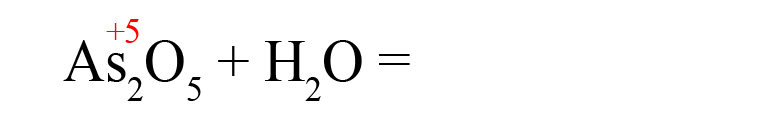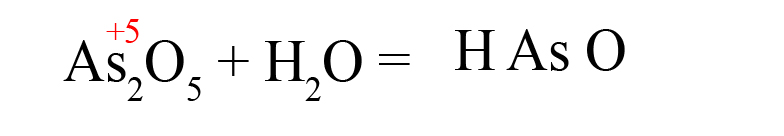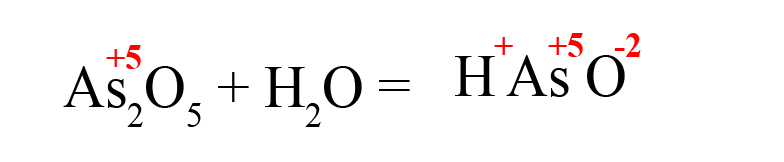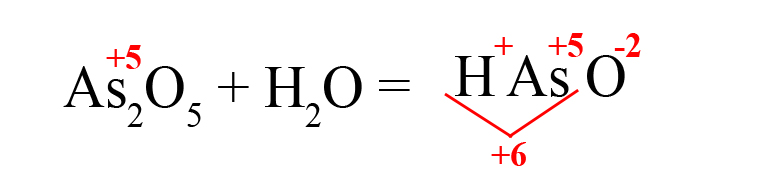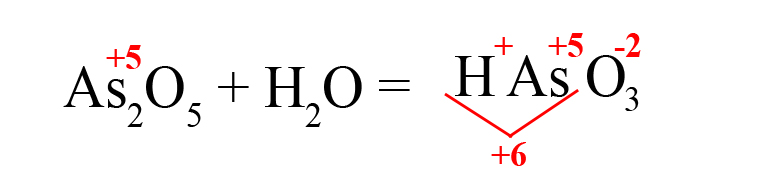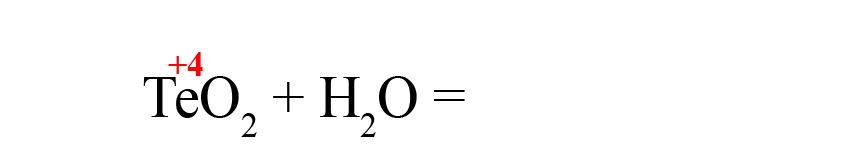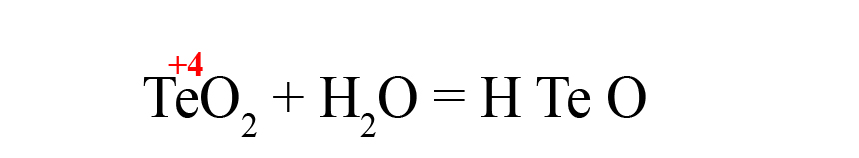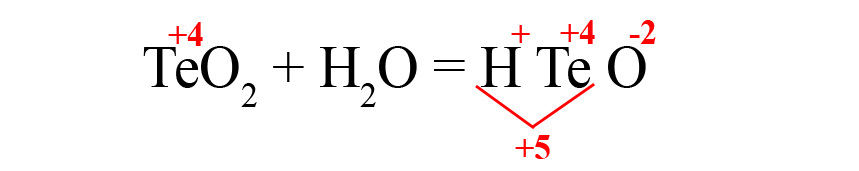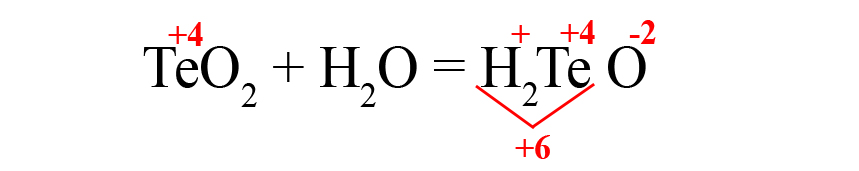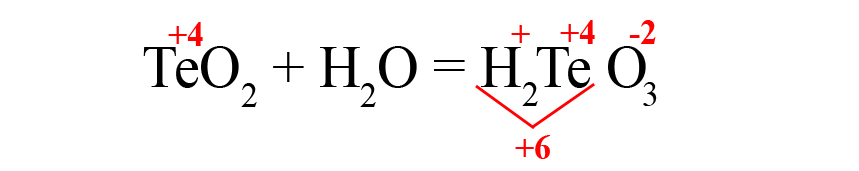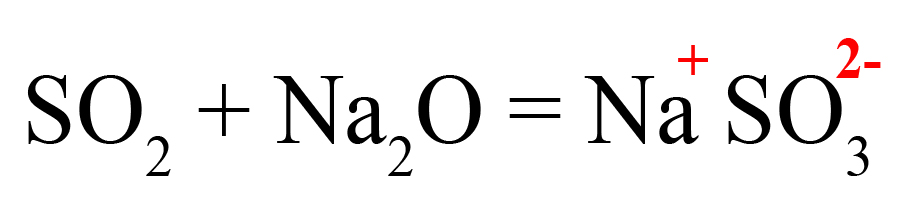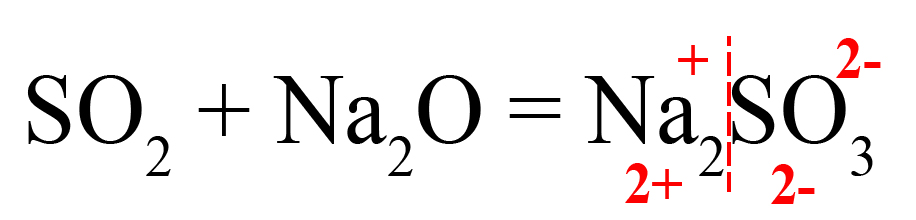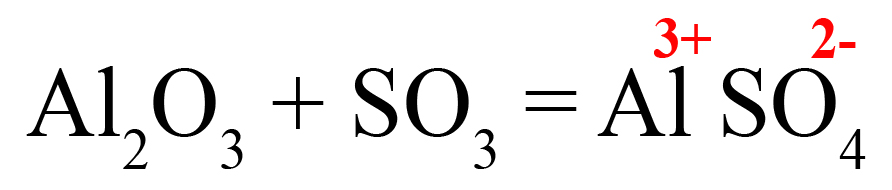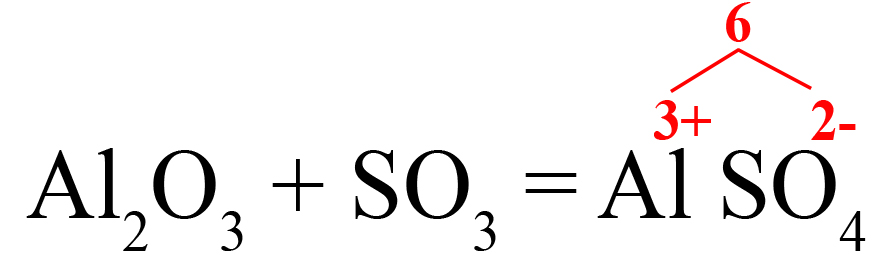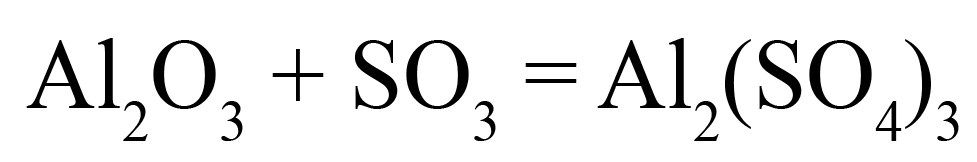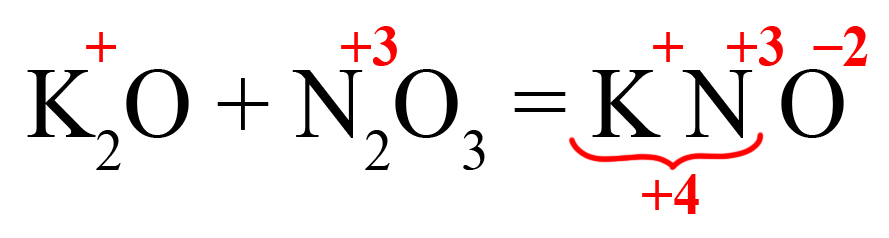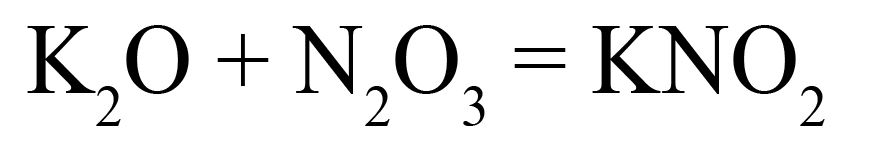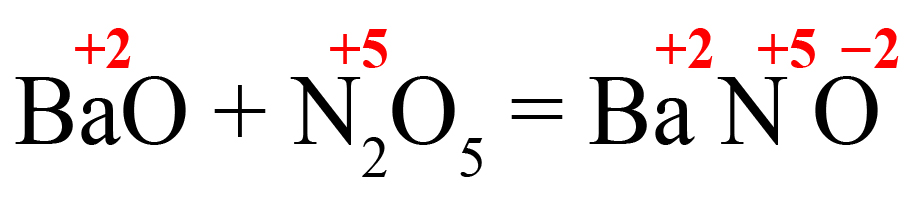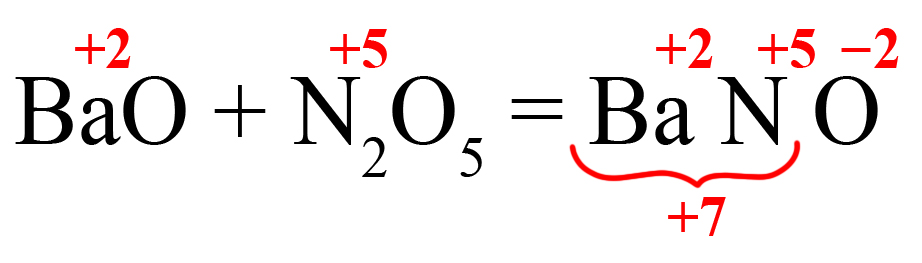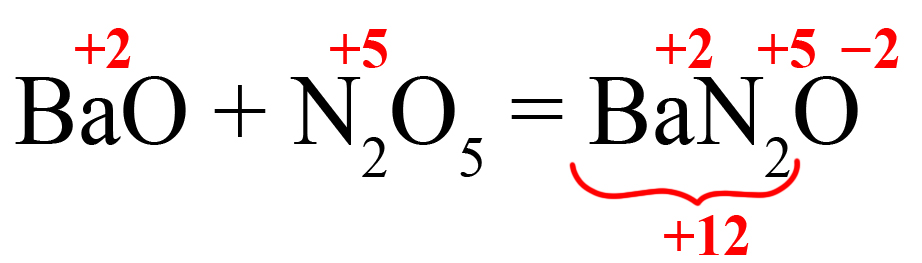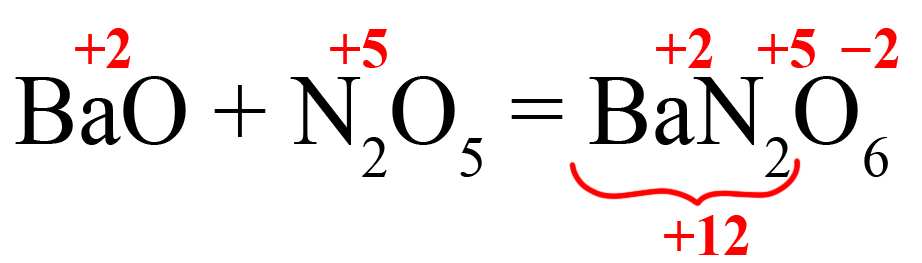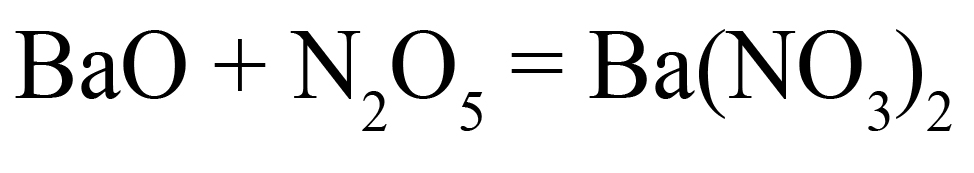Классификация оксидов, способы получения оксидов.
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с основными оксидами и основаниями с образованием солей.
При этом действует правило — хотя бы одному из оксидов должен соответствовать сильный гидроксид (кислота или щелочь).
Кислотные оксиды сильных и растворимых кислот взаимодействуют с любыми основными оксидами и основаниями:
SO3 + CuO = CuSO4
SO3 + Cu(OH)2 = CuSO4 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
SO3 + Na2O = Na2SO4
Кислотные оксиды нерастворимых в воде и неустойчивых или летучих кислот взаимодействуют только с сильными основаниями (щелочами) и их оксидами. При этом возможно образование кислых и основных солей, в зависимости от соотношения и состава реагентов.
Например, оксид натрия взаимодействует с оксидом углерода (IV), а оксид меди (II), которому соответствует нерастворимое основание Cu(OH)2 — практически не взаимодействует с оксидом углерода (IV):
Na2O + CO2 = Na2CO3
CuO + CO2 ≠
2. Кислотные оксиды взаимодействуют с водой с образованием кислот.
Исключение — оксид кремния, которому соответствует нерастворимая кремниевая кислота. Оксиды, которым соответствуют неустойчивые кислоты, как правило, реагируют с водой обратимо и в очень малой степени.
SO3 + H2O = H2SO4
3. Кислотные оксиды взаимодействуют с амфотерными оксидами и гидроксидами с образованием соли или соли и воды.
Обратите внимание — с амфотерными оксидами и гидроксидами взаимодействуют, как правило, только оксиды сильных или средних кислот!
Например, ангидрид серной кислоты (оксид серы (VI)) взаимодействует с оксидом алюминия и гидроксидом алюминия с образованием соли — сульфата алюминия:
3SO3 + Al2O3 = Al2(SO4)3
3SO3 + 2Al(OH)3 = Al2(SO4)3 + 3H2O
А вот оксид углерода (IV), которому соответствует слабая угольная кислота, с оксидом алюминия и гидроксидом алюминия уже не взаимодействует:
CO2 + Al2O3 ≠
CO2 + Al(OH)3 ≠
(не забудьте повторить классификацию кислот).
4. Кислотные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид кремния SiO2 вытеснит более летучий углекислый газ из карбоната кальция при сплавлении:
CaCO3 + SiO2 = CaSiO3 + CO2
5. Кислотные оксиды способны проявлять окислительные свойства.
Как правило, оксиды элементов в высшей степени окисления — типичные окислители (SO3, N2O5, CrO3 и др.). Сильные окислительные свойства проявляют и некоторые элементы с промежуточной степенью окисления (NO2 и др.).
6. Восстановительные свойства.
Восстановительные свойства, как правило, проявляют оксиды элементов в промежуточной степени окисления (CO, NO, SO2 и др.). При этом они окисляются до высшей или ближайшей устойчивой степени окисления.
Например, оксид серы (IV) окисляется кислородом до оксида серы (VI):
2SO2 + O2 = 2SO3
Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Щелочь |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2: CaO + H2O → Ca(OH)2 MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок): SiO2 + H2O → реакция не идет |
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
SiO2 + 4HF(нед.) → SiF4 + 2H2O
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC2 + 3CO
2Al2O3 + 9C → Al4C3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P2O5 + 5C → 4P + 5CO2
SO2 + C → S + CO2
2NO + C → N2 + CO2
2N2O + C → 2N2 + CO2
SiO2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H2 → N2 + 2H2O
N2O + H2 → N2 + H2O
SiO2 + H2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 <=> CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
CO2 + C → 2CO
SO2 + C → S + CO2
3. С сильными восстановителями SO2 проявляет свойства окислителя:
SO2 + 2H2S → 3S + 2H2O
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2C → S + CO2
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
4. Сильные окислители окисляют SO2:
SO2 + Cl2 <=> SO2Cl2
SO2 + Br2 <=> SO2Br2
SO2 + NO2 → SO3 + NO
SO2 + H2O2 → H2SO4
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
SO2 + HNO3 + H2O → H2SO4 + NO
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO2 + 4CO → N2 + 4CO2
2NO2 + 2S → N2 + 2SO2
2NO2 + 4Cu → N2 + 4CuO
N2O5 + 5Cu → N2 + 5CuO
2N2O5 + 2KI → I2 + 2NO2 + 2KNO3
N2O5 + H2S → 2NO2 + S + H2O
2NO + 2H2 → N2 + 2H2O
2NO + C → N2 + CO2
2NO + Cu → N2 + 2Cu2O
2NO + Zn → N2 + ZnO
2NO + 2H2S → N2 + 2S + 2H2O
N2O + H2 → N2 + H2O
2N2O + C → 2N2 + CO2
N2O + Mg → N2 + MgO
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O2 → 2CO2
CO + 2H2 <=> CH3OH (t, p, kt)
CO + Cl2 <=> COCl2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na2O2 → Na2CO3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO2
3CO + Fe2O3 → 2Fe + 3CO2
3CO + Cr2O3 → 2Cr + 3CO2
2CO + SO2 → S + 2CO2 (Al2O3, 500°C)
5CO + I2O5 → I2 + 5CO2
4CO + 2NO2 → N2 + 4CO2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + 2NaOH → Na2SiO3 +H2O
SiO2 + CaO → CaSiO3
SiO2 + BaO → BaSiO3
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O.
Свойства оксида P2O5 как сильного водоотнимающего средства
HCOOH + P2O5 → CO + H3PO4
2HNO3 + P2O5 → N2O5 + 2HPO3
2HClO4 + P2O5 → Cl2O7 + 2HPO3.
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Кислотные:
2SO3 → 2SO2 + O2 (t)
2N2O → 2N2 + O2 (t)
2N2O5 → 4NO2 + O2 (t)
Амфотерные:
4MnO2 → 2Mn2O3 + O2 (t)
6Fe2O3 → 4Fe3O4 + O2 (t).
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
2N+4O2 + 2NaOH → NaN+3O2 + NaN+5O3 + H2O
4NO2 + 2Ba(OH)2 → Ba(NO2)2 + Ba(NO3)2 + 2H2O
2NO2 + Na2CO3 → NaNO3 + NaNO2 + CO2
В аналогичных реакциях с кислородом образуются только соединения с N+5, так как он окисляет нитрит до нитрата:
4NO2 + O2 + 4NaOH → 4NaNO3 + 2H2O
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2Cl+4O2 + H2O → HCl+3O2 + HCl+5O3
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 4H2O.
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Прежде чем начать говорить про химические свойства оксидов, нужно вспомнить о том, что все оксиды делятся на 4 типа, а именно основные, кислотные, амфотерные и несолеобразующие. Для того чтобы определить тип какого-либо оксида, прежде всего нужно понять — оксид металла или неметалла перед вами, а затем воспользоваться алгоритмом (его надо выучить!), представленным в следующей таблице:
| Оксид неметалла | Оксид металла |
| 1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла +1 или +2 Вывод: оксид металла — основный Исключение: BeO, ZnO и PbO не относятся к основным оксидам |
| 2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3 или +4 Вывод: оксид амфотерный Исключение: BeO, ZnO и PbO амфотерны, несмотря на степень окисления +2 у металлов 3) Степень окисления металла +5, +6, +7 Вывод: оксид кислотный |
Помимо типов оксидов, указанных выше, введем также еще два подтипа основных оксидов, исходя из их химической активности, а именно активные основные оксиды и малоактивные основные оксиды.
- К активным основным оксидам отнесем оксиды щелочных и щелочноземельных металлов (все элементы IA и IIA групп, кроме водорода H, бериллия Be и магния Mg). Например, Na2O, CaO, Rb2O, SrO и т.д.
- К малоактивным основным оксидам отнесем все основные оксиды, которые не попали в список активных основных оксидов. Например, FeO, CuO, CrO и т.д.
Логично предположить, что активные основные оксиды часто вступают в те реакции, в которые не вступают малоактивные.
Следует отметить, что несмотря на то что фактически вода является оксидом неметалла (H2O), обычно ее свойства рассматривают в отрыве от свойств иных оксидов. Обусловлено это ее специфически огромным распространением в окружающем нас мире, в связи с чем в большинстве случаев вода является не реагентом, а средой, в которой может осуществляться бесчисленное множество химических реакций. Однако нередко она принимает и непосредственное участие в различных превращениях, в частности, некоторые группы оксидов с ней реагируют.
Какие оксиды реагируют с водой?
Из всех оксидов с водой реагируют только:
1) все активные основные оксиды (оксиды ЩМ и ЩЗМ);
2) все кислотные оксиды, кроме диоксида кремния (SiO2);
т.е. из вышесказанного следует, что с водой точно не реагируют:
1) все малоактивные основные оксиды;
2) все амфотерные оксиды;
3) несолеобразующие оксиды (NO, N2O, CO, SiO).
Примечание:
Оксид магния медленно реагирует с водой при кипячении. Без сильного нагревания реакция MgO с H2O не протекает.
Способность определить то, какие оксиды могут реагировать с водой даже без умения писать соответствующие уравнения реакций, уже позволяет получить баллы за некоторые вопросы тестовой части ЕГЭ.
Теперь давайте разберемся, как же все-таки те или иные оксиды реагируют с водой, т.е. научимся писать соответствующие уравнения реакций.
Активные основные оксиды, реагируя с водой, образуют соответствующие им гидроксиды. Напомним, что соответствующим оксиду металла является такой гидроксид, который содержит металл в той же степени окисления, что и оксид. Так, например, при реакции с водой активных основных оксидов K+12O и Ba+2O образуются соответствующие им гидроксиды K+1OH и Ba+2(OH)2:
K2O + H2O = 2KOH – гидроксид калия
BaO + H2O = Ba(OH)2 – гидроксид бария
Все гидроксиды, соответствующие активным основным оксидам (оксидам ЩМ и ЩЗМ), относятся к щелочам. Щелочами называют все хорошо растворимые в воде гидроксиды металлов, а также малорастворимый гидроксид кальция Ca(OH)2 (как исключение).
Взаимодействие кислотных оксидов с водой так же, как и реакция активных основных оксидов с водой, приводит к образованию соответствующих гидроксидов. Только в случае кислотных оксидов им соответствуют не основные, а кислотные гидроксиды, чаще называемые кислородсодержащими кислотами. Напомним, что соответствующей кислотному оксиду является такая кислородсодержащая кислота, которая содержит кислотообразующий элемент в той же степени окисления, что и в оксиде.
Таким образом, если мы, например, хотим записать уравнение взаимодействия кислотного оксида SO3 с водой, прежде всего мы должны вспомнить основные, изучаемые в рамках школьной программы, серосодержащие кислоты. Таковыми являются сероводородная H2S, сернистая H2SO3 и серная H2SO4 кислоты. Cероводородная кислота H2S, как легко заметить, не является кислородсодержащей, поэтому ее образование при взаимодействии SO3 с водой можно сразу исключить. Из кислот H2SO3 и H2SO4 серу в степени окисления +6, как в оксиде SO3, содержит только серная кислота H2SO4. Поэтому именно она и будет образовываться в реакции SO3 с водой:
H2O + SO3 = H2SO4
Аналогично оксид N2O5, содержащий азот в степени окисления +5, реагируя с водой, образует азотную кислоту HNO3, но ни в коем случае не азотистую HNO2, поскольку в азотной кислоте степень окисления азота, как и в N2O5, равна +5, а в азотистой — +3:
N+52O5 + H2O = 2HN+5O3
Исключение:
Оксид азота (IV) (NO2) является оксидом неметалла в степени окисления +4, т.е. в соответствии с алгоритмом, описанным в таблице в самом начале данной главы, его нужно отнести к кислотным оксидам. Однако не существует такой кислоты, которая содержала бы азот в степени окисления +4.
В случае оксида NO2 принято считать, что ему соответствуют сразу две кислоты, поскольку его взаимодействие с водой приводит к одновременному образованию двух кислот:
2NO2 + H2O = HNO2 + HNO3
Взаимодействие оксидов друг с другом
Прежде всего нужно четко усвоить тот факт, что среди солеобразующих оксидов (кислотных, основных, амфотерных) практически никогда не протекают реакции между оксидами одного класса, т.е. в подавляющем большинстве случаев невозможно взаимодействие:
1) основный оксид + основный оксид ≠
2) кислотный оксид + кислотный оксид ≠
3) амфотерный оксид + амфотерный оксид ≠
В то время, как практически всегда возможно взаимодействие между оксидами, относящимися к разным типам, т.е. практически всегда протекают реакции между:
1) основным оксидом и кислотным оксидом;
2) амфотерным оксидом и кислотным оксидом;
3) амфотерным оксидом и основным оксидом.
В результате всех таких взаимодействий всегда продуктом является средняя (нормальная) соль.
Рассмотрим все указанные пары взаимодействий более детально.
В результате взаимодействия:
MexOy + кислотный оксид, где MexOy – оксид металла (основный или амфотерный)
образуется соль, состоящая из катиона металла Me (из исходного MexOy) и кислотного остатка кислоты, соответствующей кислотному оксиду.
Для примера попробуем записать уравнения взаимодействия следующих пар реагентов:
Na2O + P2O5 и Al2O3 + SO3
В первой паре реагентов мы видим основный оксид (Na2O) и кислотный оксид (P2O5). Во второй – амфотерный оксид (Al2O3) и кислотный оксид (SO3).
Как уже было сказано, в результате взаимодействия основного/амфотерного оксида с кислотным образуется соль, состоящая из катиона металла (из исходного основного/амфотерного оксида) и кислотного остатка кислоты, соответствующей исходному кислотному оксиду.
Таким образом, при взаимодействии Na2O и P2O5 должна образоваться соль, состоящая из катионов Na+ (из Na2O) и кислотного остатка PO43-, поскольку оксиду P+52O5 соответствует кислота H3P+5O4. Т.е. в результате такого взаимодействия образуется фосфат натрия:
3Na2O + P2O5 = 2Na3PO4 — фосфат натрия
В свою очередь, при взаимодействии Al2O3 и SO3 должна образоваться соль, состоящая из катионов Al3+ (из Al2O3) и кислотного остатка SO42-, поскольку оксиду S+6O3 соответствует кислота H2S+6O4. Таким образом, в результате данной реакции получается сульфат алюминия:
Al2O3 + 3SO3 = Al2(SO4)3 — сульфат алюминия
Более специфическим является взаимодействие между амфотерными и основными оксидами. Данные реакции осуществляют при высоких температурах, и их протекание возможно благодаря тому, что амфотерный оксид фактически берет на себя роль кислотного. В результате такого взаимодействия образуется соль специфического состава, состоящая из катиона металла, образующего исходный основный оксид и «кислотного остатка»/аниона, в состав которого входит металл из амфотерного оксида. Формулу такого «кислотного остатка»/аниона в общем виде можно записать как MeO2x—, где Me – металл из амфотерного оксида, а х = 2 в случае амфотерных оксидов с общей формулой вида Me+2O (ZnO, BeO, PbO) и x = 1 – для амфотерных оксидов с общей формулой вида Me+32O3 (например, Al2O3, Cr2O3 и Fe2O3).
Попробуем записать в качестве примера уравнения взаимодействия
ZnO + Na2O и Al2O3 + BaO
В первом случае ZnO является амфотерным оксидом с общей формулой Me+2O, а Na2O – типичный основный оксид. Согласно сказанному выше, в результате их взаимодействия должна образоваться соль, состоящая из катиона металла, образующего основный оксид, т.е. в нашем случае Na+ (из Na2O) и «кислотного остатка»/аниона c формулой ZnO22-, поскольку амфотерный оксид имеет общую формулу вида Me+2O. Таким образом, формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Na2ZnO2:
ZnO + Na2O =to=> Na2ZnO2
В случае взаимодействующей пары реагентов Al2O3 и BaO первое вещество является амфотерным оксидом с общей формулой вида Me+32O3, а второе — типичным основным оксидом. В этом случае образуется соль, содержащая катион металла из основного оксида, т.е. Ba2+ (из BaO) и «кислотного остатка»/аниона AlO2—. Т.е. формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Ba(AlO2)2, а само уравнение взаимодействия запишется как:
Al2O3 + BaO =to=> Ba(AlO2)2
Как мы уже писали выше, практически всегда протекает реакция:
MexOy + кислотный оксид,
где MexOy – либо основный, либо амфотерный оксид металла.
Однако следует запомнить два «привередливых» кислотных оксида – углекислый газ (CO2) и сернистый газ (SO2). «Привередливость» их заключается в том, что несмотря на явные кислотные свойства, активности CO2 и SO2 недостаточно для их взаимодействия с малоактивными основными и амфотерными оксидами. Из оксидов металлов они реагируют только с активными основными оксидами (оксидами ЩМ и ЩЗМ). Так, например, Na2O и BaO, являясь активными основными оксидами, могут с ними реагировать:
CO2 + Na2O = Na2CO3
SO2 + BaO = BaSO3
В то время, как оксиды CuO и Al2O3, не относящиеся к активным основным оксидам, в реакцию с CO2 и SO2 не вступают:
CO2 + CuO ≠
CO2 + Al2O3 ≠
SO2 + CuO ≠
SO2 + Al2O3 ≠
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H2SO4 = FeSO4 + H2O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO2 + 6HF = H2[SiF6] + 2H2O,
а в случае недостатка HF:
SiO2 + 4HF = SiF4 + 2H2O
2) SO2, будучи кислотным оксидом, легко реагирует с сероводородной кислотой H2S по типу сопропорционирования:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
3) Оксид фосфора (III) P2O3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P2O3 | + | 2H2SO4 | + | H2O | =to=> | 2SO2 | + | 2H3PO4 |
| (конц.) |
| 3P2O3 | + | 4HNO3 | + | 7H2O | =to=> | 4NO↑ | + | 6H3PO4 |
| (разб.) |
| P2O3 | + | 4HNO3 | + | H2O | =to=> | 2H3PO4 | + | 4NO2↑ |
| (конц.) |
4) Оксид серы (IV) SO2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO3 | + | SO2 | =to=> | H2SO4 | + | 2NO2↑ |
| (конц.) |
| 2HNO3 | + | 3SO2 | + | 2H2O | =to=> | 3H2SO4 | + | 2NO↑ |
| (разб.) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO3 + 2NaOH = Na2SO4 + H2O
Кислотные оксиды, которым соответствуют многоосновные кислоты, с щелочами могут образовывать как нормальные, так и кислые соли:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH = NaHCO3
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 4KOH = 2K2HPO4 + H2O
P2O5 + 2KOH + H2O = 2KH2PO4
«Привередливые» оксиды CO2 и SO2, активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только основные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH)2 + CO2 = (ZnOH)2CO3 + H2O (в растворе)
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH)3, Cr(OH)3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO2 =to=> Na2SiO3 + H2O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] — тетрагидроксоалюминат натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO2x—, где x = 2 в случае амфотерного оксида типа Me+2O и x = 1 для амфотерного оксида вида Me2+2O3:
ZnO + 2NaOH =to=> Na2ZnO2 + H2O
BeO + 2NaOH =to=> Na2BeO2 + H2O
Al2O3 + 2NaOH =to=> 2NaAlO2 + H2O
Cr2O3 + 2NaOH =to=> 2NaCrO2 + H2O
Fe2O3 + 2NaOH =to=> 2NaFeO2 + H2O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na2[Zn(OH)4] =to=> Na2ZnO2 + 2H2O
Na[Al(OH)4] =to=> NaAlO2 + 2H2O
Взаимодействие оксидов со средними солями
Чаще всего средние соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO2) и углекислый (CO2) газы соответственно. Например:
Al2O3 + Na2CO3 =to=> 2NaAlO2 + CO2
SiO2 + K2SO3 =to=> K2SiO3 + SO2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K2СO3 + SO2 = K2SO3 + CO2
ОВР с участием оксидов
Восстановление оксидов металлов и неметаллов
Аналогично тому, как металлы могут реагировать с растворами солей менее активных металлов, вытесняя последние в свободном виде, оксиды металлов при нагревании также способны реагировать с более активными металлами.
Напомним, что сравнить активность металлов можно либо используя ряд активности металлов, либо, если одного или сразу двух металлов нет в ряду активности, по их положению относительно друг друга в таблице Менделеева: чем ниже и левее металл, тем он более активен. Также полезно помнить, что любой металл из семейства ЩМ и ЩЗМ будет всегда активнее металла, не являющегося представителем ЩМ или ЩЗМ.
В частности, на взаимодействии металла с оксидом менее активного металла основан метод алюмотермии, используемый в промышленности для получения таких трудновосстанавливаемых металлов, как хром и ванадий:
Cr2O3 + 2Al =to=> Al2O3 + 2Cr
При протекании процесса алюмотермии образуется колоссальное количество тепла, а температура реакционной смеси может достигать более 2000oC.
Также оксиды практически всех металлов, находящихся в ряду активности правее алюминия, могут быть восстановлены до свободных металлов водородом (H2), углеродом (C) и угарным газом (CO) при нагревании. Например:
Fe2O3 + 3CO =to=> 2Fe + 3CO2
CuO + C =to=> Cu + CO
FeO + H2 =to=> Fe + H2O
Следует отметить, что в случае, если металл может иметь несколько степеней окисления, при недостатке используемого восстановителя возможно также неполное восстановление оксидов. Например:
Fe2O3 + CO =to=> 2FeO + CO2
4CuO + C =to=> 2Cu2O + CO2
Оксиды активных металлов (щелочных, щелочноземельных, магния и алюминия) с водородом и угарным газом не реагируют.
Однако оксиды активных металлов реагируют с углеродом, но иначе, чем оксиды менее активных металлов.
В рамках программы ЕГЭ, чтобы не путаться, следует считать, что в результате реакции оксидов активных металлов (до Al включительно) с углеродом образование свободного ЩМ, ЩЗМ, Mg, а также Al невозможно. В таких случаях происходит образование карбида металла и угарного газа. Например:
2Al2O3 + 9C =to=> Al4C3 + 6CO
CaO + 3C =to=> CaC2 + CO
Оксиды неметаллов нередко могут быть восстановлены металлами до свободных неметаллов. Так, например, оксиды углерода и кремния при нагревании реагируют с щелочными, щелочноземельными металлами и магнием:
CO2 + 2Mg =to=> 2MgO + C
SiO2 + 2Mg =to=> Si + 2MgO
При избытке магния последнее взаимодействие может приводить также к образованию силицида магния Mg2Si:
SiO2 + 4Mg =to=> Mg2Si + 2MgO
Оксиды азота могут быть относительно легко восстановлены даже менее активными металлами, например, цинком или медью:
Zn + 2NO =to=> ZnO + N2
2NO2 + 4Cu =to=> 4CuO + N2
Взаимодействие оксидов с кислородом
Для того чтобы в заданиях реального ЕГЭ суметь ответить на вопрос, реагирует ли какой-либо оксид с кислородом (O2), прежде всего нужно запомнить, что оксиды, способные реагировать с кислородом (из тех, что могут попасться вам на самом экзамене) могут образовать только химические элементы из списка:
углерод С, кремний Si, фосфор P, сера S, медь Cu, марганец Mn, железо Fe, хром Cr, азот N
Встречающиеся в реальном ЕГЭ оксиды любых других химических элементов с кислородом реагировать не будут (!).
Для более наглядного удобного запоминания перечисленных выше списка элементов, на мой взгляд, удобна следующая иллюстрация:
В первую очередь, среди перечисленных элементов следует рассмотреть азот N, т.к. отношение его оксидов к кислороду заметно отличается от оксидов остальных элементов приведенного выше списка.
Следует четко запомнить тот факт, что всего азот способен образовать пять оксидов, а именно:
Из всех оксидов азота с кислородом может реагировать только NO. Данная реакция протекает очень легко при смешении NO как с чистым кислородом, так и с воздухом. При этом наблюдается быстрое изменение окраски газа с бесцветной (NO) на бурую (NO2):
| 2NO | + | O2 | = | 2NO2 |
| бесцветный | бурый |
Для того чтобы дать ответ на вопрос — реагирует ли с кислородом какой-либо оксид любого другого из перечисленных выше химических элементов (т.е. С, Si, P, S, Cu, Mn, Fe, Cr) — прежде всего обязательно нужно запомнить их основные степени окисления (СО). Вот они:
| элемент | С | Si | P | S | Cu | Cr | Mn | Fe |
| его основные положительные СО | +2, +4 | +2, +4 | +3, +5 | +4, +6 | +1, +2 | +2, +3, +6 | +2, +4, +6, +7 | +2, +3, +6 |
Далее нужно запомнить тот факт, что из возможных оксидов указанных выше химических элементов, с кислородом будут реагировать только те, которые содержат элемент в минимальной, среди указанных выше, степени окисления. При этом степень окисления элемента повышается до ближайшего положительного значения из возможных:
| элемент |
Отношение его оксидов к кислороду |
| С |
Минимальная среди основных положительных степеней окисления углерода равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов C+2O и C+4O2 реагирует только CO. При этом протекает реакция: 2C+2O + O2 =to=> 2C+4O2 CO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления углерода. |
| Si |
Минимальная среди основных положительных степеней окисления кремния равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов Si+2O и Si+4O2 реагирует только SiO. Из-за некоторых особенностей оксидов SiO и SiO2 возможно окисление лишь части атомов кремния в оксиде Si+2O. Т.е. в результате его взаимодействия с кислородом, образуется смешанный оксид, содержащий как кремний в степени окисления +2, так и кремний в степени окисления +4, а именно Si2O3 (Si+2O·Si+4O2): 4Si+2O + O2 =to=> 2Si+2,+42O3 (Si+2O·Si+4O2) SiO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления кремния. |
| P |
Минимальная среди основных положительных степеней окисления фосфора равна +3, а ближайшая к нему положительная — +5. Таким образом, с кислородом из оксидов P+32O3 и P+52O5 реагирует только P2O3. При этом протекает реакция доокисления фосфора кислородом от степени окисления +3 до степени окисления +5: P+32O3 + O2 =to=> P+52O5 P+52O5 + O2 ≠ — реакция невозможна в принципе, т.к. +5 – высшая степень окисления фосфора. |
| S |
Минимальная среди основных положительных степеней окисления серы равна +4, а ближайшая к ней по значению положительная — +6. Таким образом, с кислородом из оксидов S+4O2, S+6O3 реагирует только SO2. При этом протекает реакция: 2S+4O2 + O2 =to=> 2S+6O3 2S+6O3 + O2 ≠ — реакция невозможна в принципе, т.к. +6 – высшая степень окисления серы. |
| Cu |
Минимальная среди положительных степеней окисления меди равна +1, а ближайшая к ней по значению — положительная (и единственная) +2. Таким образом, с кислородом из оксидов Cu+12O, Cu+2O реагирует только Cu2O. При этом протекает реакция: 2Cu+12O + O2 =to=> 4Cu+2O CuO + O2 ≠ — реакция невозможна в принципе, т.к. +2 – высшая степень окисления меди. |
| Cr |
Минимальная среди основных положительных степеней окисления хрома равна +2, а ближайшая к ней по значению положительная равна +3. Таким образом, с кислородом из оксидов Cr+2O, Cr+32O3 и Cr+6O3 реагирует только CrO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +3: 4Cr+2O + O2 =to=> 2Cr+32O3 Cr+32O3 + O2 ≠ — реакция не протекает, несмотря на то что существует оксид хрома и в большей, чем +3, степени окисления (Cr+6O3). Невозможность протекания данной реакции связана с тем, что требуемый для ее гипотетического осуществления нагрев сильно превышает температуру разложения оксида CrO3. Cr+6O3 + O2 ≠ — данная реакция не может протекать в принципе, т.к. +6 – высшая степень окисления хрома. |
| Mn |
Минимальная среди основных положительных степеней окисления марганца равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из возможных оксидов Mn+2O, Mn+4O2, Mn+6O3 и Mn+72O7 реагирует только MnO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +4: 2Mn+2O + O2 =to=> 2Mn+4O2 в то время, как: Mn+4O2 + O2 ≠ и Mn+6O3 + O2 ≠ — реакции не протекают, несмотря на то что существует оксид марганца Mn2O7, содержащий Mn в большей, чем +4 и +6, степени окисления. Связанно это с тем, что требуемый для дальнейшего гипотетического окисления оксидов Mn+4O2 и Mn+6O3 нагрев существенно превышает температуру разложения получаемых оксидов MnO3 и Mn2O7. Mn+72O7 + O2 ≠ — данная реакция невозможна в принципе, т.к. +7 – высшая степень окисления марганца. |
| Fe |
Минимальная среди основных положительных степеней окисления железа равна +2, а ближайшая к ней среди возможных — +3. Несмотря на то что для железа существует степень окисления +6, кислотного оксида FeO3, впрочем, как и соответствующей ему «железной» кислоты не существует. Таким образом, из оксидов железа с кислородом могут реагировать только те оксиды, которые содержат Fe в степени окисления +2. Это либо оксид Fe+2O, либо смешанный оксид железа Fe+2,+33O4 (железная окалина): 4Fe+2O + O2 =to=> 2Fe+32O3 или 6Fe+2O + O2 =to=> 2Fe+2,+33O4 смешанный оксид Fe+2,+33O4 может быть доокислен до Fe+32O3: 4Fe+2,+33O4 + O2 =to=> 6Fe+32O3 Fe+32O3 + O2≠ — протекание данной реакции невозможно в принципе, т.к. оксидов, содержащих железо в степени окисления выше, чем +3, не существует. |
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ХИМИЧЕСКИЕ СВОЙСТВА НЕСОЛЕОБРАЗУЮЩИХ ОКСИДОВ
Несолеобразующие оксиды не реагируют с растворами щелочей и с кислотами.
1. ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА:
Несолеобразующие оксиды могут реагировать с водородом.
Например, смеси оксидов азота (I) и (II) с водородом взрывают.
N2O + H2 = N2 + H2O 2NO + 2H2 = N2 + 2H2O
Смесь угарного газа с водородом называется синтез-газом, ее применяют для получения ряда органических соединений, например, метанола.
2. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА:
Реагируют с кислородом, например, угарный газ CO горит при поджигании голубым пламенем.
2CO + O2 = 2CO2
Бесцветный оксид азота (II) окисляется на воздухе при обычных условиях до оксида азота (IV) — газообразного вещества, имеющего бурую окраску.
2NO + O2 = 2NO2
При взаимодействии угарного газа с хлором при нагревании над активированным углем образуется фосген, который применяют для производства пластмасс.
2CO + Cl2 = 2COCl2
Оксид азота (I) — термодинамически нестабильное соединение и при нагревании разлагается.
2N2O = 2N2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. ОСНОВНЫЙ ОКСИД + КИСЛОТА + СОЛЬ + ВОДА
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ H2O,
NiO + H2SO4 = NiSO4 + H2O
2. ОСНОВНЫЙ ОКСИД (IА группа, CaO, SrO, BaO) + ВОДА = ЩЕЛОЧЬ
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
3. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. РЕАКЦИИ ОСНОВНЫХ ОКСИДОВ С ВОССТАНОВИТЕЛЯМИ
(СО, С, водород, алюминий, магний).
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
FeO + H2 = Fe + H2O (при нагревании)
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
5. ОКИСЛЕНИЕ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+5, +6, +7), например, CrO3, Mn2O7.
По агрегатному состоянию:
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. КИСЛОТНЫЙ ОКСИД + ВОДА = КИСЛОТА
Не реагирует с водой только SiO2.
N2O3 + H2O = 2HNO2
SO2 + H2O = H2SO3
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
2.КИСЛОТНЫЙ ОКСИД + ОСНОВНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
CO2 + CaO = CaCO3
N2O5 + ZnO = Zn(NO3)2
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
P4O10 + 6FeO = 2Fe3(PO4)2 (при нагревании)
3.КИСЛОТНЫЙ ОКСИД + ОСНОВАНИЕ = СОЛЬ + ВОДА
Реакция возможна только со щелочами, но оксиды сильных кислот
SO3, CrO3, N2O5, Cl2O7 реагируют и с нерастворимыми основаниями.
CO2 + Ca(OH) 2 = CaCO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O (при нагревании),
SO3 + 2NaOH = Na2SO4 + H2O,
N2O5 + 2KOH = 2KNO3 + H2O.
4.КИСЛОТНЫЙ ОКСИД + СОЛЬ БОЛЕЕ ЛЕТУЧЕЙ КИСЛОТЫ = СОЛЬ + ЛЕТУЧИЙ ОКСИД
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании)
5.ОКИСЛЕНИЕ ОКСИДОВ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ:
Для элементов, которые образуют несколько оксидов с разной степенью окисления.
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, Cr2O3, PbO и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1.ОКСИД + КИСЛОТА = СОЛЬ + ВОДА
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + HNO3 = Al(NO3)3 +H2O
2.КИСЛОТНЫЙ ОКСИД + АМФОТЕРНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. ПРИ СПЛАВЛЕНИИ С ОКСИДАМИ ОБРАЗУЕТ СРЕДНИЕ СОЛИ.
ZnO2(2-) — цинкат
BeO2(2-) — бериллат
AlO2(-) — алюминат
CrO2(-) — хромат
ZnO + Na₂O = Na₂ZnO2.
2.АМФОТЕРНЫЙ ОКСИД + РАСПЛАВ ЩЕЛОЧИ + СОЛЬ
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + H2O (при нагревании)
ZnO + 2KOH =K2ZnO2 + H2O (при нагревании)
3.АМФОТЕРНЫЙ ОКСИД + РАСТВОР ЩЕЛОЧИ = РАСТВОР ГИДРОКСОКОМПЛЕКСА
[Zn(OH)4 ](2-) — тетрагидроксоцинкат
[Be(OH)4](2-) — тетрагидроксобериллат
[Al(OH)4](-) — тетрагидроксоалюминат
[Cr(OH)4](-) — тетрагидроксохромат
Al2O3 + 2KOH +3H2O = 2K[Al(OH)4]
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2
4.АМФОТЕРНЫЙ ОКСИД + КАРБОНАТЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ = СОЛЬ + ГАЗ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = NaAlO2 (или Na3AlO3) + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5.ВЗАИМОДЕЙСТВИЕ С СИЛЬНЫМИ ВОССТАНОВИТЕЛЯМИ
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2
ПОЛУЧЕНИЕ МЕТАЛЛОВ
1 . МЕТАЛЛЫ И НЕМЕТАЛЛЫ С КИСЛОРОДОМ →
Реагируют все металлы, кроме золота, платины. Натрий, калий, рубидий, цезий сразу образуют пероксиды и надпероксиды. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив.
4Cr + 3О2 = 2Cr2О3
C+ O₂ (нед) = CO
2. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ:
Неактивные металлы реагируют с водой только в раскаленном состоянии , образуя оксиды (железо – железную окалину)
Zn + Н2O = ZnO + H2 ↑ 3Fe + 4HOH = Fe3O4 + 4H2↑
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ОКСИДАМИ (оксидами неметаллов и менее активных металлов)
Металлы (Al, Mg,Са ), восстанавливают при высокой температуре неметаллы или менее активные металлы из их оксидов → неметалл или малоактивный металл и оксид (кальцийтермия, магнийтермия, алюминотермия)
2Al + Cr2O3 = 2Cr + Al2O3
ЗСа + Cr₂O₃ = ЗСаО + 2Cr (800 °C)
Металлы железо и хром реагируют со оксидами, уменьшая степень окисления
Cr + Cr2⁺³O3 = 3Cr⁺²O
4. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ПЕРОКСИДАМИ
Щелочные металлы при взаимодействии с пероксидами переводят их в оксиды
2Na + Na2O2 = 2Na2O
3K+ KO2 = 2K2O
5.ВЗАИМОДЕЙСТВИЕ УГЛЕРОДА С ОКСИДАМИ
2ZnO + C = 2Zn + CO
4С + Fe₃O₄ = 3Fe + 4CO
6.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С НИЗШИМИ С ОКСИДАМИ
окисляет низшие оксиды до высших:
2Fe⁺²O + O2 = Fe2⁺³O3;
2C⁺²O + O2 = 2C⁺⁴O2
7.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С КИСЛОТАМИ
Безводные бескислородные кислоты (бинарные соединения) сгорают в атмосфере кислорода
2H2S + 3O2 = 2SO2 + 2H2O
8.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С СОЛЯМИ И БИНАРНЫМИ СОЕДИНЕНИЯМИ
Горение
4FeS2 +11O2 = 2Fe2O3 + 8SO2
CH4 + 2O2 = CO2 + 2H2O
Каталитическое окисление
NH3 + O2 = NO + H2O
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 —-АМФОТЕРНЫЙ с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С
Реагирует с солями
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Взаимодействует с водным растворoм аммиака.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + H2O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2NH3 = ЗСu + N2↑ + 3H2О
II ГРУППА Б ОКСИД ЦИНКА (II)
Твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + H2O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VI ГРУППА Б ОКСИДЫ ХРОМА.
ОКСИД ХРОМА (II) имеют основный характер. Красные кристаллы или черный пирофорный порошок.
ОКСИД ХРОМА (III) Cr₂O₃ АМФОТЕРНЫЙ
зелёный, нерастворимый в воде порошок.
Получают при прокаливании гидроксида хрома (III), дихроматов калия и аммония или окислении оксида (II):
2Cr(OH)₃= Cr₂O₃ + 3H₂O
4K₂Cr₂O₇ = 2Cr₂O₃ + 4K₂CrO₄(хромат калия) + 3O₂↑
(NH ₄)₂Cr₂O₇ = Cr₂O₃ + N₂↑ + 4H₂O
1. При сплавлении Cr₂O₃ с оксидами, щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + FeO = Fe(CrO2)2
Cr₂O₃ + 2NaOH = 2NaCrO₂ (хромит натрия) + H₂O
Cr₂O₃ + Na₂CO₃ = 2NaCrO₂ + CO₂↑
Cr₂O₃ + 6KHSO₄ = Cr₂(SO₄)₃ + 3K₂SO₄ + 3H₂O
2. При сплавлении со смесью щёлочи и окислителя проявляют свойства восстановителя, получают соединения хрома в
степени окисления (+6):
2Cr₂O₃ + 4KOH + KClO₃ = 2K₂Cr₂O₇(дихромат калия) + KCl + 2H₂O
Сг2O3 + KClO₃ + 2К2СO3 = 2К₂CrO4 + КС1 + 2CO2↑
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2↑
Cr2O3 + 3KNO3 + 4KOH = 2Na2CrO4 + 3KNO2 + 2H₂O
5Cr2O3 + 6NaBrO3 + 3H2SO4 + 2H2O = 5H2Cr2O7 + 3Br2 + 3Na2SO4
ОКСИД ХРОМА (VI) CrO₃ — кислотный оксид,
кристаллическое вещество тёмно-красного цвета, сильный окислитель.
Взаимодействует с водой → хромовая или двухромовая кислота
CrО3 + Н2О = Н2СrО4
2. основными оксидами и основаниями
CrО3 + CaO = СаСrО4
CrО3 + 2NaOH = Na2СrО4 + H2О
3. Сильный окислитель: окисляет неорганические и органические вещества
4CrО3 + 3S = 3SО2↑ + 2Cr2О3
4CrО3 + C2H5OH + 6H2SО4 = 2Cr2(SО4)3 + 2CО2↑ + 9H2О
4. Разлагается при нагревании
4CrО3 = 2Cr2О3 + 3О2↑
Получают из хромата (или дихромата) калия и H₂SO₄(конц.).
K₂CrO₄ + H₂SO₄ →CrO₃ + K₂SO₄ + H₂O
K₂Cr₂O₇ + H₂SO₄ →2CrO₃ + K₂SO₄ + H₂O
VII ГРУППА Б ОКСИДЫ МАРГАНЦА
ОКСИД МАРГАНЦА(II) MnO ОСНОВНЫЙ
Твердое вещество зеленого цвета, не растворимое в воде
ОКСИД МАРГАНЦА (III) Mn2O3 ОСНОВНЫЙ
Твердое вещество бурого цвета цвета, не растворимое в воде
Обладает окислительными свойствами
Mn2O3 + H2 = 2MnO + H2O
Обладает восстановительными свойствами, реагируя с разбавленной серной кислотой:
2Mn2O3 + 4H2SO4 = 2MnO2 + Mn2(SO4)3 + SO2 + 4H2O
ОКСИД МАРГАНЦА (VI) MnO3
В свободном состоянии не выделен
ОКСИД МАРГАНЦА (VII) Mn₂O₇ КИСЛОТНЫЙ
тёмно-зелёная жидкость, растворяется в воде, неустойчив.
Получают действием концентрированной серной кислоты на кристаллический KMnO₄ (марганцевая кислота HMnO₄ нестабильна):
2KMnO₄ + H₂SO₄ → Mn₂O₇ + + K₂SO₄ + H₂O
1. При растворении в щелочах образует перманганаты:
Mn₂O₇ + 2KOH → 2KMnO₄ + H₂O
2. При ударе и слабом нагревании разлагается со взрывом до MnO2:
2Mn₂O₇ → 2MnO2 + 3HO₂↑
VIII ГРУППА Б ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II) FeO ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5H2O.
ОКСИД ЖЕЛЕЗА (III) Fe₂O₃ АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV ГРУППА А ОКСИДЫ УГЛЕРОДА.
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит.
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
1) реагирует с водородом, в зависимости от условий образуются
разные продукты:
СО + Н2 = СН4↑ (метан) + Н2О СО + Н2 = СН3ОН (метанол)
2) под давлением реагирует со щелочью, образуя формиат – соль муравьиной кислоты:
CO + NaOH = HCOONa (формиат натрия)
CO2 -КИСЛОТНЫЙ О=С=О
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
С аммиаком образует мочевину :
CO2 + 2NH3 → NH2-CO-NH2 + H2O
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем, без цвета, без запаха, единственный из кислотных нерастворимый в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF (р-р)= H2[SiF6] + 2H2O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
1. Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2 2NO + Cl2 = 2NOCl (хлористый нитрозил)
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т.п.
2NO + 2H2 =N2 + 2H2O
2NO + 2SO2 =2SO3 + N2
N2O3 ОКСИД АЗОТА (III), АЗОТИСТЫЙ АНГИДРИД
темно-синяя жидкость (при низких температурах). КИСЛОТНЫЙ
Получение:NO2 + NO ⇄ N2O3 (при охлаждении)
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует две кислоты сразу с водой:
2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +H2O
3. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
3. Димеризация:
2NO2(бурый газ)⇄ N2O4(бесцветная жидкость) – димер.
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД
кристаллическое вещество, легко плавится (40°С) КИСЛОТНЫЙ
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
ОКСИДЫ ФОСФОРА
P2O3 — ФОСФОРИСТЫЙ АНГИДРИД (оксид фосфора (III). КИСЛОТНЫЙ
Белые кристаллы, в парах состоит из молекул димера P4O6.
1. Взаимодействие с водой:
P2O3 + 3H2O = 2H3PO3
2. Взаимодействие с основаниями
P2O3+ 4NaOH = 2Na2HPO3+ H2O
2. Сильный восстановитель:
O2 + P2O3 = P2O5
P2O5 (ОКСИД ФОСФОРА (V) КИСЛОТНЫЙ ФОСФОРНЫЙ АНГИДРИД).
Белые кристаллы. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O =H4P2O7 (пирофосфорная кислота)
P2O5 +3H2O = 2H3PO4 (ортофосфорная кислота)
2) Сильное водоотнимающее средство, можно использовать для получения ангидридов сильных кислот:
P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
1) Реакции окисления S⁺⁴ – 2ē = S⁺⁶
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 +2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2) Реакции восстановления S ⁺⁴ + 4ē = S⁰
SO2 + С = S + СO2
SO2 + 2H2S = 3S + 2H2O
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
SO3 + H2SO4 = H2S2O7
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
Большинство оксидов галогенов неустойчивы и получаются косвенным путем, так как галогены с кислородом не взаимодействуют.
ОКСИД ХЛОРА(I) Cl2O — ядовитый газообразный газ желтого цвета, с резким запахом, хорошо растворим в воде.
Соединение крайне неустойчиво, при повышенной температуре разлагается со взрывом.
Cl2O хорошо растворим в воде, его водный раствор проявляет свойства слабой кислоты:
H2O + Cl2O = 2HClO (хлорноватистая кислота).
ОКСИД БРОМА (I) Br2O напоминает по свойствам и методу синтеза Cl2O.
ДИОКСИД ХЛОРА ClO2 . КИСЛОТНЫЙ
Газ красно-желтого цвета. Используется как отбеливающее вещество.
Взрывается газ от внезапного механического воздействия, введения в систему восстановителя (резиновая пробка).
В щелочной среде ClO2 диспропорционирует
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
ДИОКСИД БРОМА BrO2. КИСЛОТНЫЙ
BrO2- неустойчивый оксид, при повышении температуры разлагается.
BrO2 →2Br2O + 2Br2↑ + 7O2↑
ОКСИД ХЛОРА (VI) Cl2O6 КИСЛОТНЫЙ
красная маслообразная жидкость, взрывоопасная, легко разлагается на ClO2 и O2.
Является смешанным ангидридом кислот HClO3 и HClO4.
Cl2O6 + H2O = HClO3 + HClO4.
ОКСИД ИОДА (V) I2O5 КИСЛОТНЫЙ
белое твердое вещество, единственный термодинамически устойчивый из оксидов галогенов.
I2O5 используется как окислитель в количественном анализе для определения СО:
5СО + I2O5 → I2 + 5CO2.
ОКСИД ХЛОРА (VII) Cl2O7 КИСЛОТНЫЙ
маслянистая бесцветная жидкость, легко взрывается.
Cl2O7 — ангидрид хлорной кислоты HClO4.
Получают дегидратацией концентрированной хлорной кислоты с помощью P2O5 с последующей осторожной перегонкой в вакууме:
6HClO4 + P2O5 → 3Cl2O7 + 2H3PO4.
8(Б), 31(П), 37(В) Перекиси и другие бинарные соединения (теоретический курс)
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства основных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства амфотерных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства кислотных оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления –2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Классификация оксидов, которую мы ещё раз с вами повторим:
- основные: металл в степени окисления +1 и +2;
- амфотерные: металл в степени окисления +3 и +4. Исключения: ZnO, BeO, SnO, PbO;
- кислотные: все неметаллы и металлы в степенях окисления +5, +6 и +7;
- несолеобразующие: NO, N2O, CO, SiO.
Физические свойства оксидов.
- По агрегатному состоянию оксиды делятся на три группы: твердые (K2O, Al2O3, P2O5), жидкие (SO3, Mn2O7), и газообразные (CO2, NO2, SO2).
- По растворимости в воде оксиды делятся на растворимые (SO2, CO2, K2O) и нерастворимые (CuO, FeO, SiO2, Al2O3). Все кислотные оксиды, кроме SiO2, растворимы в воде. Среди основных оксидо растворимыми являются только оксиды щелочных металлов и щелочноземельных металлов. Амфотерные оксиды не растворяются в воде.
Химические свойства основных оксидов
1. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей:
Оксид + H2O = Щелочь;
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Оксид + кислота = соль + H2O
CaO + H2SO4 = CaSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
3. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей:
Основные оксид + кислотный оксид = Соль
3СaO + P2O5 = Ca3(PO4)2
BaO + CO2 = BaCO3
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Кислотный оксид + H2O = кислота
P2O5 + 3H2O = 2H3PO4
N2O5 + H2O = 2HNO3
2. Общим свойством всех кислотных оксидов является их способность взаимодействовать с овнованиями с образованием соли и воды:
кислотный оксид + основание = соль + H2O
P2O5 + 6NaOH = 2Na3PO4 + 6H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
3. Кислотные оксиды взаимодействую с основными оксидами с образованием солей (при нагревании)
Ксилотный оксид + основные оксид = соль;
3CaO + P2O5 = Ca3(PO4)2
CrO3 + CaO = CaCrO4
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды — проявляют свойства основных оксидов.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды — проявляют свойства ксилотных оксидов.
Амфотерный оксид + щелочь = соль + H2O
ZnO + KOH = K2ZnO2 + H2O
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + основный оксид = соль
ZnO + Na2O = Na2ZnO2
Получение оксидов
1. Взаимодействие простых веществ с кислородом:
Металл или неметалл + O2 = Оксид
2. Разложение некоторых оксокислот:
Оксокислота = кислотный оксид + H2O
3. Разложение нерастворимых основний:
Нерастворимое основание = основный оксид + H2O;
4. Разложение некоторых солей:
Соль = основный оксид + кислотный оксид
Свойства кислотных оксидов
Материал по химии
К кислотным оксидам относят оксиды неметаллов (кроме CO, SiO, NO и N2O), а также оксиды металлов в степени окисления «+5», «+6», «+7».
Кислотные оксиды реагируют с водой, основными и амфотерными оксидами, основаниями, с солями.
- При взаимодействии с водой все кислотные оксиды (за редким исключением, например, SiO2) образуют кислоты.
- При взаимодействии с основными оксидами образуется средняя соль.
- При взаимодействии с основаниями образуется средняя соль и вода, либо кислая соль и вода не выделяется.
- При взаимодействии с растворами солей образуются кислые соли. Оксид, соответствующий более сильной кислоте, может вытеснить из соли оксид, соответствующий менее сильной кислоте.
- Кислотные оксиды не реагируют с кислотами, исключение: P2O5 с кислородсодержащими кислотами (кислотными гидроксидами).
- Кислотный оксид + вода = кислота
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
Как определить, какая кислота образуется из кислотного оксида?
Способ первый. Выучить оксиды, соответствующие кислотам:
- Оксиду SO2 соответствует кислота H2SO3 (сернистая)
SO2 + H2O = H2SO3
- Оксиду SO3 соответствует кислота H2SO4 (серная)
SO3 + H2O = H2SO4
- Оксиду CO2 соответствует кислота H2CO3 (угольная)
CO2 + H2O = H2CO3
- Оксиду P2O5 соответствуют кислоты H3PO4, H4P2O7, HPO3 (ортофосфорная, пирофосфорная и метафосфорная соответственно)
Кислота зависит от соотношения воды и оксида фосфора:
P2O5 + H2O = 2HPO3 (метафосфорная)
P2O5 + 2H2O = H4P2O7 (пирофосфорная)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная)
- Оксиду N2O3 соответствует кислота HNO2 (азотистая)
N2O3 + H2O = 2HNO2
- Оксиду N2O5 соответствует кислота HNO3 (азотная)
N2O5 + H2O = 2HNO3
- Оксиду NO2 также соответствует кислота HNO3, однако, при определенных условиях из этого оксида можно получить смесь азотной и азотистой кислот:
NO2 + H2O + O2 = HNO3
NO2 + H2O = HNO2 + HNO3
- Оксиду SiO2 соответствует кислота H2SiO3 (кремниевая), но напрямую из этого оксида кислоту получить нельзя, так как диоксид кремния нерастворим в воде.
- Оксиду CrO3 соответствуют кислоты H2CrO4 и H2Cr2O7 (хромовая и дихромовая):
CrO3 + H2O = H2CrO4
2CrO3 + H2O = H2Cr2O7
- Оксиду Mn2O7 соответствует кислота HMnO4 (марганцовая)
Mn2O7 + H2O = HMnO4
- Оксидам Cl2O, Br2O, I2O соответствуют кислоты HClO, HBrO, HIO (хлорноватистая, бромноватистая, йодноватистая)
Cl2O + H2O = 2HClO
Br2O + H2O = 2HBrO
I2O + H2O = 2HIO
- Оксидам Cl2O3, Br2O3, I2O3 соответствуют кислоты HClO2, HBrO2, HIO2 (хлористая, бромистая, йодистая)
Cl2O3 + H2O = 2HClO2
Br2O3 + H2O = 2HBrO2
I2O3 + H2O = 2HIO2
- Оксидам Cl2O5, Br2O5, I2O5 соответствуют кислота HClO3, HBrO3, HIO3 (хлорноватая, бромноватая, йодноватая)
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
- Оксидам Cl2O7, Br2O7, I2O7 соответствуют HClO4, HBrO4, HIO4 (хлорная, бромная, йодная).
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Способ второй. Считать степени окисления (или валентность). В оксиде и образующейся из неё кислоте у основного элемента должна быть одинаковая степень окисления. Таким образом оксиду SO3 соответствует только H2SO4, потому что степень окисления в обоих веществах «+6» (или валентность VI), а из всего разнообразия хлорсодержащих кислот, оксиду Cl2O3 будет соответствовать HClO2, так как и в оксиде, и в кислоте степень окисления хлора равна «+3» (или валентность III).
Свойства кислотных оксидов
Какие оксиды соответствуют кислотам?
Способ третий. Составим кислоту самостоятельно, пользуясь алгоритмом (это особенно удобно, когда дан оксид, соответствующую кислоту которого мы не знаем):
- Пишем исходные вещества, определим степень окисления оксидообразующего элемента:
- В продуктах запишем «скелет» молекулы (последовательность всегда будет следующей водород → элемент → кислород):
- Расставим степени окисления в продукте (они равны исходным степеням окисления в оксидах):
- Складываем положительные заряды:
- Ставим после кислорода такой индекс, чтобы умножение его на -2 дало значение равное количеству положительных зарядов, посчитанных ранее (в нашем примере индекс «3»):
В результате реакции оксида мышьяка образовалась мышьяковая кислота.
Рассмотрим еще один пример – получения теллуристой кислоты.
- Пишем исходные оксиды, определяем степень окисления теллура:
- Формируем основу кислоты в порядке: водород → теллур → кислород.
- Переносим степени окисления из левой части уравнения (у водорода и кислорода в кислотах и оксидах типичные для них степени окисления, поэтому они не указаны в первой части уравнения), считаем сумму положительных зарядов:
- В данном случае общий положительный заряд равен нечётному числу, чтобы молекула стала электронейтральной, после кислорода пришлось бы ставить индекс 2,5, что недопустимо. Поэтому сначала помножаем элемент, дающий нечётную степень окисления (у нас это водород) на 2, поставив индекс после него:
Это влияет на общий положительный заряд, который теперь становится чётным.
- Осталось умножить кислород на «3», чтобы общий отрицательный заряд стал равен шести:
- Кислотный оксид + основный оксид = средняя соль.
Например: CaO + N2O5 = Ca(NO3)2
Как определить, какая соль образуется из кислотного оксида?
Способ первый. Соль состоит из катиона металла и кислотного остатка. Кислотный остаток соответствует оксиду с такой же степенью окисления, как в нём. Как определить степень окисления элемента в ионе? Прежде всего, необходимо помнить, что ион отличается от молекулы наличием заряда (молекулы элетронейтральны). Этот заряд складывается из положительных и отрицательных зарядов частиц, образующих ион:
Степень окисления кислорода в большинстве веществ равна ‒2, ион содержит три кислорода, они суммарно вносят в заряд этого иона ‒6, азот вносит х. Из этого получим уравнение: x ‒ 6 = ‒ 1 (где «‒1» — общий заряд иона), откуда х = 5.
Таким образом, нитрат-ион соответствует оксиду азота V, потому что в них одинаковая степень окисления азота.
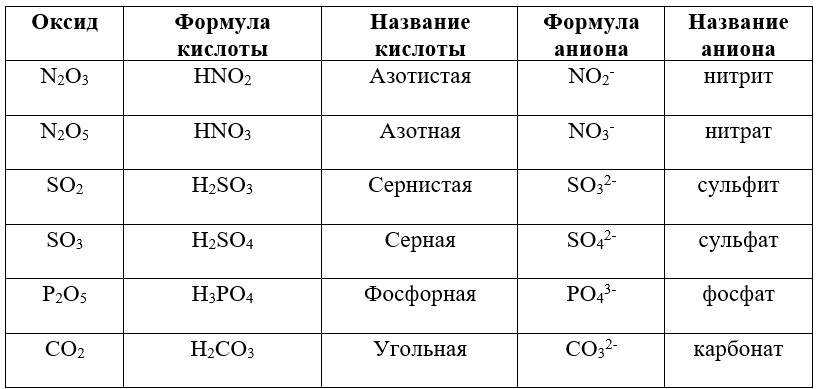
В таблице приведены готовые группы соответствующих веществ и ионов:
Таблица «Взаимосвязь оксидов, кислот и их остатков»
Не забывайте об индексах! После того как Вы подобрали нужный анион, нужно убедиться, что количество положительных и отрицательных зарядов в молекуле равны.
Рассмотрим, несколько примеров расстановки индексов в солях.
Пример 1. Взаимодействие оксида серы IV и оксида натрия:
- Подберем нужные ионы продуктах. Оксид серы IV соответствует сульфит-иону:
- Проверяем количество положительных и отрицательных ионов. В полученном веществе на один положительный заряд приходится два отрицательных. Количество положительных и отрицательных зарядов должно быть одинаковым, поэтому добавляем индекс «2» после натрия:
Индекс «2» говорит о том, что в сульфите натрия содержится два катиона натрия, каждый из которых несет заряд «+», таким образом, два натрия имеют общий заряд «2+».
Пример 2. Взаимодействие оксида серы VI с оксидом алюминия (с кислотными оксидами ведет себя как основный).
- Подбираем ионы в продуктах. Оксиду серы VI соответствует сульфат-ион:
- В случаях, когда придется ставить коэффициенты после обоих ионов, находим наименьшее общее кратное:
- Делим наименьшее общее кратное на 3 (заряд алюминия), получаем индекс «2» после алюминия. Делением общего кратного на 2 (заряд сульфат-иона), получаем индекс «3» после SO42-. Сульфат-ион заключаем в скобки, так как индекс после скобок действует на весь ион, без скобок он будет действовать только на тот элемент, после которого стоит.
Способ второй.
Этот способ уже рассматривался выше, он основан на степенях окисления элементов в исходных оксидах.
Пример 1. Образование нитрита калия.
- В продукте образуется соль, на первом месте должен стоять металл, на втором – элемент из кислотного оксида, на третьем – кислород. Определим степени окисления элементов в исходных оксидах, перенесем эти степени в правую часть уравнения:
- Посчитаем общее количество положительных зарядов:
- Поделим это количество на степень окисления кислорода, получим индекс «2»:
Пример 2. Образование нитрата бария.
- В правой части реакции образуем соль. На первое место ставим металл, на второе – элемент из кислотного оксида, на третье – кислород. Определяем степень окисления элементов в исходных веществах, переносим вправо:
- Определяем количество положительных зарядов:
Получаем нечетное значение. Если оставить всё так, то индекс после кислорода должен стать равным 3,5. Чтобы избежать этого поставим удваивающий индекс после того элемента, который даёт нечетный заряд (азот):
Теперь общее количество положительных зарядов равно двенадцати.
- Делим 12 на степень окисления кислорода, получаем индекс «6»:
- Выносим индекс «2» за скобку, получаем формулу нитрата бария:
- Кислотный оксид + основание = соль + вода
Кислотный оксид + основание = кислая соль.
При образовании средней и кислой соли можно руководствоваться теми же способами, которые использовались в реакциях кислотных оксидов с основными.
От чего зависит, будет ли образованная соль кислой или средней? Рассмотрим два примера образования разных солей из одинаковых реагентов:
KOH + SO2 = KHSO3 (кислая соль, гидросульфит калия)
2KOH + SO2 = K2SO3 + H2O(средняя соль, сульфит калия)
Разница заключается лишь в количестве взятых реагентов. При образовании средней соли гидроксида калия в два раза больше оксида серы (об этом говорят коэффициенты перед веществами: «2» KOH и «1» перед SO2. Перед оксидом серы IV коэффициента нет, в таком случае подразумевается единица). При образовании кислой соли KOH взяли в два раза меньше относительно реакции, в которой образовалась средняя соль. В таких случаях говорят о том, что гидроксид калия был взят в недостатке или оксид серы – в избытке.
Рассмотрим другие пары реакций со схожим результатом:
Ca(OH)2 + CO2 = CaCO3 + H2O (образуется мутный раствор из-за образования нерастворимого карбоната кальция).
Ca(OH)2 + 2CO2 = Ca(HCO3)2 (образуется прозрачный раствор, так как гидрокарбонат растворим).
При образовании кислой соли был взят избыток углекислого газа (или недостаток гидроксида кальция).
Оксиды, соответствующие трехосновным кислотам (см.Классификация кислот)
, могут образовывать не одну кислую соль, а несколько:
6NaOH + P2O5 = 2Na3PO4 + 3H2O (образуется фосфат натрия, средняя соль).
4NaOH + P2O5 = 2Na2HPO4 + H2O (образуется гидрофосфат натрия, кислая соль).
2NaOH + P2O5 + H2O = 2NaH2PO4 (образуется дигидрофосфат натрия, кислая соль)
Из этих трех реакций можно сделать вывод: чем меньше взято щелочи, тем кислее будет соль.
Если оксид соответствует одноосновной кислоте, то при его реакции с основаниями будут образовываться только средние соли:
2KOH + Cl2O = 2KClO + H2O (Cl2O соответствует кислоте HClO)
NaOH + Mn2O7 = NaMnO4 + H2O (Mn2O7 соответствует кислоте HMnO4)
- Соль + кислотный оксид = кислая соль.
Оксид должен соответствовать двухосновной или многоосновной кислоте, оксид должен совпадать с кислотным остатком, уже имеющимся в соли, реакция идет в растворах или при наличии воды в окружающей среде.
Примеры:
CaCO3 + CO2 + H2O = Ca(HCO3)2 (мутный раствор становится прозрачным).
Na2SO3 + SO2 + H2O = 2NaHSO3
Одни кислотные оксиды могут вытеснять другие кислотные оксиды из солей:
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
Nакая реакция происходит, когда засыхает силикатный клей. В тюбике с клеем содержится раствор силиката натрия, при выдыхании человек выделяет углекислый газ, который взаимодействует с силикатом натрия с образованием кремниевой кислоты, которая при высыхании полимеризуется, склеивая бумагу.
Na2CO3 + SiO2 = Na2SiO3 + CO2 (такая реакция происходит при нагревании).
Оксиды, соответствующие более сильным кислотам, вытесняют из соединений оксиды, соответствующие менее сильным кислотам:
Na2CO3 + SO3 = Na2SO4 + CO2
Оксид серы VI (SO3) соответствует сильной серной кислоте, а углекислый газ (CO2) – слабой угольной кислоте, поэтому оксид серы вытесняет оксид углерода.
- Оксид фосфора отнимает у кислородсодержащих кислот воду, при этом образуется фосфорная кислота и оксид, соответствующий исходной кислоте (основной элемент оксида имеет такую же степень окисления, как в исходной кислоте):
2HNO3 + P2O5 = 2HPO3 + N2O5
HClO4 + P2O5 = HPO3 + Cl2O7
Прежде чем начать говорить про химические свойства оксидов, нужно вспомнить о том, что все оксиды делятся на 4 типа, а именно основные, кислотные, амфотерные и несолеобразующие.
Для того чтобы определить тип какого-либо оксида, прежде всего нужно понять — оксид металла или неметалла перед вами, а затем воспользоваться алгоритмом (его надо выучить!), представленным в следующей таблице:
| Оксид неметалла | Оксид металла |
| 1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам | 1) Степень окисления металла +1 или +2 Вывод: оксид металла — основный Исключение: BeO, ZnO и PbO не относятся к основным оксидам |
| 2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 | 2) Степень окисления металла +3 или +4 Вывод: оксид амфотерный Исключение: BeO, ZnO и PbO амфотерны, несмотря на степень окисления +2 у металлов 3) Степень окисления металла +5, +6, +7 Вывод: оксид кислотный |
Помимо типов оксидов, указанных выше, введем также еще два подтипа основных оксидов, исходя из их химической активности, а именно активные основные оксиды и малоактивные основные оксиды.
- К активным основным оксидам отнесем оксиды щелочных и щелочноземельных металлов (все элементы IA и IIA групп, кроме водорода H, бериллия Be и магния Mg). Например, Na2O, CaO, Rb2O, SrO и т.д.
- К малоактивным основным оксидам отнесем все основные оксиды, которые не попали в список активных основных оксидов. Например, FeO, CuO, CrO и т.д.
Логично предположить, что активные основные оксиды часто вступают в те реакции, в которые не вступают малоактивные.
Следует отметить, что несмотря на то что фактически вода является оксидом неметалла (H2O), обычно ее свойства рассматривают в отрыве от свойств иных оксидов. Обусловлено это ее специфически огромным распространением в окружающем нас мире, в связи с чем в большинстве случаев вода является не реагентом, а средой, в которой может осуществляться бесчисленное множество химических реакций. Однако нередко она принимает и непосредственное участие в различных превращениях, в частности, некоторые группы оксидов с ней реагируют.
Какие оксиды реагируют с водой?
Из всех оксидов с водой реагируют только:
1) все активные основные оксиды (оксиды ЩМ и ЩЗМ);
2) все кислотные оксиды, кроме диоксида кремния (SiO2);
т.е. из вышесказанного следует, что с водой точно не реагируют:
1) все малоактивные основные оксиды;
2) все амфотерные оксиды;
3) несолеобразующие оксиды (NO, N2O, CO, SiO).
Примечание:
Оксид магния медленно реагирует с водой при кипячении. Без сильного нагревания реакция MgO с H2O не протекает.
Способность определить то, какие оксиды могут реагировать с водой даже без умения писать соответствующие уравнения реакций, уже позволяет получить баллы за некоторые вопросы тестовой части ЕГЭ.
Теперь давайте разберемся, как же все-таки те или иные оксиды реагируют с водой, т.е. научимся писать соответствующие уравнения реакций.
Активные основные оксиды, реагируя с водой, образуют соответствующие им гидроксиды. Напомним, что соответствующим оксиду металла является такой гидроксид, который содержит металл в той же степени окисления, что и оксид. Так, например, при реакции с водой активных основных оксидов K+12O и Ba+2O образуются соответствующие им гидроксиды K+1OH и Ba+2(OH)2:
K2O + H2O = 2KOH – гидроксид калия
BaO + H2O = Ba(OH)2 – гидроксид бария
Все гидроксиды, соответствующие активным основным оксидам (оксидам ЩМ и ЩЗМ), относятся к щелочам. Щелочами называют все хорошо растворимые в воде гидроксиды металлов, а также малорастворимый гидроксид кальция Ca(OH)2 (как исключение).
Взаимодействие кислотных оксидов с водой так же, как и реакция активных основных оксидов с водой, приводит к образованию соответствующих гидроксидов. Только в случае кислотных оксидов им соответствуют не основные, а кислотные гидроксиды, чаще называемые кислородсодержащими кислотами. Напомним, что соответствующей кислотному оксиду является такая кислородсодержащая кислота, которая содержит кислотообразующий элемент в той же степени окисления, что и в оксиде.
Таким образом, если мы, например, хотим записать уравнение взаимодействия кислотного оксида SO3 с водой, прежде всего мы должны вспомнить основные, изучаемые в рамках школьной программы, серосодержащие кислоты. Таковыми являются сероводородная H2S, сернистая H2SO3 и серная H2SO4 кислоты. Cероводородная кислота H2S, как легко заметить, не является кислородсодержащей, поэтому ее образование при взаимодействии SO3 с водой можно сразу исключить. Из кислот H2SO3 и H2SO4 серу в степени окисления +6, как в оксиде SO3, содержит только серная кислота H2SO4. Поэтому именно она и будет образовываться в реакции SO3 с водой:
H2O + SO3 = H2SO4
Аналогично оксид N2O5, содержащий азот в степени окисления +5, реагируя с водой, образует азотную кислоту HNO3, но ни в коем случае не азотистую HNO2, поскольку в азотной кислоте степень окисления азота, как и в N2O5, равна +5, а в азотистой — +3:
N+52O5 + H2O = 2HN+5O3
Исключение:
Оксид азота (IV) (NO2) является оксидом неметалла в степени окисления +4, т.е. в соответствии с алгоритмом, описанным в таблице в самом начале данной главы, его нужно отнести к кислотным оксидам. Однако не существует такой кислоты, которая содержала бы азот в степени окисления +4.
В случае оксида NO2 принято считать, что ему соответствуют сразу две кислоты, поскольку его взаимодействие с водой приводит к одновременному образованию двух кислот:
2NO2 + H2O = HNO2 + HNO3
Взаимодействие оксидов друг с другом
Прежде всего нужно четко усвоить тот факт, что среди солеобразующих оксидов (кислотных, основных, амфотерных) практически никогда не протекают реакции между оксидами одного класса, т.е. в подавляющем большинстве случаев невозможно взаимодействие:
1) основный оксид + основный оксид ≠
2) кислотный оксид + кислотный оксид ≠
3) амфотерный оксид + амфотерный оксид ≠
В то время, как практически всегда возможно взаимодействие между оксидами, относящимися к разным типам, т.е. практически всегда протекают реакции между:
1) основным оксидом и кислотным оксидом;
2) амфотерным оксидом и кислотным оксидом;
3) амфотерным оксидом и основным оксидом.
В результате всех таких взаимодействий всегда продуктом является средняя (нормальная) соль.
Рассмотрим все указанные пары взаимодействий более детально.
В результате взаимодействия:
MexOy + кислотный оксид, где MexOy – оксид металла (основный или амфотерный)
образуется соль, состоящая из катиона металла Me (из исходного MexOy) и кислотного остатка кислоты, соответствующей кислотному оксиду.
Для примера попробуем записать уравнения взаимодействия следующих пар реагентов:
Na2O + P2O5 и Al2O3 + SO3
В первой паре реагентов мы видим основный оксид (Na2O) и кислотный оксид (P2O5). Во второй – амфотерный оксид (Al2O3) и кислотный оксид (SO3).
Как уже было сказано, в результате взаимодействия основного/амфотерного оксида с кислотным образуется соль, состоящая из катиона металла (из исходного основного/амфотерного оксида) и кислотного остатка кислоты, соответствующей исходному кислотному оксиду.
Таким образом, при взаимодействии Na2O и P2O5 должна образоваться соль, состоящая из катионов Na+ (из Na2O) и кислотного остатка PO43-, поскольку оксиду P+52O5 соответствует кислота H3P+5O4. Т.е. в результате такого взаимодействия образуется фосфат натрия:
3Na2O + P2O5 = 2Na3PO4 — фосфат натрия
В свою очередь, при взаимодействии Al2O3 и SO3 должна образоваться соль, состоящая из катионов Al3+ (из Al2O3) и кислотного остатка SO42-, поскольку оксиду S+6O3 соответствует кислота H2S+6O4. Таким образом, в результате данной реакции получается сульфат алюминия:
Al2O3 + 3SO3 = Al2(SO4)3 — сульфат алюминия
Более специфическим является взаимодействие между амфотерными и основными оксидами. Данные реакции осуществляют при высоких температурах, и их протекание возможно благодаря тому, что амфотерный оксид фактически берет на себя роль кислотного. В результате такого взаимодействия образуется соль специфического состава, состоящая из катиона металла, образующего исходный основный оксид и «кислотного остатка»/аниона, в состав которого входит металл из амфотерного оксида. Формулу такого «кислотного остатка»/аниона в общем виде можно записать как MeO2x—, где Me – металл из амфотерного оксида, а х = 2 в случае амфотерных оксидов с общей формулой вида Me+2O (ZnO, BeO, PbO) и x = 1 – для амфотерных оксидов с общей формулой вида Me+32O3 (например, Al2O3, Cr2O3 и Fe2O3).
Попробуем записать в качестве примера уравнения взаимодействия
ZnO + Na2O и Al2O3 + BaO
В первом случае ZnO является амфотерным оксидом с общей формулой Me+2O, а Na2O – типичный основный оксид. Согласно сказанному выше, в результате их взаимодействия должна образоваться соль, состоящая из катиона металла, образующего основный оксид, т.е. в нашем случае Na+ (из Na2O) и «кислотного остатка»/аниона c формулой ZnO22-, поскольку амфотерный оксид имеет общую формулу вида Me+2O. Таким образом, формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Na2ZnO2:
ZnO + Na2O =to=> Na2ZnO2
В случае взаимодействующей пары реагентов Al2O3 и BaO первое вещество является амфотерным оксидом с общей формулой вида Me+32O3, а второе — типичным основным оксидом. В этом случае образуется соль, содержащая катион металла из основного оксида, т.е. Ba2+ (из BaO) и «кислотного остатка»/аниона AlO2—. Т.е. формула получаемой соли при соблюдении условия электронейтральности одной ее структурной единицы («молекулы») будет иметь вид Ba(AlO2)2, а само уравнение взаимодействия запишется как:
Al2O3 + BaO =to=> Ba(AlO2)2
Как мы уже писали выше, практически всегда протекает реакция:
MexOy + кислотный оксид,
где MexOy – либо основный, либо амфотерный оксид металла.
Однако следует запомнить два «привередливых» кислотных оксида – углекислый газ (CO2) и сернистый газ (SO2). «Привередливость» их заключается в том, что несмотря на явные кислотные свойства, активности CO2 и SO2 недостаточно для их взаимодействия с малоактивными основными и амфотерными оксидами. Из оксидов металлов они реагируют только с активными основными оксидами (оксидами ЩМ и ЩЗМ). Так, например, Na2O и BaO, являясь активными основными оксидами, могут с ними реагировать:
CO2 + Na2O = Na2CO3
SO2 + BaO = BaSO3
В то время, как оксиды CuO и Al2O3, не относящиеся к активным основным оксидам, в реакцию с CO2 и SO2 не вступают:
CO2 + CuO ≠
CO2 + Al2O3 ≠
SO2 + CuO ≠
SO2 + Al2O3 ≠
Взаимодействие оксидов с кислотами
С кислотами реагируют основные и амфотерные оксиды. При этом образуются соли и вода:
FeO + H2SO4 = FeSO4 + H2O
Несолеобразующие оксиды не реагируют с кислотами вообще, а кислотные оксиды не реагируют с кислотами в большинстве случаев.
Когда все-таки кислотный оксид реагирует с кислотой?
Решая часть ЕГЭ с вариантами ответа, вы должны условно считать, что кислотные оксиды не реагируют ни с кислотными оксидами, ни с кислотами, за исключением следующих случаев:
1) диоксид кремния, будучи кислотным оксидом, реагирует с плавиковой кислотой, растворяясь в ней. В частности, благодаря этой реакции в плавиковой кислоте можно растворить стекло. В случае избытка HF уравнение реакции имеет вид:
SiO2 + 6HF = H2[SiF6] + 2H2O,
а в случае недостатка HF:
SiO2 + 4HF = SiF4 + 2H2O
2) SO2, будучи кислотным оксидом, легко реагирует с сероводородной кислотой H2S по типу сопропорционирования:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
3) Оксид фосфора (III) P2O3 может реагировать с кислотами-окислителями, к которым относятся концентрированная серная кислота и азотная кислота любой концентрации. При этом степень окисления фосфора повышается от значения +3 до +5:
| P2O3 | + | 2H2SO4 | + | H2O | =to=> | 2SO2 | + | 2H3PO4 |
| (конц.) |
| 3P2O3 | + | 4HNO3 | + | 7H2O | =to=> | 4NO↑ | + | 6H3PO4 |
| (разб.) |
| P2O3 | + | 4HNO3 | + | H2O | =to=> | 2H3PO4 | + | 4NO2↑ |
| (конц.) |
4) Оксид серы (IV) SO2 может быть окислен азотной кислотой, взятой в любой концентрации. При этом степень окисления серы повышается с +4 до +6.
| 2HNO3 | + | SO2 | =to=> | H2SO4 | + | 2NO2↑ |
| (конц.) |
| 2HNO3 | + | 3SO2 | + | 2H2O | =to=> | 3H2SO4 | + | 2NO↑ |
| (разб.) |
Взаимодействие оксидов с гидроксидами металлов
С гидроксидами металлов как основными, так и амфотерными реагируют кислотные оксиды. При этом образуется соль, состоящая из катиона металла (из исходного гидроксида металла) и кислотного остатка кислоты, соответствующей кислотному оксиду.
SO3 + 2NaOH = Na2SO4 + H2O
Кислотные оксиды, которым соответствуют многоосновные кислоты, с щелочами могут образовывать как нормальные, так и кислые соли:
CO2 + 2NaOH = Na2CO3 + H2O
CO2 + NaOH = NaHCO3
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 4KOH = 2K2HPO4 + H2O
P2O5 + 2KOH + H2O = 2KH2PO4
«Привередливые» оксиды CO2 и SO2, активности которых, как уже было сказано, не хватает для протекания их реакции с малоактивными основными и амфотерными оксидами, тем не менее, реагируют с большей частью соответствующих им гидроксидов металлов. Точнее, углекислый и сернистый газы взаимодействуют с нерастворимыми гидроксидами в виде их суспензии в воде. При этом образуются только основные соли, называемые гидроксокарбонатами и гидроксосульфитами, а образование средних (нормальных) солей невозможно:
2Zn(OH)2 + CO2 = (ZnOH)2CO3 + H2O (в растворе)
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (в растворе)
Однако с гидроксидами металлов в степени окисления +3, например, такими, как Al(OH)3, Cr(OH)3 и т.д., углекислый и сернистый газ не реагируют вовсе.
Следует отметить также особую инертность диоксида кремния (SiO2), в природе наиболее часто встречаемого в виде обычного песка. Данный оксид является кислотным, однако из гидроксидов металлов способен реагировать только с концентрированными (50-60%) растворами щелочей, а также с чистыми (твердыми) щелочами при сплавлении. При этом образуются силикаты:
2NaOH + SiO2 =to=> Na2SiO3 + H2O
Амфотерные оксиды из гидроксидов металлов реагируют только со щелочами (гидроксидами щелочных и щелочноземельных металлов). При этом при проведении реакции в водных растворах образуются растворимые комплексные соли:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] — тетрагидроксоалюминат натрия
А при сплавлении этих же амфотерных оксидов со щелочами получаются соли, состоящие из катиона щелочного или щелочноземельного металла и аниона вида MeO2x—, где x = 2 в случае амфотерного оксида типа Me+2O и x = 1 для амфотерного оксида вида Me2+2O3:
ZnO + 2NaOH =to=> Na2ZnO2 + H2O
BeO + 2NaOH =to=> Na2BeO2 + H2O
Al2O3 + 2NaOH =to=> 2NaAlO2 + H2O
Cr2O3 + 2NaOH =to=> 2NaCrO2 + H2O
Fe2O3 + 2NaOH =to=> 2NaFeO2 + H2O
Следует отметить, что соли, получаемые сплавлением амфотерных оксидов с твердыми щелочами, могут быть легко получены из растворов соответствующих комплексных солей их упариванием и последующим прокаливанием:
Na2[Zn(OH)4] =to=> Na2ZnO2 + 2H2O
Na[Al(OH)4] =to=> NaAlO2 + 2H2O
Взаимодействие оксидов со средними солями
Чаще всего средние соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO2) и углекислый (CO2) газы соответственно. Например:
Al2O3 + Na2CO3 =to=> 2NaAlO2 + CO2
SiO2 + K2SO3 =to=> K2SiO3 + SO2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K2СO3 + SO2 = K2SO3 + CO2
ОВР с участием оксидов
Восстановление оксидов металлов и неметаллов
Аналогично тому, как металлы могут реагировать с растворами солей менее активных металлов, вытесняя последние в свободном виде, оксиды металлов при нагревании также способны реагировать с более активными металлами.
Напомним, что сравнить активность металлов можно либо используя ряд активности металлов, либо, если одного или сразу двух металлов нет в ряду активности, по их положению относительно друг друга в таблице Менделеева: чем ниже и левее металл, тем он более активен. Также полезно помнить, что любой металл из семейства ЩМ и ЩЗМ будет всегда активнее металла, не являющегося представителем ЩМ или ЩЗМ.
В частности, на взаимодействии металла с оксидом менее активного металла основан метод алюмотермии, используемый в промышленности для получения таких трудновосстанавливаемых металлов, как хром и ванадий:
Cr2O3 + 2Al =to=> Al2O3 + 2Cr
При протекании процесса алюмотермии образуется колоссальное количество тепла, а температура реакционной смеси может достигать более 2000oC.
Также оксиды практически всех металлов, находящихся в ряду активности правее алюминия, могут быть восстановлены до свободных металлов водородом (H2), углеродом (C) и угарным газом (CO) при нагревании. Например:
Fe2O3 + 3CO =to=> 2Fe + 3CO2
CuO + C =to=> Cu + CO
FeO + H2 =to=> Fe + H2O
Следует отметить, что в случае, если металл может иметь несколько степеней окисления, при недостатке используемого восстановителя возможно также неполное восстановление оксидов. Например:
Fe2O3 + CO =to=> 2FeO + CO2
4CuO + C =to=> 2Cu2O + CO2
Оксиды активных металлов (щелочных, щелочноземельных, магния и алюминия) с водородом и угарным газом не реагируют.
Однако оксиды активных металлов реагируют с углеродом, но иначе, чем оксиды менее активных металлов.
В рамках программы ЕГЭ, чтобы не путаться, следует считать, что в результате реакции оксидов активных металлов (до Al включительно) с углеродом образование свободного ЩМ, ЩЗМ, Mg, а также Al невозможно. В таких случаях происходит образование карбида металла и угарного газа. Например:
2Al2O3 + 9C =to=> Al4C3 + 6CO
CaO + 3C =to=> CaC2 + CO
Оксиды неметаллов нередко могут быть восстановлены металлами до свободных неметаллов. Так, например, оксиды углерода и кремния при нагревании реагируют с щелочными, щелочноземельными металлами и магнием:
CO2 + 2Mg =to=> 2MgO + C
SiO2 + 2Mg =to=> Si + 2MgO
При избытке магния последнее взаимодействие может приводить также к образованию силицида магния Mg2Si:
SiO2 + 4Mg =to=> Mg2Si + 2MgO
Оксиды азота могут быть относительно легко восстановлены даже менее активными металлами, например, цинком или медью:
Zn + 2NO =to=> ZnO + N2
2NO2 + 4Cu =to=> 4CuO + N2
Взаимодействие оксидов с кислородом
Для того чтобы в заданиях реального ЕГЭ суметь ответить на вопрос, реагирует ли какой-либо оксид с кислородом (O2), прежде всего нужно запомнить, что оксиды, способные реагировать с кислородом (из тех, что могут попасться вам на самом экзамене) могут образовать только химические элементы из списка:
углерод С, кремний Si, фосфор P, сера S, медь Cu, марганец Mn, железо Fe, хром Cr, азот N
Встречающиеся в реальном ЕГЭ оксиды любых других химических элементов с кислородом реагировать не будут (!).
Для более наглядного удобного запоминания перечисленных выше списка элементов, на мой взгляд, удобна следующая иллюстрация:
В первую очередь, среди перечисленных элементов следует рассмотреть азот N, т.к. отношение его оксидов к кислороду заметно отличается от оксидов остальных элементов приведенного выше списка.
Следует четко запомнить тот факт, что всего азот способен образовать пять оксидов, а именно:
Из всех оксидов азота с кислородом может реагировать только NO. Данная реакция протекает очень легко при смешении NO как с чистым кислородом, так и с воздухом. При этом наблюдается быстрое изменение окраски газа с бесцветной (NO) на бурую (NO2):
| 2NO | + | O2 | = | 2NO2 |
| бесцветный | бурый |
Для того чтобы дать ответ на вопрос — реагирует ли с кислородом какой-либо оксид любого другого из перечисленных выше химических элементов (т.е. С, Si, P, S, Cu, Mn, Fe, Cr) — прежде всего обязательно нужно запомнить их основные степени окисления (СО). Вот они:
| элемент | С | Si | P | S | Cu | Cr | Mn | Fe |
| его основные положительные СО | +2, +4 | +2, +4 | +3, +5 | +4, +6 | +1, +2 | +2, +3, +6 | +2, +4, +6, +7 | +2, +3, +6 |
Далее нужно запомнить тот факт, что из возможных оксидов указанных выше химических элементов, с кислородом будут реагировать только те, которые содержат элемент в минимальной, среди указанных выше, степени окисления. При этом степень окисления элемента повышается до ближайшего положительного значения из возможных:
| элемент |
Отношение его оксидов к кислороду |
| С |
Минимальная среди основных положительных степеней окисления углерода равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов C+2O и C+4O2 реагирует только CO. При этом протекает реакция: 2C+2O + O2 =to=> 2C+4O2 CO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления углерода. |
| Si |
Минимальная среди основных положительных степеней окисления кремния равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из оксидов Si+2O и Si+4O2 реагирует только SiO. Из-за некоторых особенностей оксидов SiO и SiO2 возможно окисление лишь части атомов кремния в оксиде Si+2O. Т.е. в результате его взаимодействия с кислородом, образуется смешанный оксид, содержащий как кремний в степени окисления +2, так и кремний в степени окисления +4, а именно Si2O3 (Si+2O·Si+4O2): 4Si+2O + O2 =to=> 2Si+2,+42O3 (Si+2O·Si+4O2) SiO2 + O2 ≠ — реакция невозможна в принципе, т.к. +4 – высшая степень окисления кремния. |
| P |
Минимальная среди основных положительных степеней окисления фосфора равна +3, а ближайшая к нему положительная — +5. Таким образом, с кислородом из оксидов P+32O3 и P+52O5 реагирует только P2O3. При этом протекает реакция доокисления фосфора кислородом от степени окисления +3 до степени окисления +5: P+32O3 + O2 =to=> P+52O5 P+52O5 + O2 ≠ — реакция невозможна в принципе, т.к. +5 – высшая степень окисления фосфора. |
| S |
Минимальная среди основных положительных степеней окисления серы равна +4, а ближайшая к ней по значению положительная — +6. Таким образом, с кислородом из оксидов S+4O2, S+6O3 реагирует только SO2. При этом протекает реакция: 2S+4O2 + O2 =to=> 2S+6O3 2S+6O3 + O2 ≠ — реакция невозможна в принципе, т.к. +6 – высшая степень окисления серы. |
| Cu |
Минимальная среди положительных степеней окисления меди равна +1, а ближайшая к ней по значению — положительная (и единственная) +2. Таким образом, с кислородом из оксидов Cu+12O, Cu+2O реагирует только Cu2O. При этом протекает реакция: 2Cu+12O + O2 =to=> 4Cu+2O CuO + O2 ≠ — реакция невозможна в принципе, т.к. +2 – высшая степень окисления меди. |
| Cr |
Минимальная среди основных положительных степеней окисления хрома равна +2, а ближайшая к ней по значению положительная равна +3. Таким образом, с кислородом из оксидов Cr+2O, Cr+32O3 и Cr+6O3 реагирует только CrO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +3: 4Cr+2O + O2 =to=> 2Cr+32O3 Cr+32O3 + O2 ≠ — реакция не протекает, несмотря на то что существует оксид хрома и в большей, чем +3, степени окисления (Cr+6O3). Невозможность протекания данной реакции связана с тем, что требуемый для ее гипотетического осуществления нагрев сильно превышает температуру разложения оксида CrO3. Cr+6O3 + O2 ≠ — данная реакция не может протекать в принципе, т.к. +6 – высшая степень окисления хрома. |
| Mn |
Минимальная среди основных положительных степеней окисления марганца равна +2, а ближайшая к ней положительная — +4. Таким образом, с кислородом из возможных оксидов Mn+2O, Mn+4O2, Mn+6O3 и Mn+72O7 реагирует только MnO, при этом окисляясь кислородом до соседней (из возможных) положительной степени окисления, т.е. +4: 2Mn+2O + O2 =to=> 2Mn+4O2 в то время, как: Mn+4O2 + O2 ≠ и Mn+6O3 + O2 ≠ — реакции не протекают, несмотря на то что существует оксид марганца Mn2O7, содержащий Mn в большей, чем +4 и +6, степени окисления. Связанно это с тем, что требуемый для дальнейшего гипотетического окисления оксидов Mn+4O2 и Mn+6O3 нагрев существенно превышает температуру разложения получаемых оксидов MnO3 и Mn2O7. Mn+72O7 + O2 ≠ — данная реакция невозможна в принципе, т.к. +7 – высшая степень окисления марганца. |
| Fe |
Минимальная среди основных положительных степеней окисления железа равна +2, а ближайшая к ней среди возможных — +3. Несмотря на то что для железа существует степень окисления +6, кислотного оксида FeO3, впрочем, как и соответствующей ему «железной» кислоты не существует. Таким образом, из оксидов железа с кислородом могут реагировать только те оксиды, которые содержат Fe в степени окисления +2. Это либо оксид Fe+2O, либо смешанный оксид железа Fe+2,+33O4 (железная окалина): 4Fe+2O + O2 =to=> 2Fe+32O3 или 6Fe+2O + O2 =to=> 2Fe+2,+33O4 смешанный оксид Fe+2,+33O4 может быть доокислен до Fe+32O3: 4Fe+2,+33O4 + O2 =to=> 6Fe+32O3 Fe+32O3 + O2≠ — протекание данной реакции невозможно в принципе, т.к. оксидов, содержащих железо в степени окисления выше, чем +3, не существует. |
Автор: С.И. Широкопояс https://scienceforyou.ru/

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)