Физические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Способ получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Качественная реакция
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет.
Химические свойства
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом. При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
1.5. Литий реагирует с углеродом с образованием карбида:
2Li + 2C = Li2C2
1.6. При взаимодействии с кислородом литий образует оксид.
4Li + O2 = 2Li2O
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой. Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li0 + H2+O = 2Li+OH + H20
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, литий бурно реагирует с соляной кислотой:
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2Li + 3H2SO4(конц.) = 2LiHSO4 + SO2↑ +2H2O
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства. Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами, фенолом и органическими кислотами.
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
2.6. В расплаве литий может взаимодействовать с некоторыми солями. Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например, литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за
их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при
высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид,
натрий — пероксид, калий, рубидий и цезий — супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления
+1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет».
Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный,
цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из
пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции
щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется
газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов —
смешанных оксидов (при высоких температурах — прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3
и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной,
и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Литий
Литий — химический элемент 2-го периода, 1-й группы в периодической системе Менделеева. Данное название получил от собственного местонахождения (в «камнях», от греч. λίθος), в дальнейшем название видоизменялось. Представляет собой щелочной металл с атомным номером 3.
Изотопы
Литий природного происхождения состоит из двух изотопов: 6Li и 7Li, являющихся стабильными. 7Li входит в несчетно малое число изотопов, произошедших при таком процессе, как нуклеосинтез. Также, у лития существует 7 радиоактивных изотопов искусственного происхождения и 2 атомных изомера. Большей устойчивость среди них обладает 8Li.
Физические свойства лития
- Мягкий и пластичный металл с серебряно-белым окрасом
- Имеет способность к обработке прессом или прокатом
- При нормальных условиях имеет кристаллическую решетку в виде куба
- Температура плавления-180,54°С, кипения-1340 °C
- Низкая плотность
- Из-за малых размеров атома, литий имеет специфические свойства смешивания с другими металлами.
Химические свойства
Литий является самым неактивным среди щелочных металлов, оттого при комнатной температуре почти не вступает в реакции даже с воздухом (сухим). С тесанием долгого времени и только во влажном воздухе взаимодействует с азотом и прочими газами. При нагревании вступает в реакцию с кислородом, образуя оксид лития. Интересен и тот факт, что в пределах температур от 100°С до 300°С литий покрывается плотным слоем оксидный пленки, что позволяет ему не окисляться в дальнейшем. Качественные реакции заключаются в том, что литий и его соединения придают пламени красноватый оттенок. Спокойно протекает реакция лития с водой. Реагирует с рядом веществ: водород, аммиак и галогены (в большинстве случаев только при наличии определенной температуры). Взаимодействует и с такими веществами, как сера,углерод и кремний. Реагирует также с этиловым спиртом.
Геохимия лития
По степени распространенности относится к литофильным элементам (составляющие ~93 % массы земной коры и ~97 % массы солевого состава океанической воды). Основные его минералы — пироксен сподумен и слюда лепидолит. В случае, если литий не образовывает отдельные минералы, он в широких масштабах замещает калий в породообразующих минералах.
Его месторождениями является не только земля, но и рассолы немногих озёр. Также, необычайно высока концентрация лития в звездных образованиях, состоящих из сверхгиганта.
Широко применение лития в данных сферах:
- Как источник тока
- Материалы для смазки
- Регенерация кислорода
- Металлургия алюминия
- Фармацевтика
- Керамика и стекло
- Полимеры
- Безостановочная разливка стали
- Окислители
- Пиротехника
- Сплавы
- Электроника и радиоэлектроника
- Ядерная энергетика
- Сушка газов
- Медицина
- Текстильная промышленность
- Пищевая промышленность.
Биологическая роль лития
Так как литий участвует во многих важнейших для человека биологических процессах, его наличие в организме как микроэлемента незаменимо и достигает до 200 мкг/день для взрослого человека. В большей степени располагается в лимфоузлах, сердце, печени, кишечнике, щитовидной железе, лёгких, надпочечниках и в плазме крови.
Процессы, в которых литий принимает активное участие:
- Понижает уровень нервной возбудимости
- Поддерживает в норме иммунную систему
- Предупреждает возникновение аллергии
- Принимает участие в обменах углеродами и жирами
Помимо этого, литейные препараты нашли весьма обширное применение в профилактике и лечении психических расстройств. Выведение же лития из организма человека происходит главным образом через почки.
По материалам сайта chemicalportal.ru
2.2.1. Характерные химические свойства щелочных металлов.
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1 гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
| Литий | |
|---|---|
| Очень лёгкий, очень мягкий металл серебристо-белого цвета | |

Литий |
|
| Название, символ, номер | литий / Lithium (Li), 3 |
| Атомная масса (молярная масса) |
[6,938; 6,997]а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s1 |
| Радиус атома | 145 пм |
| Ковалентный радиус | 134 пм |
| Радиус иона | 76 (+1e) пм |
| Электроотрицательность | 0,98 (шкала Полинга) |
| Электродный потенциал | -3,06В |
| Степени окисления | +1 |
| Энергия ионизации (первый электрон) |
519,9 (5,39) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,534 г/см³ |
| Температура плавления | 453,69 K (180,54 °C, 356,97 °F) |
| Температура кипения | 1613 K (1339,85 °C, 2443,73 °F) |
| Уд. теплота плавления | 2,89 кДж/моль |
| Уд. теплота испарения | 148 кДж/моль |
| Молярная теплоёмкость | 24,86 Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,490 Å |
| Температура Дебая | 400 K |
| Теплопроводность | (300 K) 84,8 Вт/(м·К) |
| Номер CAS | 7439-93-2 |
Литий (Li, лат. lithium) — химический элемент первой группы, второго периода периодической системы с атомным номером 3. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета.
Содержание
- 1 История и происхождение названия
- 2 Физические свойства
- 3 Химические свойства
- 4 Нахождение в природе
- 4.1 Геохимия лития
- 4.2 Месторождения
- 4.3 Изотопы лития
- 4.4 В космосе
- 5 Получение
- 5.1 Добыча
- 6 Применение
- 6.1 Термоэлектрические материалы
- 6.2 Химические источники тока
- 6.3 Лазерные материалы
- 6.4 Окислители
- 6.5 Дефектоскопия
- 6.6 Пиротехника
- 6.7 Сплавы
- 6.8 Электроника
- 6.9 Металлургия
- 6.9.1 Металлургия алюминия
- 6.10 Ядерная энергетика
- 6.10.1 Литий-6
- 6.10.2 Литий-7
- 6.11 Сушка газов
- 6.12 Медицина
- 6.13 Смазочные материалы
- 6.14 Регенерация кислорода в автономных аппаратах
- 6.15 Силикатная промышленность
- 6.16 Прочие области применения
- 7 Биологическое значение лития
- 8 Цены
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите K2Li3Al5[Si6O20](F,OH)4. Металлический литий впервые получил Гемфри Дэви в 1818 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Карминово-красное окрашивание пламени солями лития
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать); он может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом и другими газами, находящимися в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3.
6Li + N2 ⟶ 2Li3N
2Li + 2H2O ⟶ 2LiOH + H2
Поэтому длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках.
В кислороде при нагревании горит, превращаясь в оксид Li2O.
4Li + O2 ⟶ 2Li2O
Интересная особенность лития в том, что в интервале температур от 100 °C до 300 °C он покрывается плотной оксидной плёнкой и в дальнейшем не окисляется. В отличие от остальных щелочных металлов, дающих стабильные надпероксиды и озониды; надпероксид и озонид лития — нестабильные соединения.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура самовоспламенения находится в районе 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2.
-
- 2Li + 2H2O → 2LiOH + H2
Реагирует также с этиловым спиртом (с образованием этанолята):
2Li + 2C2H5OH ⟶ 2C2H5OLi + H2
Вступает в реакцию с водородом (при 500—700 °C) с образованием гидрида лития:
2Li + H2 ⟶ 2LiH
Реагирует с аммиаком при нагревании, при этом сначала образует амид лития (220 °C), а затем имид лития (400 °C):
2Li + 2NH3 ⟶ 2LiNH2 + H2
2Li + NH3 ⟶ Li2NH + H2
Реагируя с галогенами (с йодом — только при нагревании, выше 200 °C) образует соответствующие галогениды:
2Li + F2 ⟶ 2LiF
2Li + Cl2 ⟶ 2LiCl
2Li + Br2 ⟶ 2LiBr
2Li + I2 ⟶ 2LiI
При 130 °C реагирует с серой с образованием сульфида:
2Li + S ⟶ Li2S
В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид):
2Li + 2C ⟶ Li2C2
При 600—700 °C литий реагирует с кремнием с образованием силицида:
4Li + Si ⟶ Li4Si
Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
В водном растворе ион лития имеет самый низкий стандартный электродный потенциал (−3,045 В) из-за малого размера и высокой степени гидратации иона лития.
Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л.
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10](F, OH)2 и пироксен сподумен — LiAl[Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространённых породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносолёных озёр.
Месторождения
Месторождения лития известны в Чили, Боливии (Солончак Уюни — крупнейшее в мире), США, Аргентине, Конго, Китае (озеро Чабьер-Цака), Бразилии, Сербии, Австралии.
В России более 50 % запасов сосредоточено в редкометалльных месторождениях Мурманской области.
Изотопы лития
Основная статья: Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6Li (7,5 %) и 7Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов (4Li − 12Li) и два ядерных изомера (10m1Li и 10m2Li). Наиболее устойчивый из них, 8Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3Li (трипротон), по-видимому, не существует как связанная система.
7Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть в период от 1 секунды до 3 минут после Большого Взрыва) в количестве не более 10−9 от всех элементов. Некоторое количество изотопа 6Li, как минимум в десять тысяч раз меньшее, чем 7Li, также образовано в первичном нуклеосинтезе.
Примерно в десять раз больше 7Li образовались в звёздном нуклеосинтезе. Литий является промежуточным продуктом реакции ppII, но при высоких температурах активно преобразуется в два ядра гелия-4 (через 8Be).
В космосе
Аномально высокое содержание лития наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житкова.
Также имеется большое количество звёзд-гигантов с необычно высоким содержанием лития, что объясняется попаданием лития в атмосферу звёзд при поглощении ими экзопланет-гигантов.
Получение
- Сырьё
Исходным сырьём для лития служат два источника: минеральное сырьё (например, сподумен) и солевые растворы из соляных озёр, богатые солями лития. В обоих случаях результатом работы является карбонат лития Li2CO3.
Сподумен (силикат лития и алюминия) можно перерабатывать несколькими способами. Например, спеканием с сульфатом калия получают растворимый сульфат лития, который осаждают из раствора содой:
- Li2SO4 + Na2CO3 ⟶ Li2CO3↓ + Na2SO4 .
Солевые растворы предварительно выпаривают. В солевых растворах содержится хлорид лития LiCl. Однако вместе с ним содержатся большие количества других хлоридов. Для увеличения концентрации лития из выпаренного раствора осаждают карбонат лития Li2CO3, например по схеме
- 2LiCl + Na2CO3 ⟶ Li2CO3↓ + 2NaCl.
- Получение металла
Металлический литий чаще всего получают электролизом расплава солей или восстановлением из оксида.
- Электролиз
При электролизе используется хлорид лития. Его получают из карбоната по схеме:
- Li2CO3 + 2HCl ⟶ 2LiCl + H2O + CO2.
Поскольку температура плавления хлорида лития близка к температуре кипения лития, применяют эвтектическую смесь с хлоридом калия или бария, что понижает температуру расплава и позволяет избавиться от необходимости улавливать пары металла. Расход электроэнергии до 14 кВт∙ч на 1 кг лития. На другом электроде получают газообразный хлор.
- Восстановление
Поскольку литий — активный металл, его восстановление из оксидов или галогенидов возможно только при немедленном удалении лития из зоны реакции. В противном случае невозможно сместить баланс реакции в нужную сторону. Литий удаляют из зоны реакции путём поддержания температур, при которых литий испаряется и покидает зону реакции в виде паров. Другие реагенты при этом должны оставаться в расплаве. Для восстановления используются кремний или алюминий, например:
- 2Li2O + Si ⟶ 4Li↑ + SiO2
- Рафинирование
Полученный литий очищают методом вакуумной дистилляции, последовательно выпаривая разные металлы из сплава при определённых температурах.
Добыча
В 2015 году в мире добыли 32,5 тыс. тонн лития и его соединений в пересчёте на металл. Крупнейшие страны по добыче — Австралия, Чили и Аргентина. В России собственная добыча лития была полностью утрачена после распада СССР, но в 2017 году Россия запустила экспериментальную установку, позволяющую добывать литий из бедных руд с небольшими затратами.
Большая часть добывается из естественных водных линз в толще соляных озёр, в насыщенных соляных растворах которых концентрируется хлорид лития. Раствор выкачивается и выпаривается на солнце, полученная смесь солей перерабатывается. Содержание лития в растворе колеблется от 0,01 % до 1 %. Также значительная доля добычи приходится на минеральное сырьё, например, минерал сподумен.
Применение
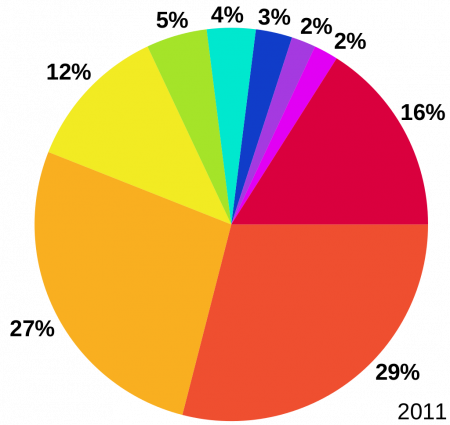
Оценка использования лития в мире в 2011 году: Керамика и стекло (29 %) Источники тока (27 %) Смазочные материалы (12 %) Непрерывная разливка стали (5 %) Регенерация кислорода (4 %) Полимеры (3 %) Металлургия алюминия (2 %) Фармацевтика (2 %) другое (16 %)
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Из лития изготовляют аноды химических источников тока (аккумуляторов, например, литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Сульфат лития используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике для окрашивания огней в красный цвет.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике (из-за их лёгкости). На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придаёт им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике.
Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Гидроксид лития добавляют в электролит щелочных аккумуляторов для увеличения срока их службы.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия, и его потребление растёт с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5—3,5 кг на тонну выплавляемого алюминия).
- Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления ёмкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6Li и 7Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Литий-6
Применяется в термоядерной энергетике.
При облучении нуклида 6Li тепловыми нейтронами получается радиоактивный тритий 3H:
- 36Li + 01n → 13H + 24He
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7
Применяется в ядерных реакторах. Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов жидкий литий-7 (часто в виде сплава с натрием или цезием) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Соединения лития, обогащённые по изотопу лития-7, применяются на реакторах PWR для поддержания водно-химического режима, а также в деминерализаторе первого контура. Ежегодная потребность США оценивается в 200—300 кг, производством обладают лишь Россия и Китай.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Основная статья: Препараты лития
Соли лития обладают нормотимическими и другими лечебными свойствами. Поэтому они находят применение в медицине.
Смазочные материалы
Стеарат лития («литиевое мыло») используется в качестве загустителя для получения пастообразных высокотемпературных смазок машин и механизмов. См. напр.: Литол, ЦИАТИМ-201.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 применяются для очистки воздуха от углекислого газа; при этом последнее соединение реагирует с выделением кислорода (например, 2Li2O2 + 2CO2 → 2Li2CO3 + O2), благодаря чему используется в изолирующих противогазах, в патронах для очистки воздуха на подлодках, на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Весьма перспективно использовать литий в качестве наполнителя поплавка батискафов — этот металл имеет плотность, почти в два раза меньшую, чем вода (точнее, 534 кг/м³), это значит, что один кубический метр лития может удерживать на плаву почти на 170 кг больше, чем один кубический метр бензина. Однако литий — щелочной металл, активно реагирующий с водой, следует каким-то образом надёжно разделить эти вещества, не допустить их контакта.
Из лития изготавливают аноды химических источников тока (например, литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, Литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил). Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов. Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития). Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом). Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп. Гидроксид лития добавляют в электролит щелочных аккумуляторов для увеличения срока их службы.
Биологическое значение лития
Литий в небольших количествах необходим организму человека (порядка 100 мкг/день для взрослых). Преимущественно в организме находится в щитовидной железе, лимфоузлах, сердце, печени, лёгких, кишечнике, плазме крови, надпочечниках.
Литий принимает участие в важных процессах:
- участвует в углеводном и жировом обменах;
- поддерживает иммунную систему;
- предупреждает возникновение аллергии;
- снижает нервную возбудимость.
Препараты лития широко используются в терапии психических расстройств.
Выделяется литий преимущественно почками.
Цены
По состоянию на конец 2007 — начало 2008 года, цены на металлический литий (чистота 99 %) составляли 63—66 долларов за 1 кг.
Теория по химии на тему «Литий»
- 14.09.2016
Очень полезная теория для подготовки к ЕГЭ по химии. В файле представлена очень интересная и нужная информация на тему «Литий».
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Литий: способы получения и химические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Качественная реакция
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет .
Химические свойства
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами .
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
1.5. Литий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом литий образует оксид.
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой . Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li 0 + H2 + O = 2 Li + OH + H2 0
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , литий бурно реагирует с соляной кислотой :
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
2.6. В расплаве литий может взаимодействовать с некоторыми солями . Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например , литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
Свойства лития. Реакции воды и некоторых кислот с литием
C какими веществами реагирует литий
Литий — металл первой группы второго периода в таблице Менделеева — был открыт в 1817 году. Сделал это открытие шведский ученый Иоганн Аугуст Арфведсон, когда он исследовал разные минералы. Элемент этот находился в петалите, сподумене и лепидолите. Немного позднее, в 1818 году, Гемфри Деви получил металлический литий.
Литий и его соединения являются незаменимыми химическими элементами в жизни человека. Литий используется во многих промышленных сферах:
- в производстве химических источников тока;
- в пиротехнике: нитрат лития придает огню красный цвет;
литий часто используется как металл для сплавов — с ним получаются легкие, но в тоже время прочные припои;
также литий используют в радиоэлектронике и ядерной энергетике;
в медицине широко применяют соли лития.
Вообще, в небольших количествах литий необходим для здоровья человека и поддерживает функционирование жизненно важных органов, таких как сердце, печень и легкие.
И это далеко не все сферы, где применяется этот металл и его соединения.
Физические свойства лития
Литий представляет собой щелочной металл серебристо-белого цвета. Он пластичен и легко поддается обработке: кубик металлического лития можно разрезать ножом.
Примечательно, что литий является единственным металлом из этой группы, который кипит и плавится при довольно высоких температурах: 1340 и 180,54 °С соответственно. Но также примечательно, что, по сравнению с «щелочными соседями», у лития самая низкая плотность (она в два раза меньше плотности воды). Из-за этого свойства литий не тонет даже в керосине.
Химические свойства
Литий относится к щелочной группе металлов, однако он устойчиво ведет себя на воздухе и практически не взаимодействует с кислородом, даже с сухим . Из-за необычных свойств лития — в отличие от других щелочных металлов — его не хранят в керосиновой жидкости. Кроме того, из-за малой плотности он держался бы на плаву. Хранить литий стоит в парафине, петролейном эфире, газолине или минеральном масле в герметичной жестяной упаковке.
Во влажном воздухе литий может вступать в медленные реакции с азотом и другими газами, которые входят в состав воздуха. При этом образуется: Li₃N, LiOH и Li₂CO₃ — нитрид, гидроксид и карбонат соответственно.
Другие химические свойства лития
При нагревании с кислородом литий сгорает с образованием оксида лития Li₂O.
Литий и его соли окрашивают пламя в карминно-красный цвет.
Такая качественная реакция на литий была установлена Леопольдом Гмелином в 1818 году.
При температурах от 100 до 300 °С на поверхности лития образуется плотная оксидная пленка, которая защищает металл от дальнейшего окисления. Литий легко реагирует с галогенами (кроме йода).
С водой литий реагирует спокойно: реакция не сопровождается возгоранием или взрывом.
Литий взаимодействует со спиртами, образуя алкоголяты.
При нагревании реагирует с серой, кремнием, йодом, водородом с образованием сульфида, силицида, йодида и гидрида лития.
Реакция лития с водой
Реакция проходит довольно спокойно. Если литий — как и все щелочные металлы — опустить в воду, начнет образовываться щелочь и выделяться водород, а металл будет плавать на поверхности и буквально таять на глазах. Реакция растворения лития в воде сопровождается характерным шипением.
Щелочь, образующаяся в растворе, — гидроксид лития LiOH. Он представляет собой кристаллы белого цвета и является довольно сильным основанием:
2Li + 2H₂O → 2LiOH + H₂↑
Реакция лития и серной кислоты
Если добавить небольшую пластинку лития в концентрированную серную кислоту, получится сульфат лития, сероводород и вода.
Внимание! Не пытайтесь повторить этот опыт самостоятельно! Здесь вы найдете безопасные эксперименты, которые можно проводить дома.
Сама по себе реакция опасна, особенно в домашних условиях, поскольку литий моментально загорается ярким пламенем:
8Li + 5H₂SO₄ → 4Li₂SO₄ + Н₂S + 4H₂O
С разбавленной серной кислотой литий взаимодействует с образованием сульфата лития и водорода.
2Li + H₂SO₄ → Li₂SO₄ + Н₂
Реакция лития с азотной кислотой
Если опустить кусочек лития в разбавленную азотную кислоту, образуется нитрат лития, нитрат аммония и вода:
8Li + 10HNO₃ → 8LiNO₃ + NH₄NO₃ + 3H₂O
С концентрированной азотной кислотой литий реагирует иначе. Продуктами реакции будут нитрат лития, вода и диоксид азота:
Li + 2HNO₃ → LiNO₃ +NO₂ + H₂O
Реакция с соляной кислотой
С соляной кислотой литий реагирует как и другие металлы — образуется хлорид лития и выделяется водород:
2Li + 2HCl = 2LiCl + H₂
Стоить отметить, что реакция лития и других щелочных металлов с кислотами идет неоднозначно, поскольку в растворах кислот содержится вода, с которой литий активно взаимодействует с образованием гидроксида лития, который вступает в реакцию с кислотами с образованием соли и воды.
Литий
| Литий |
|---|
| Очень лёгкий, очень мягкий металл серебристо-белого цвета |
 |
Название, символ, номерлитий / Lithium (Li), 3Атомная масса
(молярная масса)[6,938; 6,997]а. е. м. (г/моль)Электронная конфигурация[He] 2s 1Радиус атома145 пмКовалентный радиус134 пмРадиус иона76 (+1e) пмЭлектроотрицательность0,98 (шкала Полинга)Электродный потенциал-3,06ВСтепени окисления+1Энергия ионизации
(первый электрон)519,9 (5,39) кДж/моль (эВ)Плотность (при н. у.)0,534 г/см³Температура плавления453,69 K (180,54 °C, 356,97 °F)Температура кипения1613 K (1339,85 °C, 2443,73 °F)Уд. теплота плавления2,89 кДж/мольУд. теплота испарения148 кДж/мольМолярная теплоёмкость24,86 Дж/(K·моль)Молярный объём13,1 см³/мольСтруктура решёткикубическая объёмноцентрированнаяПараметры решётки3,490 ÅТемпература Дебая400 KТеплопроводность(300 K) 84,8 Вт/(м·К)Номер CAS7439-93-2
Литий (Li, лат. lithium ) — химический элемент первой группы, второго периода периодической системы с атомным номером 3. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета.
Содержание
- 1 История и происхождение названия
- 2 Физические свойства
- 3 Химические свойства
- 4 Нахождение в природе
- 4.1 Геохимия лития
- 4.2 Месторождения
- 4.3 Изотопы лития
- 4.4 В космосе
- 5 Получение
- 5.1 Добыча
- 6 Применение
- 6.1 Термоэлектрические материалы
- 6.2 Химические источники тока
- 6.3 Лазерные материалы
- 6.4 Окислители
- 6.5 Дефектоскопия
- 6.6 Пиротехника
- 6.7 Сплавы
- 6.8 Электроника
- 6.9 Металлургия
- 6.9.1 Металлургия алюминия
- 6.10 Ядерная энергетика
- 6.10.1 Литий-6
- 6.10.2 Литий-7
- 6.11 Сушка газов
- 6.12 Медицина
- 6.13 Смазочные материалы
- 6.14 Регенерация кислорода в автономных аппаратах
- 6.15 Силикатная промышленность
- 6.16 Прочие области применения
- 7 Биологическое значение лития
- 8 Цены
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите K2Li3Al5[Si6O20](F,OH)4. Металлический литий впервые получил Гемфри Дэви в 1818 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать); он может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом и другими газами, находящимися в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3.
Поэтому длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках.
В кислороде при нагревании горит, превращаясь в оксид Li2O.
Интересная особенность лития в том, что в интервале температур от 100 °C до 300 °C он покрывается плотной оксидной плёнкой и в дальнейшем не окисляется. В отличие от остальных щелочных металлов, дающих стабильные надпероксиды и озониды; надпероксид и озонид лития — нестабильные соединения.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура самовоспламенения находится в районе 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2.
Реагирует также с этиловым спиртом (с образованием этанолята):
Вступает в реакцию с водородом (при 500—700 °C) с образованием гидрида лития:
Реагирует с аммиаком при нагревании, при этом сначала образует амид лития (220 °C), а затем имид лития (400 °C):
Реагируя с галогенами (с йодом — только при нагревании, выше 200 °C) образует соответствующие галогениды:
При 130 °C реагирует с серой с образованием сульфида:
В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид):
При 600—700 °C литий реагирует с кремнием с образованием силицида:
Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
В водном растворе ион лития имеет самый низкий стандартный электродный потенциал (−3,045 В) из-за малого размера и высокой степени гидратации иона лития.
Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л .
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10](F, OH)2 и пироксен сподумен — LiAl[Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространённых породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносолёных озёр.
Месторождения
Месторождения лития известны в Чили, Боливии (Солончак Уюни — крупнейшее в мире), США, Аргентине, Конго, Китае (озеро Чабьер-Цака), Бразилии, Сербии, Австралии.
В России более 50 % запасов сосредоточено в редкометалльных месторождениях Мурманской области.
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов ( 4 Li − 12 Li) и два ядерных изомера ( 10m1 Li и 10m2 Li). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li (трипротон), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть в период от 1 секунды до 3 минут после Большого Взрыва) в количестве не более 10 −9 от всех элементов. Некоторое количество изотопа 6 Li, как минимум в десять тысяч раз меньшее, чем 7 Li, также образовано в первичном нуклеосинтезе.
Примерно в десять раз больше 7 Li образовались в звёздном нуклеосинтезе. Литий является промежуточным продуктом реакции ppII, но при высоких температурах активно преобразуется в два ядра гелия-4 (через 8 Be).
В космосе
Аномально высокое содержание лития наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житкова.
Также имеется большое количество звёзд-гигантов с необычно высоким содержанием лития, что объясняется попаданием лития в атмосферу звёзд при поглощении ими экзопланет-гигантов.
Получение
Исходным сырьём для лития служат два источника: минеральное сырьё (например, сподумен) и солевые растворы из соляных озёр, богатые солями лития. В обоих случаях результатом работы является карбонат лития Li2CO3.
Сподумен (силикат лития и алюминия) можно перерабатывать несколькими способами. Например, спеканием с сульфатом калия получают растворимый сульфат лития, который осаждают из раствора содой:
Солевые растворы предварительно выпаривают. В солевых растворах содержится хлорид лития LiCl. Однако вместе с ним содержатся большие количества других хлоридов. Для увеличения концентрации лития из выпаренного раствора осаждают карбонат лития Li2CO3, например по схеме
2LiCl + Na2CO3 ⟶ Li2CO3↓ + 2NaCl . Получение металла
Металлический литий чаще всего получают электролизом расплава солей или восстановлением из оксида.
При электролизе используется хлорид лития. Его получают из карбоната по схеме:
Поскольку температура плавления хлорида лития близка к температуре кипения лития, применяют эвтектическую смесь с хлоридом калия или бария, что понижает температуру расплава и позволяет избавиться от необходимости улавливать пары металла. Расход электроэнергии до 14 кВт∙ч на 1 кг лития. На другом электроде получают газообразный хлор.
Поскольку литий — активный металл, его восстановление из оксидов или галогенидов возможно только при немедленном удалении лития из зоны реакции. В противном случае невозможно сместить баланс реакции в нужную сторону. Литий удаляют из зоны реакции путём поддержания температур, при которых литий испаряется и покидает зону реакции в виде паров. Другие реагенты при этом должны оставаться в расплаве. Для восстановления используются кремний или алюминий, например:
2Li2O + Si ⟶ 4Li↑ + SiO2 Рафинирование
Полученный литий очищают методом вакуумной дистилляции, последовательно выпаривая разные металлы из сплава при определённых температурах.
Добыча
В 2015 году в мире добыли 32,5 тыс. тонн лития и его соединений в пересчёте на металл. Крупнейшие страны по добыче — Австралия, Чили и Аргентина. В России собственная добыча лития была полностью утрачена после распада СССР, но в 2017 году Россия запустила экспериментальную установку, позволяющую добывать литий из бедных руд с небольшими затратами.
Большая часть добывается из естественных водных линз в толще соляных озёр, в насыщенных соляных растворах которых концентрируется хлорид лития. Раствор выкачивается и выпаривается на солнце, полученная смесь солей перерабатывается. Содержание лития в растворе колеблется от 0,01 % до 1 %. Также значительная доля добычи приходится на минеральное сырьё, например, минерал сподумен.
Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К ).
Химические источники тока
Из лития изготовляют аноды химических источников тока (аккумуляторов, например, литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Сульфат лития используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике для окрашивания огней в красный цвет.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике (из-за их лёгкости). На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придаёт им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике.
Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Гидроксид лития добавляют в электролит щелочных аккумуляторов для увеличения срока их службы.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия, и его потребление растёт с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5—3,5 кг на тонну выплавляемого алюминия).
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления ёмкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Литий-6
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 H:
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7
Применяется в ядерных реакторах. Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов жидкий литий-7 (часто в виде сплава с натрием или цезием) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Соединения лития, обогащённые по изотопу лития-7, применяются на реакторах PWR для поддержания водно-химического режима, а также в деминерализаторе первого контура. Ежегодная потребность США оценивается в 200—300 кг , производством обладают лишь Россия и Китай.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают нормотимическими и другими лечебными свойствами. Поэтому они находят применение в медицине.
Смазочные материалы
Стеарат лития («литиевое мыло») используется в качестве загустителя для получения пастообразных высокотемпературных смазок машин и механизмов. См. напр.: Литол, ЦИАТИМ-201.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 применяются для очистки воздуха от углекислого газа; при этом последнее соединение реагирует с выделением кислорода (например, 2Li2O2 + 2CO2 → 2Li2CO3 + O2), благодаря чему используется в изолирующих противогазах, в патронах для очистки воздуха на подлодках, на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Весьма перспективно использовать литий в качестве наполнителя поплавка батискафов — этот металл имеет плотность, почти в два раза меньшую, чем вода (точнее, 534 кг/м³), это значит, что один кубический метр лития может удерживать на плаву почти на 170 кг больше, чем один кубический метр бензина. Однако литий — щелочной металл, активно реагирующий с водой, следует каким-то образом надёжно разделить эти вещества, не допустить их контакта.
Из лития изготавливают аноды химических источников тока (например, литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, Литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил). Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов. Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития). Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом). Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп. Гидроксид лития добавляют в электролит щелочных аккумуляторов для увеличения срока их службы.
Биологическое значение лития
Литий в небольших количествах необходим организму человека (порядка 100 мкг/день для взрослых). Преимущественно в организме находится в щитовидной железе, лимфоузлах, сердце, печени, лёгких, кишечнике, плазме крови, надпочечниках.
Литий принимает участие в важных процессах:
- участвует в углеводном и жировом обменах;
- поддерживает иммунную систему;
- предупреждает возникновение аллергии;
- снижает нервную возбудимость.
Препараты лития широко используются в терапии психических расстройств.
Выделяется литий преимущественно почками.
По состоянию на конец 2007 — начало 2008 года, цены на металлический литий (чистота 99 %) составляли 63—66 долларов за 1 кг.
источники:
http://melscience.com/RU-ru/articles/svojstva-litiya-reakcii-vody-i-nekotoryh-kislot-s-/
http://chem.ru/litij.html