Скачать материал

Скачать материал


- Сейчас обучается 66 человек из 32 регионов






Описание презентации по отдельным слайдам:
-
1 слайд
Химические
свойства металлов
Подготовила: преподаватель химии Евдокова Н.А. -
2 слайд
Химические свойства металлов во многом зависят от строения его внешнего или предвнешнего электронного слоя.
Для металлов, расположенных в одной группе периодической системы и имеющих одинаковое строение внешней электронной оболочки, следует ожидать определённые сходства в химических свойствах.
-
3 слайд
В атоме металлов на внешнем энергетическом уровне небольшое количество электронов и очень большой радиус атома, что способствует быстрой отдаче электронов атомами металлов в результат их взаимодействия с другими соединениями.
Металлы окисляются, сами при этом выступают в роли восстановителя.
-
4 слайд
На основании восстановительной способности металлов в ряду напряжений металлы условно можно разделить на три группы: от лития до алюминия – очень активные металлы, от алюминия до водорода – металлы средней активности, от водорода до золота – малоактивные металлы.
-
5 слайд
С кислородом активно при комнатной температуре реагируют только щелочные металлы, при этом образуются оксиды или пероксиды
4Li + O2 = 2Li2O
2Na + O2 = Na2O2Металлы средней активности реагируют с кислородом
при нагревании
2Mg + O2 = 2MgO -
6 слайд
Алюминий в порошке также горит ослепительным пламенем с образованием оксида алюминия.
Эта способность используется в фейерверках, салютах, бенгальских огнях
-
7 слайд
Au, Pt не реагируют с кислородом и поэтому на воздухе практически не изменяют своего блеска.
Большинство металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются соответствующие сульфиды.
-
8 слайд
Практически все металлы реагируют с галогенами.
Условия протекания этих реакций зависит от активности металла и галогена
С металлами реагируют соединения всех классов – оксиды (в том числе вода),
кислоты, основания и соли -
9 слайд
При нагревании металлы реагируют и с другими неметаллами
С водородом реагируют только активные металлы. Например, в реакции натрия с водородом образуется гидрид натрия -
10 слайд
Активные металлы бурно реагируют с водой при комнатной температуре
-
11 слайд
Поверхность таких металлов, как магний и алюминий, защищена плотной плёнкой соответствующего оксида. Это препятствует протеканию реакции с водой.
Но если убрать эту плёнку, то эти металлы активно будут вступать в реакцию:
-
12 слайд
При повышенной температуре с водой реагируют и менее активные металлы, но в данном случае образуется оксид и водород
-
13 слайд
Металлы, стоящие в ряду активности до водорода, реагируют с кислотами (кроме HNO3 любой концентрации и H2SO4 концентрированной) с образованием солей и водорода
-
14 слайд
Малоактивные металлы часто практически не растворяются в кислотах. Это обусловлено образованием на их поверхности плёнки нерастворимой соли.
Например, свинец, стоящий в ряду активности до водорода, практически не растворяется в разбавленной серной и соляной кислотах вследствие образования на его поверхности плёнки нерастворимых солей (PbCl2, PbSO4)
-
15 слайд
В азотной кислоте растворяются металлы, стоящие и до, и после водорода. При этом образуются нитраты, а также различные продукты восстановления азотной кислоты
-
16 слайд
Концентрированная серная кислота также может вступать в реакции с металлами, расположенными в ряду активности после водорода
Al, Cr, Fe при комнатной температуре не вступают в реакцию и с концентрированной серной кислотой из-за образования на их поверхности оксидной плёнки. Это явление называется пассивацией.Благодаря этому становится возможным транспортировать концентрированную азотную серную кислоты в стальных цистернах.
-
17 слайд
Некоторые металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с образованием комплексных соединений.
В реакции бериллия с раствором гидроксида натрия образуется комплексная соль – тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида калия образуется комплексная соль – тетрагидроксоцинкат калия.
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2↑
Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑ -
18 слайд
Активные металлы вытесняют малоактивные из растворов
их солей
Fe + CuCl2 = FeCl2 + Cu↓
Cu + 2AgNO3 = Cu (NO3)2 + 2Ag↓
Металлы могут реагировать и с органическими веществами
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Натрий вступает в реакцию Вюрца с галогеналканами
2H3CCl + 2Na C2H6 + 2NaCl -
19 слайд
Выводы: о химической активности металлов можно примерно судить по их расположению в электрохимическом ряду напряжений металлов.
Чем левее расположен металл, тем выше его химическая активность в водном растворе.
Активные металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце.
Металлы реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами, кислотами, основаниями и солями
-
20 слайд
Автор шаблона для презентации: Бейгул Ольга Куприяновна
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 157 012 материалов в базе
-
Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы
Рейтинг:
5 из 5
- 09.10.2021
- 544
- 17

- 09.10.2021
- 1167
- 147





- 09.10.2021
- 1767
- 365


Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Введение в сетевые технологии»
-
Курс повышения квалификации «Экономика: инструменты контроллинга»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Финансы предприятия: актуальные аспекты в оценке стоимости бизнеса»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Управление информационной средой на основе инноваций»
-
Курс профессиональной переподготовки «Техническая диагностика и контроль технического состояния автотранспортных средств»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
Химические свойства металлов
Химия – 11
Автор: Кунова Г.В. – учитель химии ГОАОУ ЦОРиО, г. Липецк
Общая характеристика металлов
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы:
Реакции металлов относятся к окислительно-восстановительным реакциям. Окислителями металлов являются неметаллы, ионы водорода, азотная кислота разной концентрации и концентрированная серная кислота.
Для металлов как восстановителей в соединениях характерны положительные степени окисления ( +1, +2, +3 – металлы главных подгрупп I – III групп).
Многим из них присущи переменные степени окисления – металлы побочных подгрупп (Fe, Cu и др.).
Химические свойства металлов различаются в зависимости от химической активности металла.
Электрохимический ряд напряжений металлов
По активности в водных растворах металлы расположены в « Электрохимический ряд напряжений металлов»:
В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород.
Активность металлов убывает слева направо.
Металлы, расположенные в ряду напряжений до алюминия называют активными металлами.
Металлы, стоящие в ряду напряжений после водорода , называют неактивными металлами .
Химические свойства металлов
Взаимодействие с кислородом
- При взаимодействии с кислородом металлы образуют различные по составу продукты: оксиды, а также пероксиды. Полученные в результате таких реакций оксиды проявляют или осно́вные, или амфотерные свойства. Серебро, золото и платина с кислородом не реагируют.
- Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды :
- Алюминий сгорает ярким ослепительным пламенем:
- Щелочные металлы Nа, К активно реагируют с кислородом воздуха, образуя пероксиды :
Оксид натрия может быть получен при прокаливании пероксида натрия с натрием:
- Железо сгорает в кислороде с образованием железной окалины – Fe 3 O 4 (FeO ● Fe 2 O 3 ):
Химические свойства металлов
Взаимодействие с неметаллами
- Так как металлы являются восстановителями , то они отдают свои электроны неметаллам, которые, проявляют при этом окислительные свойства.
В результате образуются бинарные соединения, названия которых формируются по единому принципу:
- В случае переменной степени окисления у металла продукт его взаимодействия с неметаллом зависит от окислительных свойств последнего.
1) Металлы взаимодействуют с галогенами с образованием солей:
Химические свойства металлов
2) С водородом самые активные металлы образуют гидриды, в которых водород имеет степень окисления -1, например:
Са 0 + Н 2 0 = Са +2 Н -1 2
3) Взаимодействие с серой при нагревании:
М + S → М n S m сульфид металла
Пример:
Смесь железа с серой
Химические свойства металлов
4) Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
При обычной температуре взаимодействует с азотом только литий:
6Li + N 2 = 2Li 3 N,
при этом образуется нитрид лития.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca + 2P = Ca 3 P 2
Химические свойства металлов
Взаимодействие с водой
- Щелочные и щелочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
Алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку.
- Mg – Pb реагируют с водой при нагревании с образованием оксидов металлов и водорода: М + Н 2 О = М х О у + Н 2 .
- Неактивные металлы (Cu — Au) — не реагируют с водой.
Химические свойства металлов
Взаимодействие с растворами кислот
- Металлы взаимодействуют с растворами кислот при соблюдении ряда условий:
- металл должен находиться в ряду напряжений левее водорода ;
- в результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ кислоты к металлу прекратится;
- для этих реакций не рекомендуется использовать щелочные металлы , т.к. они активно взаимодействуют с водой;
- особым образом взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации .
Химические свойства металлов
Взаимодействие с растворами солей
- Металлы взаимодействуют с растворами солей при соблюдении ряда условий:
- металл должен находиться в ряду напряжений левее металла, образующего соль ;
- в результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ соли к металлу прекратится;
- для этих реакций не рекомендуется использовать щелочные металлы.
Если опустить кусочек свинца в раствор сульфата меди, то поверхность металла покроется тонким слоем сульфата, и реакция прекратится:
CuSO 4 + Pb ≠ PbSO 4 ↓ + Cu
Химические свойства металлов
Металлотермия – восстановление металлов из их оксидов
- Некоторые активные металлы способны вытеснять другие металлы из их оксидов.
- В методах металлотермии в качестве восстановителей используют Al, Na, Ca, Mg и др.
Пример:
- Методы металлотермии в настоящее время широко используются в металлургии для получения таких металлов как Ti, Cr, Mn, V, Mg, Ba, Ca, Rb, Cs и др.
Задания:
- Новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания растений, вскоре стал протекать.
Объясните причину разрушения стенок бака. Запишите уравнение химической реакции.
- Почему алюминиевую посуду нельзя мыть содой?
Запишите уравнения химических реакций.
Источники
- Учебники:
- Интернет-ресурсы: фото и рисунки.
Слайд 1
Химические свойства металлов 9 класс (2 урока)
Слайд 2
План изучения темы Урок 1. Взаимодействие с простыми веществами: С кислородом; С галогенами; С серой; С азотом; С фосфором; С водородом Урок 2. Взаимодействие со сложными веществами: С водой; С солями С кислотами
Слайд 3
Тема: Химические свойства металлов. 11 Ноябрь, 2020 I . Взаимодействие с простыми веществами. а) с кислородом Ca + O 2 ν ν 4K + O 2 = 2K 2 O 2 Cu+ O 2 ( окисляется) ν ν Fe + O 2 Fe 3 O 4 ( железная окалина)
Слайд 4
11 Ноябрь, 2020 Al + I 2 → AlI 3 ν ν Взаимодействие с простыми веществами. б) с галогенами: Fe + Cl 2 → Fe +3 Cl -1 3 ν ν Na + Cl 2 → Na Cl ν ν
Слайд 5
11 Ноябрь, 2020 I . Взаимодействие с простыми веществами. в) с серой Al + S → Al 2 S 3 ( сульфид алюминия) г) с азотом Mg + N 2 → Mg 3 N 2 ( нитрид магния) д) с фосфором Са +Р → Са 3 Р 2 (фосфид кальция) е) с водородом-только металлы 1 и 2 групп периодической системы. Na + H 2 → NaH ( гидрид натрия)
Слайд 6
11 Ноябрь, 2020 II . Взаимодействие со сложными веществами. 1.Взаимодействие с водой до Mg; Al после Mg После Н
Слайд 7
11 Ноябрь, 2020 II . Взаимодействие со сложными веществами. 2) Взаимодействие с солями CuSO 4 + Fe → FeSO 4 + Cu 3) Взаимодействие с кислотами а)Ме + кислота = соль + водород (до Н) (кроме серной (конц.) и азотной (конц. и разб.)) Fe + HCl → FeCl 2 + H 2 ν ν Cu + HCl → ?
Слайд 8
11 Ноябрь, 2020 II . Взаимодействие со сложными веществами. б) Ме + кислота = соль + вода + продукт из табл. Cu 0 + H 2 S +6 O 4 → Cu +2 SO 4 + H 2 O +S +4 O 2 ( конц.) Cu 0 → Cu +2 S +6 → S +4 Cu 0 + HN +5 O 3 (р) → Cu +2 (NO 3 ) 2 + H 2 O + N + 2 O Cu 0 → Cu +2 N + 5 → N + 2
Слайд 9
Cu 0 + HN +5 O 3 (к) → Al + H 2 SO 4 (k) →
Слайд 10
Al + HNO 3 (p) → Zn + HNO 3 (k) →
Слайд 11
11 Ноябрь, 2020 Домашнее задание § 8, дописать уравнения реакций и расставить коэффициенты методом электронного баланса: Al + O 2 → Na + S → Cu + Br 2 → Pb + Cl 2 → Mg + P → Mg + HCl → Ni SO 4 + Al → Zn + H 2 SO 4 (k) → Ca + HNO 3 (k) → Mg + HNO 3 (p) →
1. Получение и химические свойства металлов
2. Получение металлов
1. Восстановление металлов из
оксидов углем или угарным газом
MеxOy + C = CO2 + Me или
MеxOy + CO = CO2 + Me
2. Обжиг сульфидов с последующим
восстановлением
1 стадия – MеxSy+O2=MеxOy+SO2
2 стадия — MеxOy + C = CO2 + Me или
MеxOy + CO = CO2 + Me
3.
3 Алюминотермия (восстановление
более активным металлом)
MеxOy + Al = Al2O3 + Me
4. Водородотермия — для получения
металлов особой чистоты
MеxOy + H2 = H2O + Me
5. Восстановление металлов
электрическим током (электролиз)
4.
1) Щелочные и щелочноземельные
металлы получают в промышленности
электролизом расплавов солей (хлоридов):
2NaCl –расплав, электр. ток. → 2 Na + Cl2↑
CaCl2 –расплав, электр. ток.→ Ca + Cl2↑
расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na + O2↑ + 2H2O
5.
2) Алюминий в промышленности получают в
результате электролиза расплава оксида
алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 –расплав в криолите, электр. ток.→ 4Al + 3 O2↑
3) Электролиз водных растворов
солей используют для получения металлов
средней активности и неактивных:
2CuSO4+2H2O –раствор, электр. ток. → 2Cu + O2 +
2H2SO4
6.
7.
1) Металлы реагируют с водой
8.
Помните!!!
Алюминий реагирует с водой подобно активным
металлам, образуя основание
(без оксидной пленки):
2Al + 6H2O = 2Al(OH)3 + 3H2↑
9. 2) Металлы особо реагируют с серной концентрированной и азотной кислотами:
2) Металлы особо реагируют с
серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
ЩМ
ЩЗМ
X
Остальн Металлы
ые
после
метал водорода
лы до
(при t)
H2SO4 (конц.) + Me = соль + водо
H2O + Х
рода
Сd-Pb
H2S↑
могут S↓
или SO2↑
В зависимости
от условий
Fe, Cr,Al
1)Пассивируют
ся на холоде;
2) При
нагревании
→ SO2↑
SO2
SO2↑
Au, Pt
Ir, Rh,
Ta
Не
идет
10.
H2SO4 (разб) + Zn = ZnSO4 + H2↑
H2SO4 (разб) + Cu ≠
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O +
SO2↑
Pt, Au + H2SO4 (конц.) → реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ п
ассивация
Al, Fe, Cr + H2SO4 (конц.) t˚C→ SO2
11.
12.
HNO3 (конц.) + Me = соль + H2O + Х
ЩМ
ЩЗМ
X
N2O
Остальн
ые
метал
лы до
и
после
H2SO4 (конц.) + Me = соль + водо
H2O + Х
рода
Сd-Pb
Fe, Cr,Al
1)Пассивируют
ся на холоде;
2) При
нагревании
→ NO2↑
NO2
Au, Pt
Ir, Rh,
Ta
Не
идет
13.
HNO3 (разб) + Me = соль + H2O + Х
ЩМ
ЩЗМ
Fe, Cr,Al
Остальные
металлы до
водорода
После
водо
рода
Au, Pt
Ir, Rh,
Ta
H2SO4 (конц.) + Me = соль + H2O + Х
X
NH3
NH4NO3
NO↑
NH4NO3
NO
Не
идет
14.
4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
Внимание!
Pt, Au + HNO3 → реакции нет
Al, Fe, Cr + HNO3 (конц) холодная→ пассива
ция
Al, Fe, Cr + HNO3 (конц) t˚C→ NO2
Al, Fe, Cr + HNO3 (разб) → NO
15.
3) С растворами солей менее
активных металлов
Ме + Соль = Новый металл + Новая
соль
Вытеснение металла из соли другим
металлом
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
16.
Активность металла в реакциях с кислотами,
водными растворами солей и др. можно
определить, используя электрохимический
ряд, предложенный в 1865 г русским учёным
Н. Н. Бекетовым:
17.
от калия к золоту восстановительная
способность (способность отдавать
электроны) уменьшается, все металлы,
стоящие в ряду левее водорода, могут
вытеснять его из растворов кислот; медь,
серебро, ртуть, платина, золото,
расположенные правее, не вытесняют
водород.
Видео – Эксперимент «Взаимодействие
хлорида олова (II) с цинком («Оловянный
ежик»)»
18.
4) С неметаллами образуются
бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
19. ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Закончить уравнения практически
осуществимых реакций, назвать продукты реакции
Ca + H3PO4=
Li+ H2O =
Cu + H2O =
Al + H2O =
Ba + H2O =
Mg + H2O =
Ca + HCl=
Na + H2SO4(К)=
Al + H2S=
HCl + Zn =
H2SO4 (к)+ Cu=
H2S + Mg =
HCl + Cu =
HNO3 (K)+ Сu =
H2S + Pt =
H3PO4 + Fe =
HNO3 (p)+ Na=
20.
№2. Закончите УХР, расставьте коэффициенты методом
электронного баланса, укажите окислитель
(восстановитель):
Al
+ O2 =
Li + H2O =
Na + HNO3 (k) =
Mg + Pb(NO3)2 =
Ni + HCl =
Ag + H2SO4 (k) =
Изображение слайда
Первый слог – предлог известный, Слог второй трудней найти: Часть его составит цифра, К ней добавьте букву «Й». Чтобы целое узнать, Надо вам металл назвать.
Порознь каждый ядовит, вместе будет — аппетит.
Кислота тепла боится, быстро в воду превратится.
«Она идет», «она прошла», Никто ни скажет, что пришла.
Изображение слайда
Натрий
(Хлорид натрия)
(Угольная и сернистая кислота)
(Химическая реакция)
Если все объединим получим тему урока
Изображение слайда
4
Слайд 4: Тема урока
Общие химические свойства металлов
Изображение слайда
5
Слайд 5: Цель урока:
сформировать понятие об общих химических свойствах металлов и их восстановительных способностях.
Задачи:
Образовательные:
сформировать понятие об общих химических свойствах металлов;
проверить знания о строении металлов и их физических свойствах.
Развивающие:
совершенствовать умения записывать уравнения химических реакций; применять знания и практические умения, работая по инструкции, с соблюдением правил Техники безопасности;
развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы;
создать условия для развития познавательного интереса к предмету
устанавливать межпредметные связи.
Воспитательные:
воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов);
воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Изображение слайда
6
Слайд 6: Проверка домашнего задания
А1
Электронная формула атома магния:
1)1s 2 2s 2 2) 1s 2 2s 2 2p 6 3s 2
3) 1s 2 2s 2 2p 6 3s 1 4) 1s 2 2s 2 2p 6 3s 2 3p 2
А2Электронная формула внешнего энергетического уровня атомов элементов главной подгруппы II группы Периодической системы: А.ns1. В.ns2 np1. Б. ns2. Г. ns2 np2.
А3
Металл, обладающий самой высокой электропроводностью, — это
железо 2) медь
3) серебро 4) алюминий
Изображение слайда
А 4. В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А 5. Металл, обладающий самой высокой электропроводностью, — это
1) железо 2) медь 3) серебро 4) алюминий
А 6. Самый тугоплавкий металл – это:
хром 2) медь 3) вольфрам 4) железо
А7
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
А8 Самый легкоплавкий металл – это:
1) цезий 2) ртуть 3) алюминий 4) железо
Составьте уравнения химических реакций согласно схеме:
Ca —- CaO —- Ca (OH)2 —— CaCO3 —— CaCl2
Изображение слайда
А9 В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
Na, Mg, Al 2) Al, Mg, Na
3) K, Na, Li 4) Mg, Be, Ca
А10 Металл, обладающий самой высокой пластичностью, — это:
1) золото 2) медь
3) серебро 4) алюминий
Составьте уравнения химических реакций согласно схеме:
Ca —- CaO —- Ca (OH)2 —— CaCO3 —— CaCl2
Изображение слайда
1Б ;2 Б; 3В;4-2;5-3;6-3;7-4; 8-2;9-2;10-1
Изображение слайда
Назовите семь чудес света и укажите, какую роль играли металлы в их создании
Изображение слайда
11
Слайд 11: Проверь себя
В эпоху античности семью чудесами света считали египетские пирамиды, висячие сады Вавилона, статую Колосса Родосского, Храм Артемиды в Эфесе, статую олимпийского бога Юпитера, мавзолей в Галикариасе, Александрийский маяк.
В создании египетских пирамид играла немалую роль медь, т.к. для сооружения пирамиды использовались инструменты, изготовленные из меди.
Гигантская статуя Колосса Родосского была полностью изготовлена из бронзы.
Статуя Юпитера была частично сделана из золота: из благородного металла был изготовлен плащ Юпитера.
Изображение слайда
Изображение слайда
Почему щелочные и щелочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине?
Щелочные и щелочноземельные металлы очень активны и реагируют практически со всем, с чем соприкасаются.
Например, на воздухе эти металлы легко окисляются. Если эти металлы хранить под слоем керосина, к которому они инертны, то можно уберечь от ненужных взаимодействий. Литий — самый легкий из металлов. Он легче керосина и в отличие от других металлов всплывает в нем, поэтому его хранят в вазелине.
Изображение слайда
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.
Изображение слайда
Этот ряд впервые составил и изучил выдающийся украинский ученый Н. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Изображение слайда
16
Слайд 16: Щелочные металлы
Изображение слайда
Изображение слайда
18
Слайд 18: Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Реакция щелочных металлов с кислородом:
4 Li + O 2 → 2Li 2 O ( оксид лития)
2 Na + O 2 → Na 2 O 2 ( пероксид натрия)
K + O 2 → KO 2 ( надпероксид калия)
Изображение слайда
19
Слайд 19: Щелочные металлы:
2. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2 Li + Cl 2 → 2LiCl ( галогениды)
2 Na + S → Na 2 S ( сульфиды)
2 Na + H 2 → 2NaH ( гидриды)
6 Li + N 2 → 2Li 3 N ( нитриды)
2 Li + 2C → Li 2 C 2 ( карбиды)
Изображение слайда
2 Li + 2 H 2 O = 2 LiOH + H 2
2 Na + 2 H 2 O = 2 NaOH + H 2
2 K + 2 H 2 O = 2 KOH + H 2
Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь — гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Изображение слайда
21
Слайд 21: Щелочные металлы
3. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
4. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
5. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
Изображение слайда
6. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li + – карминово-красный
Na + – желтый
K +, Rb + и Cs + – фиолетовый
Изображение слайда
Изображение слайда
24
Слайд 24: Щелочноземельные металлы
Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO 2 :
Ba + O 2 ® BaO 2
В атмосфере кислорода магний вспыхивает ослепительным белым пламенем.При горении магния выделяются ультрафиолетовые лучи.
Продукт горения магния – белый порошкообразный оксид.
2Mg + O 2 = 2MgO
Изображение слайда
Изображение слайда
Изображение слайда
Изображение слайда
Изображение слайда
Изображение слайда
30
Слайд 30: Взаимодействие с водой
Изображение слайда
Изображение слайда
Изображение слайда
33
Слайд 33: Реакция железа с кислотами
Изображение слайда
Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно N 2, NO, NH 4 NO 3. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях.
Изображение слайда
35
Слайд 35: Проверь себя
Изображение слайда
Изображение слайда
Изображение слайда
Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого: Какой ион проявляет в этой реакции окислительные свойства?
Изображение слайда
39
Слайд 39: Проверь себя
Изображение слайда
Можно ли получить водород при взаимодействии свинца с раствором серной кислоты?
Ответ
По правилу, которое гласит, что металлы, стоящие в ряду напряжения левее водорода, вытесняют его из растворов кислот, водород при реакции свинца с раствором серной кислоты должен получиться. Но данное правило соблюдается, если в реакции металла с кислотой образуется растворимая соль, a PbSO 4 — нерастворимая соль. Поэтому в случае свинца и серной кислоты правило не действует и, следовательно, водород нельзя получить при взаимодействии свинца с раствором серной кислоты.
Изображение слайда
Как можно получить из пирита FeS2 железо и серную кислоту? Запишите уравнения реакций.
Изображение слайда
42
Слайд 42: Проверь себя
Изображение слайда
43
Последний слайд презентации: Общие химические свойства металлов химия 11 класс: Домашнее задание
Параграф 27 изучить
Выполнить №3,4,5 стр.131
Изображение слайда
Презентацию на тему «Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс»
можно скачать абсолютно бесплатно на нашем сайте. Предмет
проекта: Химия. Красочные слайды и иллюстрации помогут вам
заинтересовать своих одноклассников или аудиторию.
Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад — нажмите на
соответствующий текст под плеером. Презентация
содержит 18 слайд(ов).
Слайд 1
Химические свойства металлов.
Электрохимический ряд напряжения металлов.
Слайд 2
Верите ли Вы,что…
Слайд 3
Металлы занимают верхний левый угол в ПСХЭ. В кристаллах атомы металла связаны металлической связью. Валентные электроны металлов прочно связаны с ядром. У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона. В группе сверху вниз происходит увеличение восстановительных свойств металлов. Чтобы оценить реакционную способность металла в растворах солей и кислот, достаточно посмотреть в электрохимический ряд напряжения металлов. 7. Чтобы оценить реакционную способность металла в растворах солей и кислот, достаточно посмотреть в периодическую таблицу Д.И.Менделеева.
Слайд 4
Ме0 – ne Me+n
Ме0 – восстановитель
Простые вещества (+О2, Сl2, S…) Сложные вещества (Н2О, кислоты, растворы солей)
(+ окислитель)
Слайд 5
От каких факторов зависят восстановительные свойства металлов?
Природы металла
Положение в Электрохимическом ряду напряжения металлов
Положение в периодической таблице Менделеева
Химическая активность
Электрохимическая активность
Слайд 7
Изменение Rатома и Еионизации.
Определяет восстановительную активность металлов в химических реакциях, протекающих в водных растворах.
Таблица Менделеева
Электрохимический ряд напряжения Ме
Ме Rат (нм) Еион (кДж/ моль) Li 0,155 513,3 Na 0,190 495,8 К 0,235 418,8 Rb 0,248 403,0 Cs 0,267 375,7
Слайд 8
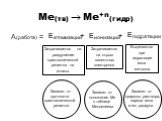
Ме(тв) Ме+n(гидр) А(работа) = Еатомизации Еионизации Егидратации
Затрачивается на разрушение кристаллической решетки на атомы
+
Затрачивается на отрыв валентных электронов
Выделяется при гидратации иона металла
Зависит от прочности кристаллической решетки
Зависит от положения Ме в таблице Менделеева
Зависит от природы раствора, заряда иона и его радиуса
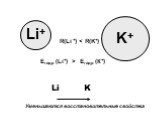
Слайд 9
K+ Li+ R(Li +) Eгидр (Li+) > Eгидр (К+)
Уменьшаются восстановительные свойства
Слайд 10
БЕКЕТОВ НИКОЛАЙ НИКОЛАЕВИЧ (1827–1911), русский физикохимик.
1863 год
Вытеснительный ряд металлов
академик Петербургской Академии наук.
Применим только для растворов электролитов (кислот, растворов солей)
Слайд 11
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li K Ba Sr Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
Вывод:
1. Уменьшается восстановительные свойства металлов при реакциях в водных растворах в стандартных условиях (250С, 1атм.);
2. Металл, стоящий левее, вытесняет металл, стоящий правее из их солей в растворе;
3. Металлы, стоящие до водорода, вытесняют его из кислот в растворе (искл.: HNO3);
4. Ме (до Al) + Н2О щелочь + Н2 Ме (до Н2) + Н2О оксид + Н2 (жесткие условия) Ме (после Н2) + Н2О не реагируют
Слайд 12
Практическая работа.
«Взаимодействие металлов с растворами солей.»
1. СuSO4 → FeSO4 2. СuSO4 → ZnSO4
“Единственный путь, ведущий к знанию, — это деятельность”. (Б. Шоу)
Слайд 13
Периодическая таблица Д.И.Менделеева
Электрохимический ряд напряжения металлов
Химические элементы
Кристаллические простые вещества (металлы и их ионы)
Особенности строения атомов Е ионизации
Способность атома Ме переходить в гидратированный ион. Стандартный электродный потенциал
Слайд 14
6. Чтобы оценить реакционную способность металла в растворах солей достаточно посмотреть в электрохимический ряд напряжения металлов.
7. Чтобы оценить реакционную способность металла в растворах солей достаточно посмотреть в периодическую таблицу Д.И.Менделеева.
Слайд 15
Блеф – игра: «Верите ли Вы, что…»
1 — нет 2 — да 3 — нет 4 – нет 5 – да 6 – да 7 — нет
Слайд 16
Домашнее задание.
Повторить из курса физики понятие «ПОТЕНЦИАЛ»; Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO3)2→ 3. Даны металлы(Fe, Mg, Pb, Cu) – предложите опыты, подтверждающие положение данных металлов в электрохимическом ряду напряжения.;
Слайд 17
Даны вещества: металлический Na, p-p CuSO4. Напишите уравнения реакций, которые будут протекать при взаимодействии этих веществ
Слайд 18
CПАСИБО ЗА ВНИМАНИЕ!
Персональная карточка № 229-436-478
1
Химические свойства металлов Урок химии в 11 классе Учитель химии: Киреева Марина Николаевна МКОУ «Тормосиновская СОШ» Чернышковского района Волгоградской области
2
Верите ли вы, что … 1.Металлы занимают верхний левый угол в ПСХЭ. 2.В кристаллах атомы металла связаны металлической связью. 3.Валентные электроны металлов прочно связаны с ядром. 4.У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона. 5.В группе сверху вниз происходит увеличение восстановительных свойств металлов.
3
Самопроверка тестов 5-6 правильных ответов – «5» 4 правильных ответа – «4» 3 правильных ответа – «3»
4
5
Почему алюминиевую посуду нельзя мыть содой? Na 2 CO 3
6
Цель урока: систематизировать и углубить знания о химических свойствах металлов, подчеркнув их функцию как восстановителей.
7
Задачи урока развивать умения пользоваться опорными знаниями, закреплять умения и навыки выполнения химического эксперимента; закреплять умения составлять уравнения реакций; сформировать понимание практического значения металлов в жизни человека; развивать познавательный интерес при выполнении теоретических и практических заданий.
8
Ме 0 – ne Me +n Ме 0 – восстановитель 1.Простые вещества (+О 2, Сl 2, S…) 2.Сложные вещества (Н 2 О, кислоты, растворы солей) (+ окислитель)
9
Ряд напряжений металлов
10
М + неметалл Е + вода Т + оксид А + кислота Л + соль Л + щёлочь Ы + органические вещества
11
Физминутка
12
Единственный путь, ведущий к знанию, — это деятельность. (Б. Шоу )
13
Чтобы жизнь свою не подвергать опасности, надо свято соблюдать все правила по технике безопасности!
14
Исследование химических свойств металлов 1 группа Металл + неметалл? 2 группа Металл + вода? Металл + оксид 3 группа Металл + кислота? 4 группа Металл + соль менее активного металла? Металл + щёлочь? 5 группа Металл + органические вещества? Металл + металл?
15
16
Жизнь человеческая подобна железу. Если употреблять его в дело, оно истирается; если же не употреблять, ржавчина его съедает. Так, Пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени. Катон Старший сказал:
17
Домашнее задание: 1 ВАРИАНТ ЗАДАНИЯ: § 18, с , протокол исследования 2 ВАРИАНТ ЗАДАНИЯ: : Закончить уравнение реакции, написать уравнения электронного баланса: Сu + Hg(NO 3 ) 2 ТВОРЧЕСКОЕ ЗАДАНИЕ: ПРЕЗЕНТАЦИЯ О ПРИМЕНЕНИИ МЕТАЛЛОВ(ПО ЖЕЛАНИЮ)