Всего: 125 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Из предложенного списка простых веществ выберите два, которые реагируют с разбавленными растворами щелочей при обычных условиях.
1) кислород
2) магний
3) хлор
4) алюминий
5) серебро
Запишите в поле ответа номера выбранных веществ.
Какие простые вещества растворимы в соляной кислоте?
1) свинец
2) марганец
3) сера
4) водород
5) цинк
Запишите номера выбранных ответов в порядке возрастания.
Из предложенного перечня выберите два простых вещества, которые растворяются в разбавленной серной кислоте, но не растворяются в щелочах. Запишите номера выбранных ответов в порядке возрастания.
1)
2)
3)
4)
5)
Задания Д6 № 324
Общим свойством серебра и железа является их способность растворяться в
1) воде
2) серной кислоте (р-р)
3) азотной кислоте (конц.)
4) растворе щелочи
Верны ли следующие утверждения о свойствах хрома?
А. Хром пассивируется холодной концентрированной серной кислотой.
Б. Хром в соединениях проявляет единственную степень окисления.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Из предложенного перечня выберите два вещества, которые реагируют с водой только при высокой температуре.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых между веществами протекает химическая реакция.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два элемента, которые реагируют с водой только при нагревании.
1) серебро
2) медь
3) цинк
4) золото
5) железо
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые с щелочами не взаимодействуют.
1) алюминий
2) натрий
3) бром
4) сера
5) магний
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, которые с щелочами не взаимодействуют.
1) алюминий
2) натрий
3) бром
4) сера
5) магний
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые реагируют с водой только при высокой температуре.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых при взаимодействии водород не выделяется.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, в каждой из которых протекает химическая реакция.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, которые реагируют с водой только при нагревании.
1) железо
2) платина
3) марганец
4) медь
5) золото
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного списка выберите два вещества, разбавленные растворы которых реагируют с медью при обычных условиях.
1) хлороводород
2) нитрат серебра
3) хлорид цинка
4) гидроксид калия
5) хлорид железа (III)
Запишите в поле ответа номера выбранных веществ.
Верны ли следующие суждения о меди?
А. Для меди характерны степени окисления +1 и +2.
Б. Медь вытесняет железо из раствора хлорида железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о меди?
А. Для меди характерны степени окисления +1 и +2.
Б, Медь вытесняет цинк из раствора сульфата цинка.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Водород не выделяется при взаимодействии кальция с раствором
1) HNO3
2) H2SO4
3) HCl
4) HCOOH
Как хлороводородная кислота, так и гидроксид натрия реагируют с
1) фосфором
2) серой
3) алюминием
4) медью
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 2
Из предложенного перечня выберите две пары веществ, которые взаимодействуют с водой при обычной температуре.
1) кислород и сера
2) фтор и калий
3) кремний и кальций
4) железо и медь
5) натрий и барий
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Всего: 125 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Тренировочные упражнения по теме «Химические свойства металлов, неметаллов и оксидов» в формате ЕГЭ по химии (тренажер задания 6 ЕГЭ по химии).
Внимание! Перед выполнением тестов я рекомендую внимательно изучить теорию по теме «Химические свойства металлов, неметаллов и оксидов» (теория для решения задания 6 ЕГЭ по химии):
Характерные химические свойства простых веществ–металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа.
Характерные химические свойства простых веществ–неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Характерные химические свойства оксидов: основных, амфотерных, кислотных
| Задание 1 | |
| Из предложенного перечня выберите два вещества, с каждым из которых реагирует калий.
|
| Задание 2 | |
| Из предложенного перечня выберите два оксида, которые реагируют с раствором гидроксида калия.
1) CrO Запишите номера выбранных ответов. |
| Задание 3 | |
| Из предложенного перечня выберите два оксида, которые реагируют с водой.
|
| Задание 4 | |
| Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует при обычных условиях.
Запишите номера выбранных ответов. |
| Задание 5 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
|
| Задание 6 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
. |
| Задание 7 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует фосфор.
. |
| Задание 8 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид меди (II).
. |
| Задание 9 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид кальция.
|
| Задание 10 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид серы (IV).
|
| Задание 11 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
|
| Задание 12 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует сера.
|
Admin
МЕТАЛЛЫ, ИХ СВОЙСТВА, ПОЛУЧЕНИЕ, ПРИМЕНЕНИЕ. ЭЛЕКТРОЛИЗ.
1. С водой не реагирует:
1) магний 2) бериллий 3) барий 4) стронций
2. Реакции разбавленной азотной кислоты с медью соответствует уравнение:
1) 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
2) Cu + 2 HNO3 = Cu(NO3)2 + H2
3) Cu + 2 HNO3 = CuO + NO2 + H2O
4) Cu + HNO3 = CuO + NH4NO3 + H2O
3. Сравните процессы, протекающие на электродах при электролизе расплава и раствора хлорида натрия.
4. При электролизе раствора AgNO3 на катоде выделяется:
1) серебро 2) водород 3) серебро и водород 4) кислород и водород
5. При электролизе раствора хлорида калия на катоде происходит:
1) восстановление воды 2) окисление воды
3) восстановление ионов калия 4) окисление хлора
6. Какой процесс происходит на медном аноде при электролизе раствора бромида натрия?
1) окисление воды 2) окисление ионов брома
3) окисление меди 4) восстановление меди
7. Реакция возможна между:
1) Ag и K2SO4 (раствор) 2) Zn и KCl (раствор)
3) Mg и SnCl2 (раствор) 4) Ag и CuSO4 (раствор)
8. В какой последовательности восстанавливаются данные металлы при электролизе растворов их солей?
1) Au , Cu , Ag , Fe 2) Cu , Ag , Fe , Au
3) Fe , Cu , Ag , Au 4) Au , Ag , Cu , Fe
9. С концентрированной HNO3 без нагревания не взаимодействует:
1) Cu 2) Ag 3) Zn 4) Fe
10. Азотная кислота накапливается в электролизёре при пропускании электрического тока через водный раствор
1) нитрата кальция 2) нитрата серебра 3) нитрата алюминия 4) нитрата цезия
11. Из приведенных ниже металлов наиболее активным является:
1) бериллий 2) магний 3) кальций 4) барий
12. Железо реагирует с каждым из двух веществ:
1) хлоридом натрия и азотом 2) кислородом и хлором
3) оксидом алюминия и карбонатом калия 4) водой и гидроксидом алюминия
13. С водой при комнатной температуре реагирует каждый из двух металлов:
1) барий и медь 2) алюминий и ртуть 3) кальций и литий 4) серебро и натрий
14. При сплавлении алюминия с гидроксидом натрия образуется:
1) NaAlO2 2) AlH3 3) Na[Al(OH)4] 4) Al2O3
15. С разбавленной HNO3 без нагревания не взаимодействует:
1) Cu 2) Ag 3) Zn 4) Pt
16. Водород не вытесняется из кислот:
1) хромом 2) железом 3) медью 4) цинком
17. Медь растворяется в разбавленном водном растворе кислоты:
1) серной 2) соляной 3) азотной 4) фтороводородной
18. Медные изделия, находящиеся в контакте с воздухом, постепенно покрываются зелёным налётом, основным ком-
понентом которого является:
1) CuO 2) CuCO3 3) Cu(OH)2 4) (CuOH)2CO3
19. При нагревании магния в атмосфере азота:
1) реакция не идёт 2) образуется нитрид магния
3) образуется нитрит магния 4) образуется нитрат магния
20. При обычной температуре магний не взаимодействует с:
А) водой
Б) растворами щелочей
В) разбавленными H2SO4 и HNO3
Г) концентрированными H2SO4 и HNO3
Д) серой
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
21. При комнатной температуре хром взаимодействует с:
А) HCl (разб.) Б) Н2О В) H2SO4 (разб.) Г) N2 Д) Н2
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
22. При электролизе водного раствора KI не образуется:
1) K 2) KOH 3) H2 4) I2
23. Вещество, из которого образуются одинаковые продукты при электролизе водного раствора и расплава, имеет
формулу:
1) CuCl2 2) KВr 3) NaOH 4) NaCl
24. Газообразные вещества будут выделяться на катоде и аноде при электролизе водного раствора:
1) AgNO3 2) KNO3 3) CuCl2 4) HgCl2
25. При электролизе раствора Cr2(SO4)3 на катоде выделяется:
1) кислород 2) водород и хром 3) хром 4) кислород и хром 26. Два инертных электрода опустили в стакан, содержащий смесь водных растворов солей с одинаковой концентра-
цией AgNO3 , Cu(NO3)2 , Hg(NO3)2 , NaNO3 . Первыми при электролизе будут восстанавливаться частицы:
1) Hg+2 2) Ag+ 3) Cu+2 4) H2O
27. При электролизе разбавленного водного раствора Ni(NO3)2 на катоде выделяется:
1) Ni 2) O2 3) Ni и H2 4) H2 и O2
28. Азотная кислота накапливается в электролизёре при пропускании электрического тока через водный раствор
1) нитрата калия 2) нитрата алюминия 3) нитрата магния 4) нитрата меди
29. Выделение кислорода происходит при электролизе водного раствора соли:
1) MgCl2 2) CuSO4 3) NaBr 4) FeBr2
30. При электролизе водного раствора нитрата серебра на катоде образуется:
1) Ag 2) NO2 3) NO 4) H2
31. Кальций в промышленности получают:
1) электролизом раствора СаСl2 2) электролизом расплава СаСl2
3) электролизом раствора Са(ОН)2 4) действием более активного металла на водные растворы солей
32. При электролизе раствора иодида натрия у катода окраска лакмуса в растворе:
1) красная 2) синяя 3) фиолетовая 4) жёлтая
33. При электролизе водного раствора нитрата калия на аноде выделяется:
1) О2 2) NO2 3) N2 4) H2
34. Водород образуется при электролизе водного раствора:
1) CaCl2 2) CuSO4 3) Hg(NO3)2 4) AgNO3
35. При взаимодействии лития с водой образуется водород и:
1) оксид 2) пероксид 3) гидрид 4) гидроксид
36. Металлические свойства слабее всего выражены у:
1) натрия 2) магния 3) кальция 4) алюминия
37. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях они имеют степень окисления +1.
Б. С неметаллами они образуют соединения с ионной связью.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения не верны
38. При комнатной температуре хром взаимодействует с:
1) H2SO4 (р-р) 2) Н2О 3) N2 4) O2
39. При взаимодействии хрома с соляной кислотой образуются:
1) CrCl2 и Н2 2) CrCl3 и Н2О 3) CrCl2 и Н2О 4) CrCl3 и Н2
40. Медь не взаимодействует с:
1) разбавленной HNO3 2) концентрированной HNO3
3) разбавленной HCl 4) концентрированной H2SO4
41. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо 2) хром 3) медь 4) цинк
42. Наиболее энергично реагирует с водой:
1) Al 2) Mg 3) Ca 4) K
43. При обычных условиях с водой реагирует:
1) Mg 2) Ca 3) Pb 4) Zn
44. В результате реакции кальция с водой образуются:
1) СаО и Н2 2) Са(ОН)2 и Н2 3) СаН2 и О2 4) Са(ОН)2 и О2
45. Химическая реакция не происходит между:
1) Zn и HCl 2) Al и HCl 3) Mg и H2SO4 (разб.) 4) Аg и H2SO4 (разб.)
46. Соляная кислота реагирует с:
1) Cu 2) Zn 3) Ag 4) Hg
47. Для алюминия при обычных условиях возможно взаимодействие с:
А) HgCl2 Б) СаО В) CuSO4 Г) HNO3 (конц.) Д) Na2SO4 E) Fe3O4
Ответ: ____________________ . (Запишите соответствующие буквы в алфавитном порядке.)
48. Установите соответствие между исходными веществами и продуктами окислительно-восстановительных реакций.
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
1) Fe + Cl2 → A) FeSO4 + H2
2) Fe + HCl → Б) Fe2(SO4)3 + H2
3) Fe + H2SO4 (разб.) → В) Fe2(SO4)3 + SO2 + H2O
4) Fe + H2SO4 (конц.) → Г) FeCl2 + H2
Д) FeCl3 + H2
Е) FeCl3
49. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного
раствора сульфата меди(II) на инертных электродах.
50. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
хлорида бария на инертных электродах.
51. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
иодида калия на инертных электродах.
52. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
серной кислоты на инертных электродах.
53. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
бромида лития на инертных электродах.
54. При обычных условиях кальций реагирует с:
1) кислородом 2) углеродом 3) серой 4) азотом
55. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
нитрата калия на инертных электродах.
56. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
сульфата натрия на инертных электродах.
57. При обычной температуре медь реагирует с:
1) водой 2) кислородом 3) хлороводородной кислотой 4) азотной кислотой
58. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
гидроксида калия на инертных электродах.
59. В разбавленной серной кислоте растворяется:
1) Cu 2) Zn 3) Ag 4) Au
60. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
азотной кислоты на инертных электродах.
61. При нагревании медь реагирует с:
1) водородом 2) сероводородной кислотой
3) разбавленной серной кислотой 4) концентрированной серной кислотой
62. Напишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора
гидроксида бария на инертных электродах.
Потапова Е.В. (МКОУ «СОШ № 1» , г. Юхнов Юхновского района Калужской области)
6. Химические свойства простых веществ
Формат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть
Скрыть
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует цинк.
- CaCl2
- MgCl2
- CuSO4
- Fe(NO3)3
- Na2S
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
- хлорид кальция (р-р)
- сульфат меди II (р-р)
- концентрированная азотная кислота
- разбавленная соляная кислота
- оксид алюминия
Из предложенного перечня веществ выберите два вещества, с каждым из которых не реагирует соляная кислота.
- Медь
- Свинец
- Железо
- Кобальт
- Золото
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует медь.
- Соляная кислота (р-р)
- Сульфат железа (III)
- Гидроксид натрия
- Азотная кислота
- Нитрат серебра
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует раствор серной кислоты.
- Медь
- Магний
- Ртуть
- Железо
- Серебро
Из предложенного перечня веществ выберите два вещества, которые НЕ реагируют с концентрированной серной кислотой при комнатной температуре.
- Железо
- Магний
- Кальций
- Хром
- Цинк
Из предложенного перечня веществ выберите два вещества, которые реагируют с водой при комнатной температуре.
- Железо
- Алюминий
- Литий
- Медь
- Натрий
Из предложенного перечня веществ выберите два вещества, которые НЕ реагируют с цинком.
- Нитрат кальция
- Сульфат железа
- Хлорид алюминия
- Нитрат хрома III
- Соляная кислота
Из предложенного перечня веществ выберите два вещества, с которыми взаимодействует магний.
- NaOH
- N2
- CaCl2
- HNO3
- Fe
Из предложенного перечня веществ выберите два вещества, с которыми взаимодействует медь.
- Гидроксид натрия
- Сульфат железа III
- Кислород
- Холодная серная кислота
- Нитрат серебра
Из предложенного перечня веществ выберите два вещества, при взаимодействии которых с раствором серной кислоты не образуется водород.
- Cu
- Сr
- Fe
- Ag
- Zn
Из предложенного перечня веществ выберите два вещества, при взаимодействии раствора щелочи с которыми образуется комплексная соль.
- Mg
- Ca
- Zn
- Cu
- Al
Из предложенного перечня веществ выберите два вещества, которые реагируют с водой только при нагревании.
- Натрий
- Серебро
- Цинк
- Никель
- Кальций
Из предложенного перечня веществ выберите два вещества, с которыми реагирует алюминий и железо при нормальных условиях.
- H2SO4(конц.)
- H2SO4 (разб.)
- H2O
- «царская водка»
- NaOH
Из предложенного перечня веществ выберите два вещества, которые НЕ реагируют с разбавленной серной кислотой.
- Железо
- Цинк
- Алюминий
- Медь
- Серебро
Из предложенного перечня веществ выберите два вещества, с которыми реагирует кальций.
- Фосфор
- Сульфат натрия
- Гидроксид лития
- Вода
- Оксид фосфора (V)
Из предложенного перечня веществ выберите два вещества, которые реагируют с водой при обычной температуре.
- Натрий
- Барий
- Железо
- Хром
- Золото
Из предложенного перечня веществ выберите два вещества, при взаимодействии которых с водой образуется щёлочь.
- Азот
- Алюминий
- Кальций
- Медь
- Литий
Из предложенного перечня веществ выберите два вещества, которые могут реагировать и с соляной кислотой, и с раствором гидроксида натрия.
- Алюминий
- Магний
- Свинец
- Калий
- Рубидий
Из предложенного перечня веществ выберите два вещества, с которыми реагирует железо.
- Фторид калия (р-р)
- Соляная кислота (р-р)
- Нитрат натрия (р-р)
- Сульфат серебра (р-р)
- Хлорид цинка (р-р)
Из предложенного перечня реактивов выберите два, которые способны растворить железо в обычных условиях, без нагревания.
- HNO3(р-р)
- H2SO4(конц)
- NH3 (р-р)
- HCl
- H2O
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует медь.
- Хлорид цинка (р-р)
- Сульфат натрия (р-р)
- Разбавленная азотная кислота
- Концентрированная серная кислота
- Оксид алюминия
Из предложенного перечня веществ выберите два вещества, в которых растворяются медь и железо.
- Вода
- Царская водка
- Серная кислота (р-р)
- Азотная кислота (конц.)
- Раствор щёлочи
Задание
6 ЕГЭ 2020 Химия
Химические свойства простых
металлов, неметаллов и оксидов
Все
химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов.
Также на металлы и неметаллы классифицируют образуемые элементами простые
вещества, исходя из их физических и химических свойств.
В
Периодической системе химических элементов Д.И. Менделеева неметаллы расположены
по диагонали: бор – астат и над ней в главных подгруппах.
Для
атомов металлов характерны сравнительно большие радиусы и небольшое число
электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4;
сурьма и висмут — 5; полоний — 6 электронов).
Атомам
неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов
на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов – три).
Отсюда
стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные
свойства, а для атомов неметаллов – стремление к приему недостающих до
устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
Металлы
В
металлах – металлическая связь и металлическая кристаллическая решетка. В узлах
решетки находятся положительно заряженные ионы металлов, связанные посредством
обобществленных внешних электронов, принадлежащих всему кристаллу.
Это
обуславливает все важнейшие физические свойства металлов: металлический блеск,
электро- и теплопроводность, пластичность (способность изменять форму под
внешним воздействием) и некоторые другие, характерные для этого класса простых
веществ.
Металлы I группы
главной подгруппы называют щелочными металлами.
Металлы II группы:
кальций, стронций, барий – щелочноземельными.
Химические свойства металлов
В
химических реакциях металлы проявляют только восстановительные свойства, т.е.
их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют
с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные
и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их
хранят под слоем вазелинового масла или керосина.
4Li + O2
= 2Li2O
2Ca + O2
= 2CaO
Обратите внимание:
при взаимодействии натрия – образуется пероксид, калия — надпероксид
2Na + O2 = Na2O2, К + О2 = КО2 а оксиды получают прокаливанием пероксида с соответствующими
металлом: 2Na + Na2O2
= 2Na2O
Железо,
цинк, медь и другие менее активные металлы медленно окисляются на воздухе и
активно при нагревании.
3Fe + 2O2
= Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2
= 2ZnO
2Cu + O2
= 2CuO
Золото и платиновые металлы не
окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2
= 2NaH
Ca + H2
= CaH2
в) хлором (с образованием хлоридов)
2K + Cl2
= 2KCl
Mg + Cl2
= MgCl2
2Al + 3Cl2
=2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид
железа (III): 2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS 2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид
железа (II): Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2
= 2K3N
3Mg + N2
= Mg3N2
2Al + N2
= 2AlN
2. Взаимодействуют
со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы
расположены в ряд, который называют электрохимическим рядом напряжений или
активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na,
Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы,
расположенные в ряду до магния, при обычных условиях вытесняют водород из воды,
образуя растворимые основания – щелочи.
2Na + 2H2O
= 2NaOH + H2↑
Ba + H2O
= Ba(OH) 2 + H2↑
Магний взаимодействует с водой
при кипячении.
Mg + 2H2O
= Mg(OH) 2 + H2↑
Алюминий
при удалении оксидной пленки бурно реагирует с водой. 2Al + 6H2O = 2Al(OH) 3
+ 3H2↑
Остальные
металлы, стоящие в ряду до водорода, при определенных условиях тоже могут
вступать в реакцию с водой с выделением водорода и образованием оксидов. 3Fe + 4H2O = Fe3O4
+ 4H2↑
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой
концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание:
не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы,
стоящие в ряду до магния и активно реагирующие с водой, не используют для
проведения таких реакций.
Металлы,
стоящие в ряду от магния до водорода, вытесняют водород из кислот. Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа. Fe + H2SO4(разб.) = FeSO4 + H2↑
Образование
нерастворимой соли препятствует протеканию реакции. Например, свинец
практически не реагирует с раствором серной кислоты из-за образования на
поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после
водорода, НЕ вытесняют
водород.
в) растворами солей
Металлы,
стоящие в ряду до магния и активно реагирующие с водой, не используют для
проведения таких реакций.
Для остальных металлов
выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы,
расположенные в ряду правее него, и сам может быть вытеснен металлами,
расположенными левее него.
Cu + HgCl2
= Hg + CuCl2
Fe + CuSO4
= FeSO4 + Cu
Как и
в случае с растворами кислот, образование нерастворимой соли препятствует
протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы,
гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O
= Na2 [Zn(OH) 4] + H2↑
2Al + 2KOH + 6H2O
= 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и
фенолом.
2C2H5OH
+ 2Na = 2C2H5ONa + H2↑
2C6H5OH
+ 2Na = 2C6H5ONa + H2↑
Металлы
участвуют в реакциях с галогеналканами, которые используют для получения низших
циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного
скелета молекулы
(реакция А.Вюрца):
CH2Cl-CH2-CH2Cl
+ Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl
+ 2Na = C2H6(этан) + 2NaCl
Неметаллы
В
простых веществах атомы неметаллов связаны ковалентной неполярной связью. При
этом образуются одинарные (в молекулах H2, F2, Cl2,
Br2, I2), двойные (в молекулах О2), тройные (в
молекулах N2) ковалентные связи.
Строение простых веществ – неметаллов:
1. молекулярное
При
обычных условиях большинство таких веществ представляют собой газы (Н2,
N2, O2, O3, F2, Cl2) или
твердые вещества (I2, P4, S8) и лишь
единственный бром (Br2) является жидкостью. Все эти вещества
молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки
из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в
кристалле, и способны к возгонке.
2. атомное
Эти
вещества образованы кристаллами, в узлах которых находятся атомы: (Bn,
Сn, Sin, Gen, Sen,
Ten). Из-за большой прочности ковалентных связей они, как правило,
имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной
связи в их кристаллах (плавление, испарение), совершаются с большой затратой
энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а
летучесть их весьма мала.
Многие
элементы – неметаллы образуют несколько простых веществ – аллотропных
модификаций. Аллотропия может быть связана с разным составом молекул: кислород
О2 и озон О3 и с разным строением кристаллов:
аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор,
мышьяк, кислород, сера, селен, теллур.
Химические свойства неметаллов
У
атомов неметаллов преобладают окислительные свойства, то есть способность
присоединять электроны. Эту способность характеризует значение
электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I,
Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность
возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут
характерны как окислительные, так и восстановительные свойства, за исключением
фтора – самого сильного окислителя.
1. Окислительные
свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S
(сульфид натрия)
3Mg + N2
= Mg3N2 (нитрид магния)
б) в реакциях с неметаллами,
расположенными левее данного, то есть с меньшим значением
электроотрицательности. Например, при взаимодействии фосфора и серы окислителем
будет сера, так как фосфор имеет меньшее значение электроотрицательности: 2P
+ 5S = P2S5 (сульфид фосфора V)
Большинство
неметаллов будут окислителями в реакциях с водородом: H2 + S = H2S
H2 +
Cl2 = 2HCl
3H2 +
N2 = 2NH3
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород,
реакции горения
CH4 +
2O2 = CO2 + 2H2O
2SO2
+ O2 = 2SO3
Окислитель – хлор
2FeCl2
+ Cl2 = 2FeCl3
2KI + Cl2
= 2KCl + I2
CH4 +
Cl2 = CH3Cl + HCl
Ch2=CH2
+ Br2 = CH2Br-CH2Br
2.
Восстановительные свойства
а) в реакциях с фтором
S + 3F2
= SF6
H2 +
F2 = 2HF
Si + 2F2
= SiF4
б) в реакциях с кислородом (кроме фтора)
S + O2
= SO2
N2 +
O2 = 2NO
4P + 5O2
= 2P2O5
C + O2
= CO2
в) в реакциях со сложными веществами – окислителями
H2 +
CuO = Cu + H2O
6P + 5KClO3
= 5KCl + 3P2O5
C + 4HNO3
= CO2 + 4NO2 + 2H2O
H2C=O
+ H2 = CH3OH
3. Реакции диспропорционирования: один и тот же неметалл является и
окислителем и восстановителем
Cl2 +
H2O = HCl + HClO
3Cl2
+ 6KOH = 5KCl + KClO3 + 3H2O
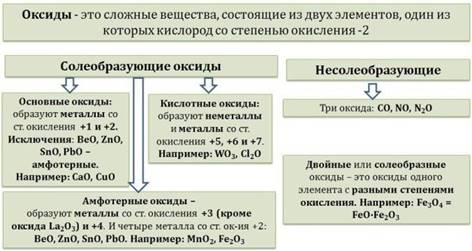
Оксиды: классификация, получение и
химические свойства
Оксиды —
это сложные вещества, состоящие из атомов двух элементов, один из которых
— кислород со степенью окисления -2. При этом кислород связан
только с менее
электроотрицательным элементом.
В зависимости от второго
элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды
традиционно делят на солеобразующие и несолеобразующие.
Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с
разными степенями окисления.
Солеобразующие оксиды
делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными
свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления
+1 и +2. Кислотные оксиды — это оксиды, характеризующиеся кислотными
свойствами. К ним относят оксиды, образованные атомами металлов со степенью
окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и
кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а
также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств,
им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO,
NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов:
большинство металлов окисляются кислородом до оксидов с устойчивыми степенями
окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом
воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → 2Na2O2
Калий, цезий, рубидий образуют
преимущественно пероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом
воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием
железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла
с высшей степенью окисления, если кислород в избытке, или оксид неметалла с
промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а
под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5 4P + 3O2(нед.) → 2P2O3 Но есть некоторые исключения.
Например, сера сгорает только до
оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно
получить только окислением оксида серы (IV) в жестких условиях в присутствии
катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре
(около 2000оС), либо
под
действием электрического разряда, и только до оксида азота (II): N2
+ O2 = 2NO
Не окисляется кислородом
фтор F2 (сам фтор окисляет
кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы
(гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных
соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом
сложных веществ, состоящих, как правило, из двух элементов, образуется смесь
оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа
(III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с
образованием оксида серы (IV) при избытке кислорода и с образованием серы при
недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с
образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до
оксида азота (II): 4NH3 + 5O2 →
4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или
оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на
оксид и воду; для разложения некоторых других (как правило, нерастворимых в
воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются
в водном растворе угольная кислота, сернистая кислота, гидроксид аммония,
гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых
гидроксидов —
кремниевая кислота, гидроксиды тяжелых металлов — гидроксид
железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей. Например, нерастворимые карбонаты и карбонат лития при нагревании
разлагаются на оксиды:
Li2CO3 → H2O + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными
кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании,
как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Химические свойства оксидов
Значительная часть
химических свойств оксидов описывается схемой взаимосвязи основных классов
неорганических веществ.
Химические свойства металлов
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li + O2 → 2Li2O
2Na + O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 + 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg + 2P → Mg3P2 (t)
2Na + Cl2 → 2NaCl
Ca + 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 + 2Mg → 2MgO + C
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg + TiCl4 → 2MgCl2 + Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al + 3Cl2 → 2AlCl3
4Al + 3C → Al4C3
2Al + N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al + H2SO4 (р) → Al2(SO4)3 + H2

2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода:
Al + 4HNO3(конц.) → Al(NO3)3 + NO
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 3NH4NO3 + 9H2O (при любой температуре, возможно образование N2O)
2Al + 6H2SO4(конц.) → Al2(SO4)3 + 3SO2
2Al + 3H2SO4(разб.) → Al2(SO4)3 + 3H2
3. Железо
1) Реагирует с кислородом:
3Fe + 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe + 4H2O → Fe3O4 + 4H2 (t)
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
Fe + I2 → FeI2 (образуется соль Fe+2)
Fe + S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe + H2SO4 (разб.) → FeSO4 + H2
Fe + 2HCl → FeCl2 + H2
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)

Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2
Fe + 4HNO3(разб.) → Fe(NO3)3 + NO
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2
9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
2FeCl3 + Fe → 3FeCl2
Fe3O4 + Fe → 4FeO
Fe2O3 + Fe → 3FeO
4. Хром
1) Реагирует с кислородом:
4Cr + 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr + 3H2O → Cr2O3 + 3H2 (t)
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
Cr + S → Cr2S3 (образуется соль Fe+3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + H2SO4 (разб.) → CrSO4 + H2
Cr + 2HCl → CrCl2 + H2
7) Пассивируется концентрированными растворами серной и азотной кислот (реакция идут только при нагревании)
Cr + 6HNO3(конц.) → Cr(NO3)3 + 3NO2
Cr + 4HNO3(разб.) → Cr(NO3)3 + NO
5. Медь
1) Реагирует с кислородом:
2Cu + O2 → 2CuO
2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
CuO + Cu → Cu2O
CuCl2 + Cu → 2CuCl
3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cu + H2 → реакция не идет
4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
Cu + H2O → реакция не идет
5) Не реагирует с щелочами
Cu + NaOH → реакция не идет
6) Реагирует с кислородом, серой, галогенами при нагревании:
Cu + Cl2 → CuCl2 (образуется соль Cu+2)
Cu + Br2 → CuBr2 (образуется соль Cu+2)
2Cu + I2 → 2CuI (образуется соль Cu+1)
Cu + S → CuS (образуется соль Cu+2)
7) Не реагирует с N2, C, Si.

Cu + H2SO4(р) → реакция не идет.
9) Реагирует с кислотами-окислителями как слабый восстановитель:
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO
Cu + 2H2SO4(конц.) → CuSO4 + SO2
7. Цинк
1) Реагирует с кислородом: 2Zn + O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
Zn + H2O → ZnO + H2
4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
Zn + 2NaOH(тв.) → Na2ZnO2 + H2 (t)
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5) Реагируют с галогенами, серой при нагревании:
Zn + Cl2 → ZnCl2
Zn + S → ZnS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Zn + H2SO4 (разб.) → ZnSO4 + H2

4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S
Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты:
Zn+4HNO3(конц.) → Zn(NO3)2 + 2NO2
4Zn + 10HNO3(разб.) → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Задание №1
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид цинка
2) сульфат меди(II)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 24
Хлорид цинка относится к солям, а железо — к металлам. Металл реагирует с солью только в том случае, если он является более активным по сравнению с тем, который входит в состав соли. Определяется относительная активность металлов по ряду активности металлов (по-другому, ряду напряжений металлов). Железо в ряду активности металлов находится правее цинка, значит, оно менее активно и не способно вытеснить цинк из соли. То есть реакция железа с веществом №1 не идет.
Сульфат меди (II) CuSO4 будет реагировать с железом, так как железо находится левее меди в ряду активности, то есть является более активным металлом.
Концентрированная азотная, а также концентрированная серная кислоты не способны без нагревания реагировать с железом, алюминием и хромом в виду такого явления, как пассивация: на поверхности данных металлов под действием указанных кислот образуется нерастворимая без нагревания соль, выполняющая роль защитной оболочки. Тем не менее, при нагревании эта защитная оболочка растворяется и реакция становится возможной. Т.е. так как указано, что нагрева нет, реакция железа с конц. HNO3 не протекает.
Соляная кислота в независимости от концентрации относится к кислотам-неокислителям. С кислотами-неокислителями с выделением водорода реагируют металлы, стоящие в ряду активности левее водорода. К таким металлам как раз относится железо. Вывод: реакция железа с соляной кислотой протекает.
В случае металла и оксида металла реакция, как и в случае с солью, возможна, если свободный металл активнее того, что входит в состав оксида. Fe, согласно ряду активности металлов, менее активен, чем Al. Это значит, Fe с Al2O3 не реагирует.
Задание №2
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует бром.
1) азотная кислота
2) кислород
3) NaOH (водн.)
4) хлорид калия
5) иодид лития
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 35
strong>Пояснение:
Очевидно, что любая реакция простого вещества с любым другим веществом (веществами) является окислительно-восстановительной.
Бром (Br2) прежде всего следует рассматривать как вещество с сильными окислительными свойствами. Реакций, в которых свободный бром проявляет восстановительные свойства крайне мало (взаимодействие со фтором, диспропорционирование в щелочи).
1) Азотная кислота содержит два элемента в высших степенях окисления (водород +1 и азот +5), т.е., очевидно они окислены бромом быть не могут. Кислород же, имеющий степень окисления -2, не может быть окислен Br0 ввиду большей чем у брома электроотрицательности. Вывод реакция HNO3 с Br2 не протекает.
2) Кислород, хлор и бром — не реагируют между собой — все три указанных вещества могут проявлять практически только окислительные свойства и «не готовы» делиться электронами друг с другом. Вывод реакция O2 c Br2 не протекает.
3) NaOH (водн.). Из простых веществ с щелочами реагируют только Be, Zn, Al, Si, P, S и галогены. Бром — галоген, следовательно, реагирует с щелочью. При этом в зависимости от температуры несколько различаются продукты реакций:
2NaOH + Br2 = NaBrO + NaBr + H2O (на холоду)
6NaOH + 3Br2 t° > NaBrO3 + 5NaBr + 3H2O
4) Хлорид калия. Свободный галоген реагирует с галогенидом металла в том случае, если исходный свободный галоген более электроотрицателен (находится выше в таблице Менделеева). Бром находится в таблице ниже, чем хлор, следовательно, реагировать с хлоридом калия не будет.
5) Аналогично пункту 4. Бром находится в таблице выше йода, следовательно реагирует с иодидом лития, вытесняя свободный йод:
Br2 + 2LiI = I2 + 2LiBr
Задание №3
Из предложенного перечня веществ выберите два таких, с которыми в обычных условиях реагирует магний.
1) концентрированная серная кислота
2) хлорид бария
3) гидроксид натрия
4) нитрат цинка
5) сера
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 14
Пояснение:
1) Концентрированная серная кислота реагирует при обычных условиях практически со всеми металлами кроме платины, золота и пассивирующихся металлов (Cr, Fe, Al). Магний — сильный восстановитель, поэтому восстановит S+6 до минимальной степени окисления серы -2 (H2S):
5H2SO4(конц.) + 4Mg = 4MgSO4 + H2S↑ + 4H2O
2) Хлорид бария с магнием не реагирует так как барий более активный металл, чем магний.
3) С гидроксидом натрия магний не реагирует, т.к. с щелочами из металлов реагируют только Be,Zn,Al
4) С нитратом цинка магний реагирует, т.к. магний более активен чем цинк, т.е. находится левее цинка в ряду активности:
Mg + Zn(NO3)2 = Mg(NO3)2 + Zn
5) С серой магний реагирует, но только при нагревании. Без нагревания реакция не протекает. Практически все реакции между твердыми веществами требуют нагревания.
Задание №4
Из предложенного перечня веществ выберите два вещества, с каждым из которых медь реагирует без нагревания.
1) разбавленная серная кислота
2) разбавленная азотная кислота
3) 10%-ная соляная кислота
4) раствор нитрата серебра
5) раствор нитрата железа (II)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 24
Пояснение:
Медь относится к малоактивным металлам (расположена в ряду активности правее водорода). В связи с этим не реагирует с растворами кислот-неокислителей. По этой причине не подходит вариант ответа 1 и 3. Азотная кислота в независимости от концентрации относится к кислотам окислителям, т.е. окисляет не водородом в степени окисления +1, а кислотообразующим элементом (азотом) в степени окисления +5. Это означает, что список металлов, с которыми может реагировать азотная кислота, распространяется не только на металлы, находящимися в ряду активности до водорода, но и на все металлы после (кроме платины и золота):
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Металл с солью может реагировать в том случае, если исходный свободный металл более активен, чем тот который содержится в исходной соли. Поскольку медь более активна, чем серебро, то ее реакция с нитратом серебра возможна и протекает в соответствии с уравнением:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Поскольку медь менее активна, чем железо, то ее реакция с солями железа (II) невозможна.
Примечание:
Соли железа (III) в отличие от солей железа (II) являются более сильными окислителями. По этой причине соли железа (III) могут реагировать не только с металлами левее Fe в ряду активности, но также и с некоторыми металлами после. Формально это противоречит правилу, однако, это не так, поскольку вытеснение свободного железа медью не происходит. Наблюдается лишь частичное восстановление железа (III) до меньшей степени окисления. Например:
Cu + 2Fe+3Cl3 = CuCl2 + 2Fe+2Cl2
Задание №5
Из предложенного перечня веществ выберите два вещества, с каждым из которых хром реагирует при комнатной температуре.
- 1. HCl (разб.)
- 2. H2O
- 3. H2SO4 (разб.)
- 4. N2
- 5. H2
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 13
Хром — металл, расположенный в ряду активности до водорода. По этой причине реагирует практически со всем кислотами, включая кислоты-неокислители. Среди представленного списка кислотами-неокислителями являются разбавленные растворы серной и соляной кислот. Обе реакции протекают по типу замещения с выделением водорода:чно Fe, Al). Реакция между пассивирующимися металлами и концентрированной серной или концентрированной азотной кислотами возможна лишь при сильном нагревании.
С водой из металлов реагируют при комнатной температуре только щелочные и щелочно-земельные металлы. Хром, будучи металлом средней активности (расположен между Al и H), реагирует с перегретым водяным паром в раскаленном состоянии, образуя оксид металла и водород.
Азот при комнатной температуре реагирует лишь с единственным металлом — литием.
Водород при комнатной температуре с металлами не реагирует. При нагревании водород способен реагировать с щелочными и щелочноземельными металлами.
[adsp-pro-3]
Задание №6
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует при обычных условиях.
1) сера (кр.)
2) серная кислота (конц., хол.)
3) нитрат цинка (р-р)
4) нитрат меди (II) (р-р)
5) серная кислота (конц., гор.)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 45
Задание №7
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует бром.
1) фторид калия
2) иодид калия
3) хлорид калия
4) гидроксид меди (II)
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 25
Задание №8
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует кальций.
- 1. K2O
- 2. H2
- 3. BaCl2
- 4. H2O
- 5. Mg
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 24
Задание №9
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует фосфор.
1) концентрированная соляная кислота
2) разбавленная серная кислота
3) концентрированная азотная кислота
4) гидроксид меди (II)
5) гидроксид калия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 35
Задание №10
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует хлор.
1) хлорид железа (II)
2) хлорид железа (III)
3) фторид железа (III)
4) фторид натрия
5) бромид натрия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 15
[adsp-pro-3]
Задание №11
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует сера.
- 1. Cl2
- 2. NaCl
- 3. HCl
- 4. H2
- 5. N2
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 14
Задание №12
Из предложенного перечня веществ выберите два вещества, с каждым из которых цинк реагирует без нагревания.
- 1. CuSO4
- 2. MgCl2
- 3. Na2SO4
- 4. AgCl
- 5. AgNO3
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 15
Задание №13
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует кремний.
1) оксид магния
2) водород
3) кислород
4) гидроксид натрия
5) гидроксид алюминия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 34
Задание №14
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует водород.
- 1. Na
- 2. Cl2
- 3. NaOH
- 4. HCl
- 5. NaCl
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 12
Задание №15
Из предложенного перечня веществ выберите два вещества, с каждым из которых хром реагирует без нагревания.
1) хлорид железа (III)
2) концентрированная серная кислота
3) разбавленная серная кислота
4) гидроксид цинка
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 13
[adsp-pro-3]
Задание №16
Из предложенного перечня веществ выберите два вещества, с каждым из которых азот может реагировать при нагревании.
1) натрий
2) водород
3) хлор
4) концентрированная серная кислота
5) концентрированная азотная кислота
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 12
Задание №17
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и водород, и хлор.
1) вода
2) аммиак
3) гидроксид кальция
4) металлический кальций
5) сера
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 45
Задание №18
Из предложенного перечня веществ выберите два вещества, в каждом из которых растворяются и железо, и медь.
1) серная кислота (разб., гор.)
2) серная кислота (конц., гор.)
3) серная кислота (конц., хол.)
4) серная кислота (разб., хол.)
5) азотная кислота (конц., гор.)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 25
Задание №19
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и сера, и хлор.
1) железо
2) азот
3) натрий
4) кислород
5) оксид углерода (IV)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 13
Задание №20
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагируют и алюминий, и фосфор.
1) хлор
2) кислород
3) водород
4) раствор хлорида железа (II)
5) раствор нитрата цинка
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 12
[adsp-pro-3]
Задание №21
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует барий.
1) сера
2) гидроксид натрия
3) сульфат калия
4) хлорид кальция
5) водород
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 15
Задание №22
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует азот.
1) литий
2) водород
3) вода
4) соляная кислота
5) хлорид калия
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 12
Задание №23
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует бром.
1) барий
2) соляная кислота
3) карбонат калия
4) азотная кислота (р-р)
5) фосфор
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 15
Задание №24
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует сера.
1) серная кислота (конц.)
2) гидроксид хрома(III)
3) карбонат натрия (р-р)
4) хлорид меди(II)
5) водород
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 15
Задание №25
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует хром.
1) гидроксид цинка
2) хлор
3) сульфат кальция (р-р)
4) соляная кислота
5) хлорид бария (р-р)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 24
[adsp-pro-3]
Задание №26
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует хлор.
1) азотная кислота (конц.)
2) оксид кремния
3) гидроксид калия (р-р)
4) фосфат кальция
5) бромид натрия (р-р)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 35
Задание №27
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует водород.
1) сера
2) серная кислота (конц.)
3) хлорид кальция (р-р)
4) оксид меди (II)
5) гидроксид натрия (р-р)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 14
Задание №28
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует цинк.
1) сульфат магния (р-р)
2) хлорид алюминия (р-р)
3) гидроксид натрия (р-р)
4) азотная кислота (р-р)
5) гидроксид железа(II)
Запишите в поле ответа номера выбранных веществ.
Решение
Ответ: 34
[adsp-pro-10]

