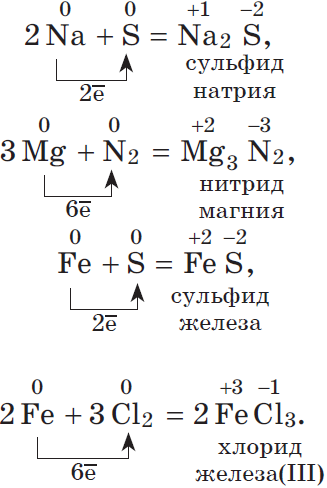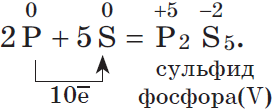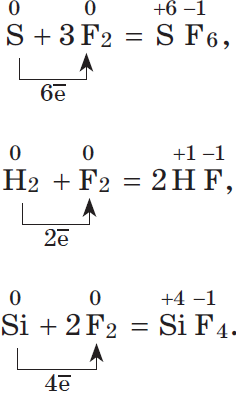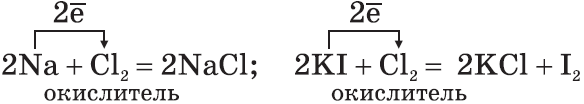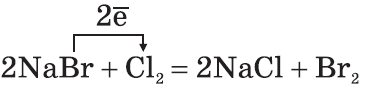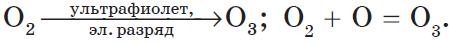Химические свойства неметаллов
1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
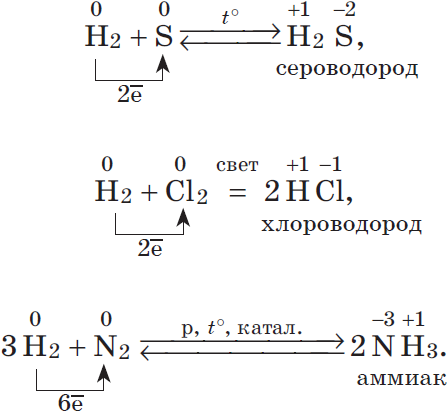
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu — > 2CuI
6) Галогены — сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами

10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
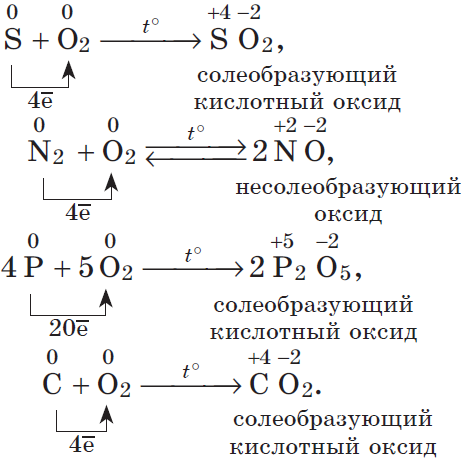
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.) → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными — только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор — ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2 → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)

3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Не взаимодействует с щелочами
C + NaOH → реакция не идет
4) Не взаимодействует с кислотами-неокислителями:
C + HCl → реакция не идет
C + H2SO4(разб.) → реакция не идет.
5) Реагирует с концентрированными растворами кислот-окислителей:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.) → CO2 + 4NO2 + 2H2O (t)
C + 4HNO3(разб.) → реакция не идет.
6) Используется при получении фосфора:
Ca3(PO4)2 + 5C + 3SiO2 → 5CO
6. Кремний
1) Реагирует с кислородом:
Si + O2 → SiO2 (кварц, песок)
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
4) Не реагирует с растворами кислот. Реагирует только с HF:
Si + 4HF → SiF4 + 2H2 (t).
Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Химические свойства водорода
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом кремния:
SiO2 + 2H2 = Si + 2H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлорноватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + 3H2O2 → 2HCl + 2H2O + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 + O2 → 2CH3-CH=O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + NaOH → Na2SO3 + Na2S + H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S + H2O (пар) → 2H2S + SO2
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000оС или действие электрического разряда) азот реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P2O5 + 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
*
Простые вещества — неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se{аморф.}$ — желтые; $Bа{морф.}$ — коричневый; $О{2(ж)}$ — голубой; $Si, As{мет.}$ — серые; $Р_4$ — бледно-желтый; $I{1(г)}$ — фиолетово-черный с металлическим блеском; $Br{2(ж)}$ — бурая жидкость; $Cl{2(г)}$ — желто-зеленый; $F{2(г)}$ — бледно-зеленый; $S{8(т)}$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)${C}↖{-4}H_4+2{O_2}↖{0}→{C}↖{+4}{O_2}↖{-2}+2H_2{O}↖{-2}$
восстановитель ${C}↖{-4}-8{e}↖{-}→{C}↖{+4}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
б)$2{S}↖{+4}O_2+{O_2}↖{0}{→}↖{t°,кат.}2{S}↖{+6}{O_3}↖{-2}$
восстановитель ${S}↖{+4}-2{e}↖{-}→{S}↖{+6}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)$2{Fe}↖{+2}{Cl_2}↖{-1}+{Cl_2}↖{0}=2{Fe}↖{+3}{Cl_3}↖{-1}$
восстановитель ${Fe}↖{+2}-1{e}↖{-}→{Fe}↖{+3}|2$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-}|1$
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
б)$2{K}↖{+1}{I}↖{-1}+{Cl_2}↖{0}={K}↖{+1}{Cl}↖{-1}+{I_2}↖{0}$
восстановитель $2{I}↖{-1}-2{e}↖{-}→{I_2}↖{0}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
в)${C}↖{-4}H_4+{Cl_2}↖{0}{→}↖{свет}{CH_3}↖{-2}{Cl}↖{-1}+H{Cl}↖{-1}$
восстановитель ${C}↖{-4}-2{e}↖{-}→{C}↖{-2}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Галогенирование метана — характерная реакция для алканов;
г)${C}↖{-2}H_2{=}↙{водный р-р}{C}↖{-2}H_2+{Br_2}↖{0}→{C}↖{-1}H_2{Br}↖{-1}-{C}↖{-1}H_2{Br}↖{-1}$
восстановитель ${C}↖{-2}-1{e}↖{-}→{C}↖{-1}|2$
окислитель ${Br_2}↖{0}+2{e}↖{-}→2{Br}↖{-1}|1$
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: ${Cl_2}↖{+1}{O}↖{−2}, {Cl}↖{+4}{O_2}↖{-2}, {Cl_2}↖{+7}{O_7}↖{-2}, {Br_2}↖{+1}{O}↖{-2}, {Br}↖{+4}{O_2}↖{-2}, {I_2}↖{+5}{O_5}↖{-2}$ и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)${H_2}↖{0}+{{Cu}↖{+2}O}↙{оксид}{→}↖{t°}{Cu}↖{0}+{H_2}↖{+1}C$
восстановитель ${H_2}↖{0}-2{e}↖{-}→2{H}↖{+1}|1$
окислитель ${Cu}↖{+2}+2{e}↖{-}→{Cu}↖{0}|1$
б)$6{P}↖{0}+5{K{Cl}↖{+5}O_3}↙{соль}{→}↖{t}5K{Cl}↖{-1}+3{P_2}↖{+5}O_5$
восстановитель ${P}↖{0}-5{e}↖{-}→{P}↖{+5}|6$
окислитель ${Cl}↖{+5}+6{e}↖{-}→{Cl}↖{-1}|5$
в)${C}↖{0}+4{H{NO}↖{+5}O_3}↙{кислота}{→}↖{t°}{C}↖{+4}O_2↑+4{N}↖{+4}O_2↑+2H_2O$
восстановитель ${C}↖{0}-4{e}↖{-}→{C}↖{+4}|1$
окислитель ${N}↖{+5}+1{e}↖{-}→{N}↖{+4}|4$
г)
восстановитель ${H_2}↖{0}-2{e}↖{-}→{2H}↖{+}|1$
окислитель ${C}↖{0}+2{e}↖{-}→{C}↖{-2}|1$
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)${Cl_2}↖{0}+H_2O⇄H{Cl}↖{-1}+H{Cl}↖{+1}O$
восстановитель ${Cl}↖{0}-1{e}↖{-}→{Cl}↖{+1}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|1$
б)$3{Cl_2}↖{0}+6KOH=5K{Cl}↖{-1}+K{Cl}↖{+5}O_3+2H_2O$
восстановитель ${Cl}↖{0}-5{e}↖{-}→{Cl}↖{+5}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|5$
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | ${B_2H_6}↙{диборан}$ | $ {CH_4}↙{метан}$ | $ {NH_3}↙{аммиак}$ | $ {H_2O}↙{вода}$ | $ {HF}↙{фтороводород}$ |
| $3$ | ${SiH_4}↙{силан}$ | $PH_3↙{фосфин}$ | ${H_2S}↙{сероводород}$ | ${HCl}↙{хлороводород}$ | |
| $4$ | ${AsH_3}↙{арсин}$ | ${H_2Se}↙{селеноводород}$ | ${HBr}↙{бромоводород}$ | ||
| $5$ | ${H_3Te}↙{теллуроводород}$ | ${HI}↙{йодоводород}$ |
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$table 1.H_2+Cl_2=2HCl; 2.N_2+3H_2⇄2NH_3;}$ В промышленности так получают хлороводород и аммиак.
$table 3.C+2H_2=CH_4; 4.2H_2+O_2=2H_2O; 5.H_2+S⇄H_2S;}$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
*
*
Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
3. Галогены активно реагируют с неметаллами:
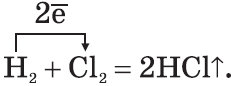
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
*
*
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°*{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична: 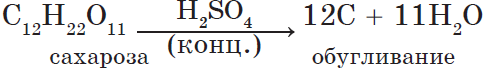 Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
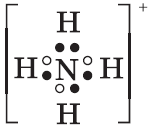
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония: 4. Взаимодействует с кислотами: $NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)*3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO*{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя — с водой: $P_2O_5+3H_2O=2H_3PO_4$ — со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ — с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
1.ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
С щелочными металлами при нормальных условиях – оксиды и пероксиды (литий – оксид, натрий – пероксид, калий, цезий, рубидий – надпероксид
4Li + O2 = 2Li2O (оксид)
2Na + O2 = Na2O2 (пероксид)
K+O2=KO2 (надпероксид)
С остальными металлами главных подрупп при нормальных условиях образует оксиды со степенью окисления, равной номеру группы
2Сa+O2=2СaO
4Al + O2 = 2Al2O3
С металлами побочных подгрупп образует при нормальных условиях и при нагревании оксиды разной степени окисления, а с железом железную окалину Fe3O4 (FeO∙Fe2O3)
3Fe + 2O2 = Fe3O4
4Cu + O₂ = 2Cu₂⁺¹O (красный);
2Cu + O₂ = 2Cu⁺²O (чѐрный );
2Zn + O₂ = ZnO
4Cr + 3О2 = 2Cr2⁺³О3
2.ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
образует оксиды – часто промежуточной степени окисления, с галогенами непосредственно не реагирует
C + O₂(изб)=CO₂;
C+ O₂ (нед) = CO
S + O₂ = SO₂
N₂ + O₂ = 2NO — Q
3.ВЗАИМОДЕЙСТВИЕ С ОКСИДАМИ
Окисляет низшие оксиды до высших::
2Fe⁺²O + O2 = Fe2⁺³O3;
2C⁺²O + O2 = 2C⁺⁴O2
4.ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ
Безводные бескислородные кислоты (бинарные соединения) сгорают в атмосфере кислорода
2H2S + O2 = 2S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
В кислородсодержащих повышает степень окисления неметалла.
2HN⁺³O2 + O2 = 2HN⁺⁵O3
5.ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
Окисляет неустойчивые гидроксиды в водных растворах до более высокой степени окисления
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
6.ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ И БИНАРНЫМИ СОЕДИНЕНИЯМИ
Вступает в реакции горения и каталитического окисления
Горение
4FeS2 +11O2 = 2Fe2O3 + 8SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 3O2 = 2N2 + 6H2O
Каталитическое окисление
NH3 + O2 = NO + H2O
С ВОДОЙ НЕ РЕАГИРУЕТ.
ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНОВ
1.ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
образуют галогениды (фториды, хлориды, бромиды, иодиды).
С щелочными при нормальных условиях, в атмосфере F2, Cl2, Br2 воспламеняются:
2Na + Cl2 = 2NaCl (хлорид)
Щелочноземельные и алюминий реагируют при нормальных условиях:
Сa+Cl2=СaCl2
2Al+3Cl2 = 2AlCl3
Металлы побочных подгрупп реагируют при повышенных температурах
Cu + Cl₂ = Cu⁺²Cl₂
Zn + Cl₂ = Zn⁺²Cl₂
2Cr + 3Br2 = 2Cr⁺³Br3
2Fe + ЗС12 = 2Fe⁺³Cl3 хлорид железа (III)
2Cu + I₂ = 2Cu⁺¹I (не бывает йодида меди (II)!)
2.ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
С кислородом непосредственно не взаимодействуют (исключение F₂) , реагируют с серой, фосфором, кремнием.
Химическая активность у брома и йода выражена слабее, чем у фтора и хлора:
Н2 + F2 = 2НF ; Si + 2F2 = SiF4.
2P + 3Cl2 = 2P⁺³Cl3; 2P + 5Cl2 = 2P⁺⁵Cl5
S + 3F2 = S⁺⁶F6; S + Cl2 = S⁺²Cl2
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА F₂
Реагирует с кислородом, образуя фторид кислорода: F2 + O2 = O⁺²F2
Реагирует с другими галогенами: Cl₂ + F₂ = 2Cl⁺¹F¯¹
Реагирует даже с инертными газами: 4F₂ + Xe = Xe⁺⁸F8¯¹.
3.ВЗАИМОДЕЙСТВИЕ С ВОДОЙ
ФТОР при нормальных условиях образует плавиковую кислоту + О₂
2F2 + 2H2O → 4НF + О2↑ или
3F2 + 3H2O → ОF2↑ + 4НF + Н2О2
ХЛОР при повышении температуры образует хлороводородную кислоту + О₂,
2Сl₂ + 2H₂O → 4HCl + O₂↑
при н.у. — «хлорная вода»
Сl2↑ + Н2О ↔ НСl + НСlO (хлороводородная и хлорноватистая кислоты)
БРОМ при нормальных условиях образует «бромную воду»
Br2 + Н2О ↔ НBr + HBrО (бромоводородная и бромноватистая кислоты)
ЙОД → реакция не идет I2 + H₂O ≠
4 .ВЗАИМОДЕЙСТВИЕ С ВОДОЙ ДВУХ ГАЛОГЕНОВ.
Cl₂ и F₂ окисляет бром и йод в воде:
5Cl₂⁰ + I₂⁰ +6H₂O → 10HCl¯¹ + 2HI⁺⁵O₃
5.ВЗАИМОДЕЙСТВИЕ С ОКСИДАМИ
Реагирует только фтор F₂ , вытесняя кислород из оксида, образуя фториды
SiO2‾² + 2F2⁰ = SiF4‾¹ + O2⁰↑
6.ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ.
реагируют с бескислородными кислотами, вытесняя менее активные неметаллы.
H2S‾² + I2⁰ → S⁰↓+ 2HI‾
7.ВЗАИМОДЕЙСТВИЕ С ЩЕЛОЧАМИ
ФТОР образует фторид + кислород и воду
2F2 + 4NaOH = 4NaF¯¹ + O2↑ + 2H2O
ХЛОР при нагревании образует хлорид, хлорат и воду
3Cl₂ + 6KOH = 5KCl¯¹ + KCl⁺⁵O3 + 3H2O
На холоде хлорид, гипохлорит и воду, с гидроксидом кальция хлорную известь и воду
Cl2 + 2KOH-(холод)= KCl¯¹ + KCl⁺¹O + H2O
С гидроксидом кальция образует хлорную известь (смесь хлорида, гипохлорита и гидроксида)
Cl2 + Ca(OH) 2 = CaOCl2+ H2O
ХЛОР при нагревании образует хлорид, хлорат и воду
3Cl₂ + 6KOH = 5KCl¯¹ + KCl⁺⁵O3 + 3H2O
На холоде хлорид, гипохлорит и воду, с гидроксидом кальция хлорную известь и воду
Cl2 + 2KOH-(холод)= KCl¯¹ + KCl⁺¹O + H2O
С гидроксидом кальция образует хлорную известь (смесь хлорида, гипохлорита и гидроксида)
Cl2 + Ca(OH) 2 = CaOCl2+ H2O
БРОМ с щелочью при любой температуре образует хлорид, хлорат и воду
3Br₂ + 6KOH = 5KBr¯¹ + KBr⁺⁵O3 + 3H2O
ЙОД реагируют с щелочами аналогично брому.
8.ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
Вытеснение менее активные галогены из солей
2KBr + Cl2↑ → 2KCl + Br2↑2KCl + Br2↑ ≠2KCl + F2↑→ 2KF + Cl2↑2KBr + J2↑≠
Окисляют в солях неметаллы до более высокой степени окисления
2Fe⁺²Cl2 + Cl2⁰ → 2Fe⁺³Cl3‾¹
Na2S⁺⁴O3 + Br2⁰↑ + 2H2O →Na2S⁺⁶O4 + 2HBr‾
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
Атомы самого электроотрицательного элемента — фтора — не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
Cпособы получения металлов
|
неметалл |
Лабораторный способ |
Промышленный сопособ |
|
H2 |
Zn + 2HCl = ZnCl2 + H2 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 Ca + 2H2O = Ca(OH)2 + H2 |
2NaCl + 2H2O = H2 + Cl2 + 2NaOH 3Fe + 4H2O = Fe3O4 + 4H2 |
|
Cl2 |
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O |
2NaCl = Cl2 + 2Na |
|
O2 |
2KClO3 = 2KCl + 3O2 |
Сжижение воздуха при низких t и его дальнейшая фракционная перегонка |
|
S |
H2SO3 + 2H2S = 3S + 3H2O |
В автоклавах |
|
N2 |
NH4NO2 = N2 + 2H2O |
Получают из сжатого воздуха |
|
P |
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5 |
|
|
Si |
SiO2 + 2Mg = Si + 2MgO |
SiO2 + 2C = Si + 2CO |
Взаимодействие с простыми веществами:
1. Взаимодействие с металлами:
2Na + Cl2 = 2NaCl;
Fe + S = FeS;
6Li + N2 = 2Li3N;
2Ca + O2 = 2CaO.
в этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
2. Взаимодействие с другими неметаллами:
- взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды:
3H2 + N2 = 2NH3;
H2 + Br2 = 2HBr.
- взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2;
t, эл. разряд
N2 + O2 = 2NO – Q
4P + 5O2 = 2P2O5.
Si + O2 = SiO2
- при взаимодействии с фтором фтор является окислителем
F2 + Cl2 = 2ClF
3F2 + Br2 = 2BrF3
Со сложными веществами
2F2 + 2H2O = O2 + 2HF
2F2 + H2O = OF2 + 2HF
2F2 + SiO2 = O2 + SiF4
Специфические реакции
- Для Si
3Si + 4HNO3 + 12HF = 3SiF4 + 4NO + 8H2O
Si + 2NaOH + 2H2O = Na2SiO3 + 3H2
Si + 4NaOH(тв.) = Na2SiO3 + 2H2 + Na2O (При нагревании)
- Для Cl2
Cl2 + H2O = HCl + HClO
Cl2 + 2NaOH = NaCl + NaClO + H2O
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (При нагревании)
- Для Br2
Br2 + H2O = HBr + HBrO
2Br2 + 2Ca(OH)2 = CaBr2 + Ca(BrO)2 + 2H2O
6Br2 + 6Ca(OH)2 = 5CaBr2 + Ca(BrO3)2 + 6H2O (При нагревании)
- Для S
S + H2O = РЕАКЦИЯ НЕ ИДЁТ
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Для P
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO4
Химические
свойства простых веществ – неметаллов
Химические свойства водорода
С
точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше
общего с галогенами. Водород, также как и галогены, является неметаллом и
образует аналогично им двухатомные молекулы (H2).
В
обычных условиях водород представляет собой газообразное, малоактивное
вещество. Невысокая активность водорода объясняется высокой прочностью связи
между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание,
либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие
водорода с простыми веществами
с металлами
Из
металлов водород реагирует только с щелочными и щелочноземельными!
К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K,
Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы,
кроме бериллия и магния (Ca, Sr, Ba, Ra)
При
взаимодействии с активными металлами водород проявляет окислительные свойства,
т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и
щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при
нагревании:
2Na + H2
= 2NaH
Ca + H2
= CaH2
Следует
отметить, что взаимодействие с активными металлами является единственным случаем,
когда молекулярный водород Н2 является
окислителем.
с неметаллами
Из
неметаллов водород реагирует только c углеродом, азотом, кислородом, серой,
селеном и галогенами!
Под
углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне
инертная аллотропная модификация углерода.
При
взаимодействии с неметаллами водород может выполнять только функцию
восстановителя, то есть только повышать свою степень окисления:
Взаимодействие
водорода со сложными веществами
с оксидами металлов
Водород
не реагирует с оксидами металлов, находящихся в ряду активности металлов до
алюминия (включительно), однако, способен восстанавливать многие оксиды
металлов правее алюминия при нагревании:
c оксидами неметаллов
Из
оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов
и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно
следует отметить его реакцию с угарным газом CO.
Смесь
CO и H2 даже имеет свое собственное название – «синтез-газ»,
поскольку из нее в зависимости от условий могут быть получены такие
востребованные продукты промышленности как метанол, формальдегид и даже
синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из
органических кислот водород реагирует только с непредельными, а также с
кислотами, содержащими функциональные группы способные к восстановлению
водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В
случае водных растворов солей их взаимодействие с водородом не протекает.
Однако при пропускании водорода над твердыми солями некоторых металлов средней
и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами
называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые
ими простые вещества. Здесь и далее по тексту, если не сказано иное, под
галогенами будут пониматься именно простые вещества.
Все
галогены имеют молекулярное строение, что обусловливает низкие температуры
плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их
формулу можно записать в общем виде как Hal2.
Галоген
Физические
свойства
F2 Светло-желтый
газ с резким раздражающим запахом
Cl2 Желто-зеленый
газ с резким удушливым запахом
Br2 Красно-бурая
жидкость с резким зловонным запахом
I2 Твердое
вещество с резким запахом, образующее черно-фиолетовые кристаллы
Следует
отметить такое специфическое физическое свойство йода, как его способность к
сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при
котором вещество, находящееся в твердом состоянии, при нагревании не плавится,
а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Как
известно, электроотрицательность неметаллов при движении вниз по подгруппе
снижается, в связи с чем активность галогенов уменьшается в ряду: F2
> Cl2 > Br2 > I2
Взаимодействие галогенов
с простыми веществами
Все
галогены являются высокоактивными веществами и реагируют с большинством простых
веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой
реакционной способности может реагировать даже с теми простыми веществами, с
которыми не могут реагировать остальные галогены. К таким простым веществам
относятся кислород, углерод (алмаз), азот, платина, золото и некоторые
благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми
благородными газами.
Остальные
галогены, т.е. хлор, бром и йод, также являются активными веществами, однако
менее активными, чем фтор. Они реагируют практически со всеми простыми
веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и
благородных газов.
Взаимодействие
галогенов с неметаллами
водородом
При
взаимодействии всех галогенов с водородом образуются галогеноводороды с общей
формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно
даже в темноте и протекает со взрывом в соответствии с уравнением: H2
+ F2 = 2HF
Реакция
хлора с водородом может быть инициирована интенсивным ультрафиолетовым
облучением или нагреванием. Также протекает со взрывом: H2 + Cl2
= 2HCl
Бром
и йод реагируют с водородом только при нагревании и при этом, реакция с
йодом является обратимой: H2 + Br2 = 2HBr
фосфором
Взаимодействие
фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора: 2P + 5F2 = 2PF5
При
взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора
как в степени окисления + 3, так и в степени окисления +5, что зависит от
пропорций реагирующих веществ:
При
этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция
начинается самопроизвольно.
Взаимодействие
же фосфора с йодом может привести к образованию только триодида фосфора из-за
существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор
окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор
и бром реагируют с серой, образуя соединения, содержащие серу в крайне не
свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются
весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих
взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее
для ознакомления:
взаимодействие серы с
хлором и бромом
Взаимодействие галогенов
с металлами
Как
уже было сказано выше, фтор способен реагировать со всеми металлами, даже
такими малоактивными как платина и золото:
Остальные
галогены реагируют со всеми металлами кроме платины и золота:
Реакции
галогенов со сложными веществами
Реакции замещения с
галогенами
Более
активные галогены, т.е. химические элементы которых расположены выше в таблице
Менделеева, способны вытеснять менее активные галогены из образуемых ими
галогеноводородных кислот и галогенидов металлов:
Аналогичным
образом, бром и йод вытесняют серу из растворов сульфидов и или сероводорода:
Хлор
является более сильным окислителем и окисляет сероводород в его водном растворе
не до серы, а до серной кислоты:
Взаимодействие галогенов
с водой
Вода
горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром
и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя,
то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом
реакции обратимы:
Взаимодействие
йода с водой протекает в настолько ничтожно малой степени, что им можно
пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов
с растворами щелочей
Фтор
при взаимодействии с водным раствором щелочи опять же выступает в роли
окислителя:
Умение
записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о
возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В
отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то
есть одновременно и повышают и понижают свою степень окисления. При этом, в
случае хлора и брома в зависимости от температуры возможно протекание по двум
разным направлениям. В частности, на холоду реакции протекают следующим
образом:
Йод
реагирует с щелочами исключительно по второму варианту, т.е. с образованием
йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при
обычной температуре и даже на холоду:
Химические свойства кислорода
Химический
элемент кислород может существовать в виде двух аллотропных модификаций, т.е.
образует два простых вещества. Оба этих вещества имеют молекулярное строение.
Одно из них имеет формулу O2 и имеет название кислород, т.е. такое
же, как и название химического элемента, которым оно образовано.
Другое
простое вещество, образованное кислородом, называется озон. Озон в отличие от
кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку
основной и наиболее распространенной формой кислорода является молекулярный
кислород O2, прежде всего мы рассмотрим именно его химические
свойства.
Химический
элемент кислород находится на втором месте по значению электроотрицательности
среди всех элементов и уступает лишь фтору. В связи с этим логично предположить
высокую активность кислорода и наличие у него практически только окислительных
свойств. Действительно, список простых и сложных веществ, с которыми может
реагировать кислород огромен. Однако, следует отметить, что поскольку в
молекуле кислорода имеет место прочная двойная связь, для осуществления
большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего
сильный нагрев требуется в самом начале реакции (поджиг) после чего многие
реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь
благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Характерные химические свойства кислорода и серы
Фосфор в зависимости от избытка или недостатка
кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие
кислорода с азотом протекает в крайне жестких условиях, в виду того что
энергии связи в молекулах кислорода и особенно азота очень велики. Также свой
вклад в сложность протекания реакции делает высокая электроотрицательность
обоих элементов. Реакция начинается лишь при температуре более 2000 oC
и является обратимой:
Не
все простые вещества, реагируя с кислородом образуют оксиды. Так, например,
натрий, сгорая в кислороде образует пероксид:
Чаще
всего, при сгорании в кислороде сложных веществ образуется смесь оксидов
элементов, которыми было образовано исходное вещество. Так, например:
Однако,
при сгорании в кислороде азотсодержащих органических веществ вместо оксида
азота образуется молекулярный азот N2. Например:
При
сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется
хлороводород:
Химические свойства озона:
Озон
является более сильным окислителем, чем кислород. Обусловлено это тем, что одна
из кислород-кислородных связей в молекуле озона легко рвется и в результате
образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода
не требует для проявления своих высоких окислительных свойств нагревания. Он
проявляет свою активность при обычной и даже низкой температурах: PbS
+ 4O3 = PbSO4 + 4O2
Как
было сказано выше, серебро с кислородом не реагирует, однако, реагирует с
озоном:
2Ag + O3
= Ag2O + O2
Качественной
реакцией на наличие озона является то, что при пропускании исследуемого газа
через раствор иодида калия наблюдается образование йода:
2KI + O3
+ H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера
как химический элемент может существовать в нескольких аллотропных
модификациях. Различают ромбическую, моноклинную и пластическую серу.
Моноклинная сера может быть получена при медленном охлаждении расплава
ромбической серы, а пластическая напротив получается при резком охлаждении
расплава серы, предварительно доведенного до кипения. Пластическая сера
обладает редким для неорганических веществ свойством эластичности – она
способна обратимо растягиваться под действием внешнего усилия, возвращаясь в
исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных
условиях ромбическая сера и все иные аллотропные модификации со временем
переходят в нее.
Молекулы
ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8.
Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы
не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера
может взаимодействовать и с простыми и со сложными веществами. В химических
реакциях проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства серы
проявляются при ее взаимодействии с металлами, а также неметаллами,
образованными атомами менее электроотрицательного элемента (водород, углерод,
фосфор):
Как
восстановитель сера выступает при взаимодействии с неметаллами, образованными
более электроотрицательными элементами (кислород, галогены), а также сложными
веществами с ярко выраженной окислительной функцией, например, серной и азотной
концентрированной кислотами:
Также
сера взаимодействует при кипячении с концентрированными водными растворами
щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера
одновременно и понижает, и повышает свою степень окисления:
Химические свойства азота
Химический
элемент азот образует только одно простое вещество. Данное вещество является
газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2.
Не смотря то, что химический элемент азот имеет высокую электроотрицательность,
молекулярный азот N2 является крайне инертным веществом. Обусловлен
данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь
(N≡N). По этой причине практически все реакции с азотом протекают только при
повышенных температурах.
Взаимодействие азота с
металлами
Единственное
вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным
является тот факт, что с остальными активными металлами, т.е. щелочными и
щелочноземельными, азот реагирует только при нагревании:
Взаимодействие
азота с металлами средней и низкой активности (кроме Pt и Au) также возможно,
однако требует несравнимо более высоких температур.
Взаимодействие азота с
неметаллами
Азот
реагирует с водородом при нагревании в присутствии катализаторов. Реакция
является обратимой, поэтому для повышения выхода аммиака в промышленности
процесс ведут при высоком давлении:
Как
восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет
при действии электрического разряда:
С
кислородом реакция идет под действием электрического разряда или при
температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с
галогенами и серой.
Взаимодействие азота со сложными веществами
В
рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими
сложными веществами кроме гидридов активных металлов:
Химические свойства фосфора
Существует
несколько аллотропных модификаций фосфора, в частности белый фосфор, красный
фосфор и черный фосфор.
Белый
фосфор образован четырехатомными молекулами P4, не является
устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и
подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за
особенностей механизма такого окисления светится в темноте (явление
хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное
воспламенение белого фосфора.
Из
всех аллотропных модификаций белый фосфор наиболее активен.
Красный
фосфор состоит из длинных молекул переменного состава Pn. В некоторых
источниках указывается то, что он имеет атомное строение, но корректнее
все-таки считать его строение молекулярным. Вследствие особенностей строения
является менее активным веществом по сравнению с белым фосфором, в частности в
отличие от белого фосфора на воздухе окисляется значительно медленнее и для его
воспламенения требуется поджиг.
Черный
фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со
структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация
имеет атомное строение. Самый устойчивый из всех аллотропных модификаций
фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже
химические свойства фосфора следует относить прежде всего к белому и красному
фосфору.
Взаимодействие фосфора с
неметаллами
Реакционная
способность фосфора является более высокой, чем у азота. Так, фосфор способен
гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а
при недостатке кислорода оксид фосфора (III):
Реакция
с галогенами также протекает интенсивно. Так, при хлорировании и бромировании
фосфора в зависимости от пропорций реагентов образуются тригалогениды или
пентагалогениды фосфора:
Ввиду
существенно более слабых окислительных свойства йода по сравнению с остальными
галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В
отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с
металлами
Фосфор
реагирует при нагревании с активными металлами и металлами средней активности
образуя фосфиды:
Взаимодействие фосфора
со сложными веществами
Фосфор
окисляется кислотами окислителями, в частности, концентрированными азотной и
серной кислотами:
взаимодействие фосфора с кислотами окислителями
Следует
знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду
специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии
пока еще не требовалось.
Тем
не менее, тем, кто претендует на 100 баллов, для собственного спокойствия,
можно запомнить следующие особенности взаимодействия фосфора с растворами
щелочей на холоду и при нагревании.
На
холоду взаимодействие белого фосфора с растворами щелочей протекает медленно.
Реакция сопровождается образованием газа с запахом тухлой рыбы —
фосфина и соединения с редкой степенью окисления фосфора +1:
При
взаимодействии белого фосфора с концентрированным раствором щелочи при
кипячении выделяется водород и образуется фосфит:
Химические свойства углерода
Углерод
способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее
инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный
уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не
имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов
слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют
активированным углем. 1 грамм активированного угля из-за наличия в нем
множества пор имеет общую поверхность более трехсот квадратных метров!
Благодаря своей способности поглощать различные вещества активированный уголь
находит широкое применение как наполнитель фильтров, а также как энтеросорбент при
различных видах отравлений.
С
химической точки зрения аморфный углерод является наиболее активной его формой,
графит проявляет среднюю активность, а алмаз является крайне инертным
веществом. По этой причине, рассматриваемые ниже химические свойства углерода
следует прежде всего относить к аморфному углероду.
Восстановительные
свойства углерода
Как
восстановитель углерод реагирует с такими неметаллами как, например, кислород,
галогены, сера.
В
зависимости от избытка или недостатка кислорода при горении угля возможно
образование угарного газа CO или углекислого газа CO2:
При взаимодействии
углерода со фтором образуется тетрафторид углерода:
При нагревании углерода
с серой образуется сероуглерод CS2:
Углерод способен
восстанавливать металлы после алюминия в ряду активности из их
оксидов. Например:
Также
углерод реагирует и с оксидами
активных металлов, однако в этом случае наблюдается, как
правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода
с оксидами неметаллов
Углерод
вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним
из наиболее важных с промышленной точки зрения процессов является так
называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар
через раскаленный уголь. При этом протекает следующая реакция:
При
высокой температуре углерод способен восстанавливать даже такое инертное
соединение как диоксид кремния. При этом в зависимости от условия возможно
образование кремния или карбида кремния (карборунда):
Также
углерод как восстановитель реагирует с кислотами окислителями, в частности,
концентрированными серной и азотной кислотами:
Окислительные свойства
углерода
Химический
элемент углерод не отличается высокой электроотрицательностью, поэтому
образуемые им простые вещества редко проявляют окислительные свойства по
отношению к другим неметаллам.
Примером
таких реакций является взаимодействие аморфного углерода с водородом при
нагревании в присутствии катализатора:
а
также с кремнием при температуре 1200-1300 оС:
Окислительные свойства
углерод проявляет по отношению к металлам. Углерод способен
реагировать с активными металлами и некоторыми металлами средней активности.
Реакции протекают при нагревании:
Карбиды
активных металлов гидролизуются водой:
а
также растворами кислот-неокислителей:
При
этом образуются углеводороды, содержащие углерод в той же степени окисления,
что и в исходном карбиде.
Химические свойства кремния
Кремний
может существовать, как и углерод в кристаллическом и аморфном состоянии и,
также, как и в случае углерода, аморфный кремний существенно более химически
активен, чем кристаллический.
Иногда
аморфный и кристаллический кремний, называют его аллотропными модификациями,
что, строго говоря, не совсем верно. Аморфный кремний представляет собой по
сути конгломерат беспорядочно расположенных друг относительно друга мельчайших
частиц кристаллического кремния.
Взаимодействие
кремния с простыми веществами
неметаллами
При
обычных условиях кремний ввиду своей инертности реагирует только со фтором:
Si + 2F2
= SiF4
С
хлором, бромом и йодом кремний реагирует только при нагревании. При этом
характерно, что в зависимости от активности галогена, требуется и
соответственно различная температура:
Все
галогениды кремния легко гидролизуются водой:
а
также растворами щелочей:
Реакция
кремния с кислородом протекает, однако требует очень сильного нагревания
(1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет
взаимодействие:
При
температуре 1200-1500 оС кремний медленно взаимодействует с
углеродом в виде графита с образованием карборунда SiC – вещества с атомной
кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду
своей низкой электроотрицательности водород может проявлять окислительные
свойства лишь по отношению к металлам. Из металлов кремний реагирует с
активными (щелочными и щелочноземельными), а также многими металлами средней
активности. В результате такого взаимодействия образуются силициды: 2Mg + Si
= Mg2Si
Силициды
активных металлов легко гидролизуются водой или разбавленными растворами
кислот-неокислителей:
При
этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния
со сложными веществами
С
водой кремний не реагирует даже при кипячении, однако аморфный кремний
взаимодействует с перегретым водяным паром при температуре около 400-500оС.
При этом образуется водород и диоксид кремния:
Из
всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной
плавиковой кислотой:
Кремний
растворяется в концентрированных растворах щелочей. Реакция сопровождается
выделением водорода:
По теме: методические разработки, презентации и конспекты
Общие химические свойства неметаллов 10 класс
Презентация к уроку «Общие химические свойства неметаллов» 10 класс учебник И.И.Новошинского…
Характеристика химического элемента-неметалла
По данной презентации можно провести урок по характеристике химического элемента-неметалла по плану: химический элемент и положение в ПС, строение атома и электронных оболочек, простое вещество и его …
Урок — исследование по теме «Свойства неметаллов и их соединений»
«Просто знать – ещё не всё, знания нужно уметь использовать» ГётеЗадача 1. В пробирку поместите 1 гранулу цинка и прилейте 1 мл соляной кислоты.Что наблюдаете? Напишите уравнение реакции и…
урок по химии в 9 классе «Неметаллы. Общие свойства неметаллов»
Метапредметный урок «Информация и знание». Это первый урок в теме «Неметаллы»…
презентация к уроку по химии «Характеристика химического элемента неметалла по положению в ПСХЭ Менделеева»
В презентации дается план общей характеристики хим. элемента по его положению в ПСХЭ. Повторить строение атома, типы хим. связи, классификацию неорганических веществ и их свойства в свете …
1. Химические свойства МЕТАЛЛОВ и НЕМЕТАЛЛОВ (ЕГЭ)
Теория (Металлы)https://chemrise.ru/theory/lessons11/metals_11https://dist-tutor.info/course/view.php?id=762&item=6693Теория (Неметаллы)https://chemrise.ru/theory/nonmetals_11Тестыhttps://onlinete…
Химические свойства предельных карбоновых кислот. Химические свойства непредельных карбоновых кислот.
Дистанционное обучение. Опорный конспект для учащихся.Тема урока: Химические свойства предельных карбоновых кислот. Химические свойства непредельных карбоновых кислот.(используем опорную схему 10, при…