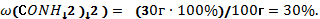Всего: 88 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Верны ли следующие утверждения о химических свойствах фосфора?
A. Фосфор может реагировать как с металлами, так и с неметаллами.
Б. Фосфор растворяется в разбавленной серной кислоте с выделением водорода.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о свойствах серы?
А. Сера может реагировать как с металлами, так и с неметаллами.
Б. Сера растворяется в щелочах с выделением водорода.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о свойствах кремния?
A. Кремний растворяется в щелочах с выделением водорода.
Б. Кремний может реагировать как с металлами, так и с неметаллами.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Верны ли следующие суждения о химических свойствах фосфора?
А. Фосфор, предварительно подожжённый на воздухе, сгорает в кислороде ярким пламенем.
Б. Красный фосфор взаимодействует с металлами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Из предложенного перечня выберите две пары веществ, с которыми реагируют сера.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует сера.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых взаимодействует бром.
1) хлорид калия (р-р)
2) оксид меди (II)
3) гидроксид бария (р-р)
4) иодид калия (р-р)
5) сульфат лития (р-р)
Запишите в поле ответа номера выбранных веществ.
Источник: ЕГЭ по химии 2018. Досрочная волна
Задания Д6 № 539
Верны ли следующие суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется оксид углерода (IV).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д6 № 668
Верны ли следующие суждения о свойствах углерода?
А. При обычной температуре углерод инертен.
Б. При нагревании углерод является сильным восстановителем.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задания Д6 № 754
Верны ли следующие суждения об окислительных свойствах азота?
А. Азот является более слабым окислителем, чем фтор.
Б. Азот является окислителем в реакции с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие утверждения о свойствах серы?
A. Сера растворяется в кислотах с выделением водорода.
Б. И высший оксид, и водородное соединение серы имеют кислотный характер.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Из предложенного перечня выберите две пары веществ, с которыми реагирует сера.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует сера.
1) и
2) и
3) и
4) и
5) и
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два простых вещества, которые реагируют с щелочами.
1) фтор
2) натрий
3) водород
4) хлор
5) магний
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня простых веществ выберите два, которые реагируют c водой при обычных условиях.
1) кислород
2) медь
3) хром
4) барий
5) фтор
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите два простых вещества, которые растворяются в щелочах, но не растворяются в соляной кислоте. Запишите номера выбранных ответов в порядке возрастания.
1)
2)
3)
4)
5)
Задания Д6 № 969
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с кислородом только при высокой температуре.
Б. Азот при нагревании реагирует с активными металлами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Верны ли следующие суждения о химических свойствах азота?
А. Азот реагирует с водородом только при высокой температуре и наличии катализатора.
Б. Одно из немногих веществ с которыми азот реагирует при комнатной температуре без участия катализатора — литий.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Всего: 88 1–20 | 21–40 | 41–60 | 61–80 …
v
ЕГЭ
— Тематические тренировочные задания
ü Задание 7.
Характерные химические
свойства простых веществ-неметаллов:
водорода, галогенов,
кислорода, серы, азота, фосфора, углерода, кремния.
1. Верны ли следующие суждения о химических
свойствах азота?
А. Азот реагирует с кислородом только при
высокой температуре.
Б. Азот при нагревании реагирует с активными
металлами.
1) верно только А 3)
верны оба суждения
2) верно только Б 4)
оба суждения неверны
2. Верны ли следующие суждения об окислительных
свойствах азота?
А. Азот является более слабым окислителем, чем
фтор.
Б. Азот является окислителем в реакции с
водородом.
1) верно только А
3) верны оба суждения
2) верно только
Б 4) оба суждения неверны
3. Окислительные свойства фосфор проявляет при
взаимодействии с
1)кислородом
2)серой 3) хлором 4) магнием
4. Верны ли следующие суждения о химических
свойствах фосфора?
А.Фосфор, предварительно подожжённый на
воздухе, сгорает в кислороде ярким пламенем.
Б.Красный фосфор взаимодействует с металлами.
1) верно только А 3)
верны оба суждения
2) верно только
Б 4) оба суждения неверны
5. Сера реагирует с каждым из двух веществ
1) O2 и SiO2 2) Cl2 и NaCl
3) HCl и N2 4)Fe и H2
6. Кремний вступает в реакцию с
1)гидроксидом алюминия 2)оксидом магния
3)кислородом 4) водородом
7. Верны ли суждения о свойствах углерода?
А. Взаимодействие углерода с кислородом
относится к экзотермическим реакциям.
Б. При полном сгорании углерода образуется
оксид углерода (IV).
1) верно только
А 3) верны оба суждения
2) верно только
Б 4) оба суждения неверны
8. Углерод выступает в качестве восстановителя в
реакции с
1)водородом 2)алюминием 3)
кальцием 4)оксидом меди
9. Окислительные свойства водород проявляет при
взаимодействии с
1)
бромом 2)
кислородом 3) углеродом 4) калием
10. Как водород, так и хлор взаимодействуют с
1)водой 2) аммиаком 3) гидроксидом
кальция 4) металлическим кальцием
11. Верны ли следующие суждения о свойствах хлора?
А. Хлор реагирует как с активными, так и с
неактивными металлами.
Б. Хлор не растворяется в воде.
1) верно только
А 3) верны оба суждения
2) верно только
Б 4) оба суждения неверны
Химические свойства неметаллов
1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu — > 2CuI
6) Галогены — сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами

10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.) → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными — только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор — ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2 → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)

3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Не взаимодействует с щелочами
C + NaOH → реакция не идет
4) Не взаимодействует с кислотами-неокислителями:
C + HCl → реакция не идет
C + H2SO4(разб.) → реакция не идет.
5) Реагирует с концентрированными растворами кислот-окислителей:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.) → CO2 + 4NO2 + 2H2O (t)
C + 4HNO3(разб.) → реакция не идет.
6) Используется при получении фосфора:
Ca3(PO4)2 + 5C + 3SiO2 → 5CO
6. Кремний
1) Реагирует с кислородом:
Si + O2 → SiO2 (кварц, песок)
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
4) Не реагирует с растворами кислот. Реагирует только с HF:
Si + 4HF → SiF4 + 2H2 (t).
Слайд 1
Задание 6 по ЕГЭ/ химия/ Химические свойства простых металлов, неметаллов и оксидов
Слайд 2
Химические свойства металлов В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы
Слайд 3
1. Взаимодействуют с неметаллами: а) кислородом (с образованием оксидов) 4Li + O 2 = 2Li 2 O 2Ca + O 2 = 2CaO Обрати внимание: при взаимодействии натрия – образуется пероксид, калия — надпероксид 2Na + O 2 = Na 2 O 2 , К + О 2 = КО 2 а оксиды получают прокаливанием пероксида с соответствующими металлом: 2Na + Na 2 O 2 = 2Na 2 O
Слайд 4
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании. 3Fe + 2O 2 = Fe 3 O 4 (смесь двух оксидов: FeO и Fe 2 O 3 ) 2Zn + O 2 = 2ZnO 2Cu + O 2 = 2CuO Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях
Слайд 5
б) водородом (с образованием гидридов) 2Na + H 2 = 2NaH Ca + H 2 = CaH 2
Слайд 6
в) хлором (с образованием хлоридов) 2K + Cl 2 = 2KCl Mg + Cl 2 = MgCl 2 2Al + 3Cl 2 =2AlCl 3 Обрати внимание: при взаимодействии железа образуется хлорид железа (III): 2Fe + 3Cl 2 = 2FeCl 3
Слайд 7
г) серой (с образованием сульфидов) 2Na + S = Na 2 S Hg + S = HgS 2Al + 3S = Al 2 S 3 Обрати внимание: при взаимодействии железа образуется сульфид железа (II): Fe + S = FeS
Слайд 8
д) азотом (с образованием нитридов) 6K + N 2 = 2K 3 N 3Mg + N 2 = Mg 3 N 2 2Al + N 2 = 2AlN
Слайд 9
2. Взаимодействуют со сложными веществами: (использовать ряд Бекетова) Li, K, Ba, Ca , Na, Mg, Al, Mn , Zn, Cr, Fe, Co, Ni, Sn , Pb , (H2), Cu, Hg, Ag, Au, Pt а) водой Металлы, расположенные в ряду до магния , при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи. 2Na + 2H 2 O = 2NaOH + H 2 ↑ Ba + H 2 O = Ba (OH) 2 + H 2 ↑
Слайд 10
Магний взаимодействует с водой при кипячении. Mg + 2H 2 O = Mg (OH) 2 + H 2 ↑ Алюминий при удалении оксидной пленки бурно реагирует с водой. 2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ↑ Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов. 3Fe + 4H 2 O = Fe 3 O 4 + 4H 2 ↑
Слайд 11
б) растворами кислот Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций Mg + 2HCl = MgCl2 + H2↑ Обрати внимание: образуются соли двухвалентного железа. Fe + H 2 SO 4 ( разб .) = FeSO 4 + H 2 ↑ Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
Слайд 12
в) растворами солей правило: Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него. Cu + HgCl 2 = Hg + CuCl 2 Fe + CuSO 4 = FeSO 4 + Cu Запомнить!!! Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
Слайд 13
г) растворами щелочей Взаимодействуют металлы, гидроксиды которых амфотерны. Zn + 2NaOH + 2H 2 O = Na 2 [Zn(OH) 4 ] + H 2 ↑ 2Al + 2KOH + 6H 2 O = 2K[Al(OH) 4 ] + 3H 2 ↑
Слайд 14
д) с органическими веществами Щелочные металлы со спиртами и фенолом. 2 C 2 H 5 OH + 2Na = 2C 2 H 5 ONa + H 2 ↑ 2C 6 H 5 OH + 2Na = 2C 6 H 5 ONa + H 2 ↑ CH 2 Cl-CH 2 -CH 2 Cl + Zn = C 3 H 6 + ZnCl 2 циклопропан Реакция Вюрца 2CH 2 Cl + 2Na = C 2 H 6 + 2 NaCl этан
Слайд 15
Неметаллы At , B, Te , H, As , I, Si , P, Se , C, S, Br , Cl , N, O, F электроотрицательность возрастает и усиливаются окислительные свойства. 1. Окислительные свойства а) в реакциях с металлами (металлы всегда восстановители) 2Na + S = Na 2 S (сульфид натрия) 3Mg + N 2 = Mg 3 N 2 (нитрид магния)
Слайд 16
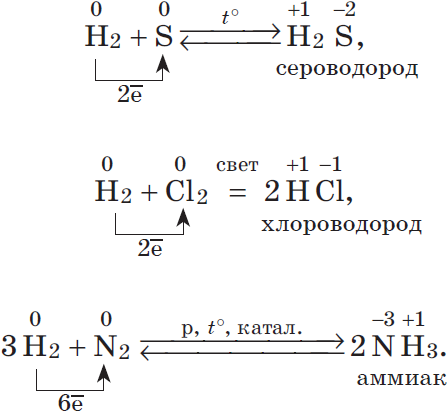
б) в реакциях с неметаллами( смотри ряд электроотрицательности ) At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F 2P + 5S = P 2 S 5 ( сульфид фосфора V) H 2 + S = H 2 S H 2 + Cl 2 = 2HCl 3H 2 + N 2 = 2NH 3
Слайд 17
в) в реакциях с некоторыми сложными веществами Окислитель – кислород , реакции горения CH 4 + 2O 2 = CO 2 + 2H 2 O 2SO 2 + O 2 = 2SO 3 Окислитель – хлор 2 FeCl 2 + Cl 2 = 2FeCl 3 2KI + Cl 2 = 2KCl + I 2 CH 4 + Cl 2 = CH 3 Cl + HCl C Н 2 =CH 2 + Br 2 = CH 2 Br-CH 2 Br
Слайд 18
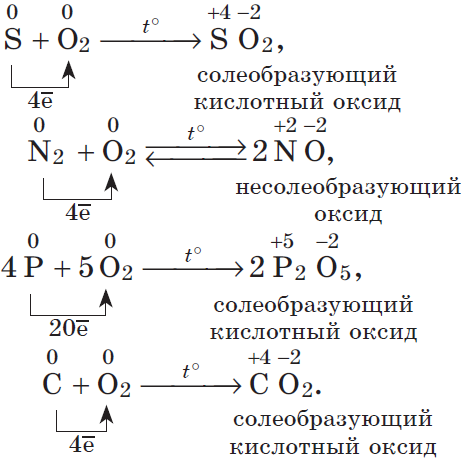
2. Восстановительные свойства а) в реакциях с фтором S + 3F2 = SF6 H2 + F2 = 2HF Si + 2F2 = SiF4 б) в реакциях с кислородом (кроме фтора) S + O2 = SO2 N2 + O2 = 2NO 4P + 5O2 = 2P2O5 C + O2 = CO2
Слайд 19
в) в реакциях со сложными веществами – окислителями H 2 + CuO = Cu + H 2 O 6P + 5KClO 3 = 5KCl + 3P 2 O 5 C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O H 2 C=O + H 2 = CH 3 OH
Слайд 20
3. Реакции диспропорционирования : один и тот же неметалл является и окислителем и восстановителем Cl 2 + H 2 O = HCl + HClO 3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O
Слайд 21
Оксиды: классификация, получение и химические свойства
Слайд 22
Получение оксидов 1. Взаимодействие простых веществ с кислородом: 1.1. Окисление металлов: 4Al + 3O 2 → 2Al 2 O 3 металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3): 4Fe + 3O 2 → 2Fe 2 O 3 4Cr + 3O 2 → 2Cr 2 O 3 Железо также горит с образованием железной окалины — оксида железа (II, III): 3Fe + 2O 2 → Fe 3 O 4
Слайд 23
1.2. Окисление простых веществ-неметаллов. 4P + 5O 2 (изб.) → 2P 2 O 5 4P + 3O 2 (нед.) → 2P 2 O 3 Исключения S + O 2 → SO 2 N 2 + O 2 = 2NO Запомни Не окисляется кислородом фтор F 2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl 2 , бром и др.), инертные газы (гелий He , неон, аргон, криптон).
Слайд 24
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д. 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2 2H 2 S + 3O 2 (изб.) → 2H 2 O + 2SO 2 2H 2 S + O 2 (нед.) → 2H 2 O + 2S 4NH 3 + 3O 2 →2N 2 + 6H 2 O 4NH 3 + 5O 2 → 4NO + 6H 2 O ( с катализатором)
Слайд 25
3. Разложение гидроксидов. H 2 CO 3 → H 2 O + CO 2 H 2 SO 3 → H 2 O + SO 2 NH 4 OH → NH 3 + H 2 O 2AgOH → Ag 2 O + H 2 O 2CuOH → Cu 2 O + H 2 O Запомни Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота,гидроксид аммония, гидроксиды серебра (I), меди (I):
Слайд 26
При нагревании H 2 SiO 3 → H 2 O + SiO 2 2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O
Слайд 27
4. Разложение солей Li 2 CO 3 → H 2 O + Li 2 O CaCO 3 → CaO + CO 2 Запомни (Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с изменением степени окисления 2Zn(NO 3 ) 2 → 2ZnO + 4NO 2 + O 2
Слайд 30
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кислород. 1оксид магния 2оксид азота(II) 3гидроксид кальция 4серная кислота (р-р) 5.гидроксид железа(II) 25
Слайд 31
Из предложенного перечня пар взаимодействующих между собой веществ выберите две пары, при взаимодействии которых водород не выделятся. 1. Zn и H2SO4 ( разб .) 2. Al и NaOH ( конц .) 3. Cu и HNO3 ( конц .) 4. Mg и HBr ( разб .) 5. Hg и H2SO4 ( конц .) 35
Слайд 32
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует медь. 1.хлор 2.водород 3.серная кислота ( конц .) 4.гидроксид натрия (р-р) 5.серная кислота (р-р) 13
Слайд 33
Из предложенного перечня выберите два вещества, с каждым из которых вступает в реакцию кремний. 1.магний 2.кислород 3.гидроксид алюминия 4.вода 5. соляная кислота 12
Слайд 34
Из предложенного перечня выберите два вещества, с каждым из которых реагирует азот. 1.вода 2.водород 3.хлорид натрия 4.соляная кислота 5.калий 25
*
Простые вещества — неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se{аморф.}$ — желтые; $Bа{морф.}$ — коричневый; $О{2(ж)}$ — голубой; $Si, As{мет.}$ — серые; $Р_4$ — бледно-желтый; $I{1(г)}$ — фиолетово-черный с металлическим блеском; $Br{2(ж)}$ — бурая жидкость; $Cl{2(г)}$ — желто-зеленый; $F{2(г)}$ — бледно-зеленый; $S{8(т)}$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)${C}↖{-4}H_4+2{O_2}↖{0}→{C}↖{+4}{O_2}↖{-2}+2H_2{O}↖{-2}$
восстановитель ${C}↖{-4}-8{e}↖{-}→{C}↖{+4}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
б)$2{S}↖{+4}O_2+{O_2}↖{0}{→}↖{t°,кат.}2{S}↖{+6}{O_3}↖{-2}$
восстановитель ${S}↖{+4}-2{e}↖{-}→{S}↖{+6}|1$
окислитель ${O_2}↖{0}+4{e}↖{-}→2{O}↖{-2}|2$
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)$2{Fe}↖{+2}{Cl_2}↖{-1}+{Cl_2}↖{0}=2{Fe}↖{+3}{Cl_3}↖{-1}$
восстановитель ${Fe}↖{+2}-1{e}↖{-}→{Fe}↖{+3}|2$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-}|1$
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
б)$2{K}↖{+1}{I}↖{-1}+{Cl_2}↖{0}={K}↖{+1}{Cl}↖{-1}+{I_2}↖{0}$
восстановитель $2{I}↖{-1}-2{e}↖{-}→{I_2}↖{0}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
в)${C}↖{-4}H_4+{Cl_2}↖{0}{→}↖{свет}{CH_3}↖{-2}{Cl}↖{-1}+H{Cl}↖{-1}$
восстановитель ${C}↖{-4}-2{e}↖{-}→{C}↖{-2}|1$
окислитель ${Cl_2}↖{0}+2{e}↖{-}→2{Cl}↖{-1}|1$
Галогенирование метана — характерная реакция для алканов;
г)${C}↖{-2}H_2{=}↙{водный р-р}{C}↖{-2}H_2+{Br_2}↖{0}→{C}↖{-1}H_2{Br}↖{-1}-{C}↖{-1}H_2{Br}↖{-1}$
восстановитель ${C}↖{-2}-1{e}↖{-}→{C}↖{-1}|2$
окислитель ${Br_2}↖{0}+2{e}↖{-}→2{Br}↖{-1}|1$
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: ${Cl_2}↖{+1}{O}↖{−2}, {Cl}↖{+4}{O_2}↖{-2}, {Cl_2}↖{+7}{O_7}↖{-2}, {Br_2}↖{+1}{O}↖{-2}, {Br}↖{+4}{O_2}↖{-2}, {I_2}↖{+5}{O_5}↖{-2}$ и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)${H_2}↖{0}+{{Cu}↖{+2}O}↙{оксид}{→}↖{t°}{Cu}↖{0}+{H_2}↖{+1}C$
восстановитель ${H_2}↖{0}-2{e}↖{-}→2{H}↖{+1}|1$
окислитель ${Cu}↖{+2}+2{e}↖{-}→{Cu}↖{0}|1$
б)$6{P}↖{0}+5{K{Cl}↖{+5}O_3}↙{соль}{→}↖{t}5K{Cl}↖{-1}+3{P_2}↖{+5}O_5$
восстановитель ${P}↖{0}-5{e}↖{-}→{P}↖{+5}|6$
окислитель ${Cl}↖{+5}+6{e}↖{-}→{Cl}↖{-1}|5$
в)${C}↖{0}+4{H{NO}↖{+5}O_3}↙{кислота}{→}↖{t°}{C}↖{+4}O_2↑+4{N}↖{+4}O_2↑+2H_2O$
восстановитель ${C}↖{0}-4{e}↖{-}→{C}↖{+4}|1$
окислитель ${N}↖{+5}+1{e}↖{-}→{N}↖{+4}|4$
г)
восстановитель ${H_2}↖{0}-2{e}↖{-}→{2H}↖{+}|1$
окислитель ${C}↖{0}+2{e}↖{-}→{C}↖{-2}|1$
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)${Cl_2}↖{0}+H_2O⇄H{Cl}↖{-1}+H{Cl}↖{+1}O$
восстановитель ${Cl}↖{0}-1{e}↖{-}→{Cl}↖{+1}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|1$
б)$3{Cl_2}↖{0}+6KOH=5K{Cl}↖{-1}+K{Cl}↖{+5}O_3+2H_2O$
восстановитель ${Cl}↖{0}-5{e}↖{-}→{Cl}↖{+5}|1$
окислитель ${Cl}↖{0}+1{e}↖{-}→{Cl}↖{-1}|5$
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | ${B_2H_6}↙{диборан}$ | $ {CH_4}↙{метан}$ | $ {NH_3}↙{аммиак}$ | $ {H_2O}↙{вода}$ | $ {HF}↙{фтороводород}$ |
| $3$ | ${SiH_4}↙{силан}$ | $PH_3↙{фосфин}$ | ${H_2S}↙{сероводород}$ | ${HCl}↙{хлороводород}$ | |
| $4$ | ${AsH_3}↙{арсин}$ | ${H_2Se}↙{селеноводород}$ | ${HBr}↙{бромоводород}$ | ||
| $5$ | ${H_3Te}↙{теллуроводород}$ | ${HI}↙{йодоводород}$ |
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$table 1.H_2+Cl_2=2HCl; 2.N_2+3H_2⇄2NH_3;}$ В промышленности так получают хлороводород и аммиак.
$table 3.C+2H_2=CH_4; 4.2H_2+O_2=2H_2O; 5.H_2+S⇄H_2S;}$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
*
*
Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
$H_2=2H – 432$ кДж$.
2. При обычных температурах водород вступает в реакцию с активными металлами:
$Ca+H_2=CaH_2$,
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
$F_2+H_2=2HF$.
3. При высоких температурах получают аммиак:
$N_2+3H_2=2NH_3$.
и гидрид титана (металл в порошке):
$Ti+H_2=TiH_2$.
4. При поджигании водород реагирует с кислородом:
$2H_2+O_2=2H_2O+484 кДж$.
5. Водород обладает восстановительной способностью:
$CuO+H_2=Cu+H_2O$.
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
3. Галогены активно реагируют с неметаллами:
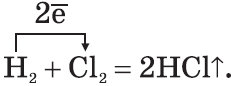
4. Галогены реагируют с водой, образуя атомарный кислород:
$H_2O+Cl_2=2HCl+O; O+O=O_2$.
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
*
*
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
— неметаллов:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
— металлов:
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
$2Cu+O_2=2CuO$;
б) горение сложных веществ:
$2{C_2H_2}↙{ацетилен}+5O_2→4CO_2+2H_2O$
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
${Ag+O_3=AgO+O_2↑}↙{text «(с кислородом серебро не реагирует)» }$
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6{e}↖{-}$, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления $+2,+4,+6$. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления $–2$.
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°{пл}=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°{пл}=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ |
1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°*{пл}=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ |
1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична:  Получение в промышленности в соответствии со схемой: $FeS_2(или S){→}↖{O_2}SO_2{→}↖{O_2}SO_3{→}↖{H_2O}H_2SO_4$ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
В таблице обобщены химические свойства азота и его соединений.
Азот и его соединения.
| Азот | Соединения азота | ||
| Аммиак | Оксиды азота | Азотная кислота | |
| 1. Очень прочная и поэтому малореакционноспособная молекула. 2. Проявляет окислительные свойства (в реакциях с водородом и металлами): $N_2+3H_2⇄2NH_3$ $N_2+3Mg=Mg_3N_2 3. Проявляет восстановительные свойства (в реакции с кислородом): $N_2+O_2=2NO$ Получение 1. В промышленности ректификацией жидкого воздуха. 2. В лаборатории термическим разложением нитрита аммония: $NH_4NO_2→↖{t°}N_2+2H_2O$ |
1. При н.у. бесцветный, резко пахнущий газ. 2. Взаимодействует с водой, образуя раствор слабого основания: $NH_3+H_2O⇄NH_4^{+}+OH^{–}$ 3. Схема электронного строения иона аммония: 4. Взаимодействует с кислотами: $NH_3+H^{+}=NH_4^+$ 5. Проявляет восстановительные свой ства: $2NH_3+3CuO{→}↖{t°}3Cu+3H_2O+N_2$ $4NH_3+3O_2=2N_2+6H_2O$ $4NH_3+5O_2{→}↖{кат}4NO+6H_2O$ Получение 1. В промышленности: $N_2+3H_2⇄2NH_3+92кДж$ 2. В лаборатории: $2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$ |
1. Оксид азота (II) окисляется кислородом воздуха при комнатной температуре:
$2NO+O_2=2NO_2$ 2. Оксид азота (IV) взаимодействует с водой в присутствии кислорода: $4NO_2+O_2+2H_2O=4HNO_3$ Образуются при взаимодействии: 1) азота с кислородом при высокой температуре или в условиях электрического разряда: $N_2+O_2=2NO$ 2) аммиака с кислородом в присутствии катализатора: $4NH_3+5O_2{→}↖{кат}4NO+6H_2O;$ 3) меди с азотной кислотой: а) концентрированной: $Cu+4HNO_3=Cu(NO_3)_2+2NO_2↑+2H_2O;$ б) разбавленной: $3Cu+8HNO_3=3Cu(NO_3)_2+2NO↑+4H_2O$ |
1. Неустойчива, разлагается под действием света:
$4HNO_3=2H_2O+4NO_2↑+O_2↑$ 2. Является сильной кислотой, диссоциирует необратимо в водном растворе: $HNO_3+H_2O=H_3O^{+}+NO_3^−$ 3. Взаимодействует с основными оксидами: $CаO+2HNO_3=Cа(NO_3)_2+H_2O$ $CаO+2H^{+}=Cа^{2+}+H_2O$ 4. Взаимодействует с основаниями: $Fe(OH)_3+3HNO_3=Fe(NO_3)_3+3H_2O$ $Fe(OH)*3+3H^{+}=Fe^{3+}+3H_2O$ 5. Реагирует с металлами без выделения водорода и по-разному — в зависимости от концентрации кислоты и активности металла. Получение 1. В промышленности взаимодействием оксида азота (IV) с водой и кислородом: $4NO_2+O_2+2H_2O=4HNO_3$ 2. В лаборатории вытеснением из солей нелетучей кислотой при нагревании: $2NaNO*{3,кр}+H_2SO_4=2HNO_3+Na_2SO_4$ |
Химические свойства фосфора.
Фосфор ($P$) — аналог азота. Однако атом фосфора характеризуется большим радиусом, меньшим значением электроотрицательности и более выраженными восстановительными свойствами. У фосфора реже встречается степень окисления $–3$ (только в фосфидах $Ca_3P_2, Na_3P$), чаще фосфор в соединениях имеет степень окисления $+5$, а вот соединение фосфин ($PH_3$) — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярная, т.к. электроотрицательности фосфора почти одинаковы.
Химический элемент фосфор образует несколько аллотропных модификаций. Рассмотрим два простых вещества фосфора: белый фосфор и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку из молекул $P_4$. Он в порошкообразном состоянии воспламеняется, светится в темноте, ядовит. Красный фосфор имеет атомную кристаллическую решетку, окисляется на воздухе медленно, нерастворим, неядовит, не светится. Химические свойства фосфора и его соединений представлены в таблице.
В природе фосфор в свободном виде не встречается — только в виде соединений.
Фосфор также является составной частью тканей организма человека, животных и растений.
Фосфор и его соединения.
| Фосфор | Соединения фосфора | |
| Оксид фосфора (V) | Фосфорная кислота | |
| 1. При обычных условиях может существовать в виде двух аллотропных модификаций: красный и белый.
2. Горит в кислороде: $4P+5O_2=2P_2O_5$ (проявляет восстановительные свойства). Белый фосфор окисляется на воздухе при комнатной температуре: $P_4+3O_2=2P_2O_3$ Получение $2Ca_3(PO_4)_2+10C+6SiO_2=P_4↑+10CO↑+6CaSiO_3–Q$ |
1. При обычных условиях очень гигроскопическое твердое вещество белого цвета.
2. Проявляет свойства кислотных оксидов, взаимодействуя — с водой: $P_2O_5+3H_2O=2H_3PO_4$ — со щелочами: $P_2O_5+6NaOH=2Na_3PO_4+3H_2O$ — с основными оксидами: $P_2O_5+3CaO=Ca_3(PO_4)_2$ Получение Сжигание фосфора в избытке воздуха: $4P+5O_2=2P_2O_5$ |
1. При обычных условиях бесцветное твердое вещество, неограниченно растворимое в воде.
2. Слабая трехосновная кислота: $H_3PO_4⇄H^{+}+H_2PO_4^{-}⇄2H^{+}+HPO_4^{2−}⇄3H^{+}PO_4^{3−}$ 3. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами, а также с аммиаком: $H_3PO_4+3NaOH=Na_3PO_4+3H_2O$ $2H_3PO_4+3CaO=Ca_3(PO_4)_2+3H_2O$ $Ca_3(PO_4)_2+4H_3PO_4=3Ca(H_2PO_4)_2$ 1) по реакции оксида фосфора (V) с водой: $P_2O_5+3H_2O=2H_3PO_4;$ $Ca_3(PO_4)_2+3H_2SO_4{→}↖{t°}3CaSO_4+2H_3PO_4$ |
Химические свойства углерода.
Углерод ($C$) — первый элемент главной подгруппы IV группы Периодической системы. На его высшем энергетическом уровне $4$ электрона, поэтому его атомы могут принимать четыре электрона, приобретая степень окисления $–4$, т.е. проявлять окислительные свойства, и отдавать свои электроны, проявляя восстановительные свойства, приобретая степень окисления $+4$.
О свойствах аллотропных модификаций алмаза и графита мы уже говорили ранее. Химические свойства углерода и его соединений обобщены в таблице.
Углерод — это особый химический элемент. Он — основа многообразия органических соединений, из которых построены все живые организмы на планете.
Углерод и его соединения.
| Углерод | Соединения углерода | |
| Оксид углерода (IV) | Угольная кислота | |
| 1. Имеет аллотропные модификации: алмаз, графит, карбин, фуллерен. 2. Проявляет восстановительные свойства: а) горит в кислороде: $C+O_2=CO_2+Q$ неполное сгорание: $2C+O_2=2CO+Q;$ б) взаимодействует с оксидом углерода (IV), образуя ядовитое вещество — угарный газ: $C+CO_2=2CO;$ в) восстанавливает металлы из их оксидов: $C+2CuO=CO_2+2Cu$ Получение Неполное сжигание метана: $CH_4+O_2=C+2H_2O$ |
1. Газ без запаха, цвета и вкуса, тяжелее воздуха. 2. Кислотный оксид. 3. При растворении взаимодействует с водой: $CO_2+H_2O⇄H_2CO_3$ 4. Реагирует с основаниями (известковая вода при его пропускании мутнеет): $CO2+Ca(OH)_2=CaCO_3↓+H_2O$ 5. Реагирует с основными оксидами: $CO_2+CaO=CaCO_3$ 6. Образуется в реакциях: — горения углерода в кислороде: $C+O_2=CO_2$ — окисления оксида углерода (II): $2CO+O_2=2CO_2$ — сгорания метана: $CH_4+2O_2=CO_2+2H_2O$ — взаимодействия кислот с карбонатами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ — термического разложения карбонатов и гидрокарбонатов: $CaCO_3=CaO+CO_2↑$ $2NaHCO_3=Na_2CO_3+CO_2↑+H_2O$ — окислительных биохимических процессов дыхания, гниения |
1. Непрочная молекула. Слабая двухосновная кислота. Равновесие в водном растворе: $CO_2+H_2O⇄H_2CO_3⇄H^{+}+HCO_3^{−}⇄2H^{+}+CO_3^{2−}$ 2. Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: $CO_2+NaOH=NaHCO_3$ $CO_2+2NaOH=Na_2CO_3+H_2O$ 3. Вытесняется из солей более сильными кислотами: $CaCO_3+2HCl=CaCl_2+CO_2↑+H_2O$ 4. Соли угольной кислоты подвергаются гидролизу: $2Na^{+}+CO_3^{2−}+H_2O⇄2Na^{+}+HCO_3^{−}+OH^{–}$ $CO_3^{2−}+H_2O⇄HCO_3^{−}+OH^–$ |
Химические свойства кремния.
Кремний ($Si$) — второй представитель главной подгруппы IV группы. По распространенности в природе кремний — второй после кислорода. Наиболее распространенными соединениями кремния являются диоксид кремния $SiO_2$ — кремнезем и силикаты.
Кристаллический кремний имеет структуру алмаза, очень хрупок, относится к тугоплавким веществам. При обычных условиях инертен, что объясняется прочностью его кристаллической решетки. В таблице обобщены химические свойства кремния и его соединений.
Соединения кремния служат основой производства стекла и цемента. Состав оконного стекла: $Na_2O·CaO·6SiO_2$.
Кремний и его соединения.
| Кремний | Соединения кремния | |
| Оксид кремния (IV) | Кремниевая кислота | |
| 1. Обладает полупроводниковыми свойствами. 2. Горит в кислороде: $Si+O_2=SiO_2+Q$ Получение — Восстановление оксида кремния (IV) углеродом (в промышленности): $SiO_2+2C=Si+2CO$ — порошком магния (в лаборатории): $SiO_2+2Mg=Si+2MgO$ |
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла. 2. В воде не растворяется и с водой не реагирует. 3. Как кислотный оксид взаимодействует с: а) щелочами: $SiO_2+2NaOH=Na_2SiO_3+H_2O;$ б) основными оксидами: $SiO_2+CaO=CaSiO_3$ 4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла): $SiO_2+Na_2CO_3=Na_2SiO_3+CO_2↑$ $SiO_2+CaCO_3=CaSiO_3+CO_2↑$ |
1. Очень слабая двухосновная не растворимая в воде кислота состава $mSiO_2·nH_2O(H_2SiO_3)$ 2. Разлагается уже при несильном нагревании: $H_2SiO_3=SiO_2+H_2O$ 3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу: $4Na^{+}+2SiO_3^{2-}+2H_2O⇄4Na^{+}+Si_2O_5^{2−}+2OH^–$ $2SiO_3^{2-}+2H_2O⇄Si_2O_5^{2−}+2OH^–$ Получение Действие кислот на растворимые силикаты: $Na_2SiO_3+2HCl=2NaCl+H_2SiO_3↓$ |
Тренировочные упражнения по теме «Химические свойства металлов, неметаллов и оксидов» в формате ЕГЭ по химии (тренажер задания 6 ЕГЭ по химии).
Внимание! Перед выполнением тестов я рекомендую внимательно изучить теорию по теме «Химические свойства металлов, неметаллов и оксидов» (теория для решения задания 6 ЕГЭ по химии):
Характерные химические свойства простых веществ–металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа.
Характерные химические свойства простых веществ–неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Характерные химические свойства оксидов: основных, амфотерных, кислотных
| Задание 1 | |
| Из предложенного перечня выберите два вещества, с каждым из которых реагирует калий.
|
| Задание 2 | |
| Из предложенного перечня выберите два оксида, которые реагируют с раствором гидроксида калия.
1) CrO Запишите номера выбранных ответов. |
| Задание 3 | |
| Из предложенного перечня выберите два оксида, которые реагируют с водой.
|
| Задание 4 | |
| Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует при обычных условиях.
Запишите номера выбранных ответов. |
| Задание 5 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
|
| Задание 6 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
. |
| Задание 7 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует фосфор.
. |
| Задание 8 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид меди (II).
. |
| Задание 9 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид кальция.
|
| Задание 10 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид серы (IV).
|
| Задание 11 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
|
| Задание 12 | |
| Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует сера.
|
Admin
1. Задания с выбором ответов А1-А13
I. Выбор одного правильного варианта из 4 предложенных
|
Вопрос |
Комментарий |
|
А1. Какая формула соответствует электронной конфигурации внешнего электронного уровня селена? 1. …3s23p4 2. …4s24p4 3. …3s23p6 4. …4s24p6 |
Селен находится в VI–A группе, значит, на последнем слое 6 электронов. В 4-ом периоде, значит, 4 электронных уровня. Правильный ответ 2. |
|
А2. У какого элемента ярче выражены неметаллические свойства: 1. теллур 2. сера 3. селен 4. кислород |
Все элементы VI-A группы, а в рамках группы неметаллические свойства усиливаются снизу вверх. Правильный ответ 4. |
|
А3. В каком соединении сера проявляет степень окисления +6? 1. SO2 2. H2SO3 3. H2SO4 4. Al2S3 |
Определяем степень окисления серы в каждом веществе, зная, что О-2, а Н+1. Сумма всех степеней окисления в молекуле должна быть равна 0. Правильный ответ 3. |
|
А4. Какой из перечисленных металлов не реагирует с концентрированной серной кислотой? 1. Медь 2. Цинк 3. Кальций 4. Железо |
Концентрированная серная кислота реагирует и с теми металлами, которые находятся в электрохимическом ряду напряжений правее водорода. Но она не реагирует с некоторыми металлами из-за пассивации. Среди этих металлов и железо. Правильный ответ 4. |
|
А5. В какой из приведенных пар оба вещества реагируют с разбавленной серной кислотой? 1. сера и оксид серы (IV) 2. медь и гидроксид меди (II) 3. оксид меди (II) и хлорид меди (II) 4. оксид меди (II) и гидроксид бария |
Разбавленная серная кислота взаимодействует с основными оксидами, основаниями, металлами, находящимися в ряду напряжений до водорода и с солями, если получается осадок или газ. Правильный ответ 4. |
|
А6. В качестве реагента на 1. Ba2+ 2. H+ 3. Cu2+ 4. Fe2+ |
Качественной реакцией на серную кислоту и её соли, т.е на ион Правильный ответ 1. |
|
А7. Степень окисления азота может быть: 1. +1 2. -4 3. +6 4. +7 |
Азот может проявлять степени окисления от -3 до +5. В указанном интервале подходит только вариант 1. Правильный ответ 1. |
|
А8. Сравните устойчивость водородных соединений азота и фосфора: 1. водородное соединение азота более устойчиво 2. водородное соединение азота менее устойчиво 3. оба соединения неустойчивы 4. оба соединения одинаково устойчивы |
Водородные соединения азота NH3 – аммиак, и фосфора PH3 – фосфин. PH3 фосфин самовоспламеняется на воздухе. Правильный ответ 1. |
|
А9. В каком соединении азот проявляет степень окисления +4? 1. N2O 2. NaNO2 3. NaNO3 4. NO2 |
Определяем степень окисления азота в каждом веществе, зная, что О-2, а Na+1. Сумма всех степеней окисления в молекуле должна быть равна 0. Правильный ответ 4. |
|
А10. Какую кристаллическую решетку имеет твердый аммиак? 1. атомную 2. молекулярную 3. ионную 4. металлическую |
Аммиак состоит из молекул. Правильный ответ 2. |
|
А11. Каким способом получают аммиак в лаборатории? 1. соединением азота с водородом 2. разложением солей аммония 3. восстановление оксидов азота водородом 4. взаимодействием солей аммония с гидроксидом кальция |
При промышленном производстве аммиака из водорода и азота требуются высокие температура и давление, и катализатор. 2NH4NO3 + Сa(OH)2 Правильный ответ 4. |
|
А12. С какими веществами аммиак вступает в реации соединения: 1. кислоты 2.кислород 3. щелочи 4. соли |
По определению реакции соединения, аммиак вступает в реакции соединения с кислотами, образуются соли аммония. Правильный ответ 1. |
|
А 13. Как различить растворы солей хлорида аммония и хлорида натрия? 1. по запаху 2. по действию нитрата серебра 3. по действию кислоты при нагревании 4. по действию щелочи при нагревании |
Характерным запахом обладает аммиак, а не соли аммония. Они запаха не имеют. 2NH4Cl+ Сa(OH)2 Аммиак определяется по запаху. Правильный ответ 4. |
2. Задания с кратким ответом и на соответствие В1-В10
В1. Укажите число возможных реакций, протекающих с образованием водорода, которые можно провести между следующими веществами
1. Раствор серной кислоты
2. Магний
3. Ртуть
4. Азотная кислота
5. Оксид магния
Комментарий
Для решения задач о возможности взаимодействия вещества с несколькими веществами удобно делать таблицу:
|
H2SO4 |
Mg |
Hg |
HNO3 |
MgO |
|
|
H2SO4 |
— |
MgSO4+H2↑ |
Х |
Х |
MgSO4+H2O |
|
Mg |
MgSO4+H2↑ |
— |
Х |
Водород не выделяется |
Х |
|
Hg |
Х |
Х |
— |
Водород не выделяется |
Х |
|
HNO3 |
Х |
Водород не выделяется |
Водород не выделяется |
— |
Mg(NO3)2+H2O |
|
MgO |
MgSO4+H2O |
Х |
Х |
Mg(NO3)2+H2O |
— |
Вещество не реагирует само с собой, поэтому по диагонали ставим прочерки.
Металлы и оксид магния не будут взаимодействовать между собой с образованием водорода. Обе кислоты будут взаимодействовать с основным оксидом MgO, но будет образовываться соль и вода. Азотная кислота любой концентрации является окислителем не за счет H+, а за счет N+5, поэтому при взаимодействии с металлами водород не выделится. Разбавленная серная кислота с Hg не взаимодействует, так как Hg стоит в ряду активности металлов после водорода, а с Mg выделяется водород.
Правильный ответ: одна реакция.
|
В2. Закончите реакцию взаимодействия между медью и концентрированной азотной кислотой. Коэффициент перед формулой азотной кислоты равен: 1. 2 2. 4 3. 6 4. 8 |
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2H2O N+5+е— = N+4 2 Cu0 -2е— = Cu+2 1 Правильный ответ :2. |
|
В3. Какое вещество образуется в результате цепочки превращений: Р В ответ надо записать название вещества. |
4P+5O2 = 2P2O5 P2O5 + 3H2O = 2H3PO4 2NH3 + H3РO4 = (NH4)2НРO4(гидроортофосфат аммония) Правильный ответ: гидроортофосфат аммония |
|
В4. При взаимодействии 6 л азота и 12 л водорода (н.у.) выделилось 2 л аммиака. Найдите выход аммиака от теоретически возможного. |
Объёмы газов относятся как небольшие целые числа. N2+3H2⇆2NH3 Водород находится в недостатке, вести расчёты будем относительно водорода. С 12л Н2 должно было образоваться 8л NH3. Находим теоретический выход Правильный ответ: 25%. |
|
В5. Какое вещество образуется в результате следующих превращений: NH3 |
4NH3+5O2 2NO +О2 ⇄ 2NO2 4NO2+ 2H2O + О2 ⇄ 4HNO3 NH3+ H NO3 = NH4NO3 Правильный ответ: нитрат аммония. |
|
В6. На сгорание 1м3 газа расходуется 3м3 кислорода. При этом образуется 2м3 водяных паров и 2м3 углекислого газа. Укажите молярную массу исходного газа. |
СхНу + 3О2 → 2СО2 + 2Н2О 1м3 3м3 2м3 2 м3 Из уравнения реакции видно, что весь кислород, содержащийся в воде и углекислом газе, берется из молекулярного кислорода, использующегося для окисления. Соответственно, других элементов, кроме углерода и водорода, в исходном газе нет. Значит, это углеводород. х = 2; у = 4, это этилен С2Н4. М (С2Н4) = 28 г/моль. Правильный ответ: 28 г/моль. |
|
В7. Для внесения 14 г азота на 1м2 почвы использовали нитрат аммония. Укажите массу нитрата аммония, необходимого для внесения на 1м2 почвы. |
NH4NO3 в х г содержится 14 г азота в 80г содержится 28 г азота. Решаем пропорцию х= Для внесения 14 г азота на 1м2 почвы нужно внести 40 г нитрата аммония. Правильный ответ: 40г NH4NO3 |
|
В8. Смесь меди и оксида меди (II) массой 38,4 г растворили в концентрированной серной кислоте. При этом выделился оксид серы (IV) объёмом 6,72 л (н.у.). Определите массовую долю оксида меди в смеси (в%). |
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O CuО + H2SO4 = CuSO4 + H2O
Правильный ответ: |
|
В9. Укажите номер периода, некоторые элементы которого образуют вещества с водородными связями. |
Водородные связи могут образовываться только в водородных соединениях наиболее электроотрицательных элементов: N, O, F и других галогенов. N, O, F находятся во втором периоде. Правильный ответ: период №2. |
|
В10. Над разогретым порошком (Х1) пропустили водород. Полученное вещество красного цвета (Х2) растворили в концентрированной серной кислоте. Полученный раствор вещества голубого цвета (Х3) нейтрализовали раствором щелочи KOH, выпал голубой осадок (Х4), который при нагревании превратился в черный порошок (Х1). Укажите молярную массу исходного и полученного вещества. |
Сульфат металла голубого цвета – это СuSO4(X3). Значит, все вещества – это соединения меди. CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 Cu(OH)2↓ CuO +H2 М(CuO) = 80 г/моль Правильный ответ: М(CuO)=80 г/моль |
3. Задания с развернутым ответом С1-С2
|
Вопрос |
Комментарий |
|
С1. Напишите уравнения реакций, которые нужно провести для осуществления следующих превращений:.
Ca(OCl)2 |
2NaBr + Cl2 → 2NaCl + Br2 NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑ 3Cl2 + 6KOH(горяч., конц.) → 5KCl + KClO3 + 3H2O 2KClO3 2Ca(OH)2 + 2Cl2 → Ca(OCl)2 + CaCl2 + 2H2O |
|
С2. Массовая доля азота в удобрении составляет 14%. Весь азот входит в удобрение в составе мочевины СO(NH2)2. Вычислите массовую долю мочевины в этом удобрении. |
Пусть было 100 г удобрения. Составляем пропорцию. В 1 моль мочевины (60г) содержится 28 г азота В х г мочевины должно содержаться 14 г азота. Решаем пропорцию. х = 30 г. Отсюда следует Правильный ответ: 30%. |
Подведение итога
Вы смогли проверить свои знания по теме «ЕГЭ. Неметаллы». Вы систематизировали и закрепили знания по расширенной теме «Неметаллы», рассмотрев определенные вопросы и разобрав решения задач, которые возможны на Едином государственном экзамене.


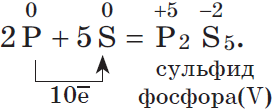
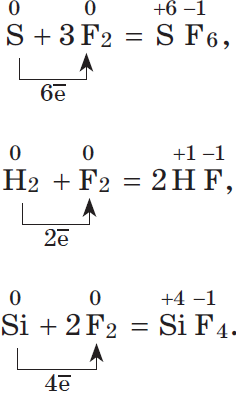
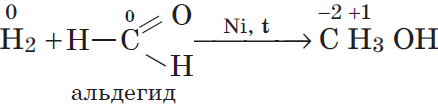
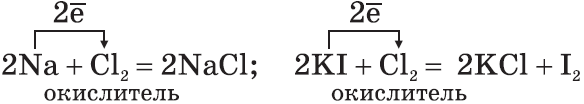
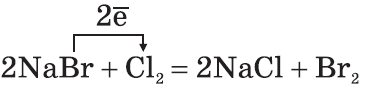
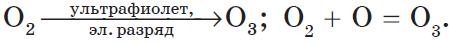
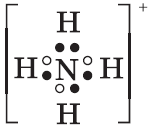
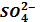 можно использовать раствор, содержащий ионы:
можно использовать раствор, содержащий ионы: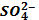 является реакция с растворимыми солями бария.
является реакция с растворимыми солями бария.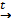 2NH3↑ + 2H2O + Сa(NO3)2.
2NH3↑ + 2H2O + Сa(NO3)2.
 …
…  …
… 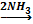 ?
?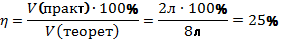
 …
… 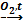 …
… 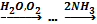 …?
…?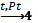 NO+6H2O
NO+6H2O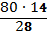 ; х = 40 (г).
; х = 40 (г).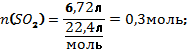
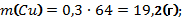
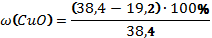 =50%
=50%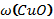 =50%
=50%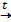 CuO + H2O
CuO + H2O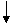 NaBr →NaCl →Cl2→ KClO3→KCl
NaBr →NaCl →Cl2→ KClO3→KCl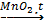 2KCl + 3O2↑
2KCl + 3O2↑