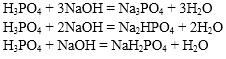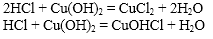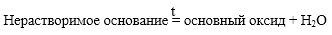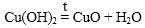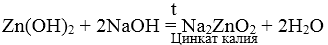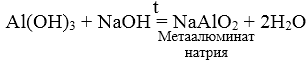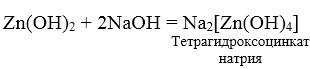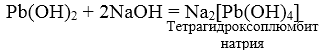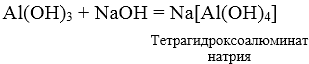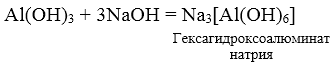Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
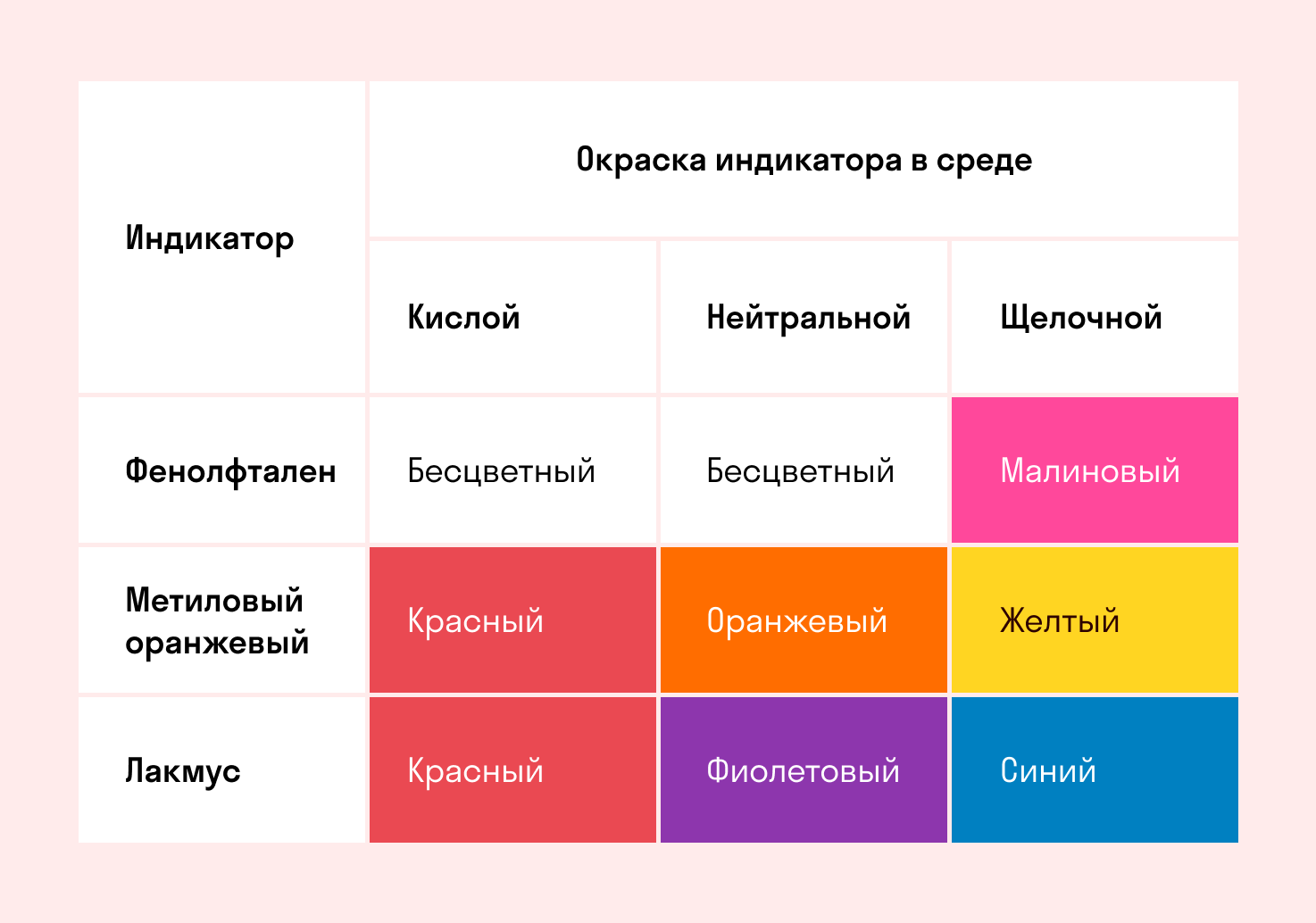
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
Физические свойства кислот
Твердые кислоты: H3PO4 (ортофосфорная кислота), H3BO3 (борная кислота), HIO4 (йодная кислота).
Жидкие кислоты: H2SO4, HNO3.
Большинство кислот растворяются в воде. Некоторые кислоты являются растворами газов в воде, например, HCl и H2S).
Химические свойства кислот
1. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации).
Если в реакциях нейтрализации участвуют многоосновные кислоты или многокислотные основания, то продуктами реакции могут быть не только средние соли.
2. Кислоты взаимодействуют с основными оксидами с образованием соли и воды.
Кислота + Основный оксид = соль + H2O
2HCl + CaO = CaCl2 + H2O
3. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды.
Кислота + амфотерный оксид = соль + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
4. Кислоты взаимодействуют с амфотерными гидроксидами с образованием соли и воды.
Кислота + амфотерный гидроксид = соль + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли новой кислоты.
Эти реакции возможно в том случае если в результате их образуется слабая кислота (в виде газа) или выпадает осадок (нерастворимая соль)
Кислота + соль = соль1 + Кислота1
HCl + AgNO3 = AgCl ↓+ HNO3
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 ↑ + H2O
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла.
Активность металла определяется его положением в электрохимическом ряду напряжений.
Взаимодействие металлов с серной концентрированной кислотой:
|
Металлы |
Активные |
Средней активности |
Неактивные |
|
H2SO4 (конц.) |
Соль + H2O + H2S 8Na + 5H2SO4 = 4Na2SO4 + H2S +4H2O |
Соль + H2O + S 4H2SO4 + 3Zn = 3ZnSO4+4H2O+S |
Cоль + H2O + SO2 2H2SO4 + 2Ag = Ag2SO4+2H2O+SO2 |
Получение кислот
1. Бескислородоные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде.
Неметалл + H2 = водородное соединение неметалла;
Неметаллы: F2, Cl2, Br2, I2, S, Se
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + кислота = Соль1 + кислота1
2NaCl(тв.) + H2SO4(конц.) = 2HCl + Na2SO4
Основания
Физические свойства оснований
Все неорганические основания —твердые вещества, кроме NH4OH
Основание имеют разный цвет: гидроксид калия (KOH) — белого цвета, гидроксид меди (II) (Cu(OH)2) — голубого цвета
Некоторые растворимые в воде основания называются едкими щелочами:
NaOH — едкий натр
KOH — едкий кали
Химические свойства оснований
1. Основания взаимодействуют с кислотами с образованием соли и воды – реакция нейтрализации.
Основание + кислота = соль + H2O
KOH + HCl = KCl + H2O
2. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Щелочь + кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
3. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание (или выделяется газ) или соль.
Раствор щелочи + раствор соли = основание2 + соль2
2NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4
4. Нерастворимые в воде основание при нагревании разлагаются на основный оксид и воду.
5. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды.
Zn + 2NaOH + 2 H2O = Na2[Zn(OH)4] + H2
Получение оснований
1. Взаимодействие щелочных и щелочноземельных металлов с водой.
2Na + 2H2O = 2NaOH + H2
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой.
BaO + H2O = Ba(OH)2
3. Получение нерастворимых оснований действием щелочей на растворимые соли металлов
Раствор щелочи + раствор соли = нераствор. основание + соль1
2NaOH + FeSO4 = Fe(OH)2 ↓ + Na2SO4
Амфотерные гидроксиды
Физические свойства
Все амфотерные гидроксиды — твердые вещества, не растворимые в воды. Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов.
Химические свойства
Амфотерные гидроксиды реагируют как с кислотами, так и со щелочами.
1. Взаимодействие амфотерных гидроксидов с кислотами.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2 H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
2. Сплавление твердых гидроксидов с твердыми щелочами.
3. При взаимодействии амфотерных гидроксидов с избытком растворов щелочей образуются комплексы.
2.6. Характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные |
двухосновные |
трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH |
H2SO4, H2SO3, H2CO3, H2SiO3 |
H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
|
H2S, HCl, CH3COOH, HCOOH |
H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
|
хорошо диссоциирующие (сильные) |
малодиссоциирующие (слабые) |
|
H2SO4, HCl, HBr, HI, HNO3, HClO4 |
H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
|
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) |
сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
|
практически все кислоты кроме HNO3 и H2SO4 (конц.) |
HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 35 1–20 | 21–35
Добавить в вариант
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д8 № 111
Разбавленная серная кислота реагирует лишь с одним из двух веществ
1) медь и оксид кремния (IV)
2) оксид алюминия и магний
3) оксид цинка и оксид меди (II)
4) гидроксид натрия и оксид углерода (II)
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Задания Д8 № 283
Серная кислота (разб.) реагирует с каждым из двух веществ:
1)
2)
3)
4)
Задания Д8 № 842
С ортофосфорной кислотой взаимодействует каждое из веществ, указанных в ряду:
1)
2)
3)
4)
С разбавленной серной кислотой взаимодействует
1) медь
2) цинк
3) ртуть
4) кремний
Разбавленная серная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
В двух пробирках находился твёрдый гидроксид меди(II). В одну пробирку добавили водный раствор вещества X, а в другую — водный раствор вещества Y. В обеих пробирках вещество растворилось, в первой пробирке раствор приобрёл сине-фиолетовый цвет, а во второй — голубой. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Задания Д8 № 627
Концентрированная азотная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
И с серной, и с фосфорной кислотой реагирует
1)
2)
3)
4)
Разбавленная серная кислота реагирует с каждым из двух веществ:
1) железо и оксид серы(IV)
2) азотная кислота и оксид цинка
3) оксид углерода(IV) и оксид меди(II)
4) хлорид бария и цинк
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 2
Образование водорода происходит при взаимодействии
1) ) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Какие две кислоты могут реагировать друг с другом?
Водород не выделяется при взаимодействии металлов с
1) муравьиной кислотой
2) разбавленной серной кислотой
3) концентрированной серной кислотой
4) соляной кислотой
В пробирку с разбавленным раствором вещества Х добавили твёрдое вещество Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4) (разб.)
5) (разб.)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В двух пробирках находился разбавленный раствор серной кислоты. В первую пробирку добавили твёрдое простое вещество Х, а во вторую – раствор вещества Y. В обеих пробирках выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
В двух химических стаканах находился порошок сульфида алюминия. В первый стакан добавили избыток раствора вещества Х, а во второй – избыток раствора вещества Y. В первом стакане порошок полностью растворился без выделения газа, а во втором порошок тоже растворился, но с образованием газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задания Д8 № 412
С разбавленной серной кислотой взаимодействует
1) серебро
2) магний
3) ртуть
4) кремний
Всего: 35 1–20 | 21–35
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Коротко о главном
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами.
Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
-
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
-
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
Mg + 2HCl = MgCl2 + H2
Zn + H2SO4 = ZnSO4 + Н2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
2H2S + SO2 = 3S + 2H2O
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
-
С чем реагируют кислоты?
-
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
-
Составьте уравнения реакций и назовите продукты реакций:
Ca + HCl
Na + H2SO4
CaO + HNO3
Fe2O3 + H2SO4
KOH + HNO3
Al(OH)3 + HF
HNO3 + CaCO3
-
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
-
Соляная кислота вступает в реакцию с каждым из двух веществ:
а. водой и цинком;
б. магнием и оксидом серы (IV);
в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.