Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 → 2CuO + CO2 + H2O
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 291 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня выберите два оксида, которые реагируют с водой.
1) оксид бария
2) оксид азота(II)
3) оксид меди(II)
4) оксид железа(II)
5) оксид хрома(VI)
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 2
Из предложенного перечня выберите два оксида, которые при обычных условиях реагируют с водой.
1) оксид углерода (II)
2) оксид меди (II)
3) оксид фосфора (V)
4) оксид железа (III)
5) оксид углерода (IV)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
В двух пробирках находился оксид меди(II). В первую пробирку добавили раствор вещества Х, а во вторую — избыток концентрированного раствора вещества Y. В обеих пробирках осадок полностью растворился. В первой пробирке раствор приобрёл голубой цвет, а во второй — зелёный. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Из предложенного перечня выберите два вещества, которые не реагируют с оксидом меди (II).
1) кислород
2) серная кислота
3) алюминий
4) водород
5) вода
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Задания Д7 № 583
Оксид меди (II) хорошо растворяется в
1) воде при обычной температуре
2) воде при нагревании
3) разбавленных кислотах при нагревании
4) разбавленных растворах щелочей
Из предложенного перечня выберите два вещества, с которыми оксид меди (II) не реагирует.
1) кислород
2) серная кислота
3) водород
4) вода
5) алюминий
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 1
Из предложенного перечня выберите два оксида, которые реагируют с водой.
1) оксид кальция
2) оксид кремния
3) оксид бария
4) оксид азота (I)
5) оксид меди (II)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
Из предложенного перечня выберите два оксида, которые при обычных условиях реагируют с водой.
1) оксид меди (II)
2) оксид железа (III)
3) оксид натрия
4) оксид алюминия
5) оксид азота (V)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два оксида, которые при обычных условиях реагируют с водой.
1) оксид меди (II)
2) оксид железа (III)
3) оксид натрия
4) оксид алюминия
5) оксид бария
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми реагирует оксид меди (II).
1) кислород
2) водород
3) вода
4) соляная кислота
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид железа (II).
1) вода
2) гидроксид натрия
3) медь
4) кислород
5) соляная кислота
Запишите номера выбранных веществ.
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид железа (II).
1) плавиковая и соляная кислота
2) вода и хлорид натрия
3) фосфорная кислота и гидроксид меди (II)
4) алюминий и гидроксид магния
5) серная кислота и водород
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми реагирует оксид кальция.
1) оксидом углерода (IV)
2) гидроксидом меди (II)
3) оксидом азота (II)
4) серной кислотой
5) гидроксидом калия
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5
Из предложенного перечня выберите две пары веществ, с каждым их которых реагирует оксид серы(IV).
1) медь и оксид углерода (II)
2) вода и кислород
3) азот и оксид фосфора (V)
4) оксид натрия и гидроксид калия
5) магний и водород
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества, с которыми реагирует оксид углерода (IV).
1) гидроксид кальция
2) вода
3) гидроксид меди (II)
4) оксид серы (VI)
5) оксид хрома (VI)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Какие два оксида не реагируют друг с другом?
1) и
2) и
3) и
4) и
Из предложенного списка выберите два оксида, которые реагируют с соляной кислотой.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ порядке возрастания.
Из предложенного перечня выберите два оксида, которые не реагируют с водой.
1)
2)
3)
4)
5)
Запишите номера выбранных ответов в порядке возрастания.
Установите соответствие между реагирующими веществами и углесодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберитесоответствующую позицию, обозначенную цифрой.
РЕАГИРУЮШИЕ ВЕЩЕСТВА
A) пропанол-1 и оксид меди (II)
Б) пропанол-2 и оксид меди (II)
В) уксусная кислота и оксид меди (II)
Г) уксусная кислота и гидроксид меди (II)
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди (I)
2) ацетат меди (II)
3) пропанон
4) пропаналь
5) пропионовая кислота
6) пропинат меди (II)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Источник: Эксперт в ЕГЭ. Под редакцией Медведева Ю. Н., Антошина А. Э., Лидина Р. А.
Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ
1) медь, оксид серы (IV)
2) оксид меди (II), оксид серы (IV)
3) нитрат меди (II), оксид азота (II), вода
4) сульфат меди (II), оксид серы (IV), вода
5) нитрат меди (II), оксид азота (IV), вода
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Всего: 291 1–20 | 21–40 | 41–60 | 61–80 …
1. Оксиды серебра и ртути являются термически неустойчивыми
2Ag2O → 4Ag + O2
2HgO → 2Hg + O2
Оксид меди (II) устойчив, но при очень высоких температурах разлагается на оксид меди (I) и кислород
4CuO → 2Cu2O + O2 (t = 1100ºC)
2. Обжиг сульфидов
При обжиге сульфидов серебра и ртути образуются не оксиды металлов, а сами металлы (так как оксиды термически неустойчивы)
Ag2S + O2 → 2Ag + SO2
Hg2S + O2 → Hg + SO2
При обжиге сульфидов других металлов, как правило, образуются два оксида
2CuS + 3O2 → 2CuO + 2SO2
2ZnS + 3O2 → 2ZnO + 2SO2
3. Термическое разложение нитратов
По тойже причине термической неустойчивости оксидов серебра и ртути их нитраты разлагаются при нагревании с образованием металла, а не оксида
2AgNO3 → 2Ag + 2NO2
Hg(NO3)2 → Hg + 2NO2
Но:
2Cu(NO3)2 → 2CuO + 4NO2

4. Термическое разложение сульфатов
Реакции протекают аналогично термическойму разложению нитратов, только с выделением сернистого газа SO2
2CuSO4 → 2CuO + 2SO2
Ag2SO4 → 2Ag + SO2
5. Сульфиды CuS, Ag2S и HgS не растворяются в воде и кислотах-неокислителях
CuS + HCl → реакция не идет.
FeS + 2HCl → H2S
ZnS + H2SO4(разб.) → H2S
Реакции рассматриваемых сульфидов возможны только с кислотами-окислителями, в результате чего возможны следующие реакции
Cu(NO3)2 + H2S → CuS
2AgNO3 + H2S → Ag2S
Следующая реакция не протекает, так как образующиеся сульфид и кислота взаимодействуют между собой
ZnSO4 + H2S → реакция не идет (ZnS + H2SO4 → ZnSO4 + H2S)
Примеры реакций с концентрированной азотной кислотой
CuS + 10HNO3(конц.) → Cu(NO3)2 + H2SO4 + 8NO2
Ag2S + 10HNO3(конц.) → 2AgNO3 + H2SO4 + 8NO2
| Оксид меди (II) | |
|---|---|
  |
|
 |
|
| Систематическое наименование |
Оксид меди (II) |
| Хим. формула | CuO |
| Состояние | черный порошок |
| Молярная масса | 79,545 г/моль |
| Плотность | 6,31 г/см³ |
| Температура | |
| • плавления | 1447 |
| • кипения | 2000 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| ГОСТ | ГОСТ 16539-79 |
| Рег. номер CAS | [1317-38-0] |
| PubChem | 164827 |
| Рег. номер EINECS | 215-269-1 |
| SMILES |
[O-2].[Cu+2] |
| InChI |
1S/Cu.O/q+2;-2 KKCXRELNMOYFLS-UHFFFAOYSA-N |
| RTECS | GL7900000 |
| ChEBI | 75955 |
| ChemSpider | 144499 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
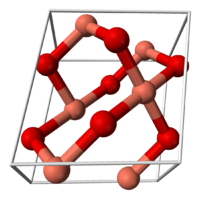
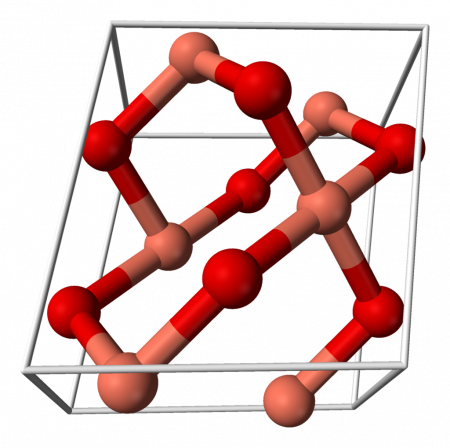
Оксид меди (II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм, b = 0.34226(5) нм, c = 0.51288(6) нм, α = 90°, β = 99,54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди (II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C):
-
- 2Cu + O2 → 2CuO
- нагревая гидроксид меди (II), её нитрат или карбонат:
-
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- CuCO3 → CuO + CO2
- Cu(OH)2 → CuO + H2O
- нагревая малахит:
-
- Cu2CO3(OH)2 →ot 2CuO + CO2 + H2O
Химические свойства
Оксид меди (II) реагирует с кислотами с образованием соответствующих солей меди (II) и воды:
-
- CuO + 2HNO3 → Cu(NO3)2 + H2O
При сплавлении CuO со щелочами образуются купраты:
-
- CuO + 2KOH →ot K2CuO2 + H2O
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди (II) соответствует гидроксид меди (II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
-
- Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (тетрагидроксокупрат (II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
-
- CuO + H2 → Cu + H2O
- 2CuO + C → 2Cu + CO2
Физические свойства
Оксид меди (II) относится к моноклинной кристаллической системе.
Работа выхода электрона из кристалла CuO составляет 5,3 эВ.
Оксид меди (II) представляет собой полупроводник p-типа с узкой шириной запрещенной зоны 1,2 эВ.
Оксид меди может быть использован для производства сухих батарей.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
2.2.4. Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + H2O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H2O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + H2SO4 (20%) → ZnSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + H2O = ZnO + H2↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4H2O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5H2O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6H2O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + Ba(OH)2 + 2H2O = Ba[Zn(OH)4] + H2↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6H2O → 4Na2[Zn(OH)4] + NH3↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4NH3·H2O → [Zn(NH3)4](OH)2 + H2↑ + 2H2O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 = ot=> 2Cr2O3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 oC соответственно):
2Cr + 3F2 = ot=> 2CrF3
2Cr + 3Cl2 = ot=> 2CrCl3
С бромом же хром реагирует при температуре красного каления (850-900 oC):
2Cr + 3Br2 = ot=> 2CrBr3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 oС:
2Cr + N2 =ot=> 2CrN
с серой
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S =ot=> CrS
2Cr + 3S =ot=> Cr2S3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3H2O =ot=> Cr2O3 + 3H2↑
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO3(конц.) =to=> Cr(NO3)3 + 3NO2↑ + 3H2O
2Cr + 6H2SO4(конц) =to=> Cr2(SO4)3 + 3SO2↑ + 6H2O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
10Cr + 36HNO3(разб) = 10Cr(NO3)3 + 3N2↑ + 18H2O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Fe + H2SO4 (разб.) = FeSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
2Fe + 6H2SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3H2O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.:
- Оксид меди (II)
-
Оксид меди(II) Общие Систематическое наименование Оксид меди(II)) Химическая формула CuO Отн. молек. масса 79.545 а. е. м. Молярная масса 79.545 г/моль Физические свойства Плотность вещества 6.31 г/мл г/см³ Состояние (ст. усл.) черный порошок Термические свойства Температура плавления 1447 [1] °C Температура разложения 1100 °C Химические свойства Растворимость в воде нерастоворим г/100 мл Классификация номер CAS [1317-38-0] Оксид меди(II)
Окси́д ме́ди(II) (окись меди) CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди относится к типу моноклинных решёток, с симметрией группы C2h и параметрами решётки a = 4.6837(5), b = 3.4226(5), c = 5.1288(6), α = 90° , β = 99.54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Применение
- 4 Литература
- 5 Примечания
Получение
Получить оксид меди(II) можно:
- нагревая металлическую медь на воздухе (при температурах выше 1100 °C получается оксид меди(II)):
2Cu + O2 → 2CuO.
- нагревая гидроксид меди(II), её нитрат или карбонат:
2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑;
Cu(OH)2·CuCO3 → 2CuO + H2O + CO2↑.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3 → Cu(NO3)2 + H2O.
При сплавлении CuO со щелочами образуются купраты:
CuO + 2KOH → K2CuO2 + H2O.
При нагревании до 1100 °C разлагается:
4CuO → 2Cu2O + O2↑.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (гидроксокупрат(II) натрия).
Оксид меди(II) может быть восстановлен до металлической меди при помощи аммиака, монооксидом углерода или водородом:
H2 + CuO → Cu + H2O.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом цвет становится розовым.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- The effect of hydrostatic pressure on the ambient temperature structure of CuO, Forsyth J.B., Hull S., J. Phys.: Condens. Matter 3 (1991) 5257-5261
Примечания
- ↑ под давлением О2
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Оксид меди (II)» в других словарях:
-
Оксид меди(I) — Оксид меди(I) … Википедия
-
Оксид меди(II) — Оксид меди(II) … Википедия
-
ОКСИД МЕДИ — ОКСИД МЕДИ, химическое соединение меди и кислорода, существующее в двух формах: закиси (Сu2О), блестящий красный порошок, встречающийся в природе в виде минерала куприта, и окиси (СuО), черного цвета, которая разлагается на Сu2О и кислород при… … Научно-технический энциклопедический словарь
-
оксид меди — (CuO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN copper oxidecupric oxidecuprous oxide … Справочник технического переводчика
-
Оксид меди (I) — Оксид меди(I) (закись меди) Cu2O твёрдое вещество красно бурого цвета, нерастворимое в воде и органических растворителях. Температура плавления 1235 °C. При нагревании до 1800 °C разлагается на металлическую медь и кислород. В природе оксид… … Википедия
-
Оксид меди — Известно три оксида меди: Оксид меди(I) Cu2O Оксид меди(II) CuO Оксид меди(III) Cu2O3 … Википедия
-
Оксид меди(III) — Общие Систематическое наименование Оксид меди(III) Традиционные названия Окисел медь Химическая формула Cu2O3 Физические свойства Состояни … Википедия
-
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
-
Меди оксиды — Известно три оксида меди: Оксид меди(I) Cu2O Оксид меди(II) CuO Оксид меди(III) Cu2O3 … Википедия
-
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия