Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.
Условие: один из реагентов должен быть растворимым.
H2SO4 + 2KOH → K2SO4 + 2H2O (соотношение реагентов 1:2)
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1)
HCl + Cu(OH)2 → CuOHCl + H2O или
2HCl + Cu(OH)2 → CuCl2 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.
4. Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2
NaOH + NH4NO3 → NH3
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
6. Щелочи реагируют с амфотерными оксидами:
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH)4]
Al(OH)3 + NaOH → Na[Al(OH)4]
2) реакции при сплавлении:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (кислота: H2ZnO2)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (кислота: H2BeO2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (кислота: HAlO2)
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O.
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Общая формула ${Me}↖{+y}(OH)_y$,где $y$ — число гидроксогрупп, равное степени окисления металла ${Me}↖{+y}$.
Классификация оснований.
| Признаки классификации | Группы оснований | Примеры |
| Растворимость в воде | растворимые (щелочи) | $NaOH, KOH, Ca(OH)_2, Ba(OH)_2$ |
| нерастворимые | $Cu(OH)_2, Fe(OH)_2, Fe(OH)_3$ | |
| Степень электролитической диссоциации | сильные ($α→1$) | щелочи |
| слабые ($α→0$) | нерастворимые основания, водный р-р аммиака $NH_3·H_2O$ | |
| Кислотность (число гидроксогрупп) | однокислотные | $NaOH, KOH$ |
| двухкислотные | $Fe(OH)_2, Cu(OH)_2$ |
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
$Ba(OH)_2=Ba_^{2+}+2OH^–$.
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
$Ca(OH)_2+HCl=CaOHCl+H_2O$.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
$Ca(OH)_2+CO_2=CaCO_3↓+H_2O$,
$NaOH+CO_{2(изб.)}=NaHCO_3$.
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:
$2NaOH+ZnO=Na_2ZnO_2+H_2O$,
$2NaOH+Zn(OH)_2=Na_2ZnO_2+2H_2O;$
б) в растворах:
$2KOH+H_2O=ZnO+K_2[Zn(OH)_4]$,
$2KOH+Zn(OH)_2=K_2[Zn(OH)_4]$.
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
$2NaOH+CuSO_4=Cu(OH)_2↓+Na_2SO_4$,
$NaOH+NH_4Cl=NH_3↑+H_2O+NaCl$.
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
$Mn(OH)_2+2HCl=MnCl_2+2H_2O$,
$Mn(OH)_2{→}↖{t}MnO+H_2O$.
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма |
—-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ |
$Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа |
—-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ |
$Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа |
—-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ |
$Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
$Zn(OH)_2+2HCl=ZnCl_2+2H_2O$.
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
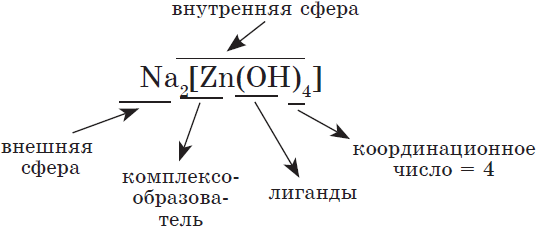
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
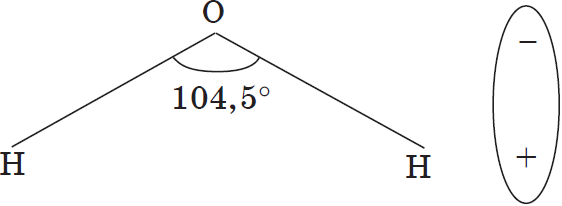
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
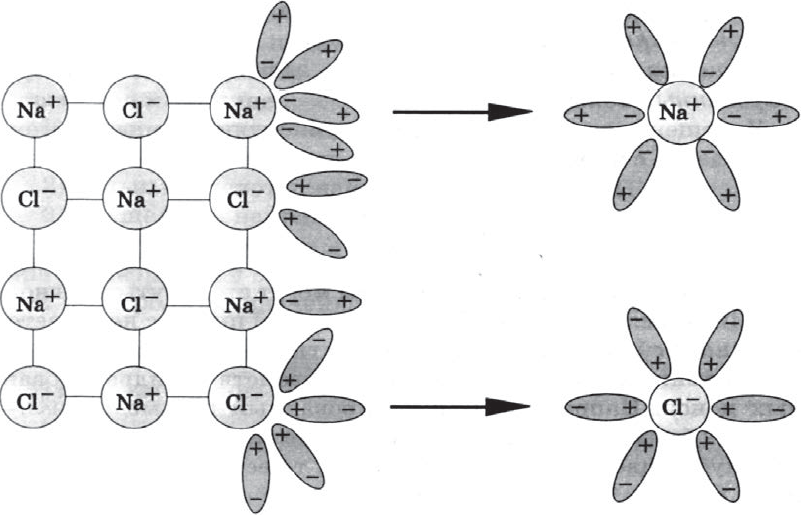
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
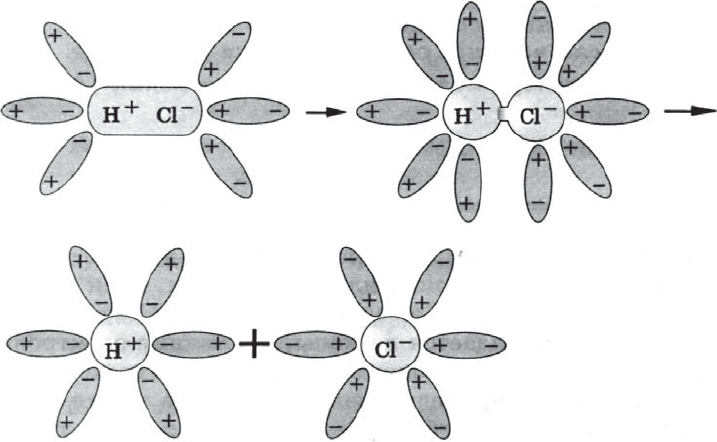
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов, обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония $H_3O^{–}$). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др., связаны с присутствием в их растворах гидроксид-ионов $OH^{–}$, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
a) $AgNO_3+HCl=AgCl↓+HNO_3$
$Ag^{+}+Cl^{–}=AgCl↓$
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) $Ba(OH)_2+2HNO_3=Ba(NO_3)_2+2H_2O$
$H^{+}+OH^{–}=H_2O$
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
в) $H_2SO_4+Na_2CO_3=Na_2SO_4+H_2O+CO_2↑$
$2H^{+}+CO_3^{2-}=H_2O+CO_2↑$
Реакция необратима, т.к. образуется углекислый газ $CO_2$ и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
${CH_3COOH}↙{text»слабый электролит»}+NaOH⇄CH_3COONa+{H_2O}↙{text»слабый электролит»}$
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$
Равновесие смещается в сторону образования более слабого электролита — $H_2O$. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
2. ЩЕЛОЧЬ + КИСЛОТА = СОЛЬ + ВОДА (реакция нейтрализации) (исключение H₂SiO₃).
Избыток кислоты → кислая соль, избыток щелочи → средняя)
КОН + H₂SO₄ → KНSO₄ + 2H₂O
2КОН + H₂SO₄ → K₂SO₄ + 2H₂O
3) С КИСЛОТНЫМИ ОКСИДАМИ = КИСЛЫЕ ИЛИ СРЕДНИЕ СОЛИ
избыток щелочи → средняя, избыток оксида → кислая)
SiO2(тв.)+ 2NaOH = Na2SiO3 + +H2O
2NaOH (избыток) + CO2 = Na2CO3 + H2O(средняя соль)
NaOH+ CO2(избыток) = NaНCO3 (кислая соль)
4)С РАСТВОРАМИ СРЕДНИХ СОЛЕЙ = СОЛЬ + ОСНОВАНИЕ
Исходные вещества должны быть растворимы, в продуктах — газ или осадок.
2NaOH + FeSO4 = Fe(OH)2↓+ Na2SO4
2KOH + (NH4)2SO4 = K2SO4 + 2NH3↑+ 2H2O
5)СОЛЬ АМФОТЕРНОГО МЕТАЛЛА С ЩЕЛОЧЬЮ + ГИДРОКСИД или ГИДРОКСОКОМПЛЕКС
AlCl3 + 3KOH(недостаток) = Al(OH)3↓ + 3KCl
AlCl3 + 4KOH(избыток) = 3KCl + K[Al(OH)4]
6) С КИСЛЫМИ СОЛЯМИ + СРЕДНЯЯ СОЛЬ
NaOH + NaHCO3 = H2O + Na2CO3;
7) С АМФОТЕРНЫМИ ОКСИДАМИ И ГИДРОКСИДАМИ (сплавление) = СРЕДНЯЯ СОЛЬ + ВОДА
2NaOH + Cr2O3 =2NaCrO2 (хромат натрия) + H2O
2NaOH +Zn(OH)2= Na2ZnO2 (цинкат натрия) + 2H2O
В РАСТВОРАХ = ГИДРОКСОКОМПЛЕКС.
2KOH + ZnO +H2O= K2[Zn(OH)4] (тетрагидроксоцинкат калия)
2NaOH +Zn(OH)2= Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)

2KOH + Zn(сплавление) = K2ZnO2 + H2↑
В РАСТВОРАХ = ГИДРОКСОКОМПЛЕКС + H2↑
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2↑
9) С НЕМЕТАЛЛАМИ = СОЛЬ + H2↑,
с серой и галогенами – 2 соли (кислородсодержащая + бескислородная + H2O
(Не реагируют N2, C, O2, инертные газы)
Si + 2KOH + H2O = K2SiO3 + 2H2↑
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
Исключение:
2F2 + 4NaOH = O2 или (OF2) + 4NaF + 2H2O
10) ЩЕЛОЧИ ПРИ НАГРЕВАНИИ НЕ РАЗЛАГАЮТСЯ ( исключение LiOH)
11) В РАСПЛАВАХ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУ
NaOH(расплав) → Na⁰ + O2⁰ + H2O
Катод Анод
ХЛОРНОВАТИСТАЯ КИСЛОТА HCl⁺¹O.
Существует только в виде разбавленных водных растворов. HClO — слабая кислота и сильный окислитель. Соли – гипохлориты
Разлагается: на свету до хлороводорода и кислорода:
HClO (свет) = HCl+ O2↑
Без света – до хлороводорода и хлорноватой кислоты
3HClO = 2HCl + НСlO3
2) Реагирует со щелочами – образуются соли и вода:
HClO + KOH =KClO + H2O
HClO + Са(OH)2 = СаOСl2 + H2O
хлорная известь
3) Окислитель:
2HI + HClO = I2↑ + HCl + H2O
ХЛОРИСТАЯ КИСЛОТА HCl⁺³O2
Существует только в водных растворах. Соли – хлориты
Получение:
2ClO2+H2O2=2HClO2 + O2↑
Неустойчива, при хранении разлагается
4HClO2 = HCl + HClO3 + 2ClO2↑ + H2O
ХЛОРНОВАТАЯ КИСЛОТА HCl⁺⁵O3.
Устойчива только в водных растворах. Соли – хлораты
Концентрированная кислота разлагается
8HClO3 = 4HClO4 + 2Cl2 + 3O2 + 2H2O
Получение:
Ba(ClO3)2+H2SO4=2HClO3 + BaSO4
Cильный окислитель.
1) 6P+5HClO3 =3P2O5↑ + 5HCl
ХЛОРНАЯ КИСЛОТА HCl⁺⁷O4
очень сильная кислота и очень сильный окислитель.
1) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 = 4ClO2↑ + 3O2↑ + 2H2O
KClO4 = KCl + 2O2↑
2) Сильный окислитель:
HClO4 + C → CO2↑ + Cl2↑ + H2O
ХЛОРОВОДОРОД HCl¯¹
Бесцветный газ, хорошо растворим в воде. Раствор в воде – сильная хлороводородная кислота.
HCl – сильный восстановитель:
Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли);
выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах:
HCl + AgNO₃ → AgCl↓ + HNO3
2) Взаимодействие с окислителями (MnO2, KMnO, KCLO3 и др.):
6HCl + KClO3 → KCl +3H2O + 3Cl2↑
ФТОРОВОДОРОД HF¯¹
Бесцветный газ, хорошо растворим в воде.
Раствор в воде – фтороводородная (плавиковая) кислота – средней силы.
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 84 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Какие два вещества могут реагировать друг с другом?
1)
2)
3)
4)
Задания Д8 № 369
Гидроксид кальция взаимодействует с каждым из двух веществ:
1)
2)
3)
4)
Задания Д8 № 498
Гидроксид бария вступает в реакцию с
1)
2)
3)
4)
Задания Д8 № 799
С гидроксидом натрия взаимодействует
1)
2)
3)
4)
С гидроксидом натрия взаимодействует
1)
2)
3)
4)
Гидроксид натрия взаимодействует с каждым из двух веществ:
1)
2)
3)
4)
С гидроксидом натрия взаимодействует
1)
2)
3)
4)
С гидроксидом алюминия взаимодействует каждое из двух веществ:
1)
2)
3)
4)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Гидроксид хрома(III) превращается в комплексное соединение при взаимодействии с водным раствором
1) NaNO3
2) КОН
3) СO2
4) CaCl2
Гидроксид алюминия превращается в комплексное соединение при взаимодействии с водным раствором
1) NH3
2) NaОН
3) ZnСl2
4) SO2
Гидроксид кальция не взаимодействует с
1) оксидом углерода(II)
2) бромом
3) сероводородом
4) хлороводородом
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Задания Д8 № 584
Гидроксид калия взаимодействует с каждым из двух веществ:
1)
2)
3)
4)
Задания Д8 № 885
С гидроксидом калия взаимодействует
1)
2)
3)
4)
Гидроксид рубидия может реагировать с
1)
2)
3)
4)
Гидроксид кальция вступает в реакцию с
1)
2)
3)
4)
Гидроксид алюминия реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Источник: Демонстрационная версия ЕГЭ—2014 по химии
Гидроксид алюминия взаимодействует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 1
Гидроксидом, который взаимодействует как с раствором кислоты, так и с концентрированным раствором щелочи, является
1)
2)
3)
4)
Гидроксидом, который взаимодействует как с раствором кислоты, так и с концентрированным раствором щёлочи, является
1)
2)
3)
4)
Всего: 84 1–20 | 21–40 | 41–60 | 61–80 …
Основания.
Основания – сложные вещества, содержащие в
своем составе гидроксид-ионы или при взаимодействии с водой образующие эти ионы
в качестве анионов.
Щелочи – растворимые
основания, в водном растворе создают щелочную среду засчёт иона ОН—,
который образуется при их ДИССОЦИАЦИИ: KOH à
K+ + OH—
Нерастворимые
основания в водном растворе щелочную среду не создают!
Получение оснований:
|
Способ |
Примеры |
Примечания |
|
1) |
2Na |
С |
|
2) |
ВаО |
С |
|
3) |
2KCl |
|
|
4) |
Ba(OH)2 |
Исходные |
|
5) |
СuCl2 + 2KOH = Сu(OH)2¯ + 2KCl |
Получение |
СВОЙСТВА ОСНОВАНИЙ:
1. Свойства щелочей – растворимых оснований.
|
1) |
NaOH + HNO2 = NaNO2 + H2O |
|
2) |
SiO2(тв.)+ 2NaOH → t Na2SiO3 + +H2O 2NaOH NaOH+ |
|
3)Реакция |
2NaOH 2KOH Исходные |
|
3*) |
AlCl3 + 3KOH(недостаток) AlCl3 + 4KOH(избыток) В |
|
4) |
NaOH + NaHCO3 = H2O + Na2CO3 КОН |
|
5) |
2NaOH + Cr2O3 → t 2NaCrO2 + H2O Раствор: 2KOH + ZnO +H2O=K2[Zn(OH)4] 2NaOH 3KOH + Cr(OH)3 |
|
6) |
2NaOH (кроме Fe |
|
7) |
2F2 Si 3S |
|
|
|
2. Свойства нерастворимых оснований.
|
1) |
Fe(OH) |
|
2) |
Cu(OH)2 |
|
3) |
Сu(OH)2 AgOH |
|
4) |
4Fe(OH)2 2Mn(OH)2 |
Амфотерные гидроксиды
–
это гидроксиды, которые могут в зависимости от условий проявлять как
кислотные, так и основные свойства (двойственный характер).
+2:
Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2
+3:
Al(OH)3,
Cr(OH)3,
[Fe(OH)3–слабо амфотерный, не образует гидроксокомплексов,
реагирует со щелочами только в сплаве!]
Получение
амфотерных гидроксидов.
|
1) ZnCl2 + NaOH (недостаток) = Zn(OH)2↓ |
|
2) 2AlCl3 |
|
3) |
Свойства
амфотерных гидроксидов.
|
Свойства |
Примеры |
Примечания |
|
1) |
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Al(OH)3+3HNO3=Al(NO3)3+ |
Только |
|
2) |
2NaOH+Zn(OH)2=Na2[Zn(OH)4] Тетрагидроксоцинкат натрия. 3KOH+ Гексагидроксохромат |
в |
|
3) |
Al(OH)3 (или K3AlO3) Zn(OH)2+2KOH→ t K2ZnO2 + 2H2O |
|
|
4) |
2Al(OH)3+ Zn(OH)2 |
|
|
5) |
2Al(OH)3 → t Al2O3 |