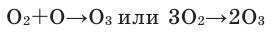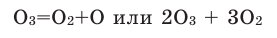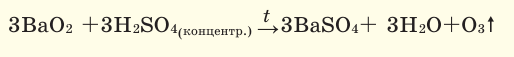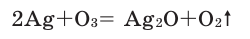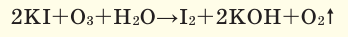2.3.2. Химические свойства кислорода и серы.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
PbS + 4O3 = PbSO4 + 4O2
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
2Ag + O3 = Ag2O + O2
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
Озон
Содержание:
- Озон
- Химические свойства озона
Озон (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Озон
Кислород в природе встречается в виде двух простых веществ: кислорода 

Явление образования нескольких простых веществ одним элементом
называется аллотропией (рис. 37). Разные простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Формула озона 
температура плавления – 193°C, в жидком состоянии цвет темно-синий, а в твердом –
от синего до темно-фиолетового. Этот газ был впервые обнаружен голландским химиком Мартином фон Меррумом (1785).
Химические свойства озона
Озон химически более активен, чем кислород, и может окислять благородные металлы: золото, серебро, платину:
Активность озона обусловлена его разложением на молекулярный и атомарный кислород:
Этим же объясняется свежесть воздуха после грозы в сосновом бору. Атомарный кислород – более сильный окислитель, чем молекулярный. Данное свойство применяется при обеззараживании питьевой воды и при отбеливании ткани, бумаги, соломы и т. д. Применение озона при обеззараживании вместо хлора экологически более выгодно. Озон, окисляя примеси сточных вод, превращается в кислород.
В верхних слоях атмосферы на высоте 25 км над землей (в стратосфере) образуется тонкий слой озона , который защищает Землю от чрезмерной дозы ультрафиолетовых лучей (УФО) Солнца (рис. 38). Этот слой разрушается под воздействием различных факторов («озоновые дыры»). Например, при запуске ракетоносителя космического корабля, а также двигатели самолетов выбрасывают в верхние слои атмосферы определенную массу оксидов азота (II).
Оксид азота (II) вступает в реакцию с озоном:
Это приводит к всевозможным природным катаклизмам (глобальное потепление, таяние ледников и айсбергов, цунами, тайфуны, сели, торнадо и т. д.).
Практическая работа №3
Получение кислорода и изучение его свойств
Цель: учащиеся самостоятельно проводят работу, изучают свойства кислорода. Знать свойства кислорода как окислителя.
Ход работы
1. Соберите прибор по рис. 30 (с. 88).
2. В колбу наберите немного раствора пероксида водорода с помощью капельной воронки.
3. Всыпьте в колбу заранее приготовленный диоксид марганца. Затем колбу закройте пробкой с газоотводной трубкой. Что наблюдаете?
4. Соберите выделившийся кислород в большие пробирки.
5. В железную ложку положите небольшой кусочек серы, зажгите его в пламени спиртовки и внесите в сосуд с кислородом, постепенно опуская ложечку.
6. После сжигания серы влейте в сосуд немного воды, закройте сосуд и хорошо взболтайте, затем подействуйте индикатором – метилоранжем.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Содержание
- Строение озона
- История открытия
- Физические свойства
- Химические свойства
- Получение озона
- Токсичность
- Применение озона
- Применение жидкого озона
- Озон в атмосфере
Озон — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
| Озон | |
|---|---|
| Общие | |
| Систематическое наименование |
Трикислород |
| Хим. формула | O3 |
| Физические свойства | |
| Состояние | голубой газ |
| Молярная масса | 47,998 г/моль |
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К) |
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К) Н/м |
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К) |
| Энергия ионизации | 12,52 ± 0,01 эВ |
| Термические свойства | |
| Температура | |
| • плавления | −197,2 °C |
| • кипения | −111,9 °C |
| Критическая точка | |
| • температура | −12,0 °С (261,1 К) °C |
| • давление | 54,6 атм. |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К) Дж/(моль·К) |
| Энтальпия | |
| • образования | 144,457 (при 0 К, отн. О2) кДж/моль |
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К) |
| Давление пара | 1 ± 1 атм |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,06 г/л (при 0 °С) |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж) |
| Оптические свойства | |
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм) |
| Структура | |
| Дипольный момент | 0,5337 Д |
| Классификация | |
| Рег. номер CAS | 10028-15-6 |
| PubChem | 24823 |
| Рег. номер EINECS | 233-069-2 |
| SMILES |
[O-][O+]=O |
| InChI |
1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N |
| RTECS | RS8225000 |
| ChEBI | 25812 |
| ChemSpider | 23208 |
| Безопасность | |
| ЛД50 | 4,8 ppm |
| Токсичность | сильнодействующий яд, обладающий раздражающим и канцерогенным действием |
| Пиктограммы СГС |     |
| NFPA 704 |
Строение озона
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д.
История открытия
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом.
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда.
Физические свойства
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³.
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3.
- Температура кипения −111,8(3) °C (161,3 К). Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению. По другим сведениям Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К).
- Критическое давление 51,6 атм.
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с.
- Теплота плавления 2,1 кДж/моль.
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль; при 90 К от 15,27 до 16,6 кДж/моль.
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы.
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ.
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства
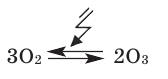
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Получение озона
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария:
Токсичность
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным, а также может приводить к преждевременной смерти.
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³;
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³;
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) — 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³.
Озон эффективно убивает плесень, бактерии и вирусы. Промышленные озонаторы используются для дезинфекции помещений от коронавируса COVID-19.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники.
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Озон в атмосфере
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
Преподаватель который помогает студентам и школьникам в учёбе.
Озон как химический элемент в химии — формулы и определение с примерами
Содержание:
Озон:
Общая характеристика:
Распространение озона в природе
Одним из аллотропических видоизменений кислорода является озоновый газ. Озон образуется на высоте примерно 25-30 км в атмосфере в результате воздействия ультрафиолетовых солнечных лучей на кислород. Озон поглощает ультрафиолетовые лучи и таким образом защищает живые организмы на Земле от их губительного действия.
Получение озона
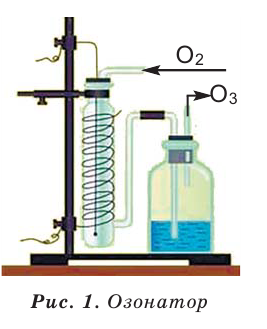
Озон получают в устройстве под названием озонатор (рис. 1).
Пропущенный через озонатор воздух (или чистый кислород), пройдя между электродами, создает электрический разряд, под воздействием которого кислород превращается в озон (10-15% по объему).
При прохождении через атмосферу ультрафиолетовых лучей (УФЛ), обладающих сверхвысокой энергией, молекула кислорода распадается на атомы.
Полученный кислородный атом тут же соединяется с молекулярным кислородом, превратившись в озон.
О получении озона свидетельствует появление приятного запаха. В отличие от кислорода, озон неустойчив, при хранении и нагревании, а также поглощении ультрафиолетовых солнечных лучей со средней энергией он вновь превращается в кислород.
Озон также получают в лаборатории в результате следующей реакции.
Физические свойства озона
Озон — это светло-голубого цвета газ молекулярного строения, с приятным запахом и без вкуса. Озон немного тяжелее воздуха, при температуре — 112 

Химические свойства озона
Озон в химическом отношении активнее кислорода. В обычных условиях он окисляет серебро, которое не вступает в реакцию с кислородом:
Такие легковоспламеняющиеся вещества, как спирт, бензин, в озоне разгораются ярким пламенем. Это объясняется распадом озона с образованием атома кислорода.
Озон является более сильным, по сравнению с кислородом, и относительно слабым, по сравнению с атомарным кислородом, окислителем. Озон вытесняет йод из раствора йодида калия (KI).
Если количество озона в атмосферном воздухе превышает 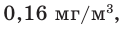
- Оксиды в химии
- Основания в химии
- Кислоты в химии
- Соли в химии
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
Химические свойства озона
Озон – сильнейший
окислитель (сильнее
кислорода, но слабее фтора)
за счет образования очень реакционноспособного
атомарного кислорода по реакции О3
→ О2
+ О (ат.)
Он окисляет все
металлы, кроме Au
и Pt
и большинство неметаллов. После некоторого
поверхностного окисления довольно
хорошо противостоят
воздействию озона Cu, Ni, Sn а также
безуглеродистые сплавы железа с 25 %
хрома.
В реакциях с озоном
очень часто выделяется кислород.
1) Взаимодействует
с неметаллами, окисляя
их до высших оксидов
Cl2
+ О3
→ Cl2O7
+ O2
С + О3
→ CO2
+ O2
2) Взаимодействует с металлами
Ag
+ О3
→ Ag2O
+ O2
3) Взаимодействует
с оксидами (низшие
переводит в высшие)
NO
+ О3
→ N2O5
+ O2 кислород
окисляет NO
только до NO2:
NO
+ O2
→ NO2
4) Взаимодействует
с сульфидами, селенидами и теллуридами,
переводя
их в сульфаты, селенаты и теллураты
PbS
+ О3
→ PbSO4
+ O2 обесцвечивание
5) Качественная реакция на озон – йодокрахмальная реакция
KJ
+ О3
+ H2O→
J2
+ KOH
+ O2
Бумажка, смоченная
в раствор KJ
и крахмала синеет в присутствии озона.
Каучук и резина
под действием озона очень быстро
рассыпаются в порошок. Многие горючие
органические вещества (спирты, кетоны,
углеводороды и т. д.) при соприкосновении
с озоном воспламеняются или взрываются.
Получение озона
Озон образуется
по реакции: 3О2
Combin 2О3
= 285 кДж/моль
– эта реакция
эндотермическая, и для нее ∆G
> 0, т.е. самопроизвольно она протекать
не может, для этого требуется большое
количество энергии.
1) Получают из
кислорода или воздуха в озонаторах под
действием тихого электрического разряда
(без искры). Максимальная
концентрация озона при этом составляет
10 – 12 %. Далее смесь сжижают глубоким
охлаждением. Сжижается O3
легче, чем O2,
и потому их несложно разделить.
2) Образуется
при взаимодействии фтора с водой (в
очень небольших количествах)
F2
+ H2O
→ HF
+ O3
Применение озона
Применение озона
обусловлено его специфическими
химическими свойствами — способностью
к окислению, дезинфекции и бактерицидным
свойствам, а также возможностью резкого
ускорения реакций горения и достижения
в них очень высоких температур.
1. Для обеззараживания
питьевой воды и очистки сточных вод;
2. В пищевой
промышленности как бактерицидное
средство на холодильниках продуктов,
консервных и пивоваренных заводах;
3. Для отбеливания
бумаги, соломы, льна, масел и др., а также
широко применяется в производстве
ванилина, камфары, жирных кислот и других
продуктов;
4. Как окислитель
ракетного топлива в ракетно-космической
технике.
Пероксид водорода h2o2 История открытия пероксида водорода
Пероксид (перекись)
водорода H2O2
открыл в 1818 г. Луи Жак Тенар (фр.), действуя
сильно охлажденной соляной кислотой
на пероксид бария, и дал ему название
«окисленная вода».
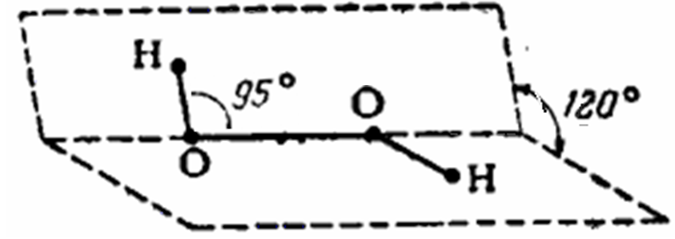
Строение молекулы h2o2
Н – О ;sup 5( -– О
;sup 5( -–Н
Молекула пероксида
водорода состоит из двух групп ОН,
связанных пероксидным
мостиком О–О, характерным для всех
пероксидов. Небольшая прочность связи
О–О обуславливает неустойчивость
молекулы H2O2.
Пространственное
строение молекулы обусловлено взаимным
отталкиванием между неподеленными
электронными парами кислорода и
электронами связи О–Н.
Молекула не плоская
и более полярна, чем Н2О:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.