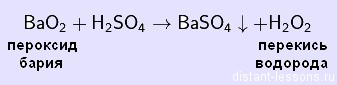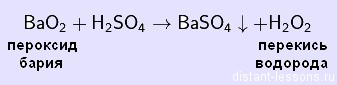Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут.
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr+3.
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2 → N2 + 6H2O
Соединения Cr+3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au+3, KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
ПЕРЕКИСЬ
ВОДОРОДА
Перекись
водорода представляет собой бесцветную сиропообразную жидкость с температурами
фазовых переходов -0,430С и 150,20С. Смешивается с водой
неограниченно.
В чистом
виде Н2О2 малоустойчива и может разлагаться со взрывом,
водные растворы довольно устойчивы.
Разложение
по уравнению: 2Н2О2 → О2 +2Н2О +
47 ккал в водном растворе идет интенсивно при нагревании, облучении или в
присутствии катализаторов ( чаще всего с MnO2).
В молекуле
перекиси два атома кислорода соединены друг с другом неполярной ковалентной
связью, образуя перекисную группу («мостик») -О-О-, поэтому степень
окисления кислорода в этом и подобных ему соединениях равна -1 ( аналогично
как и для серы в пирите).
Химические свойства.
1.
Кислотные
свойства
(перенос перекисной группы).
Н2О2
– очень слабая кислота двухосновная кислота; в воде частично диссоциирует:
Н2О2
→ Н+ + НО2- по первой стадии и по второй
НО2- →
Н+ + О2- в очень малой степени.
1. При
взаимодействии со щелочами (реакция нейтрализации) образуются соли – перекиси,
в которых сохраняется перекисный «мостик»:
Ва(ОН)2 нас.р-р
+ Н2О2 → ВаО2↓ + 2Н2О (выпадение
белых блестящих кристаллов)
2.При
взаимодействии с высшими кислотами: Н2O2+ 2H2SO4
→ H2S2O8 +H2O
образование пероксодисерной кислоты :
2.
Окислительно-восстановительные
свойства
Так как степень
окисления кислорода в перекиси -1, то это соединение может проявлять как
восстановительные так и окислительные свойства.
1) При
взаимодействии с восстановителями (качественная реакция на перекись
водорода) перекись проявляет окислительные свойства: перекисная
связь рвется и образуются два иона кислорода:
(О2)2- +2ẽ
→ 2О2-
2KI + H2SO4
+H2O2 → I2 +K2SO4 + 2H2O
Окислительные
свойства перекиси можно доказать взаимодействием со свежеполученным и
отфильтрованным сульфидом свинца (II) или бария:
PbS черный +4 H2O2 → PbSO4белый↓ + 4H2O –
изменение цвета осадка или
доокислением сернистой
кислоты в серную:
H2O2
+ H2SO3 → H2O + H2SO4
2) При
взаимодействии с более сильными окислителями перекись водорода проявляет
восстановительные свойства (количественное определение перекиси
водорода в растворе)
2KMnO4
+ 3H2SO4 + 5H2O2 → 2MnSO4
+K2SO4 +5O2 +8H2O
ОКИСЛИТЕЛЬНЫЕ
СВОЙСТВА Н2О2 ПРОЯВЛЯЕТ В БОЛЬШЕЙ СТЕПЕНИ, ЧЕМ
ВОССТАНОВИТЕЛЬНЫЕ.
3.
Образование
аддитивных соединений
Молекула перекиси
может присоединяться как целое к другой молекуле с образованием
пероксигидратов, аналогичных гидратам:
H2O2 + 2Na2CO3 → 2Na2CO3*3H2O2
Прописать
уравнения реакций по прописи эксперимента.
1. К нитрату
серебра приливают раствор аммиака, а затем по каплям добавляют 3% раствор
перекиси водорода. Выпадает темный осадок.
2. К
раствору ванадата натрия, подкисленного серной кислотой, добавляют по каплям
3% раствор перекиси водорода. Раствор окрашивается в розово-коричневый цвет
(образование пероксованадиевой кислоты HVO4)
3. В пробирку
с раствором сульфата титана (IV) внести по каплям растворы серной
кислоты и перекиси водорода. Появится желто-оранжевое окрашивание раствора
пероксотитановой кислоты (
H4TiO5).
Закончить
уравнения ОВР с участием перекиси водорода.
1. H2O2
+ KMnO4 + H2SO4 →
2. H2O2
+ KMnO4 + KOH →
3. H2O2
+ KMnO4→
4. H2O2
+ KI + H2SO4 →
5. H2O2
+ KI →
6. H2O2
+ Ca(ClO)2 →
7. H2O2
+ Ag2O →
8. H2O2
+ H2SO4 + FeSO4 →
Источник
информации
У.Шамб,
Ч.Сеттерфилд, Р.Вентворс, ПЕРЕКИСЬ ВОДОРОДА, пер с англ, изд. Иностранной
литературы, Москва, 1958
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Все химические уравнения с пероксидом водорода
Добро пожаловать, Гость!
Готовимся к сдаче ЕГЭ по химии
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2
— простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H2O.
Строение молекулы
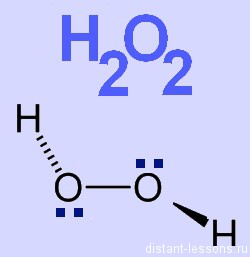
Молекула Н2O2 содержит в своем составе пероксидный анион O2 -2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H +1 -O -1 -O -1 -H +1
Физические свойства
В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см 3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства
Разложение Н2O2 (диспропорционирование)
2O -1 — 2e — → O2 0
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
(Кдисс = 1,5 * 10 -12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей — средних (пероксидов) и кислых (гидропероксидов), например:
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
Получение Н2O2 из пероксидов металлов
Так как Н2O2 — очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Правила составления окислительно-восстановительных реакций
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут .
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr +3 .
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2  → N2 + 6H2O
Соединения Cr +3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au +3 , KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
Химия, Биология, подготовка к ГИА и ЕГЭ
Это вещество продается во всех аптеках, т.е. его может приобрести любой человек. Химик Л. Ж. Тенар считается первооткрывателем «окисленной воды»
Давайте подробно разберем
свойства перекиси водорода
Строение молекулы
- валентность O = 2
- степень окисления O = -1
- молекула полярна
Физические свойства перекиси водорода
жидкое бесцветное вещество без запаха; с «металлическим» привкусом
очень хорошо растворимо в воде, точнее, перекись может смешиваться с H2O в любых соотношениях;
хорошо растворяется в полярных (органических) растворителях).
Химические свойства перекиси водорода
- Часто можно наблюдать, как капелька перекиси водорода «пузырит» — вещество очень легко разлагается на свету — образуется вода и выделяется кислород:
Поэтому перекись нельзя держать открытой на воздухе — со временем в склянке останется только вода.
пероксид водорода проявляет свойства очень слабой кислоты (слабее угольной):
с.о. -1 делает возможным и окислительные — восстановление до O(-2), и восстановительные — окисление до O2, свойства:
Окислительные свойства перекиси водорода
Восстановительные свойства перекиси водорода
В кислой среде H2O2 восстанавливается до H2O:
В щелочной или нейтральной — до OH-:
Если реакция идет с сильными окислителями, то образуется кислород:
Если реакция идет с сильными окислителями, то образуется кислород:
Биологические свойства перекиси водорода
— безвредное для организма противомикробное средство, дезинфицирующее средство
Методы получения:
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель, в аналитической химии, в медицине — как антисептик, в производстве дезинфицирующих и отбеливающих средств.
Перекись водорода применяется также для обесцвечивания волос (пергидроль) и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
источники:
http://chemrise.ru/theory/inorganic_11/rules_hydrogen_peroxide_11
http://distant-lessons.ru/svojstva-perekisi-vodoroda.html
Свойства перекиси водорода
15-Апр-2014 | Нет комментариев | Лолита Окольнова
Это вещество продается во всех аптеках, т.е. его может приобрести любой человек. Химик Л. Ж. Тенар считается первооткрывателем «окисленной воды»
Давайте подробно разберем
свойства перекиси водорода
Строение молекулы
- валентность O = 2
- степень окисления O = -1
- молекула полярна
Физические свойства перекиси водорода
жидкое бесцветное вещество без запаха; с «металлическим» привкусом
очень хорошо растворимо в воде, точнее, перекись может смешиваться с H2O в любых соотношениях;
хорошо растворяется в полярных (органических) растворителях).
Химические свойства перекиси водорода
- Часто можно наблюдать, как капелька перекиси водорода «пузырит» — вещество очень легко разлагается на свету — образуется вода и выделяется кислород:
2H2O2 = 2H2O + O2↑
Поэтому перекись нельзя держать открытой на воздухе — со временем в склянке останется только вода.
пероксид водорода проявляет свойства очень слабой кислоты (слабее угольной):
с.о. -1 делает возможным и окислительные — восстановление до O(-2), и восстановительные — окисление до O2, свойства:
|
|
|
В кислой среде H2O2 восстанавливается до H2O: H2O2 +2H(+) +2e(-) = 2H2O KNO2 + H2O2 = KNO3 + H2O В щелочной или нейтральной — до OH-: H2O2 +2e(-)= 2OH(-) 2KI + H2O2 = I2 + 2KOH Если реакция идет с сильными окислителями, то образуется кислород: H2O2-2e(-) = O2 + 2H(+) |
H2O2 + Ag2O -> 2Ag + O2 + H2O Если реакция идет с сильными окислителями, то образуется кислород: H2O2 -2e(-)-> O2 + 2H(+) H2O2 +2OH(-) -2e(-) ->O2 + 2H2O 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O 3H2O2 + 2KMnO4 = 2MnO2 + 2KOH + 3O2 + 2H2O |
Биологические свойства перекиси водорода
— безвредное для организма противомикробное средство, дезинфицирующее средство
Методы получения:
- лабораторный:
- промышленный:
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель, в аналитической химии, в медицине — как антисептик, в производстве дезинфицирующих и отбеливающих средств.
Перекись водорода применяется также для обесцвечивания волос (пергидроль) и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
Обсуждение: «Свойства перекиси водорода»
(Правила комментирования)
Химические свойства
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные, так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой. При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами.
Например, пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
При нагревании пероксиды, опять-таки, диспропорционируют:
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
2Na2O2 = 2Na2O + O2↑
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например, пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Na2O2 + CO = Na2CO3
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
Na2O2 + SO2 = Na2SO4
2Na2O2 + S = Na2SO3 + Na2O
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например, при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4