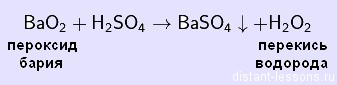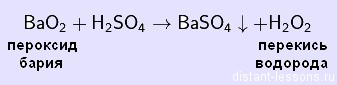Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

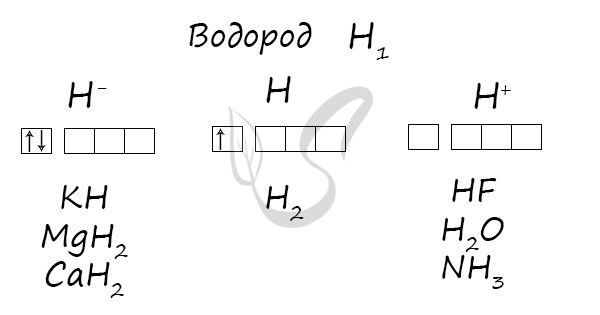
Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O
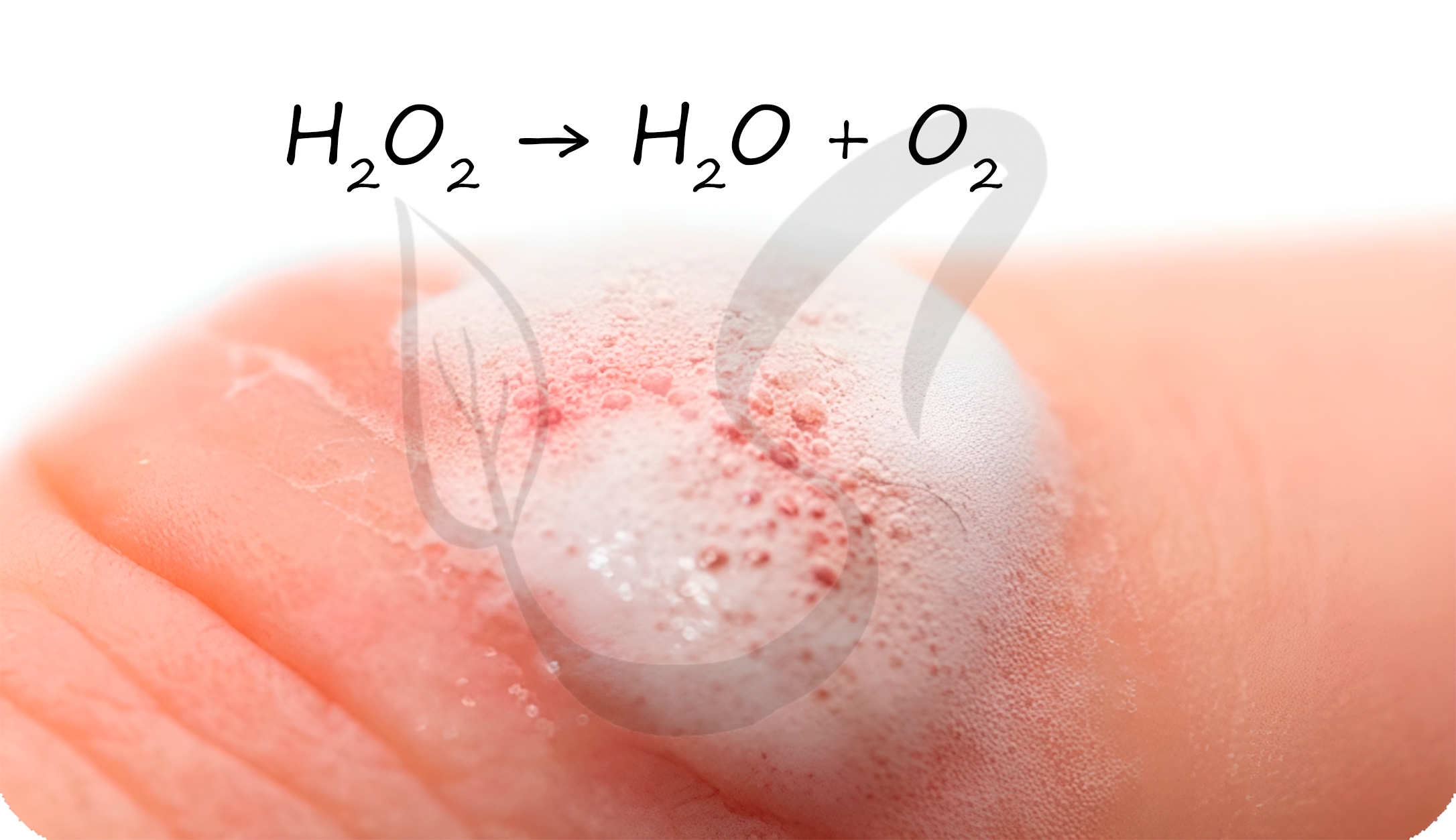
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ПЕРЕКИСЬ
ВОДОРОДА
Перекись
водорода представляет собой бесцветную сиропообразную жидкость с температурами
фазовых переходов -0,430С и 150,20С. Смешивается с водой
неограниченно.
В чистом
виде Н2О2 малоустойчива и может разлагаться со взрывом,
водные растворы довольно устойчивы.
Разложение
по уравнению: 2Н2О2 → О2 +2Н2О +
47 ккал в водном растворе идет интенсивно при нагревании, облучении или в
присутствии катализаторов ( чаще всего с MnO2).
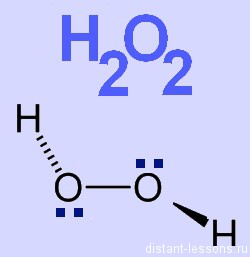
В молекуле
перекиси два атома кислорода соединены друг с другом неполярной ковалентной
связью, образуя перекисную группу («мостик») -О-О-, поэтому степень
окисления кислорода в этом и подобных ему соединениях равна -1 ( аналогично
как и для серы в пирите).
Химические свойства.
1.
Кислотные
свойства
(перенос перекисной группы).
Н2О2
– очень слабая кислота двухосновная кислота; в воде частично диссоциирует:
Н2О2
→ Н+ + НО2- по первой стадии и по второй
НО2- →
Н+ + О2- в очень малой степени.
1. При
взаимодействии со щелочами (реакция нейтрализации) образуются соли – перекиси,
в которых сохраняется перекисный «мостик»:
Ва(ОН)2 нас.р-р
+ Н2О2 → ВаО2↓ + 2Н2О (выпадение
белых блестящих кристаллов)
2.При
взаимодействии с высшими кислотами: Н2O2+ 2H2SO4
→ H2S2O8 +H2O
образование пероксодисерной кислоты :
2.
Окислительно-восстановительные
свойства
Так как степень
окисления кислорода в перекиси -1, то это соединение может проявлять как
восстановительные так и окислительные свойства.
1) При
взаимодействии с восстановителями (качественная реакция на перекись
водорода) перекись проявляет окислительные свойства: перекисная
связь рвется и образуются два иона кислорода:
(О2)2- +2ẽ
→ 2О2-
2KI + H2SO4
+H2O2 → I2 +K2SO4 + 2H2O
Окислительные
свойства перекиси можно доказать взаимодействием со свежеполученным и
отфильтрованным сульфидом свинца (II) или бария:
PbS черный +4 H2O2 → PbSO4белый↓ + 4H2O –
изменение цвета осадка или
доокислением сернистой
кислоты в серную:
H2O2
+ H2SO3 → H2O + H2SO4
2) При
взаимодействии с более сильными окислителями перекись водорода проявляет
восстановительные свойства (количественное определение перекиси
водорода в растворе)
2KMnO4
+ 3H2SO4 + 5H2O2 → 2MnSO4
+K2SO4 +5O2 +8H2O
ОКИСЛИТЕЛЬНЫЕ
СВОЙСТВА Н2О2 ПРОЯВЛЯЕТ В БОЛЬШЕЙ СТЕПЕНИ, ЧЕМ
ВОССТАНОВИТЕЛЬНЫЕ.
3.
Образование
аддитивных соединений
Молекула перекиси
может присоединяться как целое к другой молекуле с образованием
пероксигидратов, аналогичных гидратам:
H2O2 + 2Na2CO3 → 2Na2CO3*3H2O2
Прописать
уравнения реакций по прописи эксперимента.
1. К нитрату
серебра приливают раствор аммиака, а затем по каплям добавляют 3% раствор
перекиси водорода. Выпадает темный осадок.
2. К
раствору ванадата натрия, подкисленного серной кислотой, добавляют по каплям
3% раствор перекиси водорода. Раствор окрашивается в розово-коричневый цвет
(образование пероксованадиевой кислоты HVO4)
3. В пробирку
с раствором сульфата титана (IV) внести по каплям растворы серной
кислоты и перекиси водорода. Появится желто-оранжевое окрашивание раствора
пероксотитановой кислоты (
H4TiO5).
Закончить
уравнения ОВР с участием перекиси водорода.
1. H2O2
+ KMnO4 + H2SO4 →
2. H2O2
+ KMnO4 + KOH →
3. H2O2
+ KMnO4→
4. H2O2
+ KI + H2SO4 →
5. H2O2
+ KI →
6. H2O2
+ Ca(ClO)2 →
7. H2O2
+ Ag2O →
8. H2O2
+ H2SO4 + FeSO4 →
Источник
информации
У.Шамб,
Ч.Сеттерфилд, Р.Вентворс, ПЕРЕКИСЬ ВОДОРОДА, пер с англ, изд. Иностранной
литературы, Москва, 1958
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут.
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr+3.
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2 → N2 + 6H2O
Соединения Cr+3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au+3, KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
Свойства перекиси водорода
15-Апр-2014 | Нет комментариев | Лолита Окольнова
Это вещество продается во всех аптеках, т.е. его может приобрести любой человек. Химик Л. Ж. Тенар считается первооткрывателем «окисленной воды»
Давайте подробно разберем
свойства перекиси водорода
Строение молекулы
- валентность O = 2
- степень окисления O = -1
- молекула полярна
Физические свойства перекиси водорода
жидкое бесцветное вещество без запаха; с «металлическим» привкусом
очень хорошо растворимо в воде, точнее, перекись может смешиваться с H2O в любых соотношениях;
хорошо растворяется в полярных (органических) растворителях).
Химические свойства перекиси водорода
- Часто можно наблюдать, как капелька перекиси водорода «пузырит» — вещество очень легко разлагается на свету — образуется вода и выделяется кислород:
2H2O2 = 2H2O + O2↑
Поэтому перекись нельзя держать открытой на воздухе — со временем в склянке останется только вода.
пероксид водорода проявляет свойства очень слабой кислоты (слабее угольной):
с.о. -1 делает возможным и окислительные — восстановление до O(-2), и восстановительные — окисление до O2, свойства:
|
|
|
В кислой среде H2O2 восстанавливается до H2O: H2O2 +2H(+) +2e(-) = 2H2O KNO2 + H2O2 = KNO3 + H2O В щелочной или нейтральной — до OH-: H2O2 +2e(-)= 2OH(-) 2KI + H2O2 = I2 + 2KOH Если реакция идет с сильными окислителями, то образуется кислород: H2O2-2e(-) = O2 + 2H(+) |
H2O2 + Ag2O -> 2Ag + O2 + H2O Если реакция идет с сильными окислителями, то образуется кислород: H2O2 -2e(-)-> O2 + 2H(+) H2O2 +2OH(-) -2e(-) ->O2 + 2H2O 2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O 3H2O2 + 2KMnO4 = 2MnO2 + 2KOH + 3O2 + 2H2O |
Биологические свойства перекиси водорода
— безвредное для организма противомикробное средство, дезинфицирующее средство
Методы получения:
- лабораторный:
- промышленный:
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель, в аналитической химии, в медицине — как антисептик, в производстве дезинфицирующих и отбеливающих средств.
Перекись водорода применяется также для обесцвечивания волос (пергидроль) и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
Обсуждение: «Свойства перекиси водорода»
(Правила комментирования)
Все химические уравнения с пероксидом водорода
Добро пожаловать, Гость!
Готовимся к сдаче ЕГЭ по химии
Пероксид водорода
Пероксид водорода (перекись водорода), H2O2
— простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2 • 2H2O.
Строение молекулы
Молекула Н2O2 содержит в своем составе пероксидный анион O2 -2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
H +1 -O -1 -O -1 -H +1
Физические свойства
В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см 3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства
Разложение Н2O2 (диспропорционирование)
2O -1 — 2e — → O2 0
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме:
(Кдисс = 1,5 * 10 -12 при 20°С)
Кислотные свойства проявляются в реакциях со щелочами с образованием солей — средних (пероксидов) и кислых (гидропероксидов), например:
Гидролиз пероксидов металлов
Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2:
Получение Н2O2 из пероксидов металлов
Так как Н2O2 — очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например:
Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде:
Правила составления окислительно-восстановительных реакций
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут .
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr +3 .
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2  → N2 + 6H2O
Соединения Cr +3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au +3 , KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
Химия, Биология, подготовка к ГИА и ЕГЭ
Это вещество продается во всех аптеках, т.е. его может приобрести любой человек. Химик Л. Ж. Тенар считается первооткрывателем «окисленной воды»
Давайте подробно разберем
свойства перекиси водорода
Строение молекулы
- валентность O = 2
- степень окисления O = -1
- молекула полярна
Физические свойства перекиси водорода
жидкое бесцветное вещество без запаха; с «металлическим» привкусом
очень хорошо растворимо в воде, точнее, перекись может смешиваться с H2O в любых соотношениях;
хорошо растворяется в полярных (органических) растворителях).
Химические свойства перекиси водорода
- Часто можно наблюдать, как капелька перекиси водорода «пузырит» — вещество очень легко разлагается на свету — образуется вода и выделяется кислород:
Поэтому перекись нельзя держать открытой на воздухе — со временем в склянке останется только вода.
пероксид водорода проявляет свойства очень слабой кислоты (слабее угольной):
с.о. -1 делает возможным и окислительные — восстановление до O(-2), и восстановительные — окисление до O2, свойства:
Окислительные свойства перекиси водорода
Восстановительные свойства перекиси водорода
В кислой среде H2O2 восстанавливается до H2O:
В щелочной или нейтральной — до OH-:
Если реакция идет с сильными окислителями, то образуется кислород:
Если реакция идет с сильными окислителями, то образуется кислород:
Биологические свойства перекиси водорода
— безвредное для организма противомикробное средство, дезинфицирующее средство
Методы получения:
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель, в аналитической химии, в медицине — как антисептик, в производстве дезинфицирующих и отбеливающих средств.
Перекись водорода применяется также для обесцвечивания волос (пергидроль) и отбеливания зубов, однако эффект в обоих случаях основан на окислении, а следовательно, разрушении тканей, и потому такое применение (особенно в отношении зубов) не рекомендуется специалистами.
источники:
http://chemrise.ru/theory/inorganic_11/rules_hydrogen_peroxide_11
http://distant-lessons.ru/svojstva-perekisi-vodoroda.html