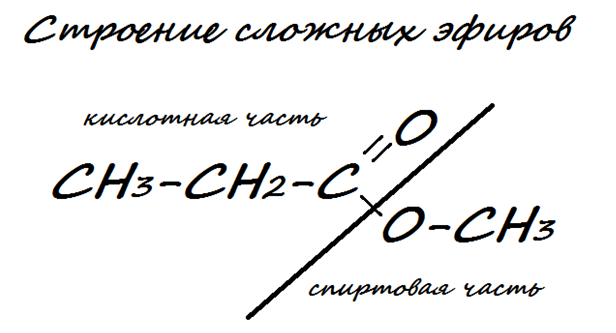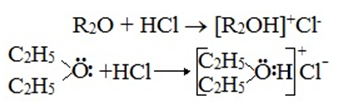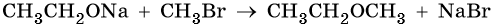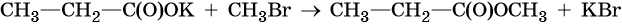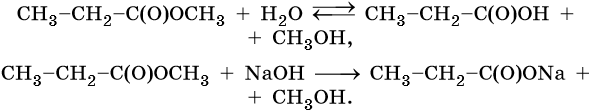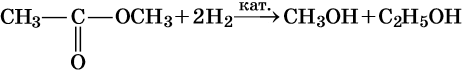…
Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
Получение простых эфиров
- Реакция Вильямсона – взаимодействие галогенированных углеводородов с алкоголятами:
При этом способе получения используются первичные реагирующие соединения.
- Межмолекулярная дегидратация спиртов протекает под действием окиси алюминия и температуре 300°С или серной кислоты как дегидратирующего агента. В результате получают симметричные простые эфиры, например, по этому принципу получают серный эфир (диэтиловый эфир):
Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
- Каталитическое присоединение спиртов к олефинам или алкинам:
При присоединении спиртов к алкинам образуются виниловые эфиры:
- Оксимеркурирование алкенов протекает в несколько стадий. Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Физические свойства
Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными.
Растворимость простых эфиров
Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
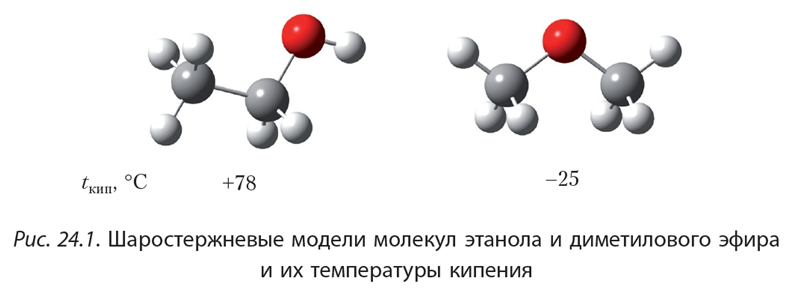
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.
Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
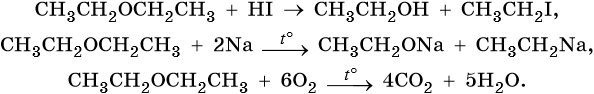
Под действием концентрированных йодоводородной или бромоводородной кислот:
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
Под действием серной кислоты:
- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):
Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
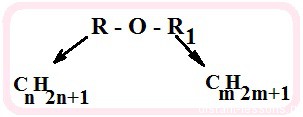
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
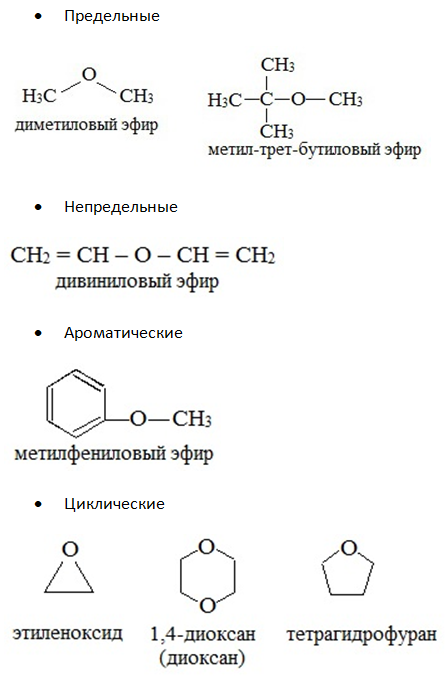
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
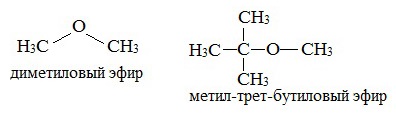
непредельные
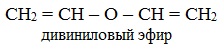
ароматические

циклические
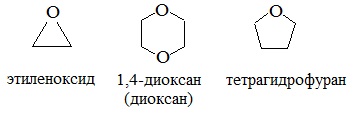
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
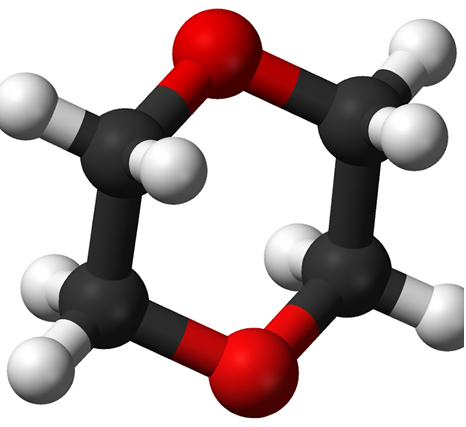
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
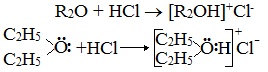
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
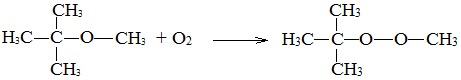
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
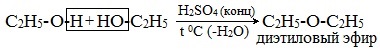
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):
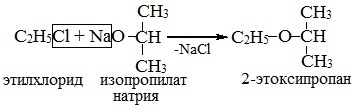
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры)
этиленоксид (эпоксид)

диоксан
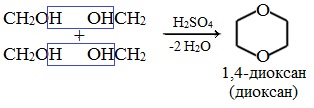
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Химические свойства фенолов
План урока:
Строение простых эфиров
Номенклатура простых и сложных эфиров
Изомерия простых и сложных эфиров
Классификация простых и сложных эфиров
Способы получения простых и сложных эфиров
Физические свойства простых и сложных эфиров
Химические свойства простых и сложных эфиров
Применение простых и сложных эфиров
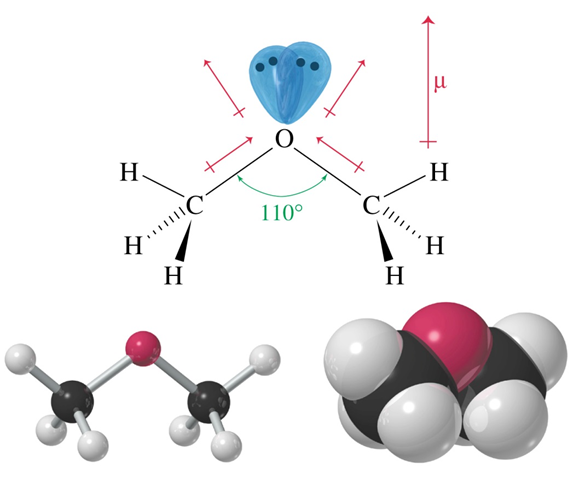
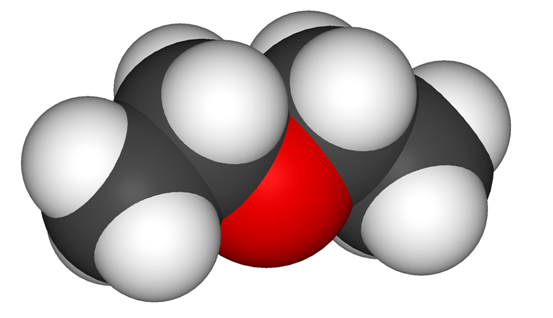
Строение простых эфиров
Для атомов углерода насыщенных простых эфиров характерно состоянии sp3-гибридизации, а в ненасыщенных соединениях – sp2-гибридизации.
Строение молекулы диметилового эфира
Номенклатура эфиров
Если в простых эфирах R и R’ идентичны, то молекула симметрична, а если различны, то молекула несиметрична. Согласно международной номенклатуре названия простых эфиров формируются с помощью суффикса «-овый» и слова «эфир».
Например, симметричная молекула С2Н5-О-С2Н5 называется диэтиловым эфиром.
В несимметричной молекуле радикалы располагаются по алфавиту. Например, молекула СН3-О-С2Н5 называется метилэтиловым эфиром.
Согласно систематической номенклатуре в сложных эфирах в спиртовом радикале суффикс заменяется на «-оат». В названиях сложных эфиров присутствуют название кислотного аниона и спиртового радикала.
Строение сложных эфиров
Например, C2H5-C(O)O-CH3 – метилэтаноат. С2Н5-С(О)О-С2Н5 – этилэтаноат.
Название соединения в тривиальной номенклатуре формируется названием спиртового радикала, слова «эфир» и названием кислоты.
Например, C2H5-C(O)O-CH3 также можно назвать как метиловый эфир этановой кислоты, а С2Н5-С(О)О-С2Н5 — этиловый эфир этановой кислоты.
Изомерия эфиров
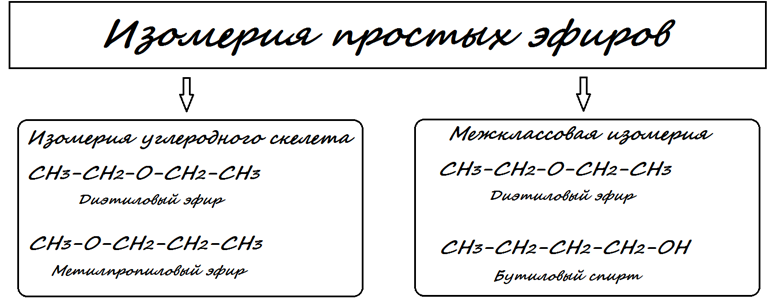
Изомерия простых эфиров
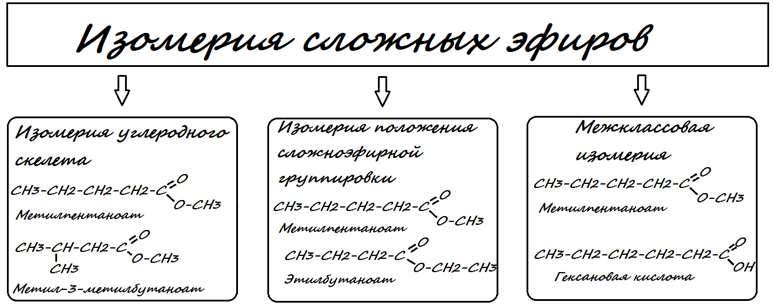
Изомерия сложных эфиров
Классификация эфиров
Виды простых эфиров
Простые эфиры классифицируются по строению углеводородного скелета.
Виды сложных эфиров
Сложные эфиры классифицируются на несколько видов.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами
С5Н11-С(О)О-СН3 – метиловый эфир пентановой кислоты
С2Н5-С(О)О-С3Н7 – пропиловый эфир этиловой кислоты
- Сложные эфиры, образованные высшими карбоновыми кислотами и спиртами
СН3-(СН2)14-С(О)О-(СН2)29-СН3 – мирициловый эфир пальмитиновой кислоты (один из компонентов пчелиного воска)
СН3-(СН2)14-С(О)О-(СН2)15-СН3 – цетиловый эфир пальмитиновой кислоты (основной компонент спермацета)
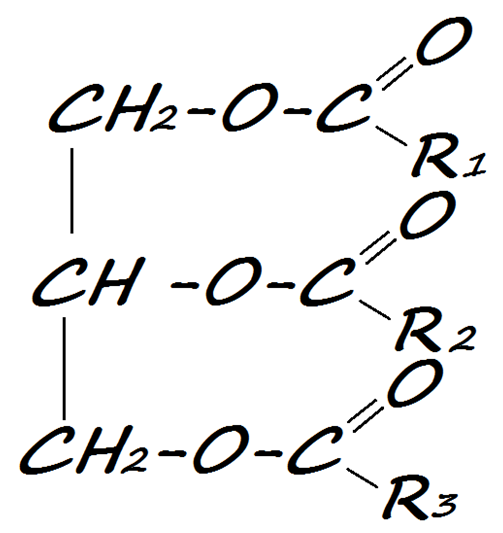
- Жиры
Жиры отличаются от других представителей класса тем, что они образованы от глицерина ОН-СН2-СН(ОН)-СН2-ОН.
Общая формула жиров
Способы получения простых и сложных эфиров
Получение простых эфиров
Простые эфиры не встречаются в природе, но есть множество химических способов получения эфиров.
- Дегидратация между молекулами спиртов
С помощью этого способа получают симметричные молекулы. Реакция дегидратации (отщепления молекулы воды) протекает в присутствии минеральной кислоты и при нагревании.
C5H11-OH + HO-C5H11 → C5H11-O-C5H11 + Н2О
- Реакция Вильямсона (взаимодействие галогенпроизводных с алкоголятами)
С помощью этого метода можно синтезировать несимметричные молекулы.
С2Н5ONa + C3H7Cl → C2H5-O-C3H7 + NaCl
- Окисление алкенов
Данным способом можно получать циклические соединения класса. Для проведения реакции необходимо нагревание и наличие катализатора.
Способ получения сложных эфиров
Реакция этерификации протекает в присутствии минеральной кислоты.
CH3-COOH + C2H5OH → CH3-C(O)O-C2H5 + H2O
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Для простых эфиров не характерно твердое состояние. Диметиловый эфир и метилэтиловый эфир – газы, а все остальные представители класса находятся в жидком состоянии. Простые эфиры кипят при более низких температурах, по сравнению со спиртами. Также им характерен приятный и сладкий запах.
Диэтиловый эфир – бесцветная жидкость, кипящая при температуре 35,5˚С. Он малорастворим в воде, но хорошо растворим в этиловом спирте. Температура воспламенения – 9,4˚С. При взаимодействии с воздухом образуется взрывоопасная смесь. Используется как растворитель. Это ядовитое вещество, которое опасно тем, что вызывает привыкание.
Диэтиловый эфир
Диоксан – хороший растворитель, из-за чего его иногда называют «органической водой». Температура кипения – 101˚С. Диоксан токсичен и ядовит.
1,4-диоксан
Простые эфиры не растворимы в воде. Эта особенность связана с неспособностью образовывать водородные связи. Простые эфиры – отличные растворители.
Физические свойства сложных эфиров
Сложные эфиры, образованные от низших карбоновых кислот и спиртов, находятся в жидком состоянии. Они обладают приятными запахами и не растворяются в воде. Приятные цветочные и плодовые запахи обусловлены наличием сложных эфиров.
У сложных эфиров более низкие температуры плавления и кипения, чем у карбоновых кислот. Эта особенность связана с отсутствием межмолекулярных водородных связей.
Сложные эфиры, образованные от высших карбоновых кислот и спиртов – воски. У них отсутствуют запахи. Также они совсем не растворимы в воде, но растворимы в органических растворителях. Воски бывают растительными, животными, ископаемыми и синтетическими.
Соты из пчелиного воска
Растительные воски можно встретить на поверхностях листовых пластин, стеблей, плодов. Они защищают от проникания лишней воды, высыхания, попадания микроорганизмов. Наиболее популярный животный воск – пчелиный. Из него насекомые строят соты. Также животный воск находится на шерсти животных. Он предотвращает попадание избыточной влаги на кожу.
Ланолин (воск шерсти животных)
Представитель ископаемых восков – горный воск, который представляет собой минерал из группы нефтяных битумов. Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Химические реакции простых и сложных эфиров
Химические реакции простых эфиров
- Взаимодействие с йодоводородной (HI) или бромоводородной (HBr) кислотой
Под действием концентрированной кислоты происходит разложение простого эфира.
R-O-R’ + HI →R-OH + R’-I
- Взаимодействие с соляной кислотой (HCl)
В результате данной реакции образуются нестойкие соли оксония.
- Взаимодействие с кислородом (окисление)
При хранении простых эфиров на воздухе образуются перекиси.
CH3-O-CH3 + O2→ CH3-O-O-CH3
Из-за образованных перекисей в процессе перегонки эфира может произойти взрыв, поэтому особенно важно очищать эфиры перед началом работы.
Химические реакции сложных эфиров
Химические реакции сложных эфиров обусловлены нуклеофильной атакой по атому углерода, находящимся в карбонильной группе, и замещением алкоксигруппы.
- Взаимодействие с водой (гидролиз)
При кислотном гидролизе сложный эфир превращается в исходную карбоновую кислоту и спирт. Реакция проходит в присутствии минеральной кислоты.
CH3-C(O)O-C2H5 + H2O → CH3COOH + C2H5OH
При щелочном гидролизе образуются соль карбоновой кислоты и спирт. Данная реакция необратима.
CH3-C(O)O-C2H5 + NaOH→ CH3-C(O)ONa + C2H5OH
Следует обратить внимание на то, что кислотный гидролиз обратим.
- Взаимодействие с водородом (гидрирование, или восстановление)
В процессе гидрирования образуются две молекулы спирта. Реакция идет при наличии катализатора.
C2H5-C(O)O-C2H5 + 2H2→ 2C2H5OH
CH3-C(O)O-C2H5 + 2H2→ CH3OH + C2H5OH
- Взаимодействие с аммиаком
При взаимодействии сложных эфиров и аммиака образуются амиды кислот и спирты.
C2H5-C(O)O-C3H7 + NH3→ C2H5-C(O)NH2 + C3H7OH
- Взаимодействие с кислородом (горение)
2СН3-С(О)О-СН3 + 7О2→2СО2 + 6Н2О
Применение эфиров
Простым эфирам характерна химическая инертность, поэтому они могут играть роль растворителя. Эфиры с разветвленными радикалами применяются в качестве антидетонационных добавок в моторных топливах. Также благодаря приятным запахам их можно встретить в парфюмерной продукции.
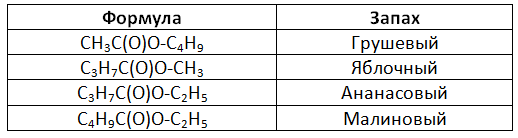
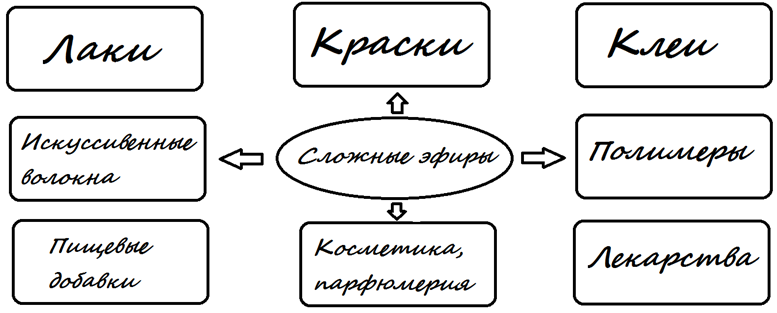
Сложные эфиры используются в парфюмерной, косметической продукции, пищевой промышленности, производстве лаков, красок, клеев и лекарственных препаратов. Также они могут выступать в роли растворителей.
Применение сложных эфиров.
Из сложных эфиров низших карбоновых кислот и спиртов, производят различные эссенции, а от ароматических спиртов – парфюмерную продукцию. Воски входят в состав смазочных веществ, кремов и мазей.
В XIX-ХХ веках ученые получили и изучили сложные эфиры, которые легли в основу многих лекарств. В число препаратов из эфиров входят салол, валидол. Раньше в качестве обезволивающего средства использовался метилсалицилат, который на современном рынке вытеснен другими эффективными лекарственными препаратами.
Простые эфиры
21-Дек-2012 | Нет комментариев | Лолита Окольнова
Простые эфиры
Общая формула:
CxH2x+2O
По этой формуле может быть 2 варианта эфиров:
n = m
CH3 — O — CH3
Тогда номенклатура эфира становится очень простой: приставка ди-, потом название радикала, суффикс -овый и слово эфир:
СH3-O-CH3 — диметиловый эфир
C2H5 — O — C2H5 — диэтиловый эфир
n ≠ m
В таком случае пишем названия радикалов в алфавитном порядке, добавляем суффикс -овый и слово эфир:
CH3 — O — C2H5 — метилэтиловый эфир
С6Н5 — O — СH3 — метилфениловый эфир
Изомерия простых эфиров:
- Изомерия углеродного скелета: изменения в структуре радикалов дают разные изомеры
- Межклассовая изомерия — простые эфиры изомерны одноатомным спиртам
Простые Эфиры.
Физические свойства
- Это летучие жидкости (очень легко переходят в газообразное состояние).
- Практически не растворимы в воде. Это объясняется тем, что простые эфиры не образуют водородных связей.
- Являются хорошими органическими растворителями
- Зачастую обладают приятными запахами
Химические свойства
Простые эфиры очень инертные вещества.
- не подвергаются гидролизу
- При нагревании выше 100 ºС реагирует с HBr или HJ:
C6H5-O-CH3 + HBr → C6H5OH + CH3Br
почему образовался фенол, а не метанол? Вспомните свойства фенолов. Бензольному кольцу так не хватает электронов, что итог реакции очевиден — бензольное кольцо «отхватит» -OH -группу себе.
Получение простых эфиров
Простые эфиры применимы и в медицине. Например, диэтиловый эфир C2H5 — O — C2H5 — это вещество, которое входит в состав наркоза.
Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом. Эфир для наркоза содержит 96–98% диэтилового эфира. Эфирный наркоз отличается хорошей контролируемостью и управляемостью.
Диметиловый эфир CH3 — O — CH3 — используется при удалении бородавок, а в Китае -это возможная альтернатива дизельному топливу.
в ЕГЭ это вопрос А16 — Rислородсодержащие органические соединения
Обсуждение: «Простые эфиры»
(Правила комментирования)
Простые и сложные эфиры
Простыми эфирами называют класс химических соединений, в которых два углеводородных радикала связаны между собой атомом кислорода (кислородным мостиком). В общем виде формула простых эфиров R—O—R1, где R и R1 — углеводородные радикалы. Для этого класса соединений характерны структурная изомерия, а также межклассовая изомерия со спиртами.
Простые эфиры образуются при межмолекулярной дегидратации спиртов, а также при взаимодействии алкоголятов с галоидными алкилами, например:
Простые эфиры химически инертны. Их характерные реакции на примере диэтилового эфира:
Пары диэтилового эфира пожаро- и взрывоопасны.
Сложными эфирами называют класс химических соединений, который отвечает общей формуле R—C(O)O—R1, где R и R1 — углеводородные радикалы. Таким образом, сложные эфиры можно рассматривать как производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, или производные спиртов, в которых атом водорода гидроксильной группы замещен на кислотный остаток карбоновой кислоты.
Сложные эфиры образуются в результате реакции этерификации (урок 25). При этом следует отметить, что при одной и той же кислоте скорость этерификации первичных спиртов в два раза выше, чем у вторичных и во много раз превосходит третичные.
Кроме того, сложные эфиры можно получить в результате взаимодействия солей карбоновых кислот с галоидными алкилами:
Для сложных эфиров характерны изомерия углеводородных радикалов кислот и спиртов, составляющих сложный эфир, а также межклассовая изомерия с карбоновыми кислотами. Ниже приведены реакции, иллюстрирующие характерные химические свойства сложных эфиров.
1. Кислый или щелочной гидролиз:
2. Реакция переэтерификации (идет в том случае, если брать избыток спирта и отгонять образующийся более легкокипящий спирт):
3. Восстановление:
Классификация простых эфиров:
предельные
непредельные
ароматические
циклические
Номенклатура
Простые эфиры — производные спиртов.
Названия образуются из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир».
Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при н.у. газы, все остальные – жидкости.
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Практически не смешиваются с водой, так как не образуют водородных связей.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители, имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением
Сложные эфиры
Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2.
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
Например, метилформиат
H-COO-CH3
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
Например, тристеарат глицерина

- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (—овая кислота) на суффикс —оат.
Химические свойства сложных эфиров
1. Гидролиз
Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей.
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например, при гидролизе метилацетата образуются уксусная кислота и метанол.

При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например, при щелочном гидролизе этилформиата образуются этанол и формиат натрия:

При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров древнейший способ получения мыла, основан на смешивании жира с золой. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:

2. Переэтерификация
Переэтерификация — превращение одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3. Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы.
В реакции этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола
C6H5-COO-C2H5 + [H] = C6H5-CH2OH + C2H5-OH
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.