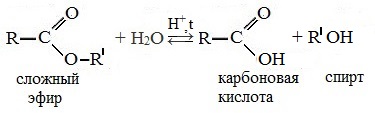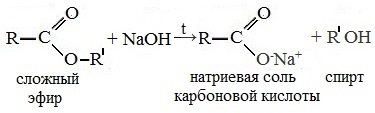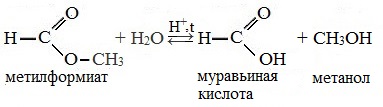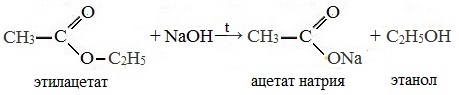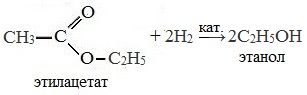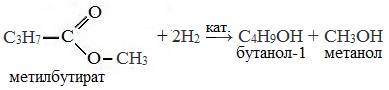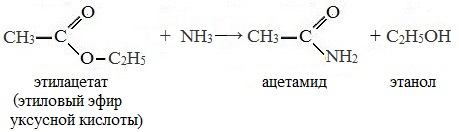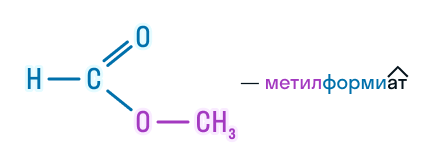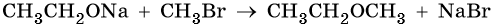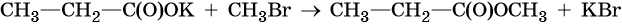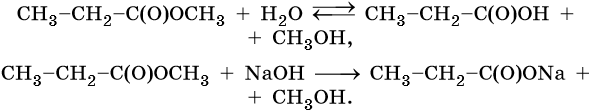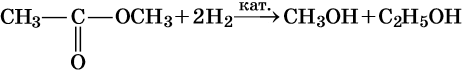Сложные эфиры: способы получения, химические и физические свойства, строение.
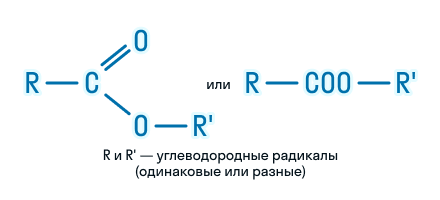
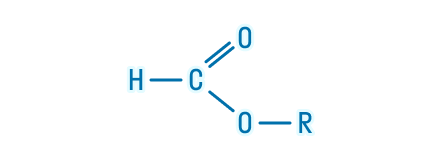
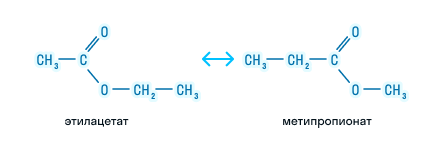
Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2.
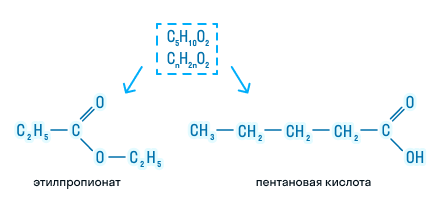
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
H-COO-CH3
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
Например, тристеарат глицерина
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Номенклатура сложных эфиров
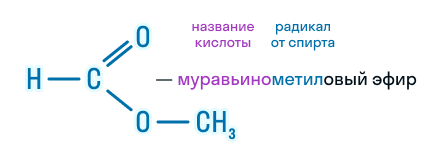
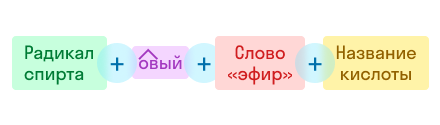
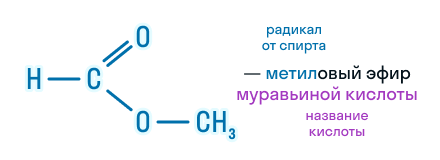
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
.1. Гидролиз
Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей.
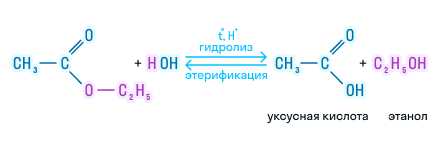
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например, при гидролизе метилацетата образуются уксусная кислота и метанол.
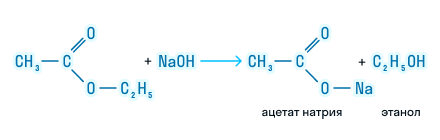
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например, при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
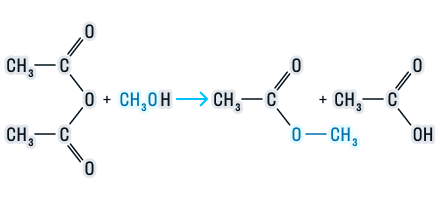
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола
C6H5-COO-C2H5 + [H] = C6H5-CH2OH + C2H5-OH
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
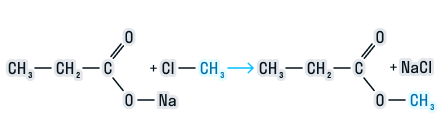
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат.
CH3-COONa + CH3-Cl = CH3-COOCH3 + NaCl
Например, при взаимодействии формиата натрия с хлорэтаном образуется этилформиат.
H-COONa + C2H5-Cl = H-COOC2H5 + NaCl
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
АЛЬДЕГИДЫ — органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Общая формула
КЕТОНЫ — соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула:
ФИЗИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
Формальдегид представляет собой газообразное при комнатной температуре вещество.
Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами.
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается.
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий. Ацетон — летучая жидкость, плохо растворимая в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ.
РЕАКЦИИ ПРИСОЕДИНЕНИЯ ПО С=О СВЯЗИ
1. Гидрирование (восстановление)
Альдегиды при взаимодействии с водородом в присутствии Ni образуют первичные спирты, кетоны — вторичные:
2. Присоединение воды – образуются гидраты (реакция обратима) :
3. Присоединение циановодородной (синильной) кислоты НСN — образуются оксинитрилы:
4.Присоединение спиртов → полуацетали (катализатор — кислота или основание).
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к образованию ацеталя (две алкоксильные группы):
5. Реакция полимеризации → при длительном стоянии
Образуется осадок белого цвета – параформальдегид (с n= 8-10)
6. Реакция тримеризации → из формальдегида образуется
циклическое вещество триоксан, из уксусного альдегида — паральдегид
7. Реакция поликонденсации → образуются полимеры
Из формальдегида с фенолом → фенолформальдегидная смола.
(катализаторы — кислоты или основания) .
РЕАКЦИЯ ЗАМЕЩЕНИЯ КАРБОНИЛЬНОГО КИСЛОРОДА
1.Взаимодействие с пентахлоридом фосфора — образуются дихлоралканы
ОКИСЛЕНИЕ АЛЬДЕГИДОВ.
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием мягких окислителей:
оксид серебра (аммиачный раствор) и гидроксид меди (II).
Данные реакции являются качественными на альдегидную группу
1. Реакция «серебряного зеркала« – окисление аммиачным раствором оксида серебра — качественная реакция №1 (серебряный налет на поверхности пробирки).
При
подкислении реакционной смеси образуются соли аммония карбоновых кислот, которые подвергаются гидролизу
При окислении муравьиного альдегида образуется карбонат аммония, при гидролизе дающий углекислый газ.
2. Окисление гидроксидом меди (II) → образуются кислоты. Качественная реакция №2 ( голубой осадок гидроксида меди при нагревании переходит в красно-кирпичноый осадок Cu2O)
3. Окисление кетонов.
Кетоны значительно более устойчивы к окислению, чем альдегиды, т. к. рядом с карбонильной группой у них нет атома водорода.
Сильные окислители, такие как перманганат калия и азотная кислота окисляют кетоны с разрывом углеродной цепи до кислот:
4. Горение альдегидов и кетонов → углекислый газ и вода
СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Общая формула одноосновных карбоновых кислот предельного ряда: СnH2n+1COOH, или СnH2nO2.
Простейшая карбоновая кислота – муравьиная, не содержит радикала.
ФИЗИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом.
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты.
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя.
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1. Простейшие карбоновые кислоты в водном растворе диссоциируют на ионы:
КИСЛОТНЫЕ СВОЙСТВА
ЗАМЕЩЕНИЕ АТОМА Н В КАРБОКСИЛЬНОЙ ГРУППЕ НА МЕТАЛЛ ИЛИ ИОН АММОНИЯ.
2.Взаимодействие с металлами → соли карбоновых кислот +H2↑
Реагируют с металлами, стоящими в ряду активности до водорода.
Самая сильная кислота — муравьиная.
3.Взаимодействие с оксидами металлов → соль + H2O
4.Реакция нейтрализации с гидроксидами металлов → соль + H2O
5.Взаимодействие с солями более слабых и летучих кислот → соль + газ
II. ЗАМЕЩЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ:
1.Реакция этерификации – образуются сложные эфиры
Высшие карбоновые кислоты с глицерином образуют сложные эфиры — жиры.
2.Взаимодействие с хлоридами фосфора (III) И (V) — образование галогенангидридов
3. Взаимодействие с аммиаком — образование амидов.
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из λ-аминокислот с участием амидных групп — пептидных связей
4. Взаимодействие с оксидом фосфора — получение ангидридов карбоновых кислот.
С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид.
III. ЗАМЕЩЕНИЕ АТОМА ВОДОРОДА ПРИ АТОМЕ УГЛЕРОДА, БЛИЖАЙШЕМ К КАРБОКСИЛЬНОЙ ГРУППЕ
1.Галогенирование кислот — замещение атомов водорода в радикале (реакция идёт в присутствии красного фосфора или на свету).
ОКИСЛЕНИЕ
1. Горение в атмосфере кислорода (образуется углекислый газ и вода):
ОСОБЕННОСТИ МУРАВЬИНОЙ КИСЛОТЫ
1. Разложение при нагревании — образуется угарный газ и вода.
2. Реакция «серебряного зеркала» и взаимодействие с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов.
3. Окисление галогенами и азотной кислотой — образуется углекислый газ.
ОСОБЕННОСТИ ЩАВЕЛЕВОЙ КИСЛОТЫ.
1. Разложение при нагревании — образуется углекислый газ, угарный газ и вода.
2. Разложение при 150C — образуется муравьиная кислота:
3. Окисление перманганатом калия — образуется угольная кислота
4. Взаимодействие с щелочами — образуется кислая соль, затем средняя:
5. Образование нерастворимого осадка оксалата кальция при добавлении к раствору кислоты растворимых солей кальция (обнаружения кальция или щавелевой кислоты):
ОСОБЕННОСТИ НЕПРЕДЕЛЬНЫХ КИСЛОТ (АКРИЛОВОЙ И ОЛЕИНОВОЙ).
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Присоединение воды и галогеноводородов к акриловой кислоте идет против правила Марковникова.
2. Присоединение галогенов и водорода:
1. При мягком окислении акриловой кислоты: образуется 2 гидроксогруппы:
Под действием жесткого окислителя двойная связь рвется с образованием из осколков молекулы кислот и/или кетонов:
ОСОБЕННОСТИ БЕНЗОЙНОЙ КИСЛОТЫ
Проявляет свойства карбоновых кислот и ароматических углеводородов
СВОЙСТВА СОЛЕЙ КАРБОНОВЫХ КИСЛОТ.
1. Обменные процессы с более сильными кислотами и щелочами.
2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария) — образуются кетоны.
3. Сплавление солей щелочных металлов с щелочами — образуются алканы и карбонаты (реакция Дюма).
4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе) — образуются алканы.
СВОЙСТВА ГАЛОГЕНАНГИДРИДОВ
1. При гидролизе образуются соответствующие кислоты
2. Взаимодействие бензола, аминов, фенола с галогенангидридами — образуются кетонные соединения.
СВОЙСТВА СЛОЖНЫХ ЭФИРОВ
Соединения, образующиеся в результате реакции этерификации (взаимодействия карбоновых кислот со спиртами.
Общая формула:
ФИЗИЧЕСКИЕ СВОЙСТВА.
Сложные эфиры — бесцветные жидкости, малорастворимые или совсем не растворимые в воде, обладают специфическим запахом (в малых концентрациях — приятным, часто фруктовым или цветочным).
Сложные эфиры высших спиртов и высших кислот — твердые вещества.
ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ (бывает кислотный и щелочной).
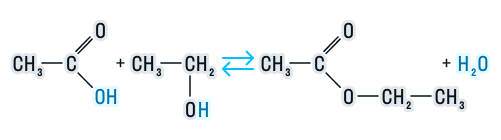
1 Кислотный гидролиз ведет к образованию кислоты и спирта, обратим:
2. Щелочной гидролиз ведет к образованию соли карбоновой кислоты (мыло) и спирта, поэтому эту реакцию называют омылением. Процесс необратим.
ВОССТАНОВЛЕНИЕ СЛОЖНЫХ ЭФИРОВ.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов
Взаимодействие с аммиаком — образование амидов
15(Б) Тесты ЕГЭ ФИПИ 2015 Альдегиды. Кетоны. Карбоновые кислоты
Химические свойства сложных эфиров
Большинство реакций сложных эфиров связано с нуклеофильной атакой по карбонильному атому углерода и замещением алкоксигруппы.
1. Реакция гидролиза (омыления)
Сложные эфиры легко гидролизуются (омыляются) на исходный спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль).
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
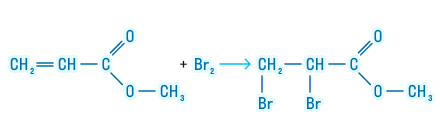
2. Реакция присоединения
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
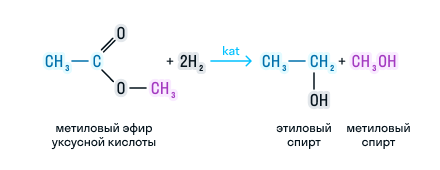
3. Реакция гидрирования (восстановления)
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
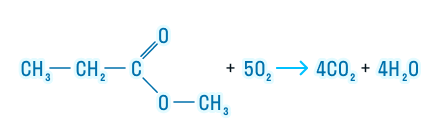
5. Реакция горения
Горение сложных эфиров происходит с образованием углекислого газа и воды:
Сложные эфиры
3.6. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
Сложные эфиры или эсте́ры (от древнегреческого αἰθήρ — «эфир») — это класс соединений на основе неорганических (минеральных) или органических (карбоновых) одно- или многоосновных кислот, у которых атом водорода в гидроксогруппе замещен на радикал. Эпитет «сложные» они получили для того, чтобы их не путали с простыми эфирами — производными спиртов.
Общая формула сложных эфиров выглядит так:
Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:
Номенклатура сложных эфиров
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
-
По номенклатуре ИЮПАК название строится следующим образом:
Например:
-
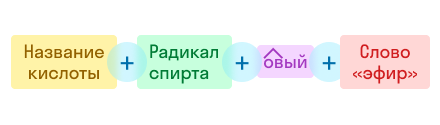
По рациональной номенклатуре название строится так:
Например:
По этой же номенклатуре эфиры можно называть, используя четыре слова: радикал спирта + слово «эфир» + название кислоты + слово «кислота». Например, муравьинометиловый эфир можно иначе назвать метиловый эфир муравьиной кислоты:
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
-
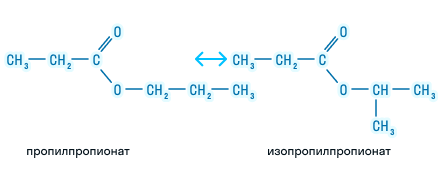
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.
-
Изомерия положения функциональной группы:
-
Межклассовая изомерия также определяется общей формулой органических соединений. Например:
Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Химические свойства сложных эфиров
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
-
В кислой среде реакция протекает следующим образом:
Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.
-
Щелочной гидролиз или реакция омыления:
Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:
Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:
Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:
Способы получения сложных эфиров
-
Реакция этерификации.
Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
-
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.
-
Взаимодействие солей карбоновых кислот с галогеналканами.
Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.
Простые и сложные эфиры
Простыми эфирами называют класс химических соединений, в которых два углеводородных радикала связаны между собой атомом кислорода (кислородным мостиком). В общем виде формула простых эфиров R—O—R1, где R и R1 — углеводородные радикалы. Для этого класса соединений характерны структурная изомерия, а также межклассовая изомерия со спиртами.
Простые эфиры образуются при межмолекулярной дегидратации спиртов, а также при взаимодействии алкоголятов с галоидными алкилами, например:
Простые эфиры химически инертны. Их характерные реакции на примере диэтилового эфира:
Пары диэтилового эфира пожаро- и взрывоопасны.
Сложными эфирами называют класс химических соединений, который отвечает общей формуле R—C(O)O—R1, где R и R1 — углеводородные радикалы. Таким образом, сложные эфиры можно рассматривать как производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, или производные спиртов, в которых атом водорода гидроксильной группы замещен на кислотный остаток карбоновой кислоты.
Сложные эфиры образуются в результате реакции этерификации (урок 25). При этом следует отметить, что при одной и той же кислоте скорость этерификации первичных спиртов в два раза выше, чем у вторичных и во много раз превосходит третичные.
Кроме того, сложные эфиры можно получить в результате взаимодействия солей карбоновых кислот с галоидными алкилами:
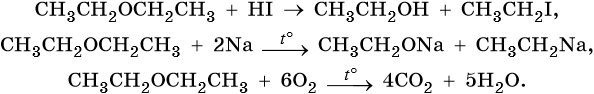
Для сложных эфиров характерны изомерия углеводородных радикалов кислот и спиртов, составляющих сложный эфир, а также межклассовая изомерия с карбоновыми кислотами. Ниже приведены реакции, иллюстрирующие характерные химические свойства сложных эфиров.
1. Кислый или щелочной гидролиз:
2. Реакция переэтерификации (идет в том случае, если брать избыток спирта и отгонять образующийся более легкокипящий спирт):
3. Восстановление:
Важнейшими представителями сложных эфиров являются жиры.
Жиры, масла
Жиры
– это сложные эфиры глицерина и высших одноатомных
карбоновых кислот
. Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты -C(O)R. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C
15
H
31
COOH, стеариновой C
17
H
35
COOH) и ненасыщенных (олеиновой C
17
H
33
COOH, линолевой C
17
H
31
COOH). Высшие карбоновые кислоты, которые входят в состав жиров имеют всегда четное количество атомов углерода (С
8
– С
18
) и неразветвленный углеводородный остаток. Природные жиры и масла – это смеси глицеридов высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:
Этерификация
— реакция образования сложных эфиров.
В состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют
маслами
. В основном, это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла (исключения пальмовое и кокосовое масла – твердые в обычных условиях). Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях – твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например бараний жир.
Состав жиров определяет их физические и химические свойства.
Физические свойства жиров
Жиры нерастворимы в воде, не имеют четкой температуры плавления и значительно увеличиваются в объеме при плавлении.
Агрегатное состояние жиров твердое, это связано с тем, что в состав жиров входят остатки предельных кислот и молекулы жиров способны к плотной упаковке. В состав масел, входят остатки непредельных кислот в cis – конфигурации, следовательно плотная упаковка молекул невозможна, и агрегатное состояние – жидкое.
Химические свойства жиров
Жиры (масла) являются сложными эфирами и для них характерны реакции сложных эфиров.
Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
Гидролиз сложных эфиров- обратимая реакция. Чтобы
сместить равновесие
в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствие щелочей или Na
2
CO
3
). В этих условиях гидролиз жиров протекает обратимо, и приводит к образованию солей карбоновых кислот, которые называются
мылами
.
Гидролиз
жиров в щелочной среде называют
омылением жиров
.
При омылении жиров образуются глицерин и мыла – натриевые и калиевые соли высших карбоновых кислот:
Омыление
– щелочной гидролиз жиров, получение мыла.
Мыла
– смеси натриевых (калиевых) солей высших предельных карбоновых кислот (натриевое мыло – твердое, калиевое — жидкое).
Мыла являются поверхностно-активными веществами (сокращенно: ПАВами, детергентами). Моющее действие мыла связано с тем, что мыла эмульгируют жиры. Мыла образуют мицеллы с загрязняющими веществами (условно — это жиры с различными включениями).
Липофильная часть молекулы мыла растворяется в загрязняющем веществе, а гидрофильная часть оказывается на поверхности мицеллы. Мицеллы заряжены одноименно, следовательно отталкиваются, при этом загрязняющее вещество и вода превращается в эмульсию (практически – это грязная вода).
В воде также происходит
гидролиз
мыла, при этом создается щелочная среда.
Мыла нельзя использовать в жесткой и морской воде, так как образующиеся при этом стеараты кальция (магния) в воде нерастворимы.








![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)