Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4+О2 → 2СО + 4Н2
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
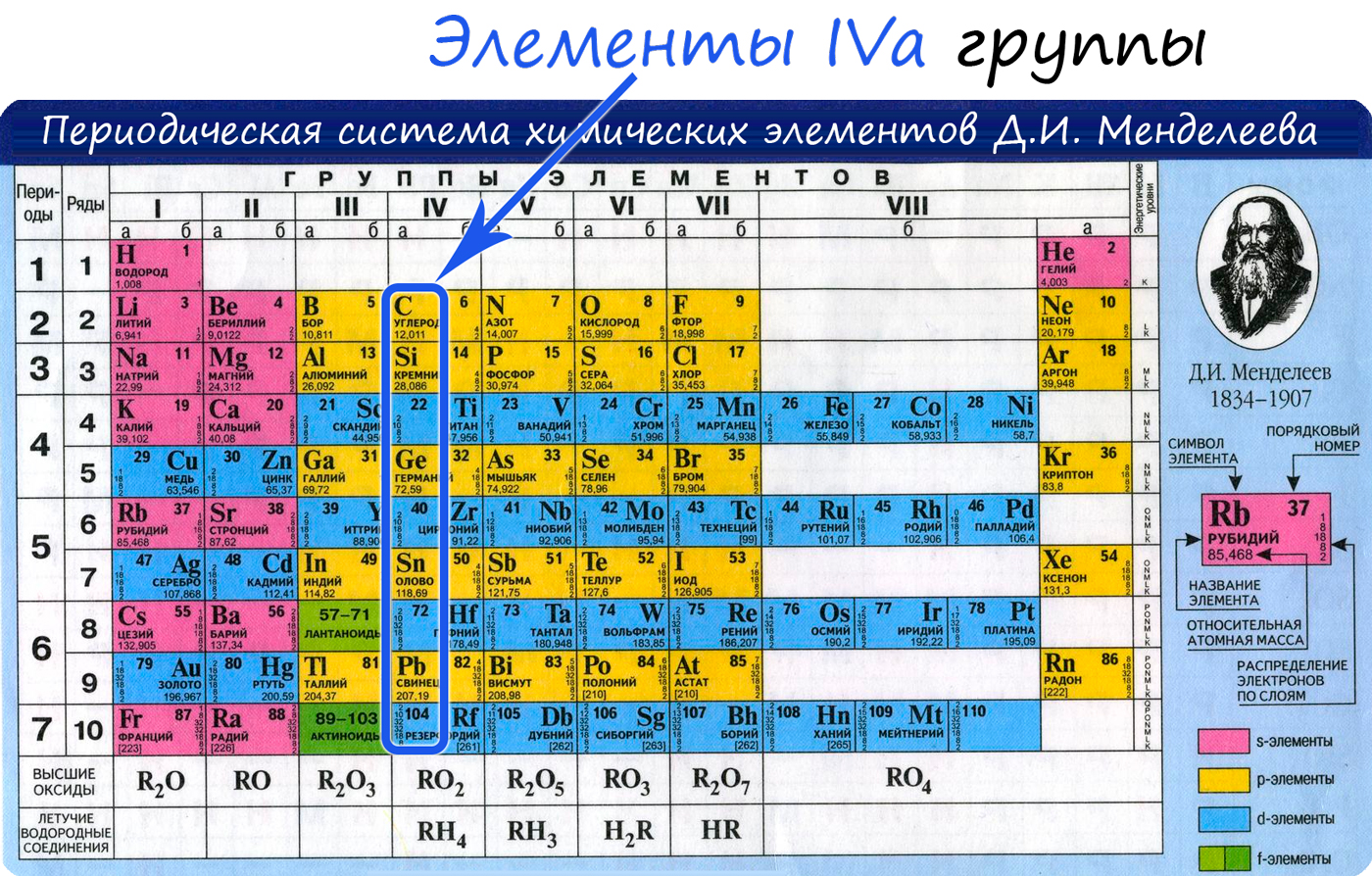
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
…
Монооксид углерода (угарный газ)
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
СН4 + Н2O → СО + 3Н2
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
СН4 + CO2 → 2СО + 2Н2
- горение углерода в недостатке кислорода (неполное окисление углерода):
2C + O2 → 2CO
- неполное окисление метана:
2СН4 + О2 → 2СО + 4Н2
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
НСООН → CO + H2O
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
H2C2O4 → CO + CO2 + H2O
Химические свойства угарного газа
СО – несолеобразующий оксид
- Формально СО
можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при
дегидратации муравьиной кислоты:
НСООН → CO + H2O
А также
образование формиата натрия в реакции с гидроксидом натрия при высоком
давлении:
CO + NaOH → HCOONa
Однако при обычных условиях он не вступает в реакции с
водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов.
Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
2СO + O2→ 2CO2
- Окисляется
хлором в присутствии катализатора или под
действием света с образованием ядовитого газа фосгена:
CO + Cl2 → COCl2
- Окисляется другими сильными окислителями до углекислого газа или
карбонатов:
CO + Na2O2→ Na2CO3
- Восстанавливает
металлы из оксидов (при Т~300 — 1500ºС):
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
4CO + Fe3O4→ 3Fe + 4CO2
- Восстановление
водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
СО + Н2О= CO2 + Н2
- Восстановление некоторых благородных металлов из солей:
СО + PdCl2 + Н2О→ Pd + CO2 + 2HCl
- Взаимодействие с водородом при повышенном давлении. Из синтез-газа (смеси угарного газа и водорода) при определенных условиях (P, T, kt) можно получить метанол, метан, или другие углеводороды:
СО + 2Н2 → СН3ОН
СО + 3Н2 → СН4 +
Н2О
nСО + (2n+1)Н2 → СnН2n+2 + nН2О
- Образование
карбонилов металлов при
нагревании:
4СO + Ni = [Ni(СO)4]
4СO + Fe = [Fe(СO)5]
- Образование
карбоксигемоглобина при
связывании угарного газа с гемоглобином крови подобно кислороду:
HbO2 + CO = HbCO + O2
Этим свойством СО и объясняется его
высокая токсичность для организма человека.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HBr → NaBr +H2O +CO2
- При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO + CO2
2NaHCO3 → Na2CO3 + H2O +CO2
- При сжигании всех видов топлив:
СxHy + O2 = H2O + CO2
- При
спиртовом брожении глюкозы под действием ферментов:
С6H12O6 → 2CO2 + 2C2H5OH
Химические свойства углекислого газа
Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
- Качественная реакция на углекислый газ — помутнение известковой воды:
Ca(OH)2 + CO2 → CaCO3 + H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 + H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
Na2O + CO2 → 2Na2CO3
KOH + CO2 → KHCO3
2KOH + CO2 → K2CO3+ H2O
- С карбонатами, с образованием гидрокарбонатов:
Na2CO3 + CO2+ H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
C6H5OK + CO2+ H2O → C6H5OH + KHCO3
- С
некоторыми восстановителями:
CO2 + 3H2 → 2CН3OН + H2O
CO2 + C → 2CO
2Мg +
CO2→ C
+ 2MgO
Внимание! Магний горит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 + mH2O = Cn(H2O)m + nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
- Синтез карбамида (мочевины):
CO2 + 2NH3 = CO(NH2)2 + H2O
- Получение питьевой соды по методу Сольвэ:
NaCl + CO2 + NH3 + H2O= NaHCO3 + NH4Cl
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная
кислота – слабая двухосновная
кислота
Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 ↔ H+ + НCO3—
НCO3— ↔ H+ + CO32-
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 + H2O = NaOH + NaHCO3
CO32-+ H2O = OH— + HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
CaCO3 → CaO + CO2
Карбонат аммония при нагревании разлагается иначе:
(NH4)2CO3 → 2NH3 + 2H2O + CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 + 2HCl → 2NaCl +
CO2 ↑ + H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
CO2 + Сa(OH)2 = CaCO3↓ + H2O
При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает:
CaCO3 + CO2 + H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 + CO2 + H2O = 2NaНCO3
Na2CO3 + HCl → NaНCO3 + NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3—+ H2O = OH— + H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 + CO2 ↑+ H2O
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑+ H2O
Оксид углерода (II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода:
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) Получение в промышленности (в газогенераторах):
Видео — опыт «Получение угарного газа»
C + O2 = CO2 + 402 кДж
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2) Получение СО в лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом:
2C+2O + O2 t˚C → 2C+4O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4) Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH Pасплав→ HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
Оксид углерода (IV) СO2 – углекислый газ
Физические свойства: Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Строение молекулы: Углекислый газ имеет следующие электронную и структурную формулы —
Все четыре связи ковалентые полярные.
Получение углекислого газа:
1. В промышленности: Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка.
CaCO3 t=1200˚C→ CaO + CO2
2. В лаборатории. Действием сильных кислот на карбонаты и гидрокарбонаты –
Видео: получение СО2 в лаборатории
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Способы собирания
Оксид углерода (II)
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Соединения углерода
Монооксид углерода (угарный газ)
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
- горение углерода в недостатке кислорода (неполное окисление углерода):
- неполное окислениеметана:
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
Химические свойства угарного газа
СО – несолеобразующий оксид
- Формально СО можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при дегидратации муравьиной кислоты:
А также образование формиата натрия в реакции с гидроксидом натрия при высоком давлении:
CO + NaOH → HCOONa
Однако при обычных условиях он не вступает в реакции с водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов.
Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
- Окисляется хлором в присутствии катализатора или под действием света с образованием ядовитого газа фосгена:
- Окисляется другими сильными окислителями до углекислого газа или карбонатов:
- Восстанавливает металлы из оксидов (при Т
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
- Восстановление водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
- Восстановление некоторых благородных металлов из солей:
- Взаимодействие с водородом при повышенном давлении. Из синтез-газа (смеси угарного газа и водорода) при определенных условиях (P, T, kt) можно получить метанол, метан, или другие углеводороды:
- Образование карбонилов металлов при нагревании:
- Образование карбоксигемоглобина при связывании угарного газа с гемоглобином крови подобно кислороду:
Этим свойством СО и объясняется его высокая токсичность для организма человека.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется при действии сильных кислот на карбонаты (растворимые и нерастворимые)и гидрокарбонаты металлов:
- При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
- При термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов:
- При сжигании всех видов топлив:
- При спиртовом брожении глюкозы под действием ферментов:
Химические свойства углекислого газа
Углекислый газ — типичный кислотный оксид. Проявляет слабые окислительные свойства
- Качественная реакция на углекислый газ — помутнение известковой воды:
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
- С карбонатами, с образованием гидрокарбонатов:
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
- С некоторыми восстановителями:
2Мg + CO2 → C + 2MgO
Внимание! Магний горит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
- С пероксидом натрия, с образованием карбоната натрия:
- Синтез карбамида (мочевины):
- Получение питьевой соды по методу Сольвэ:
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная кислота – слабая двухосновная кислота
Угольная кислота существует только в водном растворе, где количество ее молекул и анионов в сотни раз меньше, чем количество растворенных молекул углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра)
- Все карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более 900ºС) разлагаются до оксида металла и оксида углерода (IV):
Карбонат аммония при нагревании разлагается иначе:
- Качественной реакцией является взаимодействие с кислотами является на ионы СО3 2─ и НСО3 − в результате которой происходит выделение СО2:
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
При дальнейшем пропускании раствор вновь становится прозрачным, помутнение исчезает:
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
Химические свойства угарного газа уравнения реакций
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы — 
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
источники:
http://zadachi-po-khimii.ru/neorganicheskaya-ximiya/soedineniya-ugleroda.html
http://kardaeva.ru/89-dlya-uchenika/9-klass/219-ugarnyj-gaz-svojstva-fiziologicheskoe-dejstvie-na-organizm-uglekislyj-gaz-ugolnaya-kislota-i-ee-soli
Угарный газ, свойства, физиологическое действие на организм. Углекислый газ, угольная кислота и ее соли
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
Видео — опыт: «Получение угарного газа»
C + O2 = CO2 + 402 кДж
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C+2O + O2 t˚C → 2C+4O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы — 
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Опыт: “Получение углекислого газа в лаборатории”
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
Видео: «Химические свойства углекислого газа»
Кислотный оксид:
1) С водой даёт непрочную угольную кислоту:
СО2 + Н2О ↔ Н2СО3
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
С+4O2 + 2Mg t˚C→ 2Mg+2O + C0
Видео: «Горение магния в углекислом газе»
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
Применение углекислого газа:
Видео: «Тушение пламени углекислым газом»
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + H2O ↔ H2CO3
Опыт: «Разложение угольной кислоты»
Опыт: «Получение угольной кислоты»
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3—(гидрокарбонат-ион)
HCO3— ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
- Средние соли — карбонаты Na2СO3, (NH4)2CO3
- Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»
гидрокарбонаты в карбонаты
Me(HCO3)n + Me(OH)n → MeCO3+H2O
Me(HCO3)n t˚C → MeCO3↓+H2O+CO2↑
карбонаты в гидрокарбонаты
MeCO3+H2O+CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
CO2 + C =
C + H 2 O =
С O + O2 =
CO + Al2O3 =
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH =
CO + Al =
H2CO3+ K2SO4 =
CO2( изб ) + NaOH =
С O2+ Na2O =
CaCO3+ CO2 + H2O =
CO2+ Ca(OH)2 =
CO + CaO =
CO2+ H2SO4 =
Ca(HCO3)2+ Ca(OH)2=
H2CO3+ NaCl =
C + ZnO =
Задание №4. Осуществите превращения по схеме:
1) Al4C3→ CH4→ CO2→ CaCO3→ Ca(HCO3)2→ CaCO3
2) Ca → CaC2→ Ca(OH)2→ CaCO3→ CO2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
Задание №5. Решите задачи
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
2. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим.
Интерактивное задание LearningApps.org по теме:“Соединения углерода”
ЦОРы
Видео — опыт: «Получение угарного газа»
Учебный видео-фильм: “Углекислый газ”
Видео-опыт: ”Получение углекислого га в лаборатории”
Видео:«Химические свойства углекислого газа»
Видео:«Горение магния в углекислом газе»
Видео:«Тушение пламени углекислым газом»
Опыт: «Разложение угольной кислоты»
Опыт:«Получение угольной кислоты»
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»



















