14798. Чему равен объём водорода (н. у.), выделившегося при взаимодействии 97,5 г цинка с избытком разбавленной серной кислоты? (Запишите число с точностью до десятых.)

Верный ответ: 33,6
Zn + H2SO4 = ZnSO4 + H2
n(H2) = n(Zn) = 97,5 / 65 = 1,5 моль
v(H2) = 1,5 ⋅ 22,4 = 33,6 л
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14798.
14536. Из предложенного перечня выберите два вещества, с которыми реагирует водород.
1. гидроксид кальция2. хлорид магния3. бром4. оксид меди(II)5. оксид серы(IV)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14536.
14531. Из предложенного перечня выберите два вещества, с которыми взаимодействует водород без нагревания.
1. оксид меди2. азот3. кальций4. углерод5. фтор

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14531.
14524. Из предложенного перечня выберите два вещества, которые не взаимодействуют с оксидом свинца(II).
1. водород2. вода3. оксид углерода(II)4. азот5. оксид натрия

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14524.
14520. Из предложенного перечня выберите два вещества, которые реагируют с водородом.
1. N2O2. CO3. H3PO44. Al2O35. NaOH

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14520.
Для вас приятно генерировать тесты, создавайте их почаще
Тематический тест на химию водорода и галогенов.
Задание №1
Из предложенного списка простых веществ выберите те, которые являются газами при обычных условиях. Число верных ответов может быть любым.
1) йод
2) хлор
3) фтор
4) бром
5) водород
Решение
Ответ: 235
Задание №2
Из предложенного списка простых веществ выберите те, которые являются твердыми при обычных условиях. Число верных ответов может быть любым.
1) водород
2) хлор
3) йод
4) фтор
5) бром
Решение
Ответ: 3
Задание №3
Из предложенного списка простых веществ выберите те, которые не являются газами при обычных условиях. Число верных ответов может быть любым.
1) бром
2) водород
3) фтор
4) йод
5) хлор
Решение
Ответ: 14
Задание №4
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в низшей степени окисления. Число верных ответов может быть любым.
- 1. NaHCO3
- 2. KHS
- 3. CaH2
- 4. Fe(OH)SO4
- 5. NH3
Решение
Ответ: 3
Задание №5
Из предложенного списка соединений выберите те, в которых атомы водорода находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. LiNH2
- 2. NaH
- 3. BaH2
- 4. RbHS
- 5. NH4Cl
Решение
Ответ: 145
Задание №6
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. KClO
- 2. Mg(ClO4)2
- 3. NaBrO3
- 4. KIO4
- 5. Cl2O5
Решение
Ответ: 24
Задание №7
Из предложенного списка соединений выберите те, в которых атомы галогенов не находятся в высшей степени окисления. Число верных ответов может быть любым.
- 1. Ca(ClO4)2
- 2. HBrO3
- 3. NF3
- 4. NH4Cl
- 5. I2O5
Решение
Ответ: 2345
Задание №8
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +1. Число верных ответов может быть любым.
- 1. NF3
- 2. PBr3
- 3. Ca(ClO)Cl
- 4. HClO2
- 5. S2Cl2
Решение
Ответ: 3
Задание №9
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления +5. Число верных ответов может быть любым.
- 1. PCl5
- 2. KClO3
- 3. FeCl2
- 4. KBrO3
- 5. I2O5
Решение
Ответ: 245
Задание №10
Из предложенного списка соединений выберите те, в которых атомы галогенов находятся в степени окисления -1. Число верных ответов может быть любым.
- 1. NH4I
- 2. Cl2
- 3. BF3
- 4. S2Br2
- 5. Ca(ClO)Cl
Решение
Ответ: 1345
[adsp-pro-3]
Задание №11
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. Al2O3
- 2. FeO
- 3. MgO
- 4. NiO
- 5. Na2O
Решение
Ответ: 24
Задание №12
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. CuO
- 2. Fe2O3
- 3. Cu2O
- 4. Cs2O
- 5. SO2
Решение
Ответ: 45
Задание №13
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. P2O5
- 2. MgO
- 3. Li2O
- 4. ZnO
- 5. Fe3O4
Решение
Ответ: 45
Задание №14
Из предложенного списка оксидов выберите два, с которыми не может взаимодействовать водород.
- 1. PbO
- 2. H2O
- 3. BaO
- 4. ZnO
- 5. FeO
Решение
Ответ: 23
Задание №15
Из предложенного списка оксидов выберите два, с которыми может взаимодействовать водород.
- 1. CO
- 2. CaO
- 3. SrO
- 4. Rb2O
- 5. Cu2O
Решение
Ответ: 15
Задание №16
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) хлор
2) железо
3) вода
4) литий
5) ртуть
Решение
Ответ: 14
Задание №17
Из предложенного списка веществ выберите два, с которыми может взаимодействовать фтор.
1) фторид серы(VI)
2) хлорид фосфора(V)
3) фтороводород
4) бромоводород
5) фторид алюминия
Решение
Ответ: 24
Задание №18
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) хлорид серебра
2) азот
3) хлорид железа(II)
4) сероводород
5) хлорид магния
Решение
Ответ: 34
Задание №19
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) азот
2) едкое кали
3) азотная кислота
4) бромид железа(III)
5) фосфор
Решение
Ответ: 25
Задание №20
Из предложенного списка веществ выберите два, с которыми может взаимодействовать йод.
1) бромоводород
2) гашеная известь
3) песок
4) едкий натр
5) аргон
Решение
Ответ: 24
[adsp-pro-3]
Задание №21
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) оксид натрия
2) оксид цинка
3) оксид меди(II)
4) оксид бария
5) оксид хрома(II)
Решение
Ответ: 14
Задание №22
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) алмаз
2) водород
3) хлорид меди(I)
4) кислород
5) бромоводород
Решение
Ответ: 14
Задание №23
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать бром.
1) алюминий
2) оксид цинка
3) гидроксид рубидия
4) фосфор
5) кислород
Решение
Ответ: 25
Задание №24
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) бромид калия
2) йодид меди(I)
3) йодид хрома(II)
4) водород
5) едкое кали
Решение
Ответ: 12
Задание №25
Из предложенного списка веществ выберите два, с которыми может взаимодействовать хлор.
1) нитрат меди
2) серная кислота
3) азотная кислота
4) сероводородная кислота
5) йодоводородная кислота
Решение
Ответ: 45
Задание №26
Из предложенного списка веществ выберите два, с которыми может взаимодействовать водород.
1) литий
2) платина
3) ртуть
4) цезий
5) песок
Решение
Ответ: 14
Задание №27
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать хлор.
1) бромид цинка
2) йодид никеля
3) хлорид фосфора(III)
4) фторид натрия
5) бертолетова соль
Решение
Ответ: 45
Задание №28
Из предложенного списка веществ выберите два, с которыми может взаимодействовать бром.
1) сера
2) оксид азота(IV)
3) негашеная известь
4) вода
5) неон
Решение
Ответ: 14
Задание №29
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать йод.
1) сульфат магния
2) гидроксид цезия
3) фосфат натрия
4) гидроксид стронция
5) едкий натр
Решение
Ответ: 13
Задание №30
Из предложенного списка веществ выберите два, с которыми не может взаимодействовать водород.
1) железная окалина
2) поташ
3) негашеная известь
4) сажа
5) угарный газ
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид алюминия + бром
2) нитрат магния + хлор
3) бромид свинца(II) + хлор
4) фторид калия + сера
5) бромид цинка + йод
Решение
Ответ: PbBr2 + Cl2 = PbCl2 + Br2
Задание №32
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) бертолетова соль + бромат калия
2) поваренная соль + нитрат серебра
3) йод + кислород
4) хлорид фосфора(III) + йод
5) хлорид натрия + бром
Решение
Ответ: NaCl + AgNO3 = AgCl + NaNO3
Задание №33
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлор + кислород
2) бром + азот
3) литий + водород
4) йод + кислород
5) водород + песок
Решение
Ответ: 2Li + H2 = 2LiH
Задание №34
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) гидроксид алюминия + водород
2) гидроксид натрия + кислород
3) гидроксид калия + поваренная соль
4) гидроксид цезия + йод
5) гидроксид лития + азот
Решение
Ответ: 6CsOH + 3I2 = 5CsI + CsIO3 + 3H2O
Задание №35
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) серная кислота + хлор
2) азотная кислота + водород
3) фосфорная кислота + бром
4) сероводородная кислота + бром
5) плавиковая кислота + бром
Решение
Ответ: H2S + Br2 = 2HBr + S
Задание №36
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) соляная кислота + сульфид меди(II)
2) плавиковая кислота + фторид серебра
3) бромоводородная кислота + гашеная известь
4) йодоводородная кислота + медь
5) хлороводородная кислота + серебро
Решение
Ответ: Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Задание №37
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + фосфор
2) бромид калия + сера
3) фторид лития + цинк
4) хлорат калия + сера
5) бромат калия + бром
Решение
Ответ: 2KClO3 + 3S = 2KCl + 3SO2
Задание №38
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид фосфора(III) + хлор
2) бромид кремния(IV) + бром
3) йодид железа(II) + йод
4) хлорид натрия + бром
5) бромид цинка + йод
Решение
Ответ: PCl3 + Cl2 = PCl5
Задание №39
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) хлорид натрия + вода
2) бромид калия + вода
3) гидрид лития + вода
4) иодид серебра + вода
5) хлорид цезия + вода
Решение
Ответ: LiH + H2O = LiOH + H2
Задание №40
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. Запишите уравнение протекающей реакции.
1) алмаз + бром
2) азот + хлор
3) аргон + йод
4) фосфор + йод
5) железо + водород
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №41
В заданной схеме превращений
CuSO4 CuI
Y
Веществами X и Y являются соответственно
1) хлорид меди(I)
2) йодид свинца
3) хлороводород
4) хлорид меди(II)
5) йодид натрия
Решение
Ответ: 54
Задание №42
В заданной схеме превращений
MnO2 X
KClO3
Веществами X и Y являются соответственно
1) хлорид марганца(IV)
2) калий
3) едкое кали
4) оксид калия
5) хлор
Решение
Ответ: 53
Задание №43
В заданной схеме превращений
X Br2
Y
Веществами X и Y являются соответственно
1) бромат калия
2) нитрат калия
3) бромид фосфора(V)
4) фосфор
5) бромид натрия
Решение
Ответ: 53
Задание №44
В заданной схеме превращений
X Y
X
Веществами X и Y являются соответственно
1) бромид калия
2) бром
3) бромоводород
4) бромат калия
5) бертолетова соль
Решение
Ответ: 24
Задание №45
В заданной схеме превращений
KClO3 X
Y
Веществами X и Y являются соответственно
1) перхлорат калия
2) кислород
3) оксид хлора(V)
4) хлорид калия
5) хлор
Решение
Ответ: 45
Задание №46
В заданной схеме превращений
Fe3O4 Fe
FeCl2
Веществами X и Y являются соответственно
1) хлороводород
2) водород
3) хлор
4) хлорид натрия
5) хлорат калия
Решение
Ответ: 21
Задание №47
В заданной схеме превращений
X Y
CuBr2
Веществами X и Y являются соответственно
1) йодид калия
2) йодид стронция
3) йод
4) йодид меди(I)
5) йодид меди(II)
Решение
Ответ: 34
Задание №48
В заданной схеме превращений
KOH X
P2O5
Веществами X и Y являются соответственно
1) бертолетова соль
2) поваренная соль
3) фосфорная кислота
4) фосфор
5) кислород
Решение
Ответ: 14
Задание №49
В заданной схеме превращений
AgF KF
HF
Веществами X и Y являются соответственно
1) нитрат калия
2) йодид калия
3) азотная кислота
4) кремниевая кислота
5) водород
Решение
Ответ: 23
Задание №50
В заданной схеме превращений
KI X
NaIO3
Веществами X и Y являются соответственно
1) кислород
2) едкий натр
3) углекислый газ
4) йод
5) йодоводород
Решение
Ответ: 42
[adsp-pro-3]
Задание №51
Запишите уравнение взаимодействия между водородом и цезием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cs + H2 = 2CsH
Задание №52
Запишите уравнение взаимодействия между водородом и кальцием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Ca + H2 = CaH2
Задание №53
Запишите уравнение взаимодействия между водородом и хлором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2 + Cl2 = 2HCl
Задание №54
Запишите уравнение взаимодействия между водородом и оксидом железа(III). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O
Задание №55
Запишите уравнение взаимодействия между водородом и оксидом меди(I). В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu2O + H2 = 2Cu + H2O
Задание №56
Запишите уравнение взаимодействия между фтором и кремнием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Si + 2F2 = SiF4
Задание №57
Запишите уравнение взаимодействия между избытком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Cl2 = 2PCl5
Задание №58
Запишите уравнение взаимодействия между недостатком хлора и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3Cl2 = 2PCl3
Задание №59
Запишите уравнение взаимодействия между хлором и железом. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Fe + 3Cl2 = 2FeCl3
Задание №60
Запишите уравнение взаимодействия между хлором и медными опилками. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: Cu + Cl2 = CuCl2
[adsp-pro-3]
Задание №61
Запишите уравнение взаимодействия между хлором и холодным раствором едкого натра. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaOH + Cl2 = NaCl + NaClO + H2O
Задание №62
Запишите уравнение взаимодействия между хлором и горячим раствором гидроксида цезия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 6CsOH + 3Cl2 = 5CsCl + CsClO3 + 3H2O
Задание №63
Запишите уравнение взаимодействия между бромом и алюминием. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Al + 3Br2 = 2AlBr3
Задание №64
Запишите уравнение взаимодействия между избытком брома и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 5Br2 = 2PBr5
Задание №65
Запишите уравнение взаимодействия между бромом и горячим раствором гашеной извести.
Решение
Ответ: 6Ca(OH)2 + 6Br2 = 5CaBr2 + Ca(BrO3)2 + 6H2O
Задание №66
Запишите уравнение взаимодействия между бромом и йодидом алюминия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2AlI3 + 3Br2 = 2AlBr3 + 3I2
Задание №67
Запишите уравнение взаимодействия между хлором и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Задание №68
Запишите уравнение взаимодействия между бромом и раствором сероводорода. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: H2S + Br2 = S + 2HBr
Задание №69
Запишите уравнение взаимодействия между йодом и медью. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2Cu + I2 = 2CuI
Задание №70
Запишите уравнение взаимодействия между избытком йода и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2P + 3I2 = 2PI3
[adsp-pro-3]
Задание №71
Запишите уравнение взаимодействия между бертолетовой солью и избытком концентрированной соляной кислоты.
Решение
Ответ: KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
Задание №72
Запишите уравнение взаимодействия между бертолетовой солью и фосфором. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 5KClO3 + 6P = 5KCl + 3P2O5
Задание №73
Запишите уравнение каталитического разложения хлората натрия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaClO3 = 2NaCl + 3O2
Задание №74
Запишите уравнение термического разложения бертолетовой соли. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KClO3 = KCl + 3KClO4
Задание №75
Запишите уравнение взаимодействия между хлоратом калия, оксидом хрома(III) и едким кали при сплавлении. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: KClO3 + Cr2O3 + 4KOH = KCl + 2K2CrO4 + 2H2O
Задание №76
Запишите уравнение взаимодействия между перманганатом калия и концентрированной соляной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Задание №77
Запишите уравнение взаимодействия между оксидом марганца(IV) и бромоводородной кислотой. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Задание №78
Запишите уравнение взаимодействия между дихроматом калия и концентрированной соляной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Задание №79
Запишите уравнение взаимодействия между перекисью водорода и йодидом калия в присутствии серной кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KI + H2O2 + H2SO4 = K2SO4 + I2 + 2H2O
Задание №80
Запишите уравнение взаимодействия между йодидом калия и раствором медного купороса. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 4KI + 2CuSO4 = 2K2SO4 + 2CuI + I2
[adsp-pro-3]
Задание №81
Запишите уравнение взаимодействия между йодидом натрия и раствором хлорного железа. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaI + 2FeCl3 = 2FeCl2 + I2 + 2NaCl
Задание №82
Запишите уравнение взаимодействия между твердой поваренной солью и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2NaCl + H2SO4 = Na2SO4 + 2HCl
или
NaCl + H2SO4 = NaHSO4 + HCl
Задание №83
Запишите уравнение взаимодействия между твердым бромидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
Задание №84
Запишите уравнение взаимодействия между твердым йодидом калия и концентрированной серной кислотой при нагревании. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: 8KI + 5H2SO4 → 4K2SO4 + H2S + 4I2 + 4H2O
Задание №85
Запишите уравнение взаимодействия кварцевого песка и избытка плавиковой кислоты. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
Решение
Ответ: SiO2 + 4HF = SiF4 + 2H2O
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) водород Б) хлор В) негашеная известь |
1) калий, фосфор, вода 2) стронций, сера, кислород 3) цинк, натрий, ксенон 4) соляная кислота, вода, углекислый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 214
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) плавиковая кислота Б) соляная кислота В) азотная кислота |
1) едкий натр, медь, сера 2) гидроксид цезия, нитрат серебра, оксид алюминия 3) гидроксид рубидия, оксид свинца(II), кварц 4) гашеная известь, азот, фосфорная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 321
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) поваренная соль Б) бертолетова соль В) бром |
1) фосфор, азот, вода 2) нитрат серебра, серная кислота (конц.), фтор 3) сера, графит, соляная кислота 4) железо, водород, вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 234
Задание №89
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) гидрид кальция Б) фторид серебра В) йодид лития |
1) хлор, вода, бром 2) фосфат калия, хлор, бром 3) соляная кислота, нитрат бария, медь 4) вода, аргон, хлор |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 132
Задание №90
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) бромид лития Б) йодид калия В) фторид аммония |
1) нитрат магния, едкое кали, гашеная известь 2) нитрат свинца, фторид серебра, сульфат меди 3) нитрат калия, сульфат алюминия, цинк 4) нитрат серебра, хлор, фосфат натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 421
[adsp-pro-3]
Задание №91
Рассчитайте суммарный объем газов (н.у.), которые выделятся при полном разложении смеси 12,6 г дихромата аммония и 24,5 г бертолетовой соли в присутствии катализатора. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 7,84
Пояснение:
Запишем уравнения реакций:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O (I)
2KClO3 = 2KCl + 3O2 (II)
ν((NH4)2Cr2O7) = m/M = 12,6 / 252 = 0,05 моль
Исходя из уравнения реакции (I):
ν(N2) = ν((NH4)2Cr2O7) = 0,05 моль
ν(KClO3) = m/M = 24,5 / 122,5 = 0,2 моль
Исходя из уравнения реакции (II):
ν(O2) = 3⋅ν(KClO3)/2 = 3⋅0,2/2 = 0,3 моль
Рассчитаем суммарное количество молей азота и кислорода:
ν(N2+O2) = ν(N2) + ν(O2) = 0,05 моль + 0,3 моль = 0,35 моль
Тогда,
V(N2+O2) = ν(N2+O2) ⋅ Vm = 0,35⋅22,4 = 7,84 л
Задание №92
Вычислите массу воды, необходимую для реакции с 21 г гидрида кальция. Ответ приведите в граммах и округлите до целых.
Решение
Ответ: 18
Задание №93
Определите массовую долю хлорида калия в растворе, полученном при пропускании 2,24 л хлора через 280 г горячего 20%-ного раствора едкого кали. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 4,3
Задание №94
Навеску йода массой 12,7 г смешали с 28 г железных опилок и нагревали до прекращения реакции. Полученную смесь обработали 300 мл воды, осадок отделили. Вычислите массовую долю вещества в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 4,91
Пояснение:
Йод, в отличие от других галогенов окисляет железо до степени окисления +2. То есть протекает реакция:
Fe + I2 = FeI2
ν(I2) = m/M = 12,7/254 = 0,05 моль
ν(Fe) = m/M = 28/56 = 0,5 моль
В избытке железо, поэтому считаем количество продукта (йодида железа) по йоду:
ν(FeI2) = ν(I2) = 0,05 моль
Йодид железа не реагирует с водой, а просто растворяется в ней. Поэтому осадок в условии задачи – это просто непрореагировавшее железо.
Таким образом, после добавления воды мы просто получаем водный раствор йодида железа (II).
Рассчитаем массу йодида железа (II):
m(FeI2) = ν ⋅ M = 0,05 ⋅ 310 = 15,5 г
Тогда, масса полученного раствора будет равна:
mр-ра(FeI2) = m(FeI2) + m(H2O) = 15,5 г + 300 г = 315,5 г,
а массовая доля йодида железа будет составлять:
ω(FeI2) = 100 ⋅ m(FeI2) /mр-ра(FeI2) = 100% ⋅ 15,5/315,5 = 4,91 %
Задание №95
Навеску бертолетовой соли обработали избытком концентрированной соляной кислоты. Объем выделившегося газа составил 6,72 л. Рассчитайте объем кислорода, который можно получить при каталитическом разложении такой же навески исходного вещества. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 3,36
Задание №96
Навеску бертолетовой соли массой 2,45 г полностью разложили в присутствии катализатора. Полученный твердый остаток смешали с 100 г 8,5% раствора нитрата серебра. Определите суммарную массовую долю солей в полученном растворе. Ответ приведите в процентах и округлите до сотых.
Решение
Ответ: 7,22
Задание №97
Навеску смеси железных и алюминиевых опилок массой 8,3 г нагревали в токе хлора до прекращения реакции. Полученный твердый остаток растворили в воде и обработали избытком раствора питьевой соды. Рассчитайте объем выделившегося газа, если массовая доля алюминия в исходной смеси равна 32,53. Ответ приведите в литрах и округлите до сотых.
Решение
Ответ: 13,44
Задание №98
При взаимодействии навески оксида меди(II) и избытка водорода при нагревании образовался твердый остаток. Данное вещество нагревали в токе хлора, полученный продукт растворили в 100 мл воды. При пропускании в раствор сероводорода выпало 9,6 г осадка. Определите массовую долю кислоты в растворе над осадком. Ответ приведите в процентах и округлите до десятых.
Решение
Ответ: 6,8
Задание №99
Вычислите объем хлора, необходимый для полного окисления 100 мл 5%-ного раствора сульфида натрия (плотность 1,05 г/см3). Ответ приведите в литрах и округлите до целых.
Решение
Ответ: 6
Задание №100
Рассчитайте массу простого вещества, образующегося при взаимодействии 160 г 10% раствора сульфата меди и 200 мл 20% раствора йодида калия (плотность 1,15 г/см3). Ответ приведите в граммах и округлите до десятых.
Решение
Ответ: 12,7
[adsp-pro-10]
Тест по химии
Тематический тест «Водород» 2022
Контрольная работа на тему «Водород: строение, положение в ПС, химические свойства и методы получения». Тест имеет ответы для самопроверки.
Ответы
Вы учитель?
Хотите получать новые уникальные тесты раньше других?
Вы можете получать новые тесты в формате КИМ 2023 с ответами, которых нет в публичном доступе!
- Только уникальные задания
- Полное соответствие требованиям ФИПИ
- Хитрости и «ловушки», используемые на реальном ЕГЭ
И всё это здесь и только здесь 
Тест на тему “Химические свойства водорода”
Последний раз тест пройден более 24 часов назад.
-
Вопрос 1 из 10
На каком месте в периодической системе находится водород?
-
на 1 месте
-
на 3 месте
-
на 6 месте
-
на 8 месте
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы и еще 98%
ответили правильно98% ответили правильно
на этот вопрос -
-
Вопрос 2 из 10
В нормальных условиях водород:
-
не имеет запаха и вкуса, но имеет цвет
-
не имеет запаха, цвета, вкуса
-
не имеет вкуса и цвета, но имеет запах
-
не имеет вкуса, но имеет запах и цвет
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы и еще 94%
ответили правильно94% ответили правильно
на этот вопрос -
-
Вопрос 3 из 10
Какая валентность характерна для водорода?
-
I
-
II
-
III
-
IV
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы и еще 90%
ответили правильно90% ответили правильно
на этот вопрос -
-
Вопрос 4 из 10
Какую степень окисления может проявлять водород?
-
отрицательную
-
положительную
-
как положительную, так и отрицательную
-
нет ни одного верного ответа
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы и еще 69%
ответили правильно69% ответили правильно
на этот вопрос -
-
Вопрос 5 из 10
Сколько изотопов имеет водород?
-
один
-
два
-
три
-
четыре
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы ответили лучше
55% участников45% ответили правильно
на этот вопрос -
-
Вопрос 6 из 10
С каким единственным неметаллом вступает в реакцию водород при обычных условиях?
-
хлор
-
фтор
-
углерод
-
сера
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы ответили лучше
60% участников40% ответили правильно
на этот вопрос -
-
Вопрос 7 из 10
Из чего состоит гремучий газ?
-
водород + кислород
-
водород +углерод
-
водород + сера
-
водород + селен
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы и еще 54%
ответили правильно54% ответили правильно
на этот вопрос -
-
Вопрос 8 из 10
В реакции восстановления меди из оксида меди вместе с металлом образуется:
-
вода
-
оксид
-
водород
-
основание
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы ответили лучше
58% участников42% ответили правильно
на этот вопрос -
-
Вопрос 9 из 10
Какую степень окисления проявляет водород в соединениях с металлами?
-
положительную
-
отрицательную
-
водород не реагирует с металлами
-
нет ни одного правильного ответа
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы ответили лучше
52% участников48% ответили правильно
на этот вопрос -
-
Вопрос 10 из 10
Энергия связи водорода составляет:
-
150 кДж/моль
-
233 кДж/моль
-
358 кДж/моль
-
436 кДж/моль
Подсказка
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вы ответили лучше
73% участников27% ответили правильно
на этот вопрос -
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Александр Котков
10/10
-
Сергей Ефремов
7/10
ТОП-3 теста
которые проходят вместе с этим

Рейтинг теста
3.5
Средняя оценка: 3.5
Всего получено оценок: 1141.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
-
Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора.
Формула соли Продукты на катоде
А) CuSO4 1) металл
Б) FeCl2 2) водород
В) MnSO4 3) оксид серы (IV)
Г) СrС12 4) металл, водород
5) галоген
-
Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора.
Формула соли Продукты на катоде
А) CH3COONa 1) металл
Б) Cu(NO3)2 2) водород
В) K2SO4 3) оксид серы (IV)
Г) А1С13 4) металл, водород
5) галоген
6) оксид азота (IV)
-
Установите соответствие между формулой соли и продуктом, образующимся на аноде при электролизе его водного раствора.
Формула соли Продукты на аноде
А) K3PO4 1) кислород
Б) FeCl3 2) оксид фосфора (V)
В) NiSO4 3) оксид серы (IV)
Г) CrBr3 4) водород
5) галоген
-
Установите соответствие между формулой соли и продуктом, образующимся на аноде при электролизе его водного раствора.
Формула соли Продукты на аноде
А) NaF 1) O2
Б) Mn(NO3)2 2) Н2
В) NiCl2 3) SO2
Г) Na2SO4 4) NO2
5) F2
6) Cl2
-
Установите соответствие между формулой соли и продуктами, образующимися на аноде при электролизе его водного раствора.
Формула соли Продукты на аноде
A) Mn(NO3)2 1) кислород
Б) CH3COOK 2) этан
B) AlВr3 3) этан, оксид углерода (IV)
Г) Cr2(SO4)3 4) оксид азота (IV)
5) галоген
6) оксид серы (IV)
-
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула соли Продукты электролиза
А) KCl 1) металл, галоген
Б) CuCl2 2) металл, кислород
В) NaF 3) водород, галоген
Г) ZnBr2 4) водород, кислород
5) металл, водород, кислород
6) металл, водород, галоген
-
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула соли Продукты электролиза
А) Na2SO4 1) металл, галоген
Б) KNO3 2) металл, кислород
В) AgNO3 3) водород, галоген
Г) MnSO4 4) водород, кислород
-
металл, водород, кислород
-
металл, водород, галоген
23. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора
Формула вещества Продукты электролиза
А) гидроксид цезия 1) металл, галоген
Б) сульфат никеля 2) металл, кислород
В) бромид кальция 3) водород, галоген
Г) иодид натрия 4) водород, кислород
-
металл, водород, кислород
-
металл, водород, галоген
24. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты электролиза
А) Hg(NО3)2 1) металл, галоген
Б) CuSО4 2) металл, кислород
В) FeSО4 3) водород, галоген
Г) LiOH 4) водород, кислород
5) металл, водород, кислород
6) металл, водород, галоген
25. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукт на катоде
А) Li2SO4 1) Li
Б) CaBr2 2) H2
B) Pb(NO3)2 3) Ca
Г) CuBr2 4) Pb, H2
5) CuO
6) Cu
26. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) Rb2SO4 1) метан
Б) CH3COOK 2) сернистый газ
B) CuSO4 3) кислород
Г) BaBr2 4) водород
5) бром
6) этан и углекислый газ
27. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) Rb2SO4 1) рубидий
Б) CH3COOK 2) калий
B) CuSO4 3) барий
Г) BaBr2 4) медь
5) водород
6) сера
28. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) NaClO4 1) Cl2
Б) AlCl3 2) ClO2
B) Cu(NO3)2 3) NO2
Г) SrCl2 4) O2
5) N2
6) H2
29. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) NaF 1) фтор
Б) AlBr3 2) хлор
B) CuCl2 3) бром
Г) SrI2 4) иод
5) кислород
6) водород
30. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) Ca(NO3)2 1) H2
Б) LiBr 2) O2
B) Al(NO3)3 3) NO2
Г) KCl 4) NO
5) Cl2
6) Br2
31. Установите соответствие между названием металла и способом его получения
Название вещества Получение электролизом
А) литий 1) раствор фторида лития
Б) фтор 2) расплав фторида лития
B) серебро 3) раствор хлорида магния
Г) магний 4) раствор нитрата серебра
5) расплав оксида серебра
6) расплав хлорида магния
32. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) CrCl3 1) H2
Б) K3PO4 2) металл
B) Cu(NO3)2 3) металл и водород
Г) NaCl 4) O2
5) Cl2
6) N2
33. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) NiSO4 1) Cl2
Б) NiCl 2) O2
B) NiF2 3) H2
Г) K2S 4) S
5) SO2
6) HF
34. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) MgCl2 1) Mg
Б) CuSO4 2) H2
B) AgNO3 3) Ag
Г) Li2S 4) Li
5) S
6) Cu
35. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) CaCl2 1) металл
Б) Na2SO4 2) водород
B) Cu(NO3)2 3) кислород
Г) AgNO3 4) хлор
5) оксид серы
6) оксид азота
36. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) KBr 1) K
Б) K2SO4 2) H2
B) HNO3 3) Ag
Г) AgNO3 4) O2
5) S
6) NO2
37. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на аноде
А) Hg(NO3)2 1) азот
Б) MgCl2 2) сера
B) CuSO4 3) водород
Г) Na2S 4) кислород
5) металл
6) галоген
38. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) AgNO3 1) Ag
Б) FeCl2 2) Fe
B) KNO3 3) H2
Г) NaOH 4) Fe, H2
5) Na
6) O2
39. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) Au(NO3)3 1) рубидий
Б) RbF 2) цезий
B) AgNO3 3) серебро
Г) Cs2CO3 4) золото
5) водород
6) азотная кислота
40. Установите соответствие между формулой вещества и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
Формула вещества Продукты на катоде
А) AuF3 1) кальций
Б) CaI2 2) натрий
B) AgF 3) серебро
Г) Na2CO3 4) золото
5) водород
6) фтор
1. Положение водорода в периодической системе химических элементов
2. Электронное строение водорода
3. Физические свойства
4. Способы получения
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с активными металлами
5.1.2. Взаимодействие с серой
5.1.3. Взаимодействие с кремнием
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с оксидами металлов
5.2.2. Взаимодействие с органическими веществами
6. Применение водорода
Водородные соединения металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с водой
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с окислителями
Летучие водородные соединения
1. Строение молекулы и физические свойства
2. Способы получения силана
3. Способы получения аммиака
4. Способы получения фосфина
5. Способы получения сероводорода
6. Химические свойства силана
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии:
+1H 1s1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
Ca + H2 → CaH2
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
H2 + S → H2S
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
3Н2 + N2 → 2NH3
1.5. В специальных условиях водород реагирует с углеродом.
C + 2H2 → CH4
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2H2 + O2 → 2H2O
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
Например, водород взаимодействует с оксидом азота (I):
N2O + H2 = N2 + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например, при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Ca + H2 → CaH2
Химические свойства
1. Солеобразные гидриды легко разлагаются водой.
Например, гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например, гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например, гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором:
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
SiН4 + 2О2 = SiO2 + 2Н2О
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
3. Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
4. Силан при нагревании разлагается:
SiH4 → Si + 2H2
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Вода
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами.
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
Mg + 2H2O → Mg(OH)2 + H2
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
2Al + 6H2O = 2Al(OH)3 +3H2
- металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
Fe + 4Н2O → Fe3O4 + 4Н2
- металлы, расположенные в ряду активности от после Н, не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении):
Н2O + СаО = Са(OH)2
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
P2O5 + 3H2O = 2H3PO4
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком:
Например, сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой.
Например, фосфид кальция разлагается водой:
Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑
6. Бинарные соединения неметаллов также гидролизуются водой.
Например, фосфид хлора (V) разлагается водой:
PCl5 + 4H2O → H3PO4 + 5HCl
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Готовимся к ЕГЭ заблаговременно
Тесты по химии для основной и средней
школы
Продолжение. Начало см. в № 1, 2, 3/2010
Тема II. Кислород. Водород. Кислоты. Соли
Итоговый тест по теме.

а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. К кислотам относится вещество, формула
которого:
а) Na2SO4; б) H3PO4; в) Fe(NO3)2;
г) Al(OH)3.
3. Одно из химических свойств водорода
отражено в уравнении реакции:
а) 2HCl + Zn = ZnCl2 + H2;
б) 2Cu + O2 = 2CuO;
в) 2H2О2 = 2H2О + O2;
г) CuO + H2 = Cu + H2O.
4. Реакция, уравнение которой
BaO + 2HCl = BaCl2 + H2O,
относится к реакциям:
а) соединения; б) разложения;
в) обмена; г) замещения.
1. Суждение “Этот газ в смеси с
воздухом взрывоопасен”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. К кислотам не относится вещество,
формула которого:
а) H2SO4; б) H3PO4; в) Fe(NO3)2;
г) H2S.
3. B разбавленной серной кислоте
растворяется:
а) Cu; б) Zn; в) Ag; г) Au.
4. Реакция между кислотой и оксидом металла
относится к реакциям:
а) соединения; б) разложения;
в) обмена; г) замещения.
1. Суждение “Этот газ можно
собирать в сосуд, перевернутый вверх дном”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Какое из приведенных веществ является
лишним?
а) H2S; б) NaNO3; в) H2CO3; г) H3РO4.
3. B ортофосфорной кислоте растворяется:
а) Cu; б) Mg; в) Ag; г) Au.
4. Сумма коэффициентов в уравнении реакции,
схема которой
K2O + HCl —> KCl + H2O,
равна:
а) 4; б) 5; в) 6; г) 7.
1. Суждение “Этот газ можно
обнаружить с помощью тлеющей лучинки”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Какое из приведенных веществ является
лишним?
а) HCl; б) Pb(NO3)2; в) H2SiO3; г) H2SO4.
3. При действии разбавленной серной кислоты
на ртуть:
а) образуются сульфат ртути(II) и водород;
б) образуются сульфат ртути(II) и вода;
в) образуются сульфид ртути(II) и вода;
г) реакция не идет.
4. Сумма коэффициентов в уравнении реакции,
схема которой
FeO + HNO3 —> Fe(NO3)2 + H2O,
равна:
а) 4; б) 5; в) 6; г) 7.
1. Суждение “Этот газ перед
использованием проверяют на чистоту”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Соли соляной кислоты называются:
а) сульфидами; б) бромидами;
в) нитридами; г) хлоридами.
3. Какой из металлов не вытесняет водород из
разбавленной серной кислоты?
а) Хром; б) медь; в) цинк; г) железо.
4. Сумма коэффициентов в уравнении реакции
взаимодействия азотной кислоты с оксидом натрия
равна:
а) 4; б) 5; в) 6; г) 7.
1. Cуждение “Этот газ малорастворим
в воде”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Соли сероводородной кислоты называются:
а) сульфитами; б) нитратами;
в) сульфатами; г) сульфидами.
3. Какой из металлов не вытесняет
водород из соляной кислоты?
а) Магний; б) серебро; в) цинк; г) железо.
4. Сумма коэффициентов в уравнении реакции
взаимодействия соляной кислоты с оксидом
железа(III) равна:
а) 6; б) 12; в) 8; г) 14.
1. Суждение “Этот газ используют
для получения тугоплавких металлов”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Вещества, расположенные в
последовательности оксид–кислота–соль,
находятся в ряду:
а) P2O5 – H3PO4 – Na3PO4;
б) H2O – LiOH– K2CO3;
в) K2O – NaOH – PbI2;
г) CО2 – Na2CO3 – H2CO3.
3. Сумма коэффициентов в уравнении реакции
взаимодействия соляной кислоты с алюминием
равна:
а) 4; б) 7; в) 13; г) 14.
4. Сумма коэффициентов в уравнении реакции
взаимодействия ортофосфорной кислоты с оксидом
калия равна:
а) 4; б) 10; в) 6; г) 14.
1. Cуждение “Газ хорошо растворим в
воде”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Вещества, расположенные в
последовательности оксид–кислота–соль,
находятся в ряду:
а) P2O5 – BaCl2 – H3PO4;
б) H2O – LiOH – K2CO3;
в) Na2O – HCl – PbCl2;
г) H2CO3 – CО2 – Na2CO3.
3. Сумма коэффициентов в уравнении реакции
взаимодействия серной кислоты с магнием равна:
а) 4; б) 6; в) 8; г) 10.
4. Сумма коэффициентов в уравнении реакции
взаимодействия серной кислоты с оксидом
алюминия равна:
а) 4; б) 6; в) 8; г) 10.
1. Суждение “Газ поддерживает
дыхание”:
а) справедливо для кислорода;
б) справедливо для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Вещества, расположенные в
последовательности оксид–кислота–соль,
находятся в ряду:
а) P2O5 – H3PO4 – Ba(OH)2;
б) SO3 – H2SO4 – Na2SO4;
в) CuO – NaOH – PbCl2;
г) H2CO3 – Na2CO3 – CО2.
3. Сумма коэффициентов в уравнении реакции
взаимодействия ортофосфорной кислоты с магнием
равна:
а) 4; б) 5; в) 7; г) 9.
4. Смесь оксида меди (II) с медью обработали
избытком раствора соляной кислоты (при
нагревании) и профильтровали. Какое вещество
осталось на фильтре?
а) CuCl2; б) CuO; в) Cu; г) Cu(OH)2.
1. Суждение “Этот газ можно
собирать способом вытеснения воды”:
а) справедливо только для кислорода;
б) справедливо только для водорода;
в) справедливо и для кислорода, и для водорода;
г) несправедливо ни для кислорода, ни для
водорода.
2. Вещества, расположенные в
последовательности оксид–кислота–соль,
находятся в ряду:
а) P2O5 – H3PO4 – Ba(OH)2;
б) H2O – LiOH– K2CO3;
в) OF2 – NaOH – PbI2;
г) CО2 – H2CO3 – Na2CO3.
3. С бoльшей скоростью протекает
взаимодействие соляной кислоты с:
а) Cu; б) Mg; в) Fе; г) Zn.
4. Смесь оксида меди(II) с медью обработали
раствором соляной кислоты (при нагревании) и
профильтровали. Какое вещество осталось в
растворе после фильтрования?
а) CuCl2; б) CuO; в) Cu; 4) Cu(OH)2.
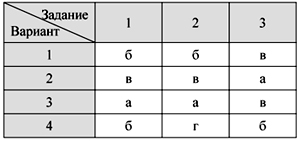
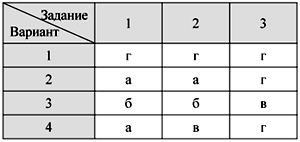
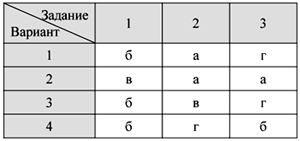
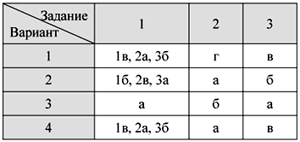
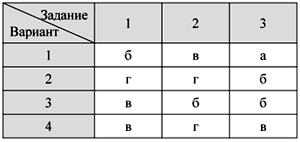
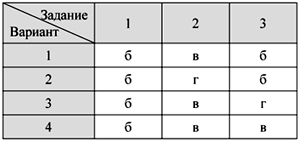
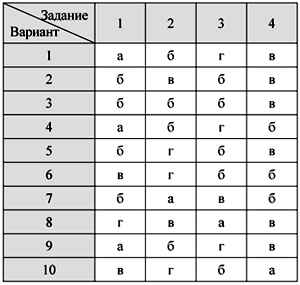
О т в е т ы
Тест 1. Кислород – элемент и
простое вещество.
Физические свойства и получение кислорода
Тест 2. Химические свойства
кислорода. Оксиды
Тест 3. Водород – химический
элемент и простое вещество.
Физические свойства водорода и его получение
Тест 4. Химические свойства и
применение водорода
Тест 5. Кислоты и соли: состав и
номенклатура
Тест 6. Свойства кислот
Итоговый тест
Продолжение следует