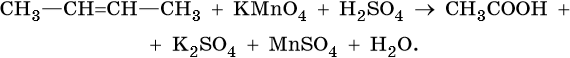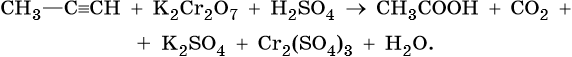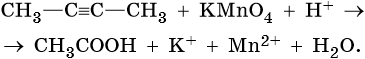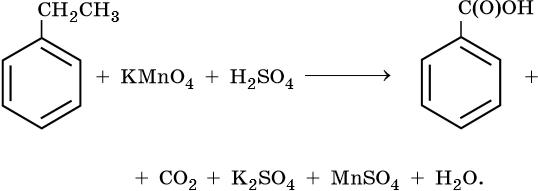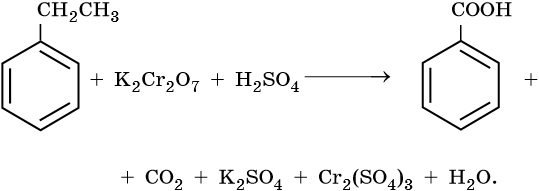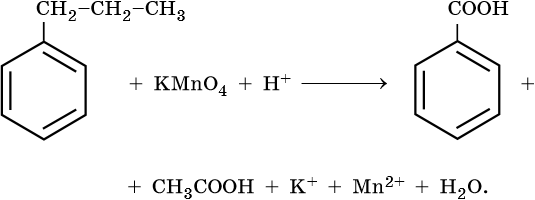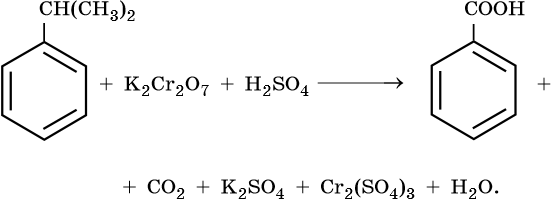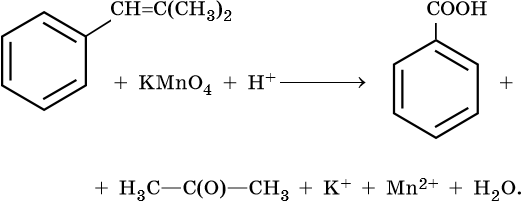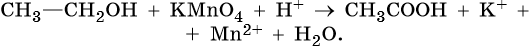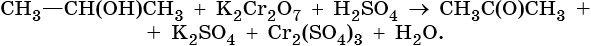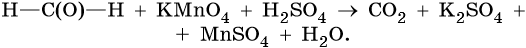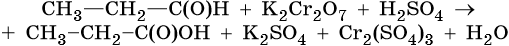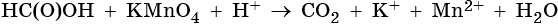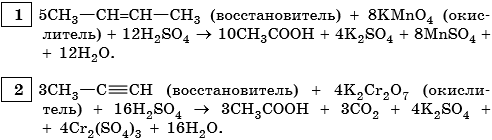II. ОВР в органической химии.
Степени окисления атомов в органических соединениях.
|
Углеводороды |
Спирты |
Альдегиды, кетоны |
Карбоновые кислоты |
|
-2 +1 -2 +1 CH2=CH2 |
-2 +1 -2 +1 CH3-OH |
0 ⸗O-2 0 -2 H-C-H (HCHO) |
+2 -2-2 HCOOH |
|
-2 -1 -3 CH2=CH-CH3 |
-3 -1 -2 CH3-CH2-OH |
-3 +1 ⸗O-2 CH3-C- H -3 +1 -2 (CH3CHO) |
-3 +3-2- 2 CH3COOH |
|
-3 -1 -1 -3 CH3-CH=CH-CH3 |
-1 -1 CH2-CH2 І І OH OH |
-3 +2 -3 CH3-C- CH3 ǁ O-2 |
+3 -2 -2 C OOH І+3-2-2 C OOH |
|
-3 0 -1 -3 CH3-C=CH-CH3 І -3 CH3 |
-1 0 -3 CH2-CH-CH3 І І OH OH |
||
|
-3 0 0 -3 CH3-CH2-CH-CH3 І І OH OH |
Углеводороды.
В кислой среде:
1) CH2=CH2 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O + CO2
-2 -2 +7 +2 +4
5CH2=CH2 + 12KMnO4 + 18H2SO4 → 6K2SO4 + 12MnSO4 + 10CO2 + 28H2O
2C-2 – 12e— → 2C+4 | 12 | 5 – окисляется, восстановитель;
Mn+7 + 5e— → Mn+2 | 5 |12 — восстанавливается, окислитель
2) C2H2 – окисляется окислителями в кислой среде до щавелевой кислоты.
-1 -1 k. H2SO4, KMnO4 (K2Cr2O7) COOH
CHΞCH ―――――――→ І (HOOC-COOH)
COOH
-2 -1 -3 +7 +4 -3 +3
3)CH2=CH-CH3 + 2KMnO4 + 3H2SO4 → CO2 + CH3-COOH + K2SO4 +
+2
2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e— | 2 — восст-тся, окислитель;
C-1 — 4e— → C+3 |} 10e—| 1 — окисляется, восстановитель
-3 -1 -1 -3 +7 -3 +3
4) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3-COOH + 4K2SO4 +
+2
8MnSO4 + 12H2O
Mn+7 + 5e— → Mn+2 |4| | 8Mn+7 +40e— →8Mn+2 — восстанавливается, окислитель;
| |× 2 |
C-1 — 4e— → C+3 |5| | 10C-1 — 40e— → 10C+3 — окисляется, восстановитель
-3 0 -1 -3 -3 +3 -2 -2 -3 +2 -3
5) CH3-C‡ CH-CH3 + 6KMnO4 + 9H2SO4 → 5CH3-COOH + 5CH3-C-CH3
+ 3K2SO4 + 6MnSO4 +9H2O
| ǁ
-3 O-2
CH3
Mn+7 + 5e— → Mn+2 |× 6| 6Mn+7+30e—→ 6Mn+2
C-1 — 4e— → C+3 | | 5C-1— 20e— → 5C+3
C0 — 2e— → C+2 | | 5C0 10e— → 5C+2
↙͞ ͞͞͞ ͞ ͞͞ ͞ ͞ ͞ ͞ ͞ ͞͞ ͞ ͞↘
-1 -1 +7 C+3OOH +2
6) 5CHΞCH + 8KMnO4 + 12H2SO4 → 5 І +4K2SO4 +8MnSO4+ 12H2O C+3OOH
только ацетилен!
2C-1 — 8e— → 2C+3 |× 5
Mn+7 + 5e— → Mn+2 |× 8
Гомологи ацетилена окисляются до одноосновных карбоновых кислот.
-1 0 -3 +7 -3 +3 +4 +2
7)5CHΞC-CH3 +8KMnO4 +12H2SO4 → 5CH3-COOH +5CO2 +4K2SO4+ 8MnSO4 + 12H2O
—3 0 0 -3 +7 -3 +3 +2

Ароматические углеводороды.
-1 -3 +7 -1 +3 +2
9) 5C6H5 -CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Mn+7 + 5e— → Mn+2 |× 6
C-3 — 6e— → C+3 |× 5
—1 -2 -3 +7 -1 +3 +4 +2
10) 5C6H5 -CH2CH3 + 12KMnO4 + 18H2SO4 → 5C6H5-COOH + 5CO2 + 6K2SO4 + 12MnSO4 + 28H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 12
C-2 — 6e— → C+4 | |
|}12e—|× 5
C-3 — 6e— → C+3 | |
-1 -3 +7 -1 +3 +2
11) 5 C6H4(CH3)2 + 12KMnO4 + 18H2SO4 → 5 C6H4(COOH)2 + 6K2SO4 + 12MnSO4 + 28H2O
1,2-диметилбензол орто-фталевая кислота
2C-3 — 12e— → 2C+3 |12e—|× 5
Mn+7 + 5e— → Mn+2 | 5e— |× 12
-1 -1 -2 +7 -1 +3 +4 +2
12) C6H5—CH=CH2 + 2KMnO4 + 3H2SO4 → C6H5COOH + CO2 + K2SO4 + 2MnSO4 + 4H2O
Mn+7 + 5e— → Mn+2 | 5e—|× 2
C-1 — 4e— → C+3 | |
|} 10e—|× 1
C-2 — 6e— → C+4 | |
В нейтральной среде:
-2 -2 +7 -1 -1 +4
1) 3CH2=CH2 + 2KMnO4 + 4H2O → CH2-CH2 + 2MnO2 + 2KOH 2C-2 — 2e— → 2C-1 |× 3
І І Mn+7 + 3e— → Mn+4 |× 1
OH OH
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
3) C6H5—CH=CH2 + 2KMnO4 + 4H2O → C6H5—CH– CH2 + 2MnO2 + 2KOH
І І
OH OH
00C
4) 3CH3–CH=CH2 + 2KMnO4 + 4H2O —→ 3CH3–CH–CH + 2MnO2 + 2KOH
І І
OH OH
C+3OOK
5) 3CHΞCH + 8KMnO4 → 5 І + 8MnO2 + 2KOH + 2H2O
C+3OOK
только ацетилен!
6) 3CH3–CH=CH–СH2– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– СH2– CH3 + 2MnO2 + 2KOH
І І
OH OH
7) CH3–CH=C– CH3 + 2KMnO4 → CH3-C- CH3 + CH3-COOH + 2MnO2 + 2KOH
І ǁ
CH3 O
Реакция присоединения против правила Марковникова:
+ — H2O2
CH3—CH=CH2 + HBr ——→ CH3—CH2—CH2 — 1-бромпропан
|
Br
При наличии атома хлора в молекуле реакция также идёт против правила, т.к. меняется поляризация молекулы:
— + + —
CH2—CH=CH2 + HBr ——→ CH2—CH2—CH2 — 1-бром-3-хлорпропан
| | |
Cl Cl Br
Спирты.
-3 -1 -2 +7 -3 +3 +2
1) CH3-CH2-OH + 4KMnO4 + 6H2SO4 → 5CH3-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-3 -1 -2 +6 -3 +3 +3
2) CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 → 3CH3-COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
+6 -2 +2 +3
3) 2K2Cr2O7 + 3CH3OH + 8H2SO4 → HCOOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
-3 +1 -2 -3 +7 -3 +2 -2 -3 +4
4) 5CH3-CH-CH2-CH3 + 2KMnO4 → 5CH3-C-CH2-CH3 + 2MnO2 + 2KOH + 4H2O
І ǁ
OH O
-1 -1 -2 +7 -1 +3 +2
5) 5C6H5 -CH2OH + 4KMnO4 + 6H2SO4 → 5C6H5-COOH + 2K2SO4 + 4MnSO4 + 11H2O
-2 +7 +4 +2
6) 5CH3-OH + 6KMnO4 + 9H2SO4 → 5CO2 + 3K2SO4 + 6MnSO4 + 19H2O
-3 -1 -2 +7 +4 -3 +3
7) 3CH3-CH2-OH + 4KMnO4 → 4MnO2 + KOH + 4H2O + 3CH3-COOK
Альдегиды.
0 +7 +4 +2
1) 5HCHO + 4KMnO4 + 6H2SO4 → 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
-3 +1 +6 -3 +3 +3
2) 3CH3CHO + K2Cr2O7 + 4H2SO4 → 3CH3-COOH + Cr2(SO4)3 + K2SO4 + 4H2O
-3 +1 +7 -3 +3 +2
3) 5CH3CHO + 2KMnO4 + 3H2SO4 → 5CH3-COOH + K2SO4 + 2MnSO4 + 3H2O
-3 +1 +7 -3 +3 +4
4) 3CH3CHO + 2KMnO4 + KOH → 3CH3-COOK + 2MnO2 + 2H2O
OH
|
5) HC-(CH2)7 -CH3 HC-(CH2)7 -CH3
3 ǁ + 2KMnO4 + 4H2O → 3 | + 2KOH + 2MnO2
HC-(CH2)7 –COOH HC-(CH2)7 -COOH
стеариновая кислота |
OH
9,10 — диоксистеариновая кислота
Другие реакции органических соединений.
Углеводороды.
t0, кат.
1) 2C4H10 + 5 O2 ——→ 4CH3-COOH + 2H2O
2) 3CH3–CH=CH– CH3 + 2KMnO4 + 4H2O → 3CH3–CH–CH– CH3 + 2MnO2 + 2KOH
І І
OH OH
Pd+2
3) 2CH2=CH2 + O2 —→ 2CH3CHO
Ароматические углеводороды.
1) 5С6H4ClC2H5 +12KMnO4 +18H2SO4 → 5C6H4СlCOOH+ 5CO2 +6K2SO4 +12MnSO4+ 28H2O
(орто-,пара- изомеры) (орто-, пара- изомеры)
t0
2) 5 O2N-С6H4-CH3 + 6KMnO4 + 9H2SO4 → 5 O2N-С6H4-COOH + 3K2SO4 + 6MnSO4 + 14H2O
(пара- изомер) (пара- изомер)
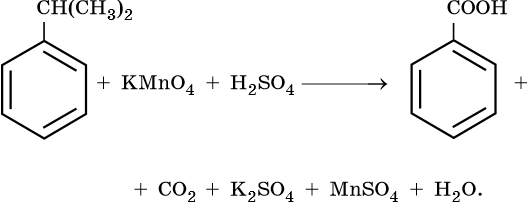
3) 5С6H5CH(CH3)2 +18KMnO4 + 27H2SO4 →5C6H5COOH +10CO2+9K2SO4 +18MnSO4+48H2O
KMnO4
4) CHΞC-С6H4-CH3 ——→ С6H4-(COOH)2
(орто — изомер) орто – фталевая кислота
5) 3С6H5-CH2 -CH=CH2 + 2KMnO4 + 4H2O → 3С6H5-CH2 –CH–CH2 + 2KOH + 2H2O
| |
OH OH
6) 5C6H5—CH2 — CH=CH2 + 16KMnO4 + 24H2SO4 → 5C6H5COOH + 10CO2 + 8K2SO4 + 16MnSO4 + 34H2O
+ —
7) O2N-С6H4-COOH + 3Fe + 7HCl → С6H4(COOH)NH3Cl + 3FeCl3 + 2H2O
Получение.
1) Al4C3 + 12H2O → 4Al(OH)4 + 3CH4
2) Al4C3 + 12HCl → 4AlCl3 + 3CH4
3) CaC2 + 2H2O → Ca(OH)2 + C2H2
Спирты.
1) 3CH2–CH=CH–CH2 + 2KMnO4 + 4H2O → 3CH2–CH–CH–CH2 + 2KOH + 2MnO2
| | | | | |
OH OH OH OH OH OH
2) 3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3-CHO + 2Cr2(SO4)3 + K2SO4 + 7H2O
ацеталь
Альдегиды.
1) CH3CHO + 2NaMnO4 + 3NaOH → CH3-COONa + 2Na2MnO4 + 2H2O
Карбоновые кислоты.
+6 +3 +4 +3
1)K2Cr2O7 +3HOOC-COOH +4H2SO4 → 6CO2 + Cr2(SO4)3 + K2SO4 +7H2O
Соли карбоновых кислот.
электролиз
1) 2CH3-COONa ———→ H2 + C2H6 + 2NaOH + 2CO2
ОКИСЛИТЕЛИ
В ОРГАНИЧЕСКОЙ ХИМИИ
Для окисления веществ в органической химии используют
многие соединения (соединения переходных металлов, кислород, озон, перекиси,
соединения серы, селена, галогенов, азота и многие другие). В данной работе я
уделила внимание, в первую очередь, таким окислителям, как перманганат калия и
бихромат аммония.
При окислении органических веществ хром (VI) в любой среде
восстанавливается до хрома (III), однако, окисление в щелочной среде в
органической химии не находит практического применения.
Перманганат калия в разных средах проявляет себя как
сильный окислитель, но его сила увеличивается в кислой среде.
Гидроксид меди (II) обычно используется для окисления
альдегидов. Реакция проводится при нагревании, при этом гидроксид меди (II)
ярко голубого цвета превращается сначала в гидроксид меди (I) желтого цвета,
который затем разлагается до красного оксида меди (I). В качестве окислителя
альдегидов также применяют аммиачный раствор гидроксида серебра реакция
серебряного зеркала.
Классы органических веществ и окисление
ЧАСТЬ 1. ОКИСЛЕНИЕ
АЛКАНОВ
В ЕГЭ пишем — алканы
не окисляются!!!
При обычных условиях (комнатной
температуре) алканы не окисляются даже сильными окислителями, например такими,
как перманганат и дихромат калия. При нагревании до 2000 С в
присутствии катализатора (чаще всего соединений марганца) происходит окисление
и,в зависимости от условий, образуются спирты, кетоны, альдегиды, карбоновые
кислоты.
В реакцию вступают наиболее
реакционноспособные вторичные или третичные связи С-Н.
СН3— СН
(СН3) -СН3кат, О2→ СН3— (СН3)
С (ОН) -СН3 (2-метил-пропанол-2)
СН3— СН2-СН2—кат, О2СН3кат, О2→ Н2О + СН13— СО-СН2-СН3 (бутанон-2)
R-
СН2-СН2— R +7→ R- СООН + R — СООН
5С10Н14 +24+3 KMn O4 +36H2SO4 → +2
→ 5С6Н5С
ООН+10CO2+12K2SO4 +24 Mn SO4 +56 H2O
При неполном окислении бутана (разрыв связи С2-С3)
получают уксусную кислоту:
СН3— СН2-СН2-СН3
+3О2 кат, О2→ 2СН3— СООН +2Н2О
Горение алканов приводит к образованию СО2 и Н2О
и сопровождается выделением большого количества теплоты (экзотермическая
реакция).
Например: СН4 +2О2
→ СО2 +2Н2О +880 кДж
Высшие алканы (n> 25) под действием кислорода воздуха в
жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот
со средней длиной цепи С12-С18
Кислорода, содержащегося в воздухе, может оказаться
недостаточно при горении высших алканов для их полного окисления до СО2.
Тогда образуются продукты частичного окисления: СО или С и вода. Поэтому высшие
алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный
угарный газ (без запаха и цвета) представляет опасность для человека.
Примечание: первичные атомы углерода имеют
степень окисления -3; вторичные атомы углерода имеют
степень окисления -2; третичные атомы углерода имеют
степень окисления -1; четвертичные атомы углерода имеют
степень окисления -0; ЧАСТЬ 2. ОКИСЛЕНИЕ АЛКЕНОВ
1.
При мягком окислении (нейтральная или слабощелочная среда)
алкены превращаются в двухатомные спирты. Восстановителями служат атомы
углерода, между которыми двойная связь.
Реакции протекают следующим образом:
Этен
Окисление пероксидом
водорода
Пропен
2,3-диметилбутен-2
Окисление
циклогексена
2.
В жестких условиях (кислая среда) при окислении
разрывается углеродная цепь по двойной связи, при этом образуются две
кислоты или кислота и углекислый газ.
Пропен
2-метил-пропен
(Пентен-2)
3.
В жестких условиях (сильнощелочная среда) при
окислении также разрывается углеродная цепь по двойной связи, при этом
образуются соль карбоновой кислоты и карбонат.
Пропен
(Пентен-2)
ЧАСТЬ 3. ОКИСЛЕНИЕ
АЛКИНОВ
Алкины окисляются в более жестких условиях, чем
алкены, при окислении разрывается углеродная цепь по тройной связи, при этом
образуются кислоты и углекислый газ. Продукты реакции зависят от условий
проведения реакций и природы окислителя. Алкины обесцвечивают разбавленный
раствор перманганата калия, что доказывает их непредельность. Происходит при
этом мягкое окисление без разрыва сигма С-С связи. Так получается щавелевая
кислота.
1. Нейтральная
среда
Этин
Бутин-2
2. Кислая среда
Этин
Пропин
ЧАСТЬ 4.
ОКИСЛЕНИЕ ГОМОЛОГОВ БЕНЗОЛА
Бензол не окисляется!
Гомологи бензола
окисляются раствором перманганата калия.
Алкильные цепи, соединенные с ароматическими кольцами,
окисляются до карбоксильных групп под действием таких окислителей, как
бихромат калия в кислой среде, перманганат калия, азотная кислота.
1. Нейтральная
среда
Толуол
Этилбензол
2. Кислая
среда
Толуол
Этилбензол
4-пропилтолуол
4-нитротолуол (при нагревании с перманганатом калия
в сильнокислой среде)
1,3,5-триметилбензол
1,2-диметилбензол
(окисление бихроматом калия)
Окисление стирола в
кислой среде
Окисление стирола в
нейтральной среде
Окисление
фенилацетилена
ЧАСТЬ 5. ОКИСЛЕНИЕ
СПИРТОВ
При окислении первичные
спирты легко превращаются в альдегиды, а вторичные — в кетоны.
Для окисления вторичных спиртов
наиболее часто используют бихромат калия или перманганат калия в кислой среде
при комнатной температуре или небольшом нагревании.
Образующиеся при окислении
альдегиды очень легко окисляются до карбоновых кислот, поэтому первичные спирты
чаще всего окисляют бихроматом калия в кислой среде при температуре кипения
альдегидов (чтобы предотвратить дальнейшее окисление альдегидов). Альдегиды
испаряются и не успевают окислиться.
Однако, при избытке
окислителей в любой среде первичные спирты превращаются в карбоновые кислоты
или соли карбоновых кислот, вторичные спирты превращаются в кетоны. Третичные
спирты в этих условиях не окисляются. Метанол окисляется до углекислого газа.
Кислая среда
Окисление
непредельного спирта в нейтральной среде
Окисление
ароматического спирта
Этиленгликоль HOCH2–CH2OH
(двухатомный спирт), при нагревании в кислой среде с раствором KMnO4 или
K2Cr2O7 легко окисляется до щавелевой кислоты,
а в нейтральной — до оксалата калия.
Окисление
пропндиола-1,4
Окисление
бутен-2-диола-1,4
Фенолы легко окисляются даже под действием кислорода
воздуха; при стоянии на воздухе фенол постепенно окрашивается в
розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным
продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче.
При окислении гидрохинона образуется хинон.
ЧАСТЬ 6. ОКИСЛЕНИЕ
АЛЬДЕГИДОВ
И КЕТОНОВ
Альдегиды легко окисляются до карбоновых кислот. Окисление
можно проводить без нагревания и на холоду раствором перманганата калия,
раствором оксида хрома (VI) в серной кислоте, гидроксидом меди (II), а также
аммиачным раствором гидроксида серебра (реакция серебряного зеркала).
Окисление сильными
окислителями при нагревании:
Муравьиный альдегид окисляется хромовой смесью и
перманганатом калия в кислой среде до углекислого газа.
Окисление этаналя в
кислой среде
Окисление этаналя в
щелочной среде
Окисление этаналя
гидроксидом меди (II)
Окисление
бензальдегида в кислой среде
Окисление кетонов протекает в более жестких условиях, чем
окисление альдегидов, т.к. сопровождается разрывом углеродуглеродных связей.
Для этого применяют сильные окислители в кислой или щелочной среде. В
результате реакции образуется смесь карбоновых кислот.
СН3−СН+3(СН3)
−СН2−С+2О−СН2−СН3 → СН3−СН
(СН3) −С+3ООН +
СН3−СН2−С
ООН
(2-метилпропановая
кислота + пропановая кислота) или: СН3−СН2−СН2−С+2О−СН2−СН3
→2СН3−СН2−С+3ООН
Ацетон CH3COCH3 окисляется кислородом
воздуха на медной поверхности, которая является катализатором. Окисление
происходит с образованием уксусной кислоты CH3COOH и уксусного
альдегида CH3CHO:
2СН3−С+2О−
СН3 +О02 →СН3С+3 ООН
+2СН3С+НО-2
Окисление кетонов
обычно ведут с помощью гипохлоритов
ЧАСТЬ 7. ОКИСЛЕНИЕ
КАРБОНОВЫХ
КИСЛОТ
Среди предельных одноосновных
кислот легко окисляется только метановая кислота. Это связано с тем, что
метановую кислоту можно рассматривать не только как кислоту, но и как альдегид.
При нагревании
Окисление муравьиной
кислоты до углекислого газа
Окисление муравьиной кислоты аммиачным раствором
оксида серебра
Окисление щавелевой
кислоты до углекислого газа
Окисление формиата
натрия до углекислого газа
Окисление
непредельной карбоновой кислоты (пропеновой)
ЧАСТЬ 8. ВАЖНЕЙШИЕ
ОКИСЛИТЕЛИ
Перманганат
калия как окислитель KMn+7O4 + восстановители →
в кислой среде Mn+2→ (соль
той кислоты, которая участвует
в реакции) — Mn+2 SO4, Mn+2 Cl2
в нейтральной среде → Mn+4 O2↓ в щелочной среде →
(K2Mn+7 O4 или KNaMn+6 O4, Na2Mn+6
O4)
Повышение степеней
окисления марганца
1. в щелочной
среде Mn+2, Mn+4 — оксид, гидроксид, соли с очень
сильными окислителями, кислородсодержащими солями хлора (в расплаве) → K2Mn+6O4
2. в кислой среде
Mn+2 — соли с очень сильными окислителями в кислой среде
(азотная или уксусная кислоты): PbO2, KBiO3→
+7 +7
KMn O4, HMn
O4
Дихромат (K2Cr+62O7)
и хромат (K2Cr+6 O4) как окислители
K2Cr2O7 (кислая
и нейтральная среда)
K2CrO4 (щелочная
среда) + восстановители → получается все-
+3
гда Cr
1. в кислой
среде Mn+2→соли кислот, участвующих в реакции
2. в
нейтральной среде → Сr (OН)3↓
3. в
щелочной среде → К3 [Cr+3 (ОН) 6], К3Cr+3О3
(КCr+3О2
в расплаве)
Повышение степеней
окисления хрома
Cr+3 прибавить
очень сильные окислители → Cr+6 (всегда независимо от среды!).
1.
Cr2O3, Cr (OH) 3, соли,
гидроксокомплексы + очень сильные окислители в щелочной среде:
а) KNO3, кислородсодержащие соли хлора (в
щелочном рас-
плаве) образуется K2CrO4
б) Cl2, Br2, H2O2 (в щелочном растворе)
2.
Cr (OH) 3, соли + очень сильные окислители в (HNO3 или
CH3COOH): PbO2, KBiO3 в
кислой среде образуетсяK2CrO7 или
Н2Cr2O7
ЧАСТЬ 9. АЗОТНАЯ И
СЕРНАЯ КИСЛОТЫ
Азотная кислота
При взаимодействии азотной кислоты
с металлами не выделяется водород, образуются продукты восстановления азота.
С холодной концентрированной азотной кислотой не
реагируют: Al, Cr, Fe, Be, Co. Не реагируют с азотной кислотой ни при
какой концентрации: Au, Pt, Pd.
Серная кислота
С холодной концентрированной серной кислотой не
реагируют: Al, Cr, Fe, Be, Co. Не реагируют с к серной кислотой ни при
какой концентрации: Au, Pt, Pd.
Понятие о реакциях
диспропорционирования
Реакции диспропорционирования — это реакции, в которых один
и тот же элемент является и окислителем, и восстановителем, одновременно и
повышая, и понижая свою степень окисления.
Диспропорционирование неметаллов — серы, фосфора, галогенов
(кроме фтора).
Диспропорционирование оксида азота (IV) и
солей.
Слайд 1
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ
Слайд 2
«Думать легко, действовать трудно, а превратить мысль в действие — самая трудная вещь на свете» И. Гете Окислительно-восстановительные реакции в органической химии представляют наибольший интерес, т.к. селективность перехода из одной степени окисления в другую сильно зависит от правильного выбора реагента и условий проведения реакций. Но ОВР изучают в обязательном курсе химии недостаточно полно. Следует обратить особое внимание учащихся на окислительно-восстановительные процессы, происходящие с участием органических веществ. Это связано с тем, что окислительно-восстановительные реакции в контрольно-измерительных материалах ЕГЭ встречаются не только в заданиях С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений органических веществ. В школьных учебниках часто окислитель записывают над стрелкой как [О]. Требованием к выполнению таких заданий на ЕГЭ является обязательное обозначение всех исходных веществ и продуктов реакции с расстановкой необходимых коэффициентов. Окислительно-восстановительные реакции традиционно важны, и в то же время изучение в 10 классе, в курсе «Органическая химия» вызывает у учащихся определенные трудности.
Слайд 3
С3 . Задания этого блока проверяют знания по органической химии В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома ( VI ), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.
Слайд 4
Определение степени окисления атомов в молекулах органических соединений ПРАВИЛО: СО (атома) = число связей с более ЭО атомами минус число связей с менее ЭО атомами.
Слайд 5
Изменение степени окисления атомов углерода в молекулах органических соединений. Класс органических соединений Степень окисления атома углерода -4/-3 -2 -1 0 +1 +2 +3 +4 Алканы CH 4 CH 3 —CH 3 CH 3 —CH 2 —CH 3 CH 3 | C H 3 —C H—CH 3 CH 3 | C H 3 —C —CH 3 | CH 3 — — — — Алкены — CH 2 =CH 2 CH 3 —CH=CH 2 — — — — Алкины — — CH=CH CH 3 —C=CH — — — — Спирты _ _ H 3 C—CH 2 — ОН H 3 C—C H—CH 3 | OH CH 3 | H 3 C — C — CH 3 | OH — — — Галогеналканы — — H 3 C—CH 2 — CI H 3 C — C H — CH 3 | CI CH 3 | H 3 C — C — CH 3 | CI — — — Альдегиды и кетоны — — — — H 3 C—CH =O H 3 C—C OCH 3 — — Карбоновые кислоты — — — — — — H 3 C—C OOH — Продукты полного окисления — — — — — — — CO 2
Слайд 7
Склонность органических соединений к окислению связывают с наличием: кратных связей (легко окисляются алкены, алкины, алкадиены); функциональных групп , способных легко окисляться ( –OH, — СНО, — NH 2 ); активированных алкильных групп , расположенных по соседству с кратными связями или бензольным кольцом (например, пропен может быть окислен до непредельного альдегида акролеина, окисление толуола до бензойной кислоты перманганатом калия в кислой среде); наличие атомов водорода при атоме углерода, содержащем функциональную группу .
Слайд 8
1.МЯГКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Для мягкого окисления органических соединений (спиртов, альдегдов, непредельных соединений) используются соединения хрома ( VI ) – оксид хрома ( VI ), CrO 3 , дихромат калия К 2 С r 2 O 7 и др. Как правило, окисление проводится в кислой среде, продуктами восстановления являются соли хрома ( III ), например: 3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 –COOH + 4K 2 SO 4 + Cr 2 (SO 4 ) 3 + 4H 2 O t 3CH 3 –CH 2 OH+2K 2 Cr 2 O 7 +8H 2 SO 4 →3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4 ) 3 + 11H 2 O При окислении спиртов дихроматом калия на холоду окисление можно остановить на стадии образования альдегида, при нагревании же образуются карбоновые кислоты: 3CH 3 –CH 2 OH+K 2 Cr 2 O 7 +4H 2 SO 4 →3CH 3 –C Н O+K 2 SO 4 +Cr 2 (SO 4 ) 3 +7H 2 O
Слайд 9
АЛК ЕН + KMnO4 -1 КОН Н 2SO4 Диол Соль карбоновой к-ты + карбонат Карбоновая к-та + СО 2 АЛК ЕН + KMnO4 -2 КОН Н 2SO4 2 соли карбоновой к-ты 2 карбоновые к-та Диол 2.Значительно более сильным окислителем является перманганат калия НЕЙТР. НЕЙТР.
Слайд 10
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4 АЛК ИН + KMnO4 -1 КОН Н 2SO4 Соль карбоновой к-ты + карбонат Карбоновая к-та + СО 2 АЛК ИН + KMnO4 -2 КОН Н 2SO4 2 соли карб . к-ты 2 карбоновых к-ты 5CH 3 C = CH + 8KMnO 4 + 12H 2 SO 4 = 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
Слайд 11
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + 14H 2 O C 6 H 5 CH 3 +2KMnO 4 C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O C 6 H 5 CH 2 CH 3 + 4KMnO 4 C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH Гомологи бензола + KMnO4 КОН Н 2SO4 бензойная кислота НЕЙТР. Бензоат
Слайд 12
Окислительно-восстановительные свойства кислородсодержащих соединений Окислителями спиртов чаще всего являются оксид меди ( II ) или перманганат калия, а окислителями альдегидов и кетонов — гидроксид меди ( II ), аммиачный раствор оксида серебра и другие окислители
Слайд 13
ОЛ + KMnO4 -1 КОН Н 2SO4 АЛЬДЕГИД ОЛ + KMnO4 -2 КОН Н 2SO4 кетон ОЛ + К MnO4 (изб.) -1 КОН Н 2SO4 НЕЙТР Соль карбоновой кислоты Соль карбоновой кислоты Карбоновая кислота
Слайд 14
Аль дегид + KMnO4 КОН Н 2SO4 Карбоновая кислота + соль карбоновой кислоты Соль карбоновой кислоты карбоновая кислота НЕЙТР . 3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
Слайд 15
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями CH 3 CHO + 2[Ag(NH 3 ) 2 ]OH CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
Слайд 16
Алгоритм подбора коэффициентов Поскольку в задании С3 при составлении уравнений ОВР не требуется написания уравнений электронного баланса, подбирать коэффициенты удобно методом подстрочного баланса – упрощенным способом баланса электронного. 1 . Составляется схема ОВР. Например, для окисления толуола до бензойной кислоты подкисленным раствором перманганата калия схема реакции такова: С 6 Н 5 -СН 3 + KMnO 4 + H 2 SO 4 С 6 Н 5 -С OO Н + K 2 SO 4 + MnSO 4 + H 2 O 2. Указываются с.о. атомов. С.о. атома углерода определяется по приведенному выше способу. С 6 Н 5 -С -3 Н 3 + KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 3. Число электронов, отданных атомом углерода (6), записывается как коэффициент перед формулой окислителя (перманганата калия): С 6 Н 5 -С -3 Н 3 + 6 KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 4. Число электронов, принятых атомом марганца (5), записывается как коэффициент перед формулой восстановителя (толуола): 5 С 6 Н 5 -С -3 Н 3 + 6 KMn +7 O 4 + H 2 SO 4 С 6 Н 5 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 5. Важнейшие коэффициенты на месте. Дальнейший подбор не составляет труда: 5 С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 5 С 6 Н 5 -С OO Н + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Слайд 17
Пример тестового задания(С3) 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Hg 2+ , H + KMnO 4 , H + С l 2 (эквимол.), h С 2 Н 2 Х 1 СН 3 СООН Х 2 СН 4 X 3 1. реакция Кучерова. Hg 2+ , H + CH CH + H 2 O CH 3 CHO 2.Альдегиды легко окисляются до карбоновых кислот, в том числе таким сильным окислителем, как перманганат калия в кислой среде. CH 3 CHO + KMnO 4 + H 2 SO 4 CH 3 COOH + K 2 SO 4 + MnSO 4 + H 2 O СН 3 С +1 Н О + KMn +7 O 4 + H 2 SO 4 СН 3 -С +3 OO Н + K 2 SO 4 + Mn +2 SO 4 + H 2 O 5 CH 3 CHO + 2 KMnO 4 + 3 H 2 SO 4 5 CH 3 COOH + K 2 SO 4 + 2 MnSO 4 + 3 H 2 O 3.Для выполнения следующего звена цепочки необходимо оценить вещество Х 2 с двух позиций: во-первых, оно в одну стадию образуется из уксусной кислоты, во-вторых, из него можно получить метан. Это вещество – ацетат щелочного металла. Записываются уравнения третьей и четвертой реакций. CH 3 COOH + NaOH CH 3 COONa + H 2 O сплавление 4. CH 3 COONa + NaOH CH 4 + Na 2 CO 3 5.Условия протекания следующей реакции (свет) однозначно указывают на ее радикальный характер. С учетом указанного соотношения реагентов (эквимолярное) записывается уравнение последней реакции: h CH 4 + Cl 2 CH 3 Cl + HCl
Слайд 18
Сайты тренажеры: http://reshuege.ru/ (Решу ЕГЭ) http://4ege.ru/himiya/4181-demoversiya-ege-po-himii-2014.html (ЕГЭ портал) http://www.alleng.ru/edu/chem3.htm (Образовательные ресурсы Интернета — Химия) http://ege.yandex.ru/ (онлайн-тесты)
Тренировочные задания. Окислительно-восстановительные реакции с участием органических веществ
1. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
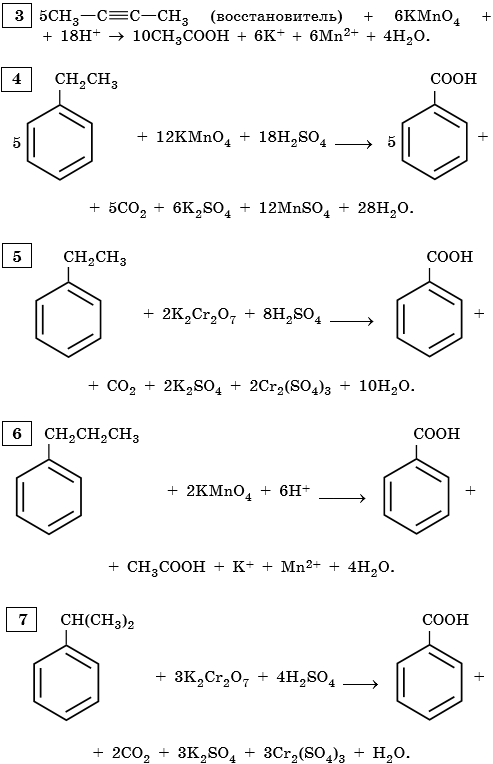
5. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
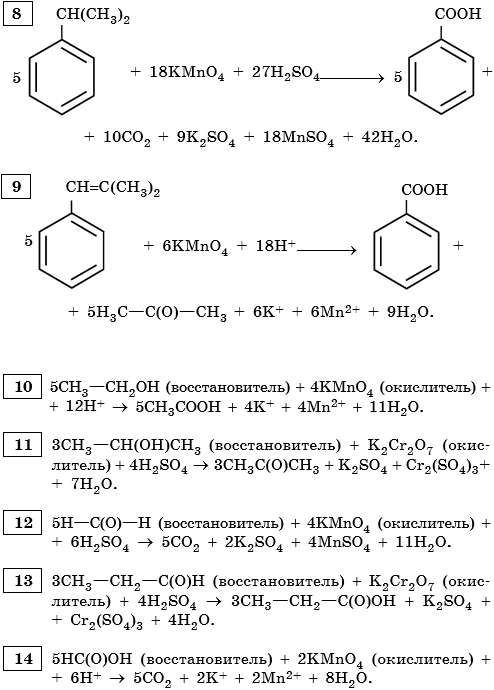
8. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель.
Ответы
Вы завершили курс по самостоятельной подготовке к ЕГЭ по химии. Если остались пробелы — закройте их с онлайн репетитором. Выбрать репетитора можно на сайте — http://profi-teacher.ru/school-predmety/repetitors-ximii/