Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 20 № 89
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 1.
2
Установите соответствие между формулой вещества и продуктом, образующимся на катоде при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ЭЛЕКТРОЛИЗА,
ОБРАЗУЮЩИЙСЯ НА КАТОДЕ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
3
Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
4
Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА АНОДЕ
1) хлор
2) оксид серы(IV)
3) оксид углерода(IV)
4) азот
5) кислород
6) оксид азота(IV)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
5
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА КАТОДЕ
1) водород
2) алюминий
3) ртуть
4) медь
5) кислород
6) натрий
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Пройти тестирование по этим заданиям
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 263 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) расплава
2) горячего водного раствора
3) водного раствора
4) расплава
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) водного раствора (без диафрагмы)
2) водного раствора
3) водного раствора
4) расплава
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и водород
2) металл, вода и кислород
3) водород и кислород
4) водород, углекислый газ и углеводород
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах:: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) металл и галоген
4) водород и галоген
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) расплава
2) холодного водного раствора
3) водного раствора
4) расплава
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) расплава
2) горячего водного раствора
3) расплава
4) раствора
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Установите соответствие между исходным веществом и продуктами электролиза этого вещества, образовавшимися на инертных электродах.
ИСХОДНОЕ ВЕЩЕСТВО
А) раствор
Б) расплав
В) раствор
Г) расплав
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между исходным веществом и продуктами электролиза этого вещества, образовавшимися на инертных электродах.
ИСХОДНОЕ ВЕЩЕСТВО
А) раствор
Б) расплав
В) раствор
Г) раствор
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, образовавшимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, образовавшимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, образовавшимися на инертных электродах.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) водород и галоген
3) металл и кислород
4) металл и галоген
5) водород и оксид азота
6) металл, водород и кислород
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) водород и галоген
3) металл и кислород
4) металл и галоген
5) водород и оксид азота
6) металл, водород и кислород
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород, галоген
2) металл, кислород
3) металл, галоген
4) водород, кислород
5) металл, галоген, кислород
6) металл, водород, кислород
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 1
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и хлор
2) водород и кислород
3) металл и кислород
4) водород и хлор
5) водород, металл и кислород
6) водород, металл и хлор
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2021. Основная волна. Вариант 2
Установите соответствие между веществом и возможным способом его получения путем электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) алюминий
Б) кислород
В) калий
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ
1) раствора в расплавленном криолите
2) водного раствора
3) водного раствора
4) расплава
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2022 по химии
Установите соответствие между формулой вещества и продуктом(ами) электролиза водного раствора этого вещества, образовавшим(и)ся на инертном аноде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ(Ы) НА АНОДЕ
1) кислород
2) галоген
3) галогеноводород
4) углекислый газ и водород
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210301.
Установите соответствие между формулой вещества и продуктом(ами) электролиза водного раствора этого вещества, образовавшим(и)ся на катоде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ(Ы) НА КАТОДЕ
1) металл
2) только водород
3) водород и щелочь
4) сернистый газ
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210302.
Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
МЕТАЛЛ
А) калий
Б) медь
В) хром
Г) кальций
СПОСОБ ПОЛУЧЕНИЯ
1) электролиз водного раствора сульфата
2) электролиз расплавленного хлорида
3) электролиз расплавленного нитрата
4) электролиз водного раствора гидроксида
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой вещества и продуктом электролиза водного раствора этого вещества, образовавшимся на инертном аноде.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Всего: 263 1–20 | 21–40 | 41–60 | 61–80 …
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
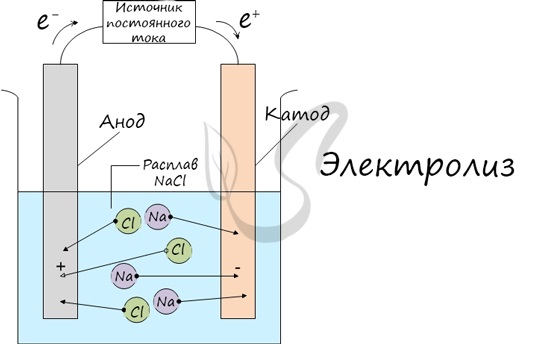
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
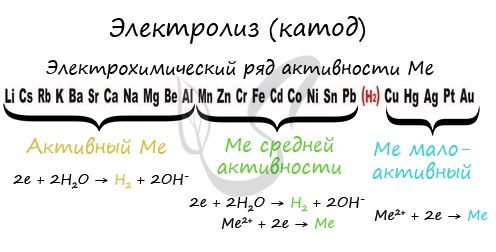
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl—, Br—,
I—, F—, S2-, CH3COO—.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
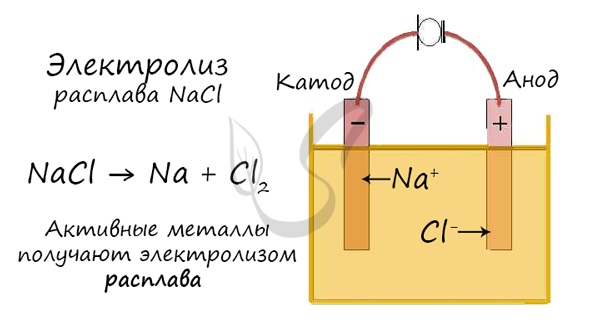
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи.
При решении задач на электролиз необходимо учитывать, что растворенное вещество может подвергнуться электролизу не полностью. Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
2H2O → O2 + 2H2
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами в ЕГЭ по химии пока нет.
1. Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO3 + 2H2O → 4Ag + 4HO3 + O2
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/108 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O2) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
Объем кислорода:
V(O2) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO3) = n(Ag) = 0,02 моль
m(HNO3) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO3) = m(HNO3)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O2) = 0,112 л, ω(HNO3) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H3PO4) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H2O → 2KOH + Cl2 + H2
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H3PO4) = mр-ра(H3PO4) ·ω(H3PO4) = 50 г · 0,196 = 9,8 г
n(H3PO4) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
H3PO4 + 3KOH → K3PO4 + 3H2O
При соотношении кислоты и щелочи n(H3PO4):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K2HPO4) = n(H3PO4) = 0,1 моль
Ответ: K2HPO4
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H2O → O2 + 2H2
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто — за счет электролиза воды. Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,2(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H2O) = mр-ра,1(NaOH) – mр-ра,2(NaOH) = 525 – 241,5 = 283,5 г
n(H2O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H2) = n(H2O) = 15,75 моль
V(H2) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О2) = 1/2·n(H2O) = 7,875 моль
V(O2) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ: V(H2) = 352,8 л, V(O2) = 176,4 л
4. При электролизе (с инертным анодом) 235 г раствора нитрата меди (II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся растворе.
5.При электролизе раствора хлорида натрия на катоде выделилось 13,44 л водорода (н.у.). Хлор, выделившийся на аноде, поглотили горячим раствором гидроксида калия. Рассчитайте количества солей – хлорида калия и хлората калия, − образовавшихся в растворе в результате реакции.
6. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора йодида калия. Рассчитайте объём газа (н.у.), выделившегося на аноде и массовую долю йодида калия в растворе.
7. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
8. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз.
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Находим массу чистого сульфата меди:
m(CuSO4) = mраствора*ω(CuSO4) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO4) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O2) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O2) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди. При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г).
При этом масса полученного раствора после электролиза mр-ра2 равна:
mр-ра2 = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля. Найдем массовую долю сульфата меди ω(CuSO4)2 и серной кислоты ω(H2SO4) в растворе, который остался после электролиза:
m(CuSO4)ост = n*M = 0,4*160 = 64 г
ω(CuSO4)2 = m(CuSO4)2/*mр-ра2 = 64/492 = 0,13 = 13%
ω(H2SO4) = m(H2SO4)/*mр-ра2 = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO4)3 = ω(CuSO4)2*mр-ра3 = 0,13*98,4 = 12,79 г
m(H2SO4)2 = ω(H2SO4)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO4) = m/M = 12,79/160 = 0,08 моль
n(H2SO4) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + 2H2O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: масса раствора 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
9. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения
искомых физических величин).
Уравнения реакций:
2CuSO4 + 2H2O = 2Cu↓ + 2H2SO4 + O2↑ (электролиз)
2H2O = 2H2↑ + O2↑ (электролиз)
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO4) = 640 · 0,15 = 96 г n(CuSO4 ) = 96 / 160 = 0,6 моль
n(O2) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO4) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H2SO4) = n(CuSO4 ) = 0,6 моль
n(O2 [1]) = 0,5n(CuSO4) = 0,3 моль
n(O2 [2]) = 0,5 – 0,3 = 0,2 моль
n(H2O прореаг.) = 2n(O2 [2]) = 0,4 моль
m(H2O прореаг.) = 0,4 · 18 = 7,2 г
m(O2 [1]) = 32 · 0,3 = 9,6 г
m(BaCl2) = 665,6 · 0,25 = 166,4 г
n(BaCl2) = 166,4 / 208 = 0,8 моль
n(BaCl2 прореаг.) = n(H2SO4) = 0,6 моль
n(BaCl2 осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl2 осталось) = 0,2 · 208 = 41,6 г
n(BaSO4) = n(BaCl2 прореаг.) = 0,6 моль
m(BaSO4) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl2) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ: ω(BaCl2) = 3,7 %
10. В результате электролиза раствора хлорида натрия получили раствор, содержащий 20 г гидроксида натрия. Газ, выделившийся на аноде, полностью прореагировал с 500 мл раствора иодида калия. Рассчитайте объём газа (н.у.) и молярную концентрацию использованного раствора иодида калия.
11. При электролизе 200 г раствора гидроксида натрия с ω(NaОН) = 4% на аноде выделилось 44,8 л (н.у.) кислорода. Какой объём водорода выделился на катоде, и какой стала массовая доля NaOH в растворе после электролиза?
12. При электролизе 200 г раствора хлорида натрия с массовой долей соли 17,55% из раствора выделилось 3,36 л хлора (н.у.). Определите массовые доли веществ в растворе после прекращения электролиза.
13. При электролизе (с инертным анодом) 235 г раствора нитрата меди(II) с ω(Cu(NO3)2) = 20% на катоде выделилось 9,6 г металла. Вычислите объём газа (н.у.), выделившегося на аноде, и массовые доли кислоты и соли в оставшемся
растворе.
14. При электролизе 900г 3%-ного раствора нитрата натрия на аноде выделилось 90л (н.у.) кислорода. Определите массовую долю нитрата натрия в растворе после окончания электролиза.
15. Какую массу свинца можно получить при электролизе 200г раствора нитрата свинца с массовой долей 10%?
16. Для нейтрализации кислоты, образовавшейся после электролиза нитрата серебра, потребовалось 145,5мл 10%-ного раствора гидроксида натрия с плотностью 1,1г/мл. Определите массу выделившегося на катоде серебра.
Ответ: 43,2г
17. После электролиза 500г водного раствора сульфата меди масса раствора уменьшилась на 8г. Оставшийся раствор нацело прореагировал с 8,96л (н.у.) сероводорода. Определите массовую долю сульфата серебра в исходном растворе и массовые доли веществ, оставшихся в растворе после электролиза.
18. После электролиза с инертными электродами 500г водного раствора сульфата меди с массовой долей 16% масса раствора уменьшилась на 16г. Определите массу меди, выделившейся на катоде и массовые доли веществ, оставшихся в растворе после электролиза.
19. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5% масса раствора уменьшилась на 20,22%. Определите массы веществ, выделившихся на электродах, и молярную концентрацию веществ в конечном растворе, если его плотность составила 1,06 мл.
20. В результате электролиза 400мл 20%-ного раствора CuSO4 с плотностью 1,2г/мл на аноде выделилось 4,48л (н.у.) газа. Определите массы веществ, выделившихся на электродах и массовые доли веществ в конечном растворе.
21. После электролиза 200г 2%-ного водного раствора гидроксида натрия массовая доля гидроксида натрия увеличилась на 0,44%. Определите количества веществ, выделившихся на катоде и аноде.
22. При электролизе соли металла, проявляющего в своих соединениях степени окисления +2 и +3, на катоде было получено 2,6 г металла, а на аноде выделился 1,68 л (н.у.) газа с плотностью по водороду 35,5. Определите формулу соли, которая подверглась электролизу.
Ответ: CrCl3
23. 150 г раствора, содержащего 8% сульфата меди (II) и 11,7% хлорида натрия, подвергли электролизу. Электролиз прекратили, когда на катоде выделилось 1,12л (н.у.) водорода. Определите, какие вещества находятся в растворе после электролиза, а также их количество.
24. Раствор, содержащий по 0,2 моль нитрата меди (II), хлорида калия и сульфата рубидия, подвергли электролизу до полного выделения меди. Определите объёмы газов, выделившихся на электродах, и количества веществ в полученном растворе. Какова среда конечного раствора?
25. Раствор, содержащий 0,1моль нитрата ртути (II), 0,3 моль хлорида калия и 0,2моль сульфата натрия подвергли электролизу до полного выделения хлора. Определите объёмы газов, выделившихся на электродах и количества веществ в полученном растворе. Какова среда полученного раствора?
Другие задачи на электролиз:
26. Электролиз 282 г 40%-ного раствора нитрата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
27. При проведении электролиза 340 г 20%-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1, 12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждении ионов серебра из отобранной порции раствора.
28. При проведении электролиза 312 г 15%-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
29. Электролиз 640 г 15%-ного раствора сульфата меди (II) остановили после того, когда масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
30. При проведении электролиза 360 г 18,75% раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
31. При проведении электролиза 624 г 10%-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
32. При проведении электролиза 500 г 16%-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди (II) в полученном растворе.
33. Через 200 г раствора поваренной соли, содержащего 17,55 мас. % NaСl, некоторое время пропускали постоянный ток. Выделилось 3,36 л хлора (н.у.). Определите концентрации веществ в мaс.% в полученном растворе.
34. При электролизе 188 г 50 мас. % раствора нитрата меди (II) на катоде выделилось 19,2 г металла. Найти объем газа (н.у.), выделившегося на аноде, и концентрации кислоты и соли в массовых процентах в электролизере.
35. После электролиза 250 г раствора нитрата ртути (II) с массовой долей соли 19,5 % масса раствора уменьшилась на 10,85 г. Определите количества веществ, выделившихся на электродах и массовые доли веществ в оставшемся растворе.
36. 50 г водного раствора сульфата меди подвергли электролизу, при этом на аноде выделилось 2,8 л газа (н.у.). Определите массовую долю сульфата меди в исходном растворе, если известно, что после электролиза масса раствора составила 42,4 г.
37. Определите состав раствора (в массовых долях), полученного в результате электролиза 100 г раствора сульфата меди, если известно, что во время электролиза на аноде выделилось 2,8 л газа (н.у.), а масса раствора после электролиза составила 92,4 г.
38. 117 г раствора хлорида натрия с массовой долей соли 5 % в течение некоторого времени подвергали электролизу. При этом на электродах выделилось 8,96 л газов (н.у.). Определите состав раствора после электролиза (в массовых долях).
39. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Ответ: w(CuSO4) = 11,79%
40. Для проведения электролиза (на инертных электродах) взяли 500 г 16%-ного раствора сульфата меди(II). После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, который нужно добавить к отобранной порции раствора до полного осаждения ионов меди.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора NaOH) = 40 г
41. Для проведения электролиза (на инертных электродах) взяли 135 г 40%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 27 г, процесс остановили. К образовавшемуся раствору добавили 160 г 30%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 12,88%
42. Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaCl) = 4,6%
43. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10%-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: m(раствора NaCl) = 29,25 г
44. Для проведения электролиза (на инертных электродах) взяли 170 г 40%-ного раствора нитрата серебра. После того как на аноде выделилось 1,12 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 175,5 г 10%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 2%
45. Для проведения электролиза (на инертных электродах) взяли 282 г 40%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 140 г 40%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 2,16%
46. Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди(II). После того как масса раствора уменьшилась на 32 г, процесс остановили. К образовавшемуся раствору добавили 400 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + 2NaOH = Na2SO4 + 2H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 3,2%
47. Для проведения электролиза (на инертных электродах) взяли 234 г 20%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю щёлочи в полученном растворе.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: w(NaOH) = 2,3%
48. Для проведения электролиза (на инертных электродах) взяли 470 г 20%-ного раствора нитрата меди(II). После того как масса раствора уменьшилась на 24 г, процесс остановили. К образовавшемуся раствору добавили 212 г 10%-ного раствора карбоната натрия. Определите массовую долю нитрата меди(II) в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Ответ: w(Cu(NO3)2) = 5,79%
49. Для проведения электролиза (на инертных электродах) взяли 360 г 18,75%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 22,2 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 8 г
50. Для проведения электролиза (на инертных электродах) взяли 376 г 30%-ного раствора нитрата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 224 г 25%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
HNO3 + NaOH = NaNO3 + H2O
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
Ответ: w(NaOH) = 1,46%
51. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10%-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: m(раствора Na2CO3) = 47,7 г
52. Для проведения электролиза (на инертных электродах) взяли 312 г 15%-ного раствора хлорида натрия. После того как на катоде выделилось 6,72 л (н.у.) газа, процесс остановили и отобрали порцию полученного раствора массой 58,02 г. Вычислите массу 20%-ного раствора сульфата меди(II), необходимого для полного осаждения гидроксид-ионов из отобранной порции раствора.
2NaCl + 2H2O = H2 + 2NaOH + Cl2 (электролиз)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Ответ: m(раствора CuSO4) = 48 г
53. Для проведения электролиза (на инертных электродах) взяли 340 г 20%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 23,2 г, процесс остановили. К образовавшемуся раствору добавили 175,5 г 20%-ного раствора хлорида натрия. Определите массовую долю хлорида натрия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + NaCl = AgCl + NaNO3
Ответ: w(NaCl) = 5,05%
53. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 120 г 20%-ного раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: w(NaOH) = 2,3%
54. Для проведения электролиза (на инертных электродах) взяли 360 г 15%-ного раствора хлорида меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Ответ: m(раствора NaOH) = 32 г
55. Для проведения электролиза (на инертных электродах) взяли 170 г 15%-ного раствора хлорида лития. После того как на аноде выделилось 2,24 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 410 г 16%-ного раствора фосфата натрия. Определите массовую долю фосфата натрия в полученном растворе.
2LiCl + 2H2O = H2 + 2LiOH + Cl2 (электролиз)
3LiOH + Na3PO4 = Li3PO4 + 3NaOH
3LiCl + Na3PO4 = Li3PO4 + 3NaCl
Ответ: w(Na3PO4) = 6%
56. Для проведения электролиза (на инертных электродах) взяли 624 г 10%-ного раствора хлорида бария. После того как на катоде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 265 г 20%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в полученном растворе.
BaCl2 + 2H2O = H2 + Ba(OH)2 + Cl2 (электролиз)
Ba(OH)2 + Na2CO3 = BaCO3 + 2NaOH
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
Ответ: w(Na2CO3) = 2,6%
57. Для проведения электролиза (на инертных электродах) взяли 240 г 40%-ного раствора сульфата меди(II). После того как на аноде выделилось 4,48 л (н.у.) газа, процесс остановили. К образовавшемуся в процессе электролиза раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
H2SO4 + BaCl2 = BaSO4 + 2HCl
CuSO4 + BaCl2 = BaSO4 + CuCl2
Ответ: w(BaCl2) = 5,67%
58. Для проведения электролиза (на инертных электродах) взяли 372,5 г 20%-ного раствора хлорида калия. После того как масса раствора уменьшилась на 29,2 г, процесс остановили. К образовавшемуся раствору добавили 152 г 20%-ного раствора сульфата железа(II). Определите массовую долю хлорида калия в полученном растворе.
2KCl + 2H2O = H2 + 2KOH + Cl2 (электролиз)
FeSO4 + 2KOH = Fe(OH)2 + K2SO4
Ответ: w(KCl) = 3,12%
59. Для проведения электролиза (на инертных электродах) взяли 80 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 0,896 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 28 г порошка железа. Определите массовую долю сульфата железа(II) в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Fe + CuSO4 = FeSO4 + Cu
Fe + H2SO4 = FeSO4 + H2
Ответ: w(FeSO4) = 19,5%
60. Для проведения электролиза (на инертных электродах) взяли 340 г 40%-ного раствора нитрата серебра. После того как масса раствора уменьшилась на 46,4 г, процесс остановили. К образовавшемуся раствору добавили 207,5 г 40%-ного раствора иодида калия. Определите массовую долю иодида калия в полученном растворе.
4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2 (электролиз)
AgNO3 + KI = AgI + KNO3
Ответ: w(KI) = 4,08%
61. Для проведения электролиза (на инертных электродах) взяли 180 г 37,5%-ного раствора хлорида меди(II). После того как на аноде выделилось 6,72 л (н.у.) газа, процесс остановили. Из полученного раствора отобрали порцию массой 55,8 г. Вычислите массу 10%-ного раствора сульфида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + Na2S = CuS + 2NaCl
Ответ: m(раствора Na2S) = 62,4 г
62. Для проведения электролиза (на инертных электродах) взяли 270 г 20%-ного раствора хлорида меди(II). После того как масса раствора уменьшилась на 40,5 г, процесс остановили. К образовавшемуся раствору добавили 70 г 40%-ного раствора гидроксида калия. Определите массовую долю щёлочи в полученном растворе.
CuCl2 = Cu + Cl2 (электролиз)
CuCl2 + 2KOH = Cu(OH)2 + 2KCl
Ответ: w(KOH) = 5,8%
63. Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того как на аноде выделилось 5,6 л (н.у.) газа, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе.
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2 (электролиз)
Zn + CuSO4 = ZnSO4 + Cu
Zn + H2SO4 = ZnSO4 + H2
Ответ: w(ZnSO4) = 20,4%
Региональный конкурс «Лучшая методическая разработка»
Номинация №3 «Лучшая авторская разработка комплекта учебно-методических материалов/ методических рекомендаций»
Методическая разработка: Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»
Разработала: Сластная Оксана Анатольевна, учитель химии и биологии
МБОУ «Мишелёвская СОШ №19»
2022
Оглавление
Немного теории 3
Задание 20 7
Задание 20 для самостоятельной работы 10
Задание 31 13
Задание 31 для самостоятельной работы 14
Задание 32 14
Задание 32 для самостоятельной работы 15
Ответы к заданиям для самостоятельной работы 16-17
Немного теории
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на катоде и аноде при пропускании электрического тока через растворы или расплавы электролитов.
Катод–отрицательно заряженный электрод, к которому притягиваются катионы.
Анод– положительно заряженный электрод, к которому притягиваются анионы.
Инертные электроды состоят из вещества, не участвующего в реакции электролиза
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион











Задание 20
1. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
|
|
А) Б) В) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
3 |
5 |
3 |
4 |
2. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
||
|
A) Б) B) Г) |
1) водород 2) алюминий 3) ртуть 4) медь 5) кислород 6) натрий |
||
|
А |
Б |
В |
Г |
|
1 |
3 |
4 |
1 |
3. Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
A) литий Б) фтор B) серебро Г) магний |
1) раствора 2) расплава 3) раствора 4) раствора 5) расплава 6) расплава |
||
|
А |
Б |
В |
Г |
|
2 |
2 |
4 |
6 |
4. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА КАТОДЕ |
|
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
|
А |
Б |
В |
Г |
|
2 |
2 |
1 |
1 |
5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
А) Б) В) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
6. Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
6 |
5 |
6 |
7. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
3 |
3 |
2 |
2 |
8. Установите соответствие между формулой вещества и простым веществом, которое образуется на катоде в результате электролиза его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
|
2 |
3 |
6 |
2 |
9. Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
||
|
А) Б) В) Г) |
1) хлор 2) оксид серы(IV) 3) водород 4) натрий 5) кислород |
||
|
А |
Б |
В |
Г |
|
1 |
5 |
5 |
5 |
10. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТ НА АНОДЕ |
||
|
A) Б) B) Г) |
1) метан 2) сернистый газ 3) кислород 4) водород 5) бром 6) этан |
||
|
А |
Б |
В |
Г |
|
3 |
6 |
5 |
3 |
Задание 20 для самостоятельной работы
1. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
СХЕМА ПРОЦЕССА НА АНОДЕ |
||
|
A) Б) B) Г) |
1) 2) 3) 4) 5) 6) |
||
|
А |
Б |
В |
Г |
2. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
АНОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) металл 3) иод 4) фтор 5) углекислый газ 6) хлор |
||
|
А |
Б |
В |
Г |
3. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) натрий 2) барий 3) алюминий 4) медь 5) водород 6) кислород |
||
|
А |
Б |
В |
Г |
4. Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
А) калий Б) медь В) хром Г) кальций |
1) электролиз водного раствора сульфата 2) электролиз расплавленного хлорида 3) электролиз расплавленного нитрата 4) электролиз водного раствора гидроксида |
||
|
А |
Б |
В |
Г |
5. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
КАТОДНЫЙ ПРОДУКТ |
||
|
А) Б) В) Г) |
1) кислород 2) только металл 3) только водород 4) металл и водород 5) азот 6) хлор |
||
|
А |
Б |
В |
Г |
6. Установите соответствие между названием металла и промышленным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
МЕТАЛЛ |
СПОСОБ ПОЛУЧЕНИЯ |
||
|
A) кальций Б) серебро B) натрий Г) свинец |
1) электролиз водного раствора хлорида 2) электролиз водного раствора нитрата 3) электролиз расплавленного нитрата 4) электролиз расплавленного хлорида |
||
|
А |
Б |
В |
Г |
7. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА В РАСТВОРЕ |
||
|
A) Б) В) Г) |
1) 2) 3) 4) 5) |
||
|
А |
Б |
В |
Г |
8. Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
||
|
А) водород Б) хлор В) калий Г) алюминий |
1) расплава 2) раствора 3) водного раствора 4) водного раствора 5) водного раствора |
||
|
А |
Б |
В |
Г |
Задание 31
1. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите молекулярные уравнения четырех описанных реакций.
Решение:
2. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, ввели в колбу с нагретым фосфором. Полученную в колбе жидкость растворили в воде. Образовавшийся раствор обесцвечивает бромную воду. Напишите уравнения четырёх описанных реакций.
Решение:
1. (электролиз)
2.
3.
4.
3. Провели электролиз раствора нитрата меди(II). Выделившийся газ прореагировал с натрием. Полученное вещество растворили в холодной воде. К образовавшемуся раствору добавили раствор сульфата хрома(III) и нагрели. При этом окраска раствора изменилась на жёлтую. Напишите уравнения описанных реакций.
Решение:
Задание 31 для самостоятельной работы
1. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, собрали в колбу, в которую затем опустили небольшой кусочек нагретого фосфора. После окончания реакции в колбу добавили воду и получили раствор, при добавлении к которому нитрата серебра выпал белый творожистый осадок. Напишите уравнения четырёх описанных реакций.
2. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
3. Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившееся на катоде простое вещество растворили в концентрированной серной кислоте, при этом наблюдали выделение бесцветного газа с резким запахом. Газ собрали и пропустили через раствор сероводородной кислоты, в результате чего в осадок выпало простое вещество желтого цвета. Это вещество прореагировало с расплавленным гидроксидом калия. Напишите уравнения четырёх описанных реакций.
Задание 32
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
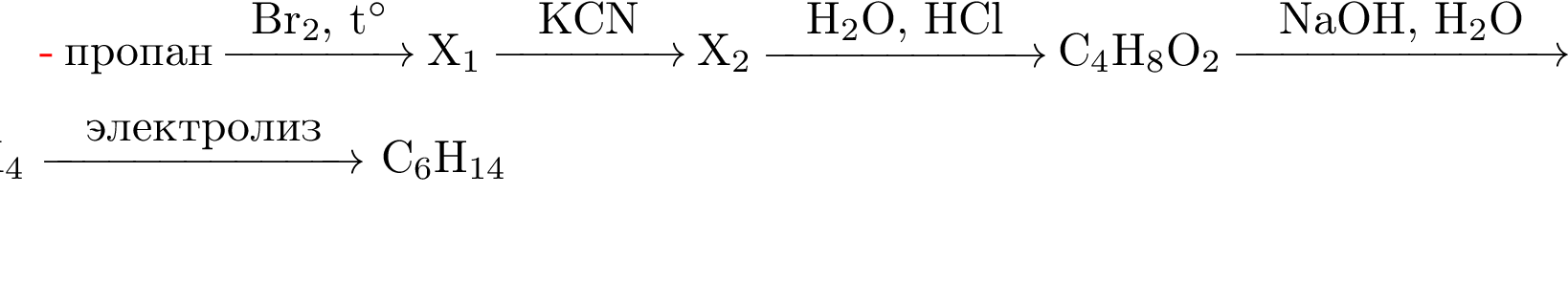
Решение:
1.
2.
3.
4.
5. 
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
→
→
→
→
Решение. 1)
2)
3)
4)
5)
Задание 32 для самостоятельной работы
1.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
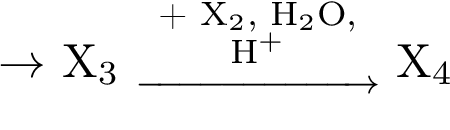
Ответы к заданиям для самостоятельной работы:
Задание 20.
|
№ задания |
А |
Б |
В |
Г |
|
1 |
3 |
3 |
2 |
2 |
|
2 |
3 |
1 |
6 |
1 |
|
3 |
5 |
5 |
5 |
4 |
|
4 |
2 |
1 |
1 |
2 |
|
5 |
3 |
2 |
3 |
4 |
|
6 |
4 |
2 |
4 |
2 |
|
7 |
3 |
3 |
5 |
4 |
|
8 |
4 |
4 |
1 |
2 |
Задание 31.
1. Решение:
1) (электролиз)
2)
3)
4)
2. Решение:
1) (электролиз)
2)
3)
4)
3. Решение:
1)
2)
3)
4)
Задание 32.
-
Решение:
1) 
2)
3) 
4) 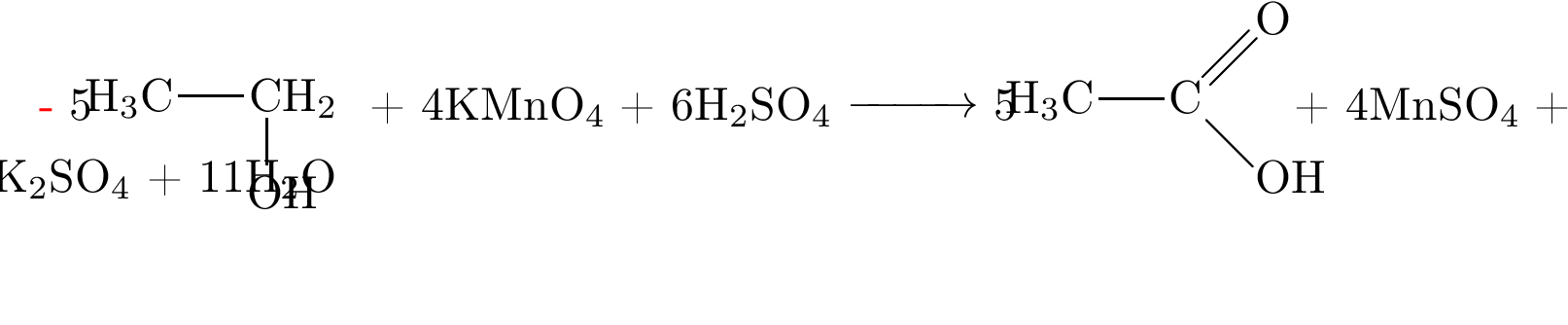
5) 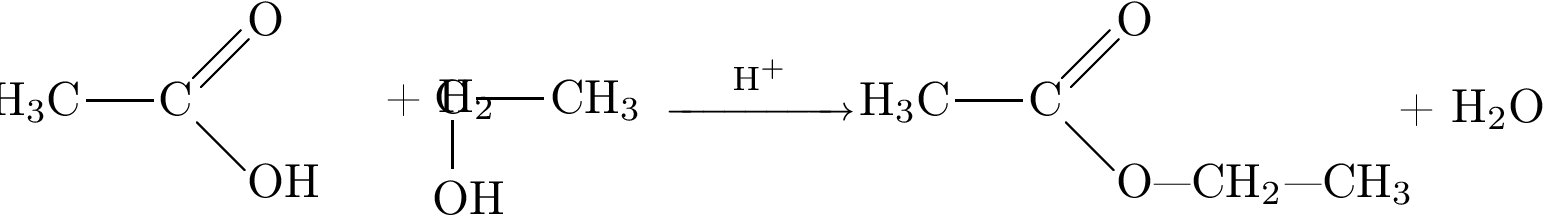
- ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей, кислот) — задания № 20 ЕГЭ по химии в формате экзамена 2022 года.
40 заданий с ответами.
→ скачать задания
Источник: vk.com/chem4you
Примеры заданий:
Установите соответствие между формулой вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Al
Б) F2
В) S
Г) K
1) электролиз раствора сульфида
2) электролиз раствора сульфата
3) электролиз расплава оксида в растворе криолита
4) электролиз расплава фторида
5) электролиз раствора фторида
6) электролиз раствора ацетата
Установите соответствие между формулами солей и продуктами, которые выделяются на инертном катоде при их электролизе в указанных условиях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) NaF (распл.)
Б) AgNO3 (р-p)
В) MnSO4 (р-р)
Г) RbCl (р-р)
1) кислород
2) водород
3) металл
4) металл, водород
5) галоген
6) оксид неметалла, кислород
Смотрите также:
Государственное общеобразовательное учреждение —
средняя общеобразовательная школа
при Посольстве России в Турции
Конспект урока по химии
в 11 классе
«Электролиз расплавов и растворов»
(изучение темы при подготовке обучающихся к сдаче ЕГЭ,
базовый уровень)
подготовила
учитель химии и биологии
Попова Елена Игоревна
г. Анкара
2012
Тема: «Электролиз растворов и расплавов»
(изучение темы при подготовке обучающихся к сдаче ЕГЭ,
базовый уровень)
Цель:
— подготовить обучающихся к решению заданий по теме «Электролиз» на ЕГЭ
Задачи.
Обучающие:
-повторить тему «Электролиз»
-повторить терминологию темы
-повторить различия в электролизе расплавов и растворов электролитов
-изучить правила протекания электролиза на аноде и катоде в растворах и расплавах электролитов
Развивающие:
— показать в сравнении электролиз расплавов и растворов электролитов
— подвести к пониманию практического значения электролиза
Воспитывающие:
— воспитание уважительного отношения к процессу познания, формирование устойчивых учебных навыков
Тип урока: комбинированный
Оборудование: таблицы, компьютер, видеопроектор, учебник, сборники заданий ЕГЭ, карточки с тестовыми заданиями
Ход урока (основные этапы)
|
№пп |
Этапы |
Ключевые моменты |
Используемые методы работы |
Примечания (компоненты здоровьесбережения, личностно-ориентированного, деятельностного подходов и т.п.) |
|
1 |
Организационный |
1. Взаимное приветствие 2. Проверка готовности к уроку. |
— визуальный контроль |
-оценка эмоционального состояния обучающихся (обзорно каждого и класса в целом) |
|
2 |
Подготовка к восприятию новой темы |
1.Проверка усвоения темы «ОВР», «Электролиты и неэлектролиты», «Электролитическая диссоциация» (кратко, по вопросам, цепочкам…) 2.Промежуточная оценка работы учащихся |
— устный опрос (определение терминов, объяснение) — активные формы (работа в парах по составлению и объяснению схем ОВР, логических цепочек) |
-«плавное вхождение в тему» -индивидуальный выбор способа действия -пробуждение интереса к изучаемому материалу |
|
3 |
Работа по теме урока |
1.Постановка проблемы 2.Определение темы, цели и задач урока (Презентация, слайд 1) 3. Объяснение учебного материала, работа по теме (теоретическая часть): |
— эвристический, проблемный методы (использование технологии «подкидная доска») |
-вопросы, связанные с историей открытия законов электролиза, М.Фарадеем -демонстрация, прослеживание связей между физическими и химическими процессами -при объяснении теоретического материала обучающиеся делают необходимые записи и пояснения в своих рабочих тетрадях -выработка понимания сущности электрохимических процессов -формирование потребности в работе по самообразованию -выработка умений обобщать, систематизировать, делать выводы -сообщение информации о возможных областях применения электролиза -смена видов деятельности при изучении нового материала -комментирование выбора способа решения заданий -поиск, обсуждение наиболее рациональных путей решения -использование материалов лекций курса «Подготовка старшеклассников к ЕГЭ по химии» («ИД 1 сентября») |
|
— 3.1. Терминология по теме (Презентация, слайд 2) |
-словесные -наглядно-иллюстративные -работа с текстом учебника -работа с диском к учебнику -лекция с элементами беседы и использованием презентации -ИКТ (просмотр и объяснение динамической модели (Электролиз») -работа обучающихся в рабочих тетрадях |
|||
|
— 3.2. Процессы на катоде (презентация, слайд 3) Пример решения типового задания (Презентация, слайд 4), Приложение 1. |
||||
|
— 3.3. Процессы на аноде (презентация, слайд 4) Пример решения типового задания (Презентация, слайд 5) Приложение 1. |
||||
|
-3.4. Алгоритм составления уравнений электролиза. Примеры решения типовых заданий (Презентация, слайды 8,9,10) Приложение 1. |
||||
|
— 3.5. (практическая часть) Решение упражнений из сборника заданий ЕГЭ Варианты (в сокращённом виде) – в Приложении 2. |
Работа по сборнику заданий ЕГЭ -решение заданий ЕГЭ (базовый уровень) -решение заданий ЕГЭ (повышенный уровень) |
|||
|
4 |
Закрепление полученных учебных навыков |
1. Опрос по понятиям темы |
— фронтальный опрос — индивидуальные ответы — самостоятельная (возможно, коллективная в парах, малых группах) работа в тестовых технологиях |
-выбор способа действия обучающимися -индивидуальная познавательная деятельность |
|
5 |
Подведение итогов работы на уроке |
1. Само- и взаимопроверка выполнения теста, анализ допущенных ошибок (Приложение 3 ) 2. Оценивание работы обучающихся на уроке. 3. Постановка учебных задач по дальнейшему изучению темы. 4. Рефлексия (слайд 11) |
— поощрение, — поучение |
-спокойное завершение урока -выбор смайлика по своему состоянию в конце урока |
|
6 |
Домашнее задание |
1. Обсуждение домашнего задания. 2. Запись в дневниках |
— самостоятельная работа в тестовых технологиях, |
-комментирование домашних упражнений -прощание с обучающимися |
|
7. |
Самоанализ урока |
Приложение 1.
- Использование материалов лекции №4 курса «Подготовка выпускников средних учебных заведений к сдаче УГЭ по химии» при объяснении решения типовых заданий о процессах электролиза на катоде и аноде (задания высвечиваются на экране, идёт совместное обсуждение задания, настроена анимация к слайдам).
П р и м е р 1. Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора.
Формула вещества Продукт электролиза
А) CuSO4; 1) Водород;
Б) K2SO4; 2) серебро;
В) AgNO3; 3) медь;
Г) CuBr2. 4) гидроксид калия;
5) кислород;
6) оксид серы(IV).
Вначале следует отбросить заведомо неверные варианты ответов из правого столбика. При электролизе водных растворов на катоде не могут выделяться кислород и оксид серы(IV) (варианты 5 и 6).
В соответствии с правилами разрядки катионов для указанных солей определяем соответствие: А–3, Б–1, В–2, Г–3.
Ответ – 3123.
П р и м е р 2. Установите соответствие между формулой вещества и продуктом, образующимся на аноде в результате электролиза его водного раствора.
Формула вещества Продукт электролиза
А) CuSO4; 1) Фтор;
Б) KCl; 2) бром;
В) AgF; 3) хлор;
Г) CuBr2. 4) хлороводород;
5) кислород;
6) оксид серы(IV).
Вначале следует отбросить заведомо неверные варианты ответов из правого столбика. При электролизе водных растворов на аноде не могут разряжаться фторид-ионы и выделяться хлороводород (варианты 1 и 4). В соответствии с правилами разрядки анионов для указанных солей определяем соответствие: А–5, Б–3, В–5, Г–2.
Ответ – 5352.
П р и м е р 3. Установите соответствие между формулой вещества и итоговым уравнением электролиза его водного раствора.
Формула вещества Уравнение электролиза
А) CuSO4; 1) 2AgF = 2Ag + F2;
Б) KCl; 2) 4AgF + 2H2O = 4Ag + 4HF + O2;
В) AgF; 3) 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2;
Г) NaNO3. 4) 2KCl + 2H2O = H2 + 2KOH + Cl2;
5) NaNO3 + H2O = NaOH + HNO3;
6) 2H2O = 2H2 + O2.
Варианты ответов 1 (фторид-ионы при электролизе водных растворов не окисляются) и 5 (реакция не является ОВР ) исключаются и устанавливается соответствие А–3 (в правом столбце вариантов с медью больше нет, поэтому нет необходимости анализировать происходящие анодный и катодный процессы). Для Б на катоде будет восстанавливаться вода (2Н2О + 2е → Н2 + 2ОН–), а на аноде – окисляться хлорид-ионы (2Cl– – 2e → 02 Cl ). Следовательно, устанавливается соответствие Б–4. Для В подходит только вариант 2 (т.к. из двух предлагаемых со фтором уравнений заведомо неверное было исключено).
Для Г на катоде будет восстанавливаться вода, а на аноде – она же окисляться (2Н2О – 4е → 4Н+ + О2): устанавливается соответствие Г–6.
Ответ – 3426.
П р и м е р 4. Установите соответствие между формулой соли и схемой процесса, протекающего на катоде в результате электролиза ее водного раствора.
Формула соли Процесс, протекающий на катоде
А) Cu(NO3)2; 1) 2Н2О + 2е → Н2 + 2ОН–;
Б) MgBr2; 2) Cu2+ + 2е → Cu0;
В) NaCl; 3) 2Br– – 2е → Br20;
Г) HgCl2. 4) Mg2+ + 2е → Mg0;
5) Hg2+ + 2е → Hg0;
6) Na+ + е → Na0.
Вначале следует исключить вариант 3, т.к. это анодный процесс окисления. На основании правил разрядки катионов устанавливаются соответствия: А–2, Б–1, В–1, Г–5. Ответ – 2115.
Для самостоятельной работы заинтересованным ученикам можно предложить решение более сложных упражнений (возможно, вынесение обсуждения таких заданий на дополнительные занятия в рамках школьного дополнительного образования):
П р и м е р 5. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
Формула вещества Продукты электролиза
А) NaCl; 1) Na, Cl2;
Б) NaClO4; 2) Na, Cl2, O2;
В) NaOH; 3) NaOH, Cl2, H2;
Г) NaNO3. 4) O2, H2;
5) NaOH, N2, O2;
6) Na, H2, O2.
Следует обратить внимание, что в левом столбике предложены соединения натрия, который не может быть получен на катоде при электролизе растворов. Следовательно, из правого столбика необходимо исключить варианты, содержащие свободный натрий: 1,2,6. Далее на основании правил разрядки катионов и анионов устанавливаются
соответствия: А–3, Б–4, В–4, Г–4.
Ответ – 3444.
П р и м е р 7. Установите соответствие между названием вещества и продуктами электролиза его водного раствора на инертных электродах.
Название вещества Продукты электролиза
А) Сульфат меди(II); 1) Cеребро, кислород, плавиковая кислота;
Б) фторид серебра; 2) серебро, фтор, водород;
В) нитрат натрия; 3) медь, кислород, серная кислота;
Г) хлорид натрия. 4) оксид меди(II), сернистый газ, водород;
5) водород, кислород;
6) гидроксид натрия, хлор, водород.
Исключаются два заведомо неверных варианта: 2 и 4 (образование оксида меди(II) при электролизе раствора невозможно). Затем на основании правил разрядки катионов и анионов устанавливаются соответствия: А–3, Б–1, В–5, Г–6. Ответ – 3156.
П р и м е р 8. Установите соответствие между названием вещества и продуктами электролиза на инертных электродах.
Название вещества Продукты электролиза
А) Хлорид меди(II) (раствор); 1) Водород, хлор;
Б) хлорид меди(II) (расплав); 2) натрий, хлор;
В) хлорид натрия (раствор); 3) гидроксид меди(II), водород;
Г) хлорид натрия (расплав). 4) медь, хлор;
5) водород, кислород;
6) гидроксид натрия, хлор, водород.
Обратите внимание, что в этом задании рассматриваются два типа электролиза: электролиз растворов и электролиз расплавов электролитов. Рекомендуем вначале рассмотреть более простой случай – электролиз расплавов, т.к. на электродах идет разрядка только тех ионов, из которых построен электролит. Устанавливаются соот-
ветствия Б–4 и Г–2. Затем на основании правил разрядки катионов и анионов уста-
навливаются соответствия для электролиза растворов: А–4, В–6.
Ответ – 4462.
ПРИЛОЖЕНИЕ 2
- Задания для работы на уроке из сборника по подготовке к ЕГЭ.
(Выполняются по разобранному ранее алгоритму. Как правило, не вызывают затруднений у обучающихся. Требуют состредоточенности, внимания к особенностям строения и агрегатного состояния веществ. Постепенно темп выполнения заданий усиливается.)
Блок вопросов 1 (выбрать один правильный ответ)
- При электролизе водного раствора сульфата меди (П) на катоде выделяется
- Медь 2) водород 3)кислород 4) оксид серы (1У)
- При электролизе водного расвора нитрата серебра на аноде выделяется
- Серебро 2) водород 3) кислород 4) оксид азота (1У)
- При электроде водного раствора сульфата марганца (П) на катоде выделяется (выделяются)
- Марганец 2) марганец и водород 3) кислород 4) марганец и кислород
- При электролизе водного раствора сульфата натрия на катоде выделяется (выделяются)
- Натрий 2) натрий и водород 3) кислород 4) водород
- При электролизе водного раствора нитрата калия на катоде выделяется (выделяются)
- Калий 2) калий и водород 3) кислород 4) водород
- Водород выделяется на катоде при электролизе водного раствора
1)нитрата калия 2) нитрата серебра 3) нитрата меди (П) 4) нитрата ртути (П)
- Кислород выделяется на аноде при электролизе водного раствора
- Хлорида натрия 2) бромида натрия 3) йодита натрия 4) фторида натрия
- При электролизе водного раствора хлорида натрия на катоде и аноде соответственно выделяются
- Натрий и хлор 2) водород и хлор 3) водород и кислород 4) натрий и кислород
- При электролизе водного раствора сульфида калия на катоде и аноде соответственно выделяются
- Водород и сера 2) калий и кислород 3) водород и кислород 4) водород и оксид серы (1У)
- Только газообразные продукты выделяются на катоде и аноде при электролизе водного раствора
- Хлорида меди (П) 2) йодита натрия 3) сульфата цинка 4) нитрата лития
Блок вопросов 2 (выбрать три правильных ответа)
- Водород и металл могут выделиться на катоде одновременно при электролизе водного раствора
- Сульфата калия 4) сульфата хрома (Ш)
- Нитрата серебра 5) нитрата меди (П)
- Нитрата цинка 6) нитрата марганца (П)
- Водород и металл могут выделиться на катоде одновременно при электролизе водного раствора
1)нитрата калия 2) сульфата хрома (П)
3)Нитрата ртути (П) 4) нитрата никеля (П)
5)Сульфата железа (П) 6) нитрата бария
- Кислород выделяется на аноде при электролизе водного раствора
- Нитрата лития 4) бромида хрома (Ш)
- Хлорида меди (П) 5) фторида натрия
- Сульфата железа (П) 6) йодита бария
- Кислород не выделяется на аноде при электролизе водного раствора
- Сульфида лития 4) хлоридаа хрома (Ш)
- Сульфата цинка 5) фторида калия
3) нитрата никеля(П) 6) бромида кальция
Блок вопросов 3 (установить соответствие) между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора
- Установить соответствие между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)NaI |
1) металл |
|
Б)AgNO3 |
2) водород |
|
В)ZnSO4 |
3) оксид азота (1У) |
|
Г)NiBr2 |
4) металл, водород |
|
5) галоген |
2. Установить соответствие между формулой соли и продуктами, образующимися на катоде при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)CuSO4 |
1) металл |
|
Б)FeCl2 |
2) водород |
|
В)MnSO4 |
3) оксид серы (1У) |
|
Г)CrCl3 |
4) металл, водород |
|
5) галоген |
3. Установить соответствие между формулой соли и продуктом, образующимся на аноде при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)K3PO4 |
1) кислород |
|
Б)FeCl3 |
2) оксид фосфора (У) |
|
В)NiSO4 |
3) оксид серы (1У) |
|
Г)CrBr3 |
4) водород |
|
5) галоген |
4. Установить соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)Na2SO4 |
1) металл, галоген |
|
Б)KNO3 |
2) металл, кослород |
|
В)AgNO3 |
3) водород, галоген |
|
Г)MnSO4 |
4) водород, кислород |
|
5) металл, водород, кислород |
|
|
6) металл, водород, галоген |
5. Установить соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)Hg(NO3)2 |
1) металл, галоген |
|
Б)CuSO4 |
2) металл, кислород |
|
В)FeSO4 |
3) водород, галоген |
|
Г)LiOH |
4) водород, кислород |
|
5) металл, водород, кислород |
|
|
6) металл, водород, галоген |
ПРИЛОЖЕНИЕ 3 Вариант карточки для итогового повторения.
1. При электролизе водного расвора нитрата серебра на аноде выделяется
1)Серебро 2) водород 3) кислород 4) оксид азота (1У)
2. При электролизе водного раствора нитрата калия на катоде выделяется (выделяются)
1)Калий 2) калий и водород 3) кислород 4) водород
3. При электролизе водного раствора сульфида калия на катоде и аноде соответственно выделяются
1) Водород и сера 2) калий и кислород 3) водород и кислород
4) водород и оксид серы (1У)
4. Кислород выделяется на аноде при электролизе водного раствора
- Нитрата лития 4) бромида хрома (Ш)
- Хлорида меди (П) 5) фторида натрия
- Сульфата железа (П) 6) йодита бария
5. Установить соответствие между формулой соли и продуктом, образующимся на аноде при электролизе его водного раствора.
|
Формула соли |
Продукты на катоде |
|
А)K3PO4 |
1) кислород |
|
Б)FeCl3 |
2) оксид фосфора (У) |
|
В)NiSO4 |
3) оксид серы (1У) |
|
Г)CrBr3 |
4) водород |
|
5) галоген |
Список использованной литературы
1. Химия: основы общей химии: учеб. для 11 кл. ОУ: базовый уровень/Г.Е. Рудзитис, Ф.Г. Фельдман — М., Просвещение, 2008
2. Репетитор по химии/Под ред. А.С. Егорова. – Ростов н/Д: Феникс, 2005г.
3. Химия. 11-й класс. Тематические тестовые задания для подготовки к ЕГЭ./Авт.-сост. Л.И. Асанова. – Ярославль:Академия развития, 2010 г.
4. Материалы курса «Подготовка выпускников средних учебных заведений к сдаче УГЭ по химии»: лекции 1-4 / О.С. Габриелян, С.А. Сладков – М.: Педагогический университет «Первое сентября», 2010.
Использованные материалы и Интернет-ресурсы
1. Мультимедийное приложение к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана Химия, 11 класс
2. Открытая химия. Электронное учебное издание – М.: ООО «Физикон», ООО «Дрофа», 2005г.

