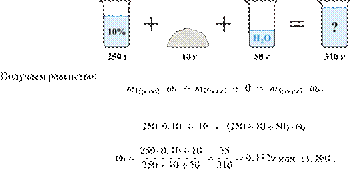
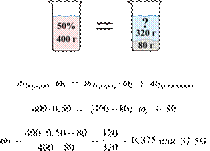
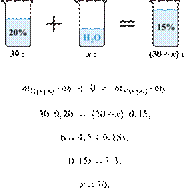
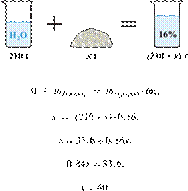
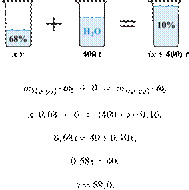
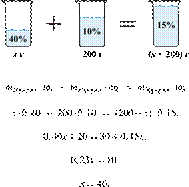
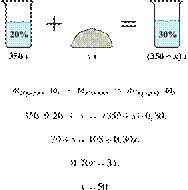
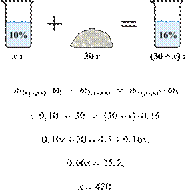
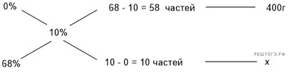При разбавлении 35%-й соляной кислоты получили 210 г 10%-й кислоты. Сколько граммов 35%-го раствора было взято? Ответ выразите в виде целого числа.
Спрятать решение
Решение.
Масса раствора, масса растворённого вещества и массовая доля растворённого вещества связаны соотношением:
При разбавлении раствора масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до целых.
Ответ: 60.
Приведём другое решение:
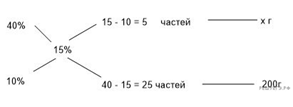
Задачи такого типа могут быть решены методом креста («конверт» Пирсона).
Значит, для приготовления 10%-го раствора нужно 10 частей 35%-й кислоты и 25 частей воды. Составив пропорцию, получаем:
Ответ просят дать с точностью до целых.
Ответ: 60.
Задания
для подготовки
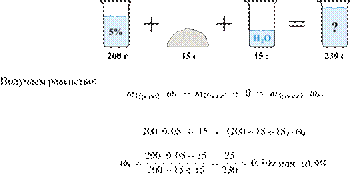
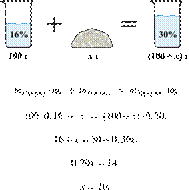
1. Задание 27 № 3265
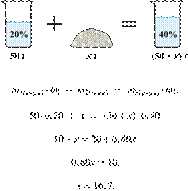
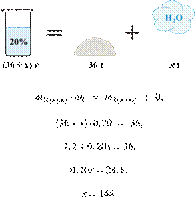
Смешали 80 г
раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с
массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 28%.
1/59
2. 4767
массу нитрата
калия (в граммах), который следует растворить в 150 г раствора с массовой долей
этой соли 10 % для получения раствора с
массовой долей 12 %. Ответ дайте точностью до десятых. Решение.
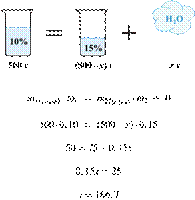
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 3,4 г.
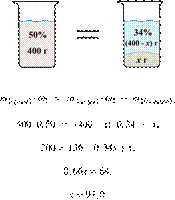
2/59
3. 6248
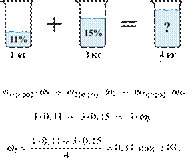
Вычислите массовую долю
соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг
15%-ного раствора соли. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
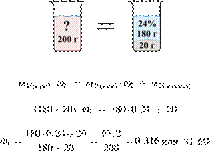
Получаем равенство:
Ответ: 14%.
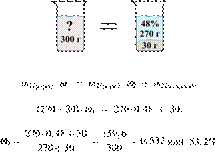
3/59
4. 6249
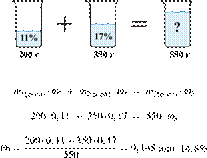
Смешали 200 г
11%-ного раствора нашатыря и 350 г 17%-ного раствора этой же соли. Вычислите
массовую долю нашатыря в полученном
растворе. Ответ укажите в процентах с
точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 14,8%.
4/59
5. 6250
Упариванием 500 г
раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %.
Вычислите массу выпаренной при этом воды. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 143 г.
5/59
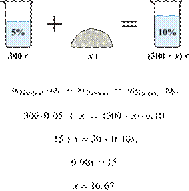
6. 6251
массу едкого натра,
который следует растворить в 300 г 5%-го раствора для получения 10%-го раствора
Ответ
укажите в граммах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
щелочи не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 16,7 г.
6/59
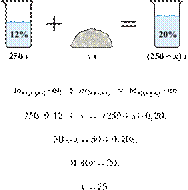
7. 6252
К 250 г 10%-го
раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Вычислите
массовую долю нитрата натрия в полученном
растворе. Ответ дайте в процентах с точностью до
десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 11,3%.
7/59
8. 6253
К 200 г 5%-ного
раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды.
Вычислите массовую долю хлорида аммония в полученном растворе. Ответ дайте в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
целых.
Ответ: 11%.
8/59
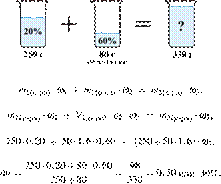
9.
6254
К 250 г 20%-ной
серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Вычислите
массовую долю кислоты в полученном растворе. Ответ дайте в процентах с
точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 30%.
10.
Задание 27 № 6255
Вычислите массу
уксусной кислоты в растворе, полученном при смешивании 155 г 5%-го и 207 г
11%-го растворов кислоты. Ответ дайте в граммах с
точностью до десятых.
Решение.
Найдём массу кислоты:
Ответ: 30,5.
9/59
11. 6256
массу воды,
которую следует добавить к 300 г 22%-го раствора уксусной кислоты, чтобы
получить 9%-й раствор. Ответ дайте в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 433 г.
10/59
12. 6257
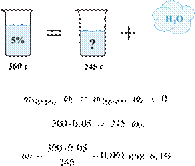
При упаривании 300
г 5%-го раствора сахарозы получены 245 г раствора. Вычислите массовую долю
сахарозы в нём. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
11/59
13. 6394
К 400 г 10%-го
раствора соли добавили 50 г этой же соли. Вычислите массовую долю соли в полученном
растворе. Ответ дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 20%.
12/59
14. 6434
Из 400 г горячего
50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите
массовую долю соли в растворе над осадком.
Ответ дайте в процентах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 37,5%.
13/59
15. 6474
массу карбоната
калия, который надо прибавить к 100 г 16%-го раствора, чтобы получить 30%-й
раствор. Ответ представьте в граммах с точностью до
целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
14/59
16. 6514
массу гидроксида
калия, который надо прибавить к 40 г 10%-го раствора, чтобы получить 40%-й
раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
15/59
17. 6551
массу воды нужно
добавить к 50 г 20%-го раствора соляной кислоты, чтобы уменьшить её
концентрацию до 10 %. Ответ укажите в
граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50 г.
16/59
18. 6552
массу воды,
которую нужно добавить к 30 г 20%-го раствора гидроксида натрия, чтобы
понизить его концентрацию до 15 %. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 10 г.
17/59
19. 6553
массу воды нужно
испарить из 500 г 10%-го раствора гидроксида натрия, чтобы
увеличить его концентрацию в 1,5 раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 167 г.
18/59
20. 6554
массу воды, которую
нужно испарить из 300 г 15 %-го раствора гидроксида калия, чтобы
увеличить его концентрацию в два раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 150 г.
19/59
21. 6555
массу соли нужно
добавить к 50 г 20%-го раствора, чтобы увеличить её концентрацию в два
раза. Ответ укажите в граммах с точностью до
целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 17 г.
20/59
22. 6611
К 300 г 10%-го
раствора гидроксида натрия добавили 60 г чистого гидроксида натрия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ укажите в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ: 25%.
21/59
23. 6651
К 200 г 10%-го
раствора гидроксида калия добавили 25 г чистого гидроксида калия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ
укажите в процентах с точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
22/59
24. 6691
Вычислите массу
твёрдого нитрата аммония, который надо добавить к 210 г воды, чтобы получить
16%-й раствор соли. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса соли не
изменяется.
Получаем равенство:
Ответ: 40 г.
23/59
25. 6731
массу твёрдого
гидроксида калия, который надо добавить к 120 г воды, чтобы получить 20%-й
раствор щёлочи. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса гидроксида
калия не изменяется.
Получаем равенство:
Ответ: 30 г.
24/59
26. 6780
К 240 г раствора с
массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в
полученном растворе. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
25/59
27. 6820
При выпаривании
25%-го водного раствора получено 60 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 180 г.
26/59
28. 6860
При выпаривании
20%-го водного раствора получено 36 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 144 г.
27/59
29. 9640
массу гидроксида калия, который
необходимо растворить в 150 г воды для получения раствора с массовой долей
щёлочи 25 %. Ответ дайте в граммах с точностью до целых. Решение.
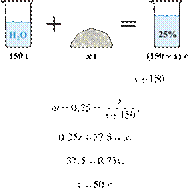
—
масса гидроксида калия (вещества), тогда — масса раствора, а —
(омега) массовая доля вещества, равная 25 % или 0,25. Имеем:
Ответ: 50.
28/59
30. 9681
Растворяя соль в горячей воде, приготовили
300 г 40%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 28%.
29/59
31. 9714
Вычислите массу
15%-го раствора вещества, который можно получить разбавлением 200 г 36%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 480 г.
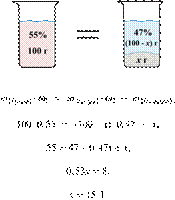
30/59
32. 9749
Растворяя соль в горячей воде, приготовили
200 г 55%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте
в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 40%.
31/59
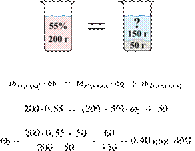
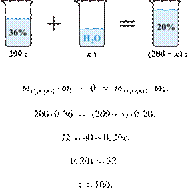
33. 9783
Разбавлением 25%-го
раствора вещества получили 350 г 10%-го раствора. Вычислите массу 25%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 140 г.
32/59
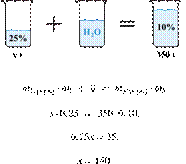
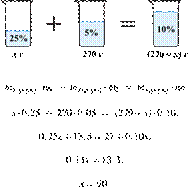
34. 9820
Сколько граммов 25%-го раствора вещества
надо добавить к 270 г 5%-го раствора, чтобы получить
10%-й раствор? (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 90.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 5 частей 25%-го раствора и 15 частей 5%-го
раствора. Составив пропорцию, получаем:
Ответ: 90.
33/59
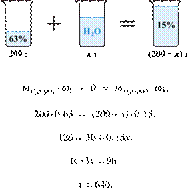
35. 9854
Вычислите массу
5%-го раствора вещества, который надо добавить к 120 г 30%-го раствора, чтобы
получить 15%-й раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 180 г.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для приготовления
15%-го раствора нужно 10 частей 30%-го раствора и 15 частей 5%-го раствора.
Составив пропорцию, получаем:
Ответ: 180 г.
34/59
36. 9888
Вычислите массу
воды, которую надо добавить к 200 г 36%-й соляной кислоты, чтобы получить 20%-ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 160 г.
35/59
37. 9922
Вычислите массу
воды, которую надо добавить к 200 г 63%-й азотной кислоты, чтобы получить 15%ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 640 г.
36/59
38. 10403
В 100 г 5%-го
раствора хлорида натрия растворили ещё 25 г этого вещества. Чему равна массовая
доля хлорида натрия (в %) в новом растворе? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 24%.
37/59
39.
10442
В 200 г 10%-го
раствора гидроксида калия растворили ещё 25 г этого вещества. Чему равна
массовая доля гидроксида калия (в %) в новом растворе? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
40.
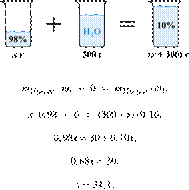
Задание 27 № 10673
Сколько граммов 98%-ной серной кислоты
надо добавить к 300 г воды, чтобы получить 10%-ный раствор кислоты? Ответ
округлите до ближайшего целого числа.
38/59
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 34.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 98%-го раствора и 88 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 34.
39/59
41. 10708
Сколько граммов
68%-ной азотной кислоты надо добавить к 400 г воды, чтобы получить 10%-ный
раствор кислоты? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 69.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 68%-го раствора и 58 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 69.
40/59
42. 11088
К 75 г раствора с
массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите
массовую долю соли в полученном растворе (в процентах). (Запишите число с
точностью до десятых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 21,6%.
41/59
43. 11168
При охлаждении 400
г горячего 50%-го раствора нитрата калия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 34% нитрата калия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 97 г.
42/59
44. 11233
При охлаждении 100
г горячего 55%-го раствора нитрата натрия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 47% нитрата натрия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 15 г.
43/59
45. 11271
Сколько граммов
40%-го раствора гидроксида калия надо смешать с 200 г 10%-го раствора этого
вещества, чтобы получить 15%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 40.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 15%-го раствора нужно 5 частей 40%-го раствора и 25 частей 10%-го
раствора. Составив пропорцию, получаем:
Ответ: 40.
44/59
46. 11306
Сколько граммов
65%-го раствора азотной кислоты надо смешать с 270 г 10%-го раствора этого
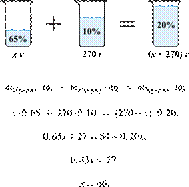
вещества, чтобы получить 20%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 60.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 20%-го раствора нужно 10 частей 65%-го раствора и 45 частей
10%-го раствора. Составив пропорцию, получаем:
Ответ: 60.
45/59
47. 11341
При разбавлении
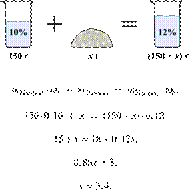
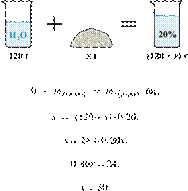
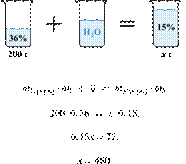
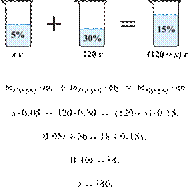
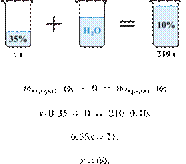
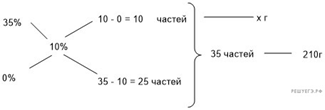
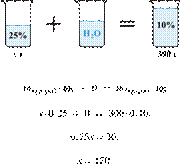
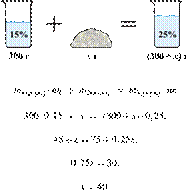
35%-й соляной кислоты получили 210 г 10%-й кислоты. Сколько граммов 35%-го
раствора было взято? Ответ выразите в виде целого числа Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 35%-й кислоты и 25 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 60.
46/59
48. 11376
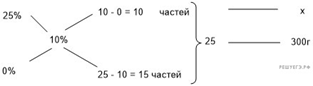
При разбавлении
25%-го раствора аммиака получили 300 г 10%-го раствора. Сколько граммов 25%го
раствора было взято? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 120.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 25%-го раствора и 15 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 120.
47/59
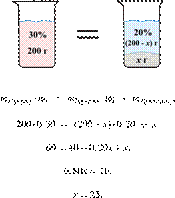
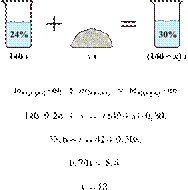
49. 12382
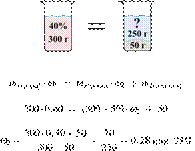
200 г горячего
30%-го раствора соли охладили до комнатной температуры. Сколько граммов соли
выпадет в осадок, если насыщенный при комнатной температуре раствор содержит
20% соли по массе?
Осадок представляет собой безводную
соль. Ответ запишите с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 25.
48/59
50. 12417
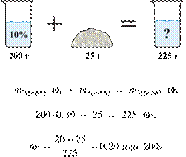
Насыщенный раствор
содержит 30 % соли по массе. Сколько граммов соли нужно растворить в 350 г
20%-го раствора для получения насыщенного раствора? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50.
49/59
51. 12616
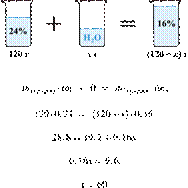
Имеется 120 г
24%-го раствора вещества. Из него надо получить 16%-й раствор. Сколько граммов
воды требуется добавить? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
50/59
52. 12651
Имеется 140 г
24%-го раствора вещества. Из него надо получить 30%-й раствор. Сколько граммов
чистого вещества требуется добавить? Ответ округлите до ближайшего целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 12.
51/59
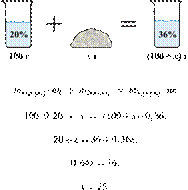
53. 12865
Сколько граммов
чистого вещества надо добавить к 100 г его 20%-го раствора, чтобы получить 36%й
раствор? Ответ представьте в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 25.
52/59
54. 13033
30 граммов чистого
вещества добавили к 10%-му раствору этого вещества и получили 16%-й раствор.
Сколько граммов 10%-го раствора было взято? Ответ представьте в виде целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 420.
53/59
55. 13095
Горячий раствор
нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и
образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата калия
(в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 31,6%.
54/59
56. 13130
Горячий раствор
нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и
образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата
натрия (в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 53,2%.
55/59
57. 13557
В 81 г воды
растворили 9 г сульфата натрия. Вычислите массовую долю вещества (в процентах) в
полученном растворе. (Запишите число с точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
Ответ просят дать с точностью до
целых.
Ответ: 10%.
56/59
58. 13630
К 250 г 12%-го
раствора гидроксида калия добавили твердый KOH и после перемешивания получили
20%-й раствор. Сколько граммов твердой щёлочи добавили? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 25.
57/59
59. 13665
К 300 г 15%-го
раствора хлорида калия добавили твёрдый и после
перемешивания получили 25%-й раствор. Сколько граммов твёрдой соли добавили?
Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 40.
58/59
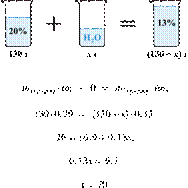
60. 13704
Найдите массу воды, которую необходимо
добавить к 130 г 20%-го раствора соли, чтобы получить
13%-ый раствор. (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 70 г.
59/59

Предлагаем вам ознакомиться с новыми открытыми вариантами ЕГЭ-23, здесь вы найдете новые ответы с объяснением, пошаговые решения и пояснения на новые варианты КИМ, ФИПИ и новым ФГОС на ЕГЭ-2023. Демоварианты вы сможете бесплатно скачать ответы в формате PDF или ВОРД / WORD для подготовки к экзамену и самостоятельно решать задачи и примеры. Также здесь можно скачать ответы, решения, пояснения и объяснения к заданиям экзамена. Домашняя работа. Вариант

Официальный сайт. Единый Государственный Экзамен ОГЭ 2022 — 2023 учебный год. 11 класс. ВПР. РП. ФИПИ ШКОЛЕ. ДНР. ФГОС. ОРКСЭ. МЦКО. ФИОКО. ОГЭ. ЕГЭ. ПНШ.ДОУ. УМК. Просвещение. Ответы. Школа России. Школа 21 век. Перспектива. Школа 2100. Планета знаний. Россия. Беларусь. ЛНР. Казахстан. РБ. Татарстан. Башкортостан









.
ЕГЭ по химии 2023, 2022, 2021, 2020
Содержание раздела ЕГЭ по химии
Также смотрите разделы связанные с разделом ЕГЭ по химии:
Ниже Вы можете бесплатно скачать электронные книги и учебники и читать статьи и уроки к разделу ЕГЭ по химии 2023, 2022, 2021, 2020:
- ЕГЭ 2023, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2023, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2023, Химия, 11 класс, Кодификатор
- ЕГЭ 2023, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2023, Химия, 11 класс, Спецификация
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2023, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2023, Химия, Тематический тренинг, Доронькин В.Н., Бережная А.Г., Февралева В.А.
- ЕГЭ 2023, Химия, Типовые экзаменационные варианты, 30 вариантов, Добротин Д.Ю.
2022 год
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2022, Химия, 11 класс, Кодификатор
- ЕГЭ 2022, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2022, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2022, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2022, Химия, 11 класс, Методы познания в химии, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Неорганическая химия, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Органическая химия, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Открытый вариант
- ЕГЭ 2022, Химия, 11 класс, Спецификация
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2022, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2022, Химия, 11 класс, Теоретические основы химии, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Теоретические основы химии, Химическая реакция, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2022, Химия, 11 класс, Тренировочная работа №5
- ЕГЭ 2022, Химия, 11 класс, Тренировочные задания, Навигатор самостоятельной подготовки
- ЕГЭ 2022, Химия, 14 вариантов, Типовые варианты, Медведев Ю.Н.
- ЕГЭ 2022, Химия, Методические материалы, Добротин Д.Ю.
- ЕГЭ 2022, Химия, Методические рекомендации, Добротин Д.Ю.
- Методические материалы для председателей и членов предметных комиссий субъектов Российской Федерации по проверке выполнения заданий с развёрнутым ответом экзаменационных работ ЕГЭ 2022 года, ХИМИЯ, Добротин Д.Ю., 2022
- Методические рекомендации обучающимся по организации индивидуальной подготовки к ЕГЭ 2022 года, Химия, Добротин Д.Ю., 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Методы познания в химии, Химия и жизнь, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Неорганическая химия, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Теоретические основы химии, Химическая реакция, 2022
- Навигатор самостоятельной подготовки к ЕГЭ 2022, Химия, Тренировочные задания, 2022
2021 год
- 100 баллов по химии, Теория и практика, Задачи и упражнения, Учебное пособие, Негребецкий В.В., 2021
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2021 года по химии
- ЕГЭ 2021, Химии, 11 класс, Демонстрационный вариант
- ЕГЭ 2021, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2021, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2021, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2021, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2021, Химия, 11 класс, Тренировочный вариант
- ЕГЭ 2021, химия, 14 вариантов, типовые варианты экзаменационных заданий от разработчиков ЕГЭ, Медведев Ю.Н., 2021
- ЕГЭ 2021, Химия, Указания по оцениванию, Методические рекомендации
- ЕГЭ 2022, Химия, 11 класс, Тренировочный вариант №1, 2021
- ЕГЭ 2022, Химия, 11 класс, Тренировочный вариант №2, 2021
- ЕГЭ-2022, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2021
- Единый государственный экзамен по ХИМИИ, Открытый вариант, 2021
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2021
- Методика формирования и оценивания базовых навыков, компетенций обучающихся по программам основного общего образования по химии, необходимых для решения практико-ориентированных задач, Добротин Д.Ю., Каверина А.А., Снастина М.Г., 2021
- Методические рекомендации для учителей, подготовленные на основе анализа типичных ошибок участников ЕГЭ 2021 года по ХИМИИ, Добротин Д.Ю., Снастина М.Г., 2021
- Химия, Подготовка к ЕГЭ, Диагностические работы, Еремин В.В., 2021
2020 год
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2020 года по химии
- ЕГЭ 2020, Тренажёр, Химия, Расчётные задачи, Рябов М.А.
- ЕГЭ 2020, Химии, 11 класс, Демонстрационный вариант, Кодификатор, Спецификация, Проект
- ЕГЭ 2020, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2020, Химия, 11 класс, Кодификатор
- ЕГЭ 2020, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2020, Химия, 11 класс, Спецификация
- ЕГЭ 2020, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2020, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2020, Химия, 11 класс, Тренировочный вариант
- ЕГЭ 2020, Химия, 11 класс, Тренировочный вариант №1-16
- ЕГЭ 2020, Химия, Досрочный вариант
- ЕГЭ 2020, Химия, Таблица Менделеева
- ЕГЭ 2020, Химия, Таблица растворимости
- ЕГЭ 2020, Химия, Типовые варианты экзаменационных заданий от разработчиков ЕГЭ, Медведев Ю.Н., 2020
- ЕГЭ 2021, Химия, Методические рекомендации, Добротин Д.Ю., Снастина М.Г., 2020
- ЕГЭ 2021, Химия, Решение задач, Антошин А.Э., 2020
- ЕГЭ 2021, Химия, Тематические тренировочные задания, Соколова И.А., 2020
- ЕГЭ 2021, Химия, Теория и практика, Антошин А.Э., 2020
- ЕГЭ 2021, Химия, Экзаменационные варианты, Мишина В.Ю., 2020
- ЕГЭ 2022, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ, Химия, Методические рекомендации по проверке заданий с развернутым ответом, Добротин Д.Ю., 2020
- ЕГЭ, Химия, Пошаговая подготовка, Мешкова О.В., 2020
- ЕГЭ, Химия, Углублённый курс подготовки, Еремин В.В., Антипин Р.Л., Дроздов А.А., Карпова Е.В., Рыжова О.Н., 2020
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2020
- Методические рекомендации для учителей по преподаванию учебных предметов в образовательных организациях с высокой долей обучающихся с рисками учебной неуспешности, Химия, Каверина А.А., Снастина М.Г., 2020
- Спецификация контрольных измерительных материалов для проведения в 2020 году единого государственного экзамена по химии
- Тайны подготовки к ЕГЭ по химии, Лякишев В.К., 2020
2019 год
- В копилку педагогического опыта будущих учителей химии, подготовка к ОГЭ и ЕГЭ, Кожина Л.Ф., Косырева И.В., Тюрина И.В., Васильчикова О.А., 2019
- Готовимся к ЕГЭ, Органическая химия, Новошинский И.И., Новошинская Н.С., 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2019 года по химии, 11 класс, 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2019 года по химии, 2019
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена по ФРАНЦУЗСКОМУ ЯЗЫКУ, 2019
- ЕГЭ 2019, Химии, 11 класс, Варианты 30-35 заданий
- ЕГЭ 2019, Химия, 10 новых тренировочных вариантов, Степанов В.Н., Овчинникова О.В., Давыдова И.Б., 2019
- ЕГЭ 2019, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2019, Химия, 11 класс, Кодификатор, Проект
- ЕГЭ 2019, Химия, 11 класс, Методические рекомендации, Добротин Д.Ю., Свириденкова Н.В., Снастина М.Г.
- ЕГЭ 2019, Химия, 11 класс, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2019, Химия, 11 класс, Спецификация, Кодификатор, Проект
- ЕГЭ 2019, Химия, 11 класс, Спецификация, Проект
- ЕГЭ 2019, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ 2019, Химия, Досрочный вариант, 2019
- ЕГЭ 2019, Химия, Медведев Ю.Н., 2019
- ЕГЭ 2019, Химия, Ответы, 2019
- ЕГЭ 2019, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2019, Химия, Тренировочный вариант, 2019
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2019, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Рябов М.А.
- ЕГЭ 2020, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2019
- ЕГЭ 2020, Химия, Сборник заданий, 600 заданий с ответами, Пашкова Л.И., 2019
- ЕГЭ, Химия, 25 лучших вариантов, Яшкин С.Н., Яшкина Е.А., 2019
- ЕГЭ, Химия, Новый полный справочник, Савинкина Е.В., 2019
- ЕГЭ, Химия, Супермобильный справочник, Гога С.Т., 2019
- ЕГЭ, Химия, Универсальный справочник, Мешкова О.В., 2019
- ЕГЭ-2019, Химия, 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2019
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 11 класс, 2019
- Сборник заданий с досрочного ЕГЭ 2019 по химии, 2019
- Спецификация контрольных измерительных материалов для проведения в 2019 году единого государственного экзамена по ХИМИИ, 11 класс, 2019
- Формирование знаний, умений, навыков в процессе подготовки к ЕГЭ по химии, Кожина Л.Ф., Тюрина И.В., Косырева И.В., Васильчикова О.А., 2019
- Химия, ЕГЭ+, Оганесян Э.Т., Попков В.А., 2019
- Химия, ЕГЭ, Готовимся к итоговой аттестации, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., 2019
- Химия, Единый государственный экзамен, Готовимся к итоговой аттестации, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., Свириденкова Н.В., Снастина М.Г., Стаханова С.В., 2019
- Химия, Методические рекомендации по оцениванию выполнения заданий ЕГЭ с развернутым ответом, Каверина А.А., Снастина М.Г., 2019
- Химия, Подготовка к ЕГЭ в 2019 году, Диагностические работы, Еремин В.В., 2019
- Химия, Подготовка к ЕГЭ, Диагностические работы, Еремин В.В., 2019
2018 год
- ЕГЭ 2018, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2017
- ЕГЭ 2018, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2018, Химия, 11 класс, Кодификатор
- ЕГЭ 2018, Химия, 11 класс, Спецификация
- ЕГЭ 2018, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2018, Химия, Вариант 113
- ЕГЭ 2018, Химия, Тренировочный вариант №16
- ЕГЭ 2018, Химия, Тренировочный вариант №17
- ЕГЭ 2018, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., 2018
- ЕГЭ 2019, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ 2019, Химия, Решение задач, Антошин А.Э., 2018
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2018
- ЕГЭ, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2018
- ЕГЭ, Химия, Алгоритмы выполнения типовых заданий, Крышилович Е.В., Мостовых В.А., 2018
- ЕГЭ, Химия, Комплекс материалов, Каверина А.А., Медведев Ю.Н., 2018
- ЕГЭ, Химия, Типовые тестовые задания, Медведев Ю.Н., 2018
- ЕГЭ-2018, Химия, Рекомендации по оцениванию заданий, Каверина А.А., Снастина М.Г., 2018
- ЕГЭ-2019, Химия, 50 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену, Савинкина Е.В., Живейнова О.Г., 2018
- Методические рекомендации для учителей, подготовленные на основе анализа типичных ошибок участников ЕГЭ 2018 года по химии, Добротин Д.Ю., Свириденкова Н.В.
- Химия для абитуриентов, как подготовиться к экзамену, учебное пособие, Москвичев С.М., 2018
- Химия, Большой справочник для подготовки к ЕГЭ, Доронькин В.И., Бережная А.Г., Сажнева Т.В., Февралева В.А., 2018
- Я сдам ЕГЭ, Химия, Курс самоподготовки, Технология решения заданий, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., Свириденкова Н.В., Снастина М.Г., Стаханова С.В., 2018
2017 год
- ЕГЭ 2017, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2017, Химия, 11 класс, Кодификатор элементов
- ЕГЭ 2017, Химия, 11 класс, Спецификация
- ЕГЭ 2017, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2017, Химия, Вариант 101
- ЕГЭ 2017, Химия, Методические рекомендации, Добротин Д.Ю.
- ЕГЭ 2017, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г., 2016
- ЕГЭ 2017, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2018, Химия, 10 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2017
- ЕГЭ 2018, Химия, Сдаем без проблем, Антошин А.Э., 2017
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2017
- ЕГЭ, 1000 заданий с ответами и решениями по химии, Все задания части 1 и 2, Рябов М.А., 2017
- ЕГЭ, Химия, Большой сборник тематических заданий, Савинкина Е.В., 2017
- ЕГЭ, Химия, Варавва Н.Э., 2017
- ЕГЭ, Химия, Варавва Н.Э., Мешкова О.В., 2017
- ЕГЭ, Химия, Высший балл, Самостоятельная подготовка, Каверина А.А., Добротин Д.Ю., Медведев Ю.Н., 2017
- ЕГЭ, Химия, Комплекс материалов для подготовки учащихся, Каверина А.А., 2017
- ЕГЭ-2018, Химия, 50 тренировочных вариантов, Савинкина Е.В., 2017
- Химия, ЕГЭ, модульный курс, практикум и диагностика, Каверина А.А., Медведев Ю.Н., 2017
- Химия, подготовка к ЕГЭ в 2017 году, Еремин В.В., 2017
- Я сдам ЕГЭ, Химия, Модульный курс, Практикум и диагностика, Каверина А.А., Медведев Ю.Н., Молчанова Г.Н., 2017
2016 год
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2016, Химия, 11 класс, Демонстрационный вариант, Проект
- ЕГЭ 2016, Химия, 11 класс, Кодификатор
- ЕГЭ 2016, Химия, 11 класс, Спецификация
- ЕГЭ 2016, Химия, 11 класс, Спецификация, Кодификатор
- ЕГЭ 2016, Химия, Досрочный экзамен, Реальный вариант №101
- ЕГЭ 2016, Химия, Методические рекомендации по оцениванию заданий, Каверина А.А., Снастина М.Г.
- ЕГЭ 2016, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2016, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2016, Химия, Тренировочные варианты 1-15
- ЕГЭ 2016, Химия, Тренировочный вариант №1-17
- ЕГЭ 2016, Химия, Тренировочный вариант №1-19
- ЕГЭ 2016, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Лидин Р.А.
- ЕГЭ 2016, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Лидин Р.А.
- ЕГЭ 2017, Химия, 50 тренировочных вариантов, Савинкина Е.В., Живейнова О.Г., 2016
- ЕГЭ, Химия, 50 тренировочных вариантов экзаменационных работ, Савинкина Е.В., Живейнова О.Г., 2016
- Малый лабораторный практикум по химии для подготовки к ЕГЭ, Кожина Л.Ф., Косырева И.В., 2016
- Химия, ЕГЭ 2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, ЕГЭ-2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, Новые задания ЕГЭ, Доронькин В.Н., 2016
- Химия, Новый полный справочник для подготовки к ЕГЭ, Савинкина Е.В., 2016
2015 год
- Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2015 года по химии
- ЕГЭ 2015, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2015, Химия, Досрочный экзамен
- ЕГЭ 2015, Химия, Методические рекомендации для учителей, Каверина А.А., Снастина М.Г.
- ЕГЭ 2015, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2015, Химия, Сборник заданий, Оржековский П.А., Богданова Н.Н., Васюкова Е.Ю., Мещерякова Л.М., 2014
- ЕГЭ 2015, Химия, Тематические тестовые задания, Медведев Ю.Н.
- ЕГЭ 2015, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2015, химия, типовые тестовые Задания, Медведев Ю.Н.
- ЕГЭ 2015, химия, типовые тестовые задания, Медведев Ю.Н., 2015
- ЕГЭ, Химия, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2015
- ЕГЭ-2015, химия, самое полное издание типовых вариантов для подготовки к ЕГЭ, Савинкина Е.В., Живейнова О.Г.
- Кодификатор элементов содержания и требований к уровню подготовки выпускников образовательных организаций для проведения единого государственного экзамена по химии, 2015
- Спецификация контрольных измерительных материалов для проведения в 2015 году единого государственного экзамена по химии
- Химия, ЕГЭ 2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, ЕГЭ-2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015
- Химия, подготовка к ЕГЭ-2015, Книга 2, учебно-методическое пособие, Доронькин В.Н.
- Химия, Решение заданий повышенного и высокого уровня сложности, Как получить максимальный балл на ЕГЭ, Каверина А.А., Молчанова Г.Н., Свириденкова Н.В., Стаханова С.В., 2015
2014 год
- Демонстрационный вариант ЕГЭ 2014 по химии, 11 класс
- ЕГЭ 2014, Химия Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2014, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2014, Химия, 11 класс, Кодификатор
- ЕГЭ 2014, Химия, 11 класс, Спецификация
- ЕГЭ 2014, Химия, Досрочный этап, 3 варианта КИМ, с сайта ФЦТ
- ЕГЭ 2014, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2014, Химия, Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г., 2014
- ЕГЭ 2014, Химия, Типовые тестовые задания, Медведев
- ЕГЭ 2014, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2014, Химия, Тренировочная работа с ответами, Варианты 501-502, 30.01.2014
- ЕГЭ 2014, Химия, Тренировочная работа №1 с ответами, Варианты 101-104, 25.10.2013
- ЕГЭ 2015, Химия, Сборник заданий, Оржековский П.А., Богданова Н.Н., Васюкова Е.Ю., Мещерякова Л.М., 2014
- ЕГЭ, Химия, 11 класс, Тренировочная работа, Варианты 10701-10702, 2014
- Кодификатор ЕГЭ 2014 по химии, 11 класс
- Спецификация ЕГЭ 2014 по химии, 11 класс
- Химия, Подготовка к ЕГЭ 2014, Диагностические работы, Богданова Н.Н., Смирнов С.С.
- Химия, подготовка к ЕГЭ-2015, Книга 1, учебно-методическое пособие, Доронькин В.Н., 2014
- Химия, Полный курс подготовки к ЕГЭ + мультимедийный репетитор Яндекс, Асанова Л.И., Вережникова О.Н., 2014
2013 год
- Демонстрационный вариант ЕГЭ 2013 по химии, 11 класс
- Диагностическая работа №1 по химии, ЕГЭ 2013, 11 класс, 2012
- ЕГЭ 2013 по химии, 11 класс, Диагностическая работа №2, Краткая
- ЕГЭ 2013 по химии, 11 класс, Диагностическая работа №2.
- ЕГЭ 2013 по химии, 11 класс, Тренировочная работа №4
- ЕГЭ 2013, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №1, 2012
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2013, Химия, 11 класс, Кодификатор
- ЕГЭ 2013, Химия, 11 класс, Спецификация
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №1, Вариант 1-4, 2012
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3, В формате ЕГЭ
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №3, На один урок
- ЕГЭ 2013, Химия, Методические рекомендации, Каверина А.А., Снастина М.Г.
- ЕГЭ 2013, Химия, Основной этап, Дальний Восток
- ЕГЭ 2013, Химия, Основной этап, Сибирь
- ЕГЭ 2013, Химия, Основной этап, Урал
- ЕГЭ 2013, Химия, Основной этап, Центр
- ЕГЭ 2013, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2012
- ЕГЭ 2013, Химия, Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2013, Химия, Самое полное издание типовых вариантов, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2013, Химия, Тематические тренировочные задания, Соколова И.А., 2012
- ЕГЭ 2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ 2013, Химия, Шпаргалки
- ЕГЭ 2014, Химия, Тренировочная работа №1 с ответами, Варианты 101-104, 25.10.2013
- ЕГЭ, Химия, 11 класс, Диагностическая работа, Варианты 10601-10604, 21.05.2013
- ЕГЭ, Химия, 11 класс, Тематическая диагностическая работа, Варианты 00203-00204, 2013
- ЕГЭ, Химия, Полный курс A,B,C, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2013
- ЕГЭ, Химия, Самостоятельная подготовка к ЕГЭ, Лидин Р.А., 2013
- ЕГЭ, Химия, Самостоятельная подготовка, Полный курс A,B,C, Лидин Р.А., 2013
- ЕГЭ-2013, Химия, Типовые тестовые задания, Медведев Ю.Н.
- Кодификатор ЕГЭ 2013 по химии, 11 класс
- Спецификация ЕГЭ 2013 по химии, 11 класс
2012 год
- Диагностическая работа №1 по химии, ЕГЭ 2013, 11 класс, 2012
- ЕГЭ 2012, 11 класс, Химия, Демонстрационный вариант, 2011
- ЕГЭ 2012, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа, 2011
- ЕГЭ 2012, Химия, 11 класс, Кодификатор
- ЕГЭ 2012, Химия, 11 класс, Спецификация
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2012, Химия, Актив-тренинг, Каверина А.А., 2011
- ЕГЭ 2012, Химия, Анализ
- ЕГЭ 2012, Химия, Демонстрационный вариант
- ЕГЭ 2012, Химия, Оптимальный банк заданий для подготовки учащихся, Каверина А.А.
- ЕГЭ 2012, Химия, Оптимальный банк заданий, Каверина А.А.
- ЕГЭ 2012, Химия, Практикум, Медведев Ю.Н.
- ЕГЭ 2012, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин, 2011
- ЕГЭ 2012, Химия, Типовые тестовые задания, Медведев Ю.Н., 2012
- ЕГЭ 2012, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина
- ЕГЭ 2012, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А.
- ЕГЭ 2012, Химия, Тренировочная работа №2, 11 класс
- ЕГЭ 2012. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2012. Химия. 11 класс. Кодификатор. 2011
- ЕГЭ 2012. Химия. 11 класс. Спецификация. 2011
- ЕГЭ 2012. Химия. Актив-тренинг. Каверина А.А. 2011
- ЕГЭ 2012. Химия. Демонстрационный вариант.
- ЕГЭ 2012. Химия. Самое полное издание типовых вариантов. Каверина А.А., Добротин Д.Ю. 2011
- ЕГЭ 2012. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ 2013, Химия, 11 класс, Диагностическая работа №1, 2012
- ЕГЭ 2013, Химия, 11 класс, Тренировочная работа №1, Вариант 1-4, 2012
- ЕГЭ 2013, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2012
- ЕГЭ 2013, Химия, Тематические тренировочные задания, Соколова И.А., 2012
- ЕГЭ 2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ 2013, Химия, Тренировочные задания, Оржековский П.А., Мишина В.Ю., Пашкова Л.И., 2012
- ЕГЭ по химии, Тематические тесты, Новые задания, Химический эксперимент (С2), Доронькин В.Н., Бережная А. Г., Сажнева Т.В., Февралева В.А., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических варианта, Савинкина Е.В., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических вариантов, Савинкина Е.В., 2012
- ЕГЭ, Химия, 11 класс, 68 диагностических вариантов, Савинкина Е.В., 2012
- ЕГЭ, Химия, Зачеты и эталоны, Часть 3, 2012
- ЕГЭ, Химия, Методические рекомендации, Часть 1, 2012
- ЕГЭ, Химия, Самостоятельные работы, Часть 2, 2012
- ЕГЭ, Химия, Экспресс-подготовка, Мешкова О.В., 2012
- ЕГЭ, Шпаргалка по химии, Копылова Н.А., 2012
- ЕГЭ-2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012
- Кодификатор ЕГЭ 2012 по химии, 11 класс
- Подготовка к ЕГЭ по химии, Доронькин В.Н., 2012
- Самое полное издание типовых вариантов заданий ЕГЭ 2012, Химия, Каверина А.А., Добротин Д.Ю., 2012
- Спецификация ЕГЭ 2012 по химии, 11 класс
- Химия, 10 класс, Краевая диагностическая работа, УМК 1, 2012
- Химия, 10 класс, Краевая диагностическая работа, УМК 2, 2012
- Химия, 11 класс, Краевая диагностическая работа, 2012
- Химия, Диагностические работы в формате ЕГЭ, Еремин В.В., Дроздов А.А., 2012
- Химия, Подготовка к ЕГЭ 2012, Доронькин В.Н., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности (С1-С5), Доронькин В.Н., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности (С1-С5), Доронькин В.Н., Бережная А.Г., 2012
- Химия, Тематические тесты для подготовки к ЕГЭ, Задания высокого уровня сложности Cl-C5, Доронькин В.Н., 2012
2011 год
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №2
- ЕГЭ 2011, Химия, 11 класс, Пробный вариант, 2010
- ЕГЭ 2011, Химия, 11 класс, Реальные фото с экзамена
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №2, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №4
- ЕГЭ 2011, Химия, Методические рекомендации
- ЕГЭ 2011, Химия, Самое полное издание типовых вариантов заданий, Корощенко А.С., Каверина А.А., Добротин Д.Ю.
- ЕГЭ 2011, Химия, Универсальные материалы, Каверина А.А., Корощенко А.С., Медведев Ю.Н.
- ЕГЭ 2011. Химия. 10-11 класс. Тематические тестовые задания. Корощенко А.С., Яшукова А.В. 2011
- ЕГЭ 2011. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2011. Химия. 8-9 класс. Тематические тестовые задания. Корощенко А.С., Яшукова А.В. 2011
- ЕГЭ 2011. Химия. Анализ. 2011
- ЕГЭ 2011. Химия. Демонстрационный вариант. Спецификация.
- ЕГЭ 2011. Химия. Самое полное издание типовых вариантов заданий. Каверина А.А., Корощенко А.С., Добротин Д.Ю. 2011
- ЕГЭ 2011. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ 2011. Химия. Универсальные материалы. Каверина А.А., Корощенко А.С., Медведев Ю.Н. 2011
- ЕГЭ 2012, 11 класс, Химия, Демонстрационный вариант, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа №1, 2011
- ЕГЭ 2012, Химия, 11 класс, Диагностическая работа, 2011
- ЕГЭ 2012, Химия, 11 класс, Тренировочная работа №1, 2011
- ЕГЭ 2012, Химия, Актив-тренинг, Каверина А.А., 2011
- ЕГЭ 2012, Химия, Решение задач, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин А.Э., 2011
- ЕГЭ 2012, Химия, Сдаем без проблем, Антошин, 2011
- ЕГЭ 2012. Химия. 11 класс. Демонстрационный вариант. 2011
- ЕГЭ 2012. Химия. 11 класс. Кодификатор. 2011
- ЕГЭ 2012. Химия. 11 класс. Спецификация. 2011
- ЕГЭ 2012. Химия. Актив-тренинг. Каверина А.А. 2011
- ЕГЭ 2012. Химия. Самое полное издание типовых вариантов. Каверина А.А., Добротин Д.Ю. 2011
- ЕГЭ 2012. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
- ЕГЭ по химии, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- ЕГЭ по химии, Экспресс-репетитор, Егоров А.С., Аминова Г.Х., 2011
- ЕГЭ, Репетитор по химии, Белов Н.В., 2011
- ЕГЭ, Репетитор по химии, Белов, 2011
- ЕГЭ, Химия, 10 класс, 52 диагностических варианта, Савинкина Е.В., 2011
- ЕГЭ, Химия, 10-11 класс, Тематические тестовые задания, Корощенко А.С., Яшукова А.В., 2011
- ЕГЭ, Химия, 8-9 класс, Тематические тестовые задания, Корощенко А.С., Яшукова А.В., 2011
- Комплекс заданий по химии для подготовки к ЕГЭ, Аввакумова Н.П., Фомин И.В., 2011
- Химия, 10 класс, Краевая диагностическая работа, УМК 1-2, 2011
- Химия, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- Химия, Экспресс-репетитор для подготовки к ЕГЭ, Егоров А.С., Аминова Г.Х., 2011
- Химия. Тематические тесты для подготвки к ЕГЭ. Доронькин В.Н. 2011
2010 год
- ЕГЭ — Химия — Практикум по выполнению типовых тестовых заданий ЕГЭ — Медведев Ю.Н.
- ЕГЭ 2010 — Химия — Типовые тестовые задания — Медведев Ю.Н.
- ЕГЭ 2010, Химия, 11 класс, Вариант №1
- ЕГЭ 2010, Химия, 11 класс, Вариант №121
- ЕГЭ 2010, Химия, 11 класс, Вариант №128
- ЕГЭ 2010, Химия, 11 класс, Вариант №133
- ЕГЭ 2010, Химия, 11 класс, Вариант №2
- ЕГЭ 2010, Химия, 11 класс, Вариант №3
- ЕГЭ 2010, Химия, 11 класс, Вариант №4
- ЕГЭ 2010, Химия, 11 класс, Вариант №5
- ЕГЭ 2010, Химия, 11 класс, Варианты №101, 103-108
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа, 2009
- ЕГЭ 2010, Химия, 11 класс, Реальный вариант
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №1, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №2, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №4, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №5
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №6
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №1
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №2
- ЕГЭ 2010, Химия, Пробный вариант ЕГЭ №3
- ЕГЭ 2010. Химия. Анализ. 2010
- ЕГЭ 2010. Химия. Демонстрационный вариант.
- ЕГЭ 2010. Химия. Кодификатор.
- ЕГЭ 2011, Химия, 11 класс, Диагностическая работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Пробный вариант, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №1, 2010
- ЕГЭ 2011, Химия, 11 класс, Тренировочная работа №2, 2010
- ЕГЭ по химии — Демонстрационный вариант — 2010
- ЕГЭ-2010 — Химия — самые новые реальные задания — Корощенко А.С., Снастина М.Г.
- ЕГЭ. Химия. Универсальный справочник. Мешкова О.В. 2010
- Отличник ЕГЭ — Химия — Решение сложных задач — Каверина А.А., Корощенко А.С., Добротин Д.Ю., Медведев Ю.Н., Снастина М.Г.
- Отличник ЕГЭ — Химия — Решение сложных задач — Каверина А.А., Корощенко А.С., Добротин Д.Ю., Медведев Ю.Н., Снастина М.Г. — 2010
- Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010 — Химия — Корощенко А.С., Снастина М.Г.
- Химия — Подготовка к ЕГЭ — Тематические тесты — Базовый и повышенный уровни — 10-11 класс — Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралёва В.А.
- Химия, 11 класс, Краевая диагностическая работа, 10.2010
- Химия, 11 класс, Краевая диагностическая работа, 2010
- Химия. Подготовка к ЕГЭ 2010. Доронькин В.Н. 2009
2009 год
- ЕГЭ 2009 — Химия — Репетитор — Оржековский П.А., Богданова В.В.
- ЕГЭ 2009 — Химия — Сборник заданий — Оржековский П.А., Богданова В.В., Васюкова Е.Ю., Мещерякова Л.М.
- ЕГЭ 2009 — Химия — Сборник экзаменационных заданий — Каверина А.А., Медведев Ю.Н., Добротин Д.Ю.
- ЕГЭ 2009 по химии, 11 класс, 37 вариантов
- ЕГЭ 2009 по химии, Репетиционный экзамен
- ЕГЭ 2009, Химия, 11 класс, Репетиционный экзамен
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №1
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №2
- ЕГЭ 2009, Химия, 11 класс, Тренировочная работа №3
- ЕГЭ 2009, Химия, Методическое письмо
- ЕГЭ 2009. Химия. Анализ. 2009
- ЕГЭ 2010, Химия, 11 класс, Диагностическая работа, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №1, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №2, 2009
- ЕГЭ 2010, Химия, 11 класс, Тренировочная работа №4, 2009
- ЕГЭ по химии — Демонстрационный вариант — 2009
- ЕГЭ, Химия, 11 класс, Демонстрационный вариант, 2009
- ЕГЭ-2009 — Химия — Самые новые реальные задания — Корощенко А.С., Снастина М.Г.
- Единый государственный экзамен, химия, задания для абитуриентов, Лукин П.М., 2009
- Подготовка к ЕГЭ на 100 баллов. Химия. 2009
- Самое полное издание типовых вариантов реальных заданий — ЕГЭ 2009 — Химия — Корощенко А.С., Снастина М.Г.
- Химия. Подготовка к ЕГЭ 2010. Доронькин В.Н. 2009
- Химия. Полный справочник для подготовки к ЕГЭ. Лидин Р.А. 2009
2008 год
- ЕГЭ 2008 по химии, 35 вариантов с ответами
- ЕГЭ 2008, Химия, 11 класс, Демонстрационный вариант
- ЕГЭ 2008, Химия, Анализ
- ЕГЭ 2008, Химия, Экзамен, 20 вариантов
- ЕГЭ 2008, Химия, Экзамен, Вариант №10
- ЕГЭ 2008. Химия. Самое полное издание реальных заданий. Корощенко А.С., Снастина М.Г. 2008
- ЕГЭ по химии — 2008.
- ЕГЭ по химии — Демонстрационный вариант — 2008.
- Самое полное издание реальных заданий ЕГЭ. Химия — Корощенко А.С., Снастина М.Г. — 2008
2007 год
- Аналитический отчет о результатах ЕГЭ по химии 2007 года
- ЕГЭ по химии — 2007.
- ЕГЭ, Химия, 11 класс, Контрольные и проверочные работы, Габриелян О.С., 2007
- Методическое письмо «Об использовании результатов единого государственного экзамена 2007 года в преподавании химии в средней школе» — 2007
- Экзаменационные материалы для подготовки к единому государственному экзамену — ЕГЭ 2007 — Химия — Стрельникова Е.Н.
2006 год
- ЕГЭ 2006, Химия, 11 класс, 29 реальных вариантов
- ЕГЭ по химии — Демонстрационный вариант — 2006
2005 год
- ЕГЭ по химии — Демонстрационный вариант — 2005.
2004 год
- ЕГЭ по химии — демонстрационный вариант — 2004
2003 год
- ЕГЭ 2003, Химия, 11 класс, Экзамен, Вариант №1201
- ЕГЭ, Шпаргалка по химии
2002 год
- ЕГЭ — Химия — Варианты контрольных измерительных материалов — 2002
- ЕГЭ 2002, Химия, 11 класс, Экзамен, Вариант №151
- ЕГЭ по химии — Демонстрационный вариант — 2002.
ЕГЭ по химии разных годов
- ЕГЭ по химии, Таблицы
- ЕГЭ по химии, Таблицы по химии
- Результаты ЕГЭ по химии
- Химия, Полный справочник для подготовки к ЕГЭ, Лидин Р.А.
Содержание раздела ЕГЭ по химии
Описание раздела «ЕГЭ по химии 2023»
Здесь Вы можете скачать реальные задания ЕГЭ по химии 2023, 2022, 2021, 2020, 2019, 2018, 2017, 2016, 2015, 2014 и 2013, демоверсии ЕГЭ по химии, демонстрационную версию ЕГЭ, реальные и демонстрационные варианты по предмету химия, реальные официальные варианты.
Единый Государственный Экзамен по химии не является обязательным для сдачи при выпускных экзаменах в школе, но его придется сдавать тем, кто хочет поступить в Медицинский, Химико-технологический, Строительный, Биотехнологический ВУЗ.
Вы можете смотреть результаты ЕГЭ по химии здесь: http://check.ege.edu.ru/.
График загрузки результатов ЕГЭ (график обработки экзаменационных работ): http://www.ege.edu.ru/ru/classes-11/res/ .
По статистике один из десяти выпускников выбирает для сдачи предмет химию. И специально для данных 10% мы предоставляем вам демонстрационные варианты ЕГЭ по химии 2023, 2022, 2021, 2020, 2019, 2018, 2017, 2016, 2015, 2014, 2013, 2012, 2011, 2010, 2009.
А также самое полное издание типовых вариантов реальных заданий, сборник экзаменационных и самых новых реальных заданий, тематические тесты — базовый и повышенный уровни, практикум по выполнению типовых тестовых заданий ЕГЭ, аналитический отчет о результатах ЕГЭ по химии прошлого года.
Здесь вы найдете материалы следующих авторов ЕГЭ по химии: Корощенко А.С., Снастина М.Г., Каверина А.А., Медведев Ю.Н., Добротин Д.Ю., Оржековский П.А., Богданова В.В., Васюкова Е.Ю., Мещерякова Л.М., Оржековский П.А., Корощенко А.С., Доронькин В.Н., Бережная А.Г., Сажнева Т.В., Февралёва В.А.
Результаты ЕГЭ по химии.
Информацию о результатах ЕГЭ смотрите здесь.
Группы заданий ЕГЭ по химии.
В 2012 и 2013 году тест ЕГЭ по химии содержал 43 вопроса.
В 2014 году тест ЕГЭ по химии содержит 43 вопроса, сгруппированных по типам заданий и разбитых на три части по уровню сложности:
- Задания А1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28 – это вопросы базовой сложности, при ответе нужно выбрать 1 правильный ответ из 4-х, за каждое правильно выполненное задание Вы получите один первичный балл.
- Задания В1, B2, B3, B4, B5, B6, B7, B8, B9, B10 – вопросы средней сложности, ответы на эти вопросы необходимо дать кратко, в виде числа или последовательности цифр.
- Задания С1, C2, C3, C4, C5 — задания очень высокой сложности, на них необходимо дать подробный ответ на вопрос по неорганической и органической химии.
На экзамене можно использовать периодическую систему химических элементов Менделеева Д.И., таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов, а также непрограммируемый калькулятор, который выдается на экзамене.
Используя материалы для подготовки к тестам, Вы успешно сдадите экзамен ЕГЭ по химии в 2023 году.
Тренировочная работа №3 статград ЕГЭ 2022 по химии 11 класс задания и ответы для вариантов ХИ2110301, ХИ2110302, ХИ2110303, ХИ2110304. Официальная дата проведения работы: 21.01.2022 (21 января 2022 год).
Скачать варианты ХИ2110301-ХИ2110302
Скачать варианты ХИ2110303-ХИ2110304
Все ответы (решения) и задания (без водяного знака)
Работа статград по химии состоит из двух частей, включающих в себя 34 задания. Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
Тренировочные варианты статград ХИ2110301 и ХИ2110302 ЕГЭ 2022 по химии 11 класс:
Решать варианты ХИ2110303 и ХИ2110304:
Сложные задания и ответы с 1 варианта:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) K, 2) Cl, 3) Li, 4) Be, 5) P Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)У каких из указанных элементов ровно треть от общего числа электронов находится на внешнем уровне (в основном состоянии)? Запишите номера выбранных элементов в порядке возрастания.
Правильный ответ: 35
2)Из указанного ряда выберите три металла. Расположите их в порядке уменьшения радиуса атома. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Правильный ответ: 134
3)Из указанного ряда выберите два элемента, которые в соединениях могут проявлять степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Правильный ответ: 25
4)Сколько всего электронов участвуют в образовании химических связей в молекуле NH3 и в ионе NH4 +? Запишите два выбранных ответа в порядке возрастания. 1) 0 2) 2 3) 4 4) 6 5) 8
Правильный ответ: 45
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислотного оксида; Б) щёлочи; В) двойной соли.
Правильный ответ: 264
6)В двух пробирках находился оксид меди(II). В первую пробирку добавили раствор вещества Х, а во вторую – избыток концентрированного раствора вещества Y. В обеих пробирках осадок полностью растворился. В первой пробирке раствор приобрёл голубой цвет, а во второй – зелёный. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) NaOH 2) Na2CO3 3) HCl 4) AgNO3 5) H2SO4
Правильный ответ: 53
11)Из предложенного перечня выберите две пары изомеров. 1) пентан и циклопентан 2) гексан и 2,3-диметилбутан 3) фенол и бензиловый спирт 4) уксусная кислота и метилформиат 5) метиламин и диметиламин.
Правильный ответ: 24
12)Из предложенного перечня выберите все вещества, при гидролизе которых в кислой среде образуется уксусная кислота. 1) CH3CN 2) CH3OC2H5 3) CH3CHCl2 4) CH3C(O)Cl 5) CH3COOC2H5
Правильный ответ: 145
13)Из предложенного перечня выберите два вещества, которые не вступают в реакцию гидролиза. 1) глицилаланин 2) фенилаланин 3) целлюлоза 4) дезоксирибоза 5) трипальмитат глицерина
Правильный ответ: 24
17)Из предложенного перечня выберите все реакции элиминирования (отщепления). 1) нагревание пропанола с концентрированной серной кислотой 2) нагревание бензола с концентрированной серной кислотой 3) нагревание 1,2-дихлорэтана с магнием 4) взаимодействие 1,2-дихлорэтана со спиртовым раствором щёлочи 5) взаимодействие метилацетата с водным раствором щёлочи
Правильный ответ: 134
18)Укажите все факторы, от которых зависит скорость разложения пероксида водорода в водном растворе. 1) температура 2) объём раствора 3) давление кислорода над раствором 4) концентрация пероксида водорода 5) действие света на раствор
Правильный ответ: 145
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих концентрацию 0.1 моль/л. Расположите эти вещества в порядке возрастания pH водного раствора. Запишите номера веществ в правильном порядке. 1) NH3 2) NH4Cl 3) KCl 4) KOH
Правильный ответ: 2314
23)В реакторе постоянного объёма смешали азот и водород в мольном соотношении 1:3. Смесь нагрели и добавили катализатор. Через некоторое время установилось равновесие: N2(г) + 3H2(г) ←→ 2NH3(г) Используя данные таблицы, найдите исходную концентрацию H2 (X) и равновесную концентрацию N2 (Y)
Правильный ответ: 62
26)Растворимость нитрата калия в воде при 60 о С составляет 110 г на 100 г воды. Сколько граммов нитрата калия содержится в 170 г насыщенного раствора при этой температуре? (Запишите число с точностью до целых.)
Правильный ответ: 89
27)Термохимическое уравнение сгорания ацетилена имеет вид: 2C2H2 + 5O2 = 4CO2 + 2H2O(ж) + 2600 кДж. Сколько теплоты (в кДж) выделится при сжигании 5,6 л (н. у.) ацетилена? (Запишите число с точностью до целых.)
Правильный ответ: 325
28)Сколько литров аммиака (н. у.) потребуется для получения 90 г карбамида (NH2)2CO по реакции с углекислым газом, если выход продукта составляет 60 %? (Запишите число с точностью до целых.)
Правильный ответ: 112
29)Для выполнения заданий 29 и 30 используйте следующий перечень веществ: хлорид хрома(III), гидрокарбонат калия, пероксид водорода, гидроксид калия, сульфат аммония, магний. Допустимо использование водных растворов веществ и воды в качестве среды для протекания реакций. Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция, приводящая к изменению цвета раствора, но без образования осадка. В ответе запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите два вещества, которые вступают в реакцию ионного обмена, при этом выделяется газ, но не выпадает осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
31)Газ, полученный при действии концентрированной соляной кислоты на твёрдый перманганат калия, пропустили через горячий крепкий раствор карбоната калия, в процессе реакции из раствора выделялся газ. При охлаждении полученного раствора из него выделились кристаллы, которые отфильтровали и высушили на воздухе. Кристаллы нагрели с красным фосфором, а продукты реакции растворили в воде и получили раствор, имеющий кислую среду. Напишите молекулярные уравнения четырёх описанных реакций.
33)Навеску сульфида железа(II) массой 14,08 г сожгли в атмосфере кислорода. Твёрдый остаток растворили в строго необходимом количестве 10%-й соляной кислоты, а в полученный раствор добавили порошок железа массой 20 г, нерастворившийся порошок отфильтровали. Рассчитайте массу полученного раствора и массовую долю соли в нем. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
34)Органическое вещество представляет собой летучую жидкость с характерным приятным запахом. При сжигании 11,1 г этого вещества было получено 10,08 л углекислого газа (н. у.) и 8,1 г воды. Установите молекулярную формулу вещества и определите его строение, если известно, что оно даёт реакцию «серебряного зеркала» и гидролизуется с образованием двух органических соединений. Напишите уравнение реакции вещества с аммиачным раствором оксида серебра (в уравнении используйте структурные формулы органических веществ).
Сложные задания и ответы с 2 варианта:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Ca, 2) O, 3) F, 4) Cr, 5) S Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)У каких из указанных элементов число электронов на внешнем уровне (в основном состоянии) больше числа внутренних электронов? Запишите номера выбранных элементов в порядке возрастания.
Правильный ответ: 23
2)Из указанного ряда выберите три неметалла. Расположите их в порядке увеличения радиуса атома. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Правильный ответ: 325
3)Из указанного ряда выберите два элемента, которые в соединениях могут проявлять степень окисления +6. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Правильный ответ: 45
4)Сколько всего электронов участвуют в образовании химических связей в молекуле H2O и в ионе H3O+? Запишите два выбранных ответа в порядке возрастания. 1) 0 2) 2 3) 4 4) 6 5) 8
Правильный ответ: 34
6)В двух колбах находился раствор карбоната калия. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В обеих колбах выпал осадок, но в первой колбе также выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Правильный ответ: 24
11)Из предложенного перечня выберите две пары изомеров. 1) бензол и гексадиин-1,5 2) уксусная кислота и метилацетат 3) гексен-2 и гексин-2 4) пиридин и анилин 5) пропиламин и триметиламин
Правильный ответ: 15
12)Из предложенного перечня выберите все вещества, при взаимодействии которых с водой в соответствующих условиях образуется уксусный альдегид. 1) C2H2 2) CH3CN 3) CH3CHCl2 4) CH3CCl3 5) CH3C(O)OCH=CH2
Правильный ответ: 135
13)Из предложенного перечня выберите два вещества, которые вступают в реакцию гидролиза. 1) сахароза 2) тристеарат глицерина 3) рибоза 4) цистеин 5) олеиновая кислота
Правильный ответ: 12
17)Из предложенного перечня выберите все реакции замещения. 1) взаимодействие пропена с хлором при сильном нагревании 2) взаимодействие пропена с бромоводородом 3) взаимодействие толуола с азотной кислотой 4) взаимодействие водорода с бензолом 5) взаимодействие этанола с уксусной кислотой в присутствии серной кислоты
Правильный ответ: 135
18)Укажите все факторы, от которых зависит скорость реакции порошка диоксида марганца с концентрированной соляной кислотой. 1) давление хлора над раствором 2) форма реакционного сосуда 3) pH в растворе кислоты 4) степень измельчения порошка 5) температура
Правильный ответ: 345
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих концентрацию 0.01 моль/л. Расположите эти вещества в порядке уменьшения pH водного раствора. Запишите номера веществ в правильном порядке. 1) MgCl2 2) Ca(OH)2 3) Ca(NO3)2 4) HClO4
Правильный ответ: 2314
26)В 115 г насыщенного при определённой температуре раствора карбоната калия содержится 62 г соли. Чему равна растворимость карбоната калия при этой температуре (в г соли на 100 г воды)? (Запишите число с точностью до целых.)
Правильный ответ: 117
27)Термохимическое уравнение сгорания этана имеет вид: 2C2H6 + 7O2 = 4CO2 + 6H2O(ж) + 3115 кДж. Сколько литров этана (н. у.) вступило в реакцию, если в результате выделилось 445 кДж теплоты? (Запишите число с точностью до десятых.)
Правильный ответ: 6,4
28)Из смеси 1 м3 угарного газа и 2 м3 водорода получен 1 кг метанола. Чему равен выход метанола (в %)? Объёмы газов даны при нормальных условиях. (Запишите число с точностью до целых.)
Правильный ответ: 70
29)Для выполнения заданий 29 и 30 используйте следующий перечень веществ: серная кислота, оксид магния, карбонат натрия, хлорид меди(I), аммиачная вода, ацетат свинца(II). Допустимо использование водных растворов веществ и воды в качестве среды для протекания реакций. Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция с выделением газа. В ответе запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите вещества, которые вступают в реакцию ионного обмена с образованием осадка, но без выделения газа. В ответ запишите уравнение только одной из возможных реакций. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
31)Белый фосфор подожгли на воздухе в условиях недостатка кислорода. Полученное твёрдое вещество растворили в воде. Раствор разделили на две части. К первой добавили подкисленный раствор перманганата калия и наблюдали обесцвечивание. Вторую часть раствора выпарили и полученное вещество сильно нагрели, при этом выделился газ. Напишите молекулярные уравнения четырёх описанных реакций.
33)Навеску сульфида меди(II) массой 14,4 г сожгли в атмосфере кислорода. Твёрдый остаток растворили в строго необходимом количестве 10 %-й серной кислоты, а полученный раствор подвергли электролизу с инертным анодом, в результате чего на аноде выделилось 1,12 л газа (н. у.). Рассчитайте массу полученного после электролиза раствора и массовые доли веществ в нём. Примите Ar(Cu) = 64. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
34)Органическое вещество представляет собой нелетучую, высококипящую жидкость со слабым характерным запахом, с водой смешивается в любых соотношениях. Его используют в качестве антифриза при противогололёдной обработке самолётов. При сжигании 11,4 г этого вещества было получено 10,08 л углекислого газа (н. у.) и 10,8 г воды. Установите молекулярную формулу вещества и определите его строение, если известно, что оно реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Напишите уравнение дегидратации (в уравнении используйте структурные фформулы органических веществ).
Другие тренировочные пробные варианты ЕГЭ по химии 11 класс:
Варианты ХИ2110201-ХИ2110204 ЕГЭ 2022 статград по химии 11 класс задания и ответы
Статград работы по химии задания и ответы
Share the post «Варианты ХИ2110301-ХИ2110304 ЕГЭ 2022 работа статград химия 11 класс с ответами»
- VKontakte
Метки: ЕГЭ 2022заданияответыстатградтренировочная работахимия 11 класс
Пробные варианты ЕГЭ 2023 по химии с ответами для проведения тренировочных работ в 11 классе.
Все варианты в формате ЕГЭ 2023 года.
Пробные варианты ЕГЭ 2023 по химии
| Широкопояс С.И. Борисов И.С. | |
| Вариант 15 | Скачать |
| Вариант 14 | Скачать |
| Вариант 13 | Скачать |
| Вариант 12 | Скачать |
| Вариант 11 | Скачать |
| Вариант 10 | Скачать |
| Вариант 9 | Скачать |
| Вариант 8 | Скачать |
| Вариант 7 | Скачать |
| Вариант 6 | Скачать |
| vk.com/chem4you | |
| Вариант 1 | Ответы |
| Вариант 2 | Ответы |
| Вариант 3 | Ответы |
| Вариант 4 | Ответы |
| Вариант 5 | Ответы |
| Вариант 6 | Ответы |
| Вариант 7 | Ответы |
| Вариант 8 | Ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| chem.family (с ответами) | |
| Вариант 1 (легкий уровень) | скачать |
| Вариант 2 (сложный уровень) | скачать |
| Вариант 3 (сложный уровень) | скачать |
| Вариант 4 (легкий уровень) | скачать |
| Вариант 5 (легкий уровень) | скачать |
| Вариант 6 (легкий уровень) | скачать |
| Вариант 7 (легкий уровень) | скачать |
| Вариант 8 (сложный уровень) | скачать |
| Купить сборники для подготовки к ЕГЭ
→ Доронькин, Февралева: ЕГЭ 2023 Химия. 10-11 классы. Тематический тренинг. Задания базового и повышенного уровней сложности → Юрий Медведев: ЕГЭ 2023 Химия. Типовые варианты экзаменационных заданий. 14 вариантов |
Экзаменационная работа состоит из двух частей, включающих в себя 34 задания.
Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева, таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы.
Для вычислений используйте непрограммируемый калькулятор.
Смотрите также:
Открытый вариант ЕГЭ 2021 по химии
Демонстрационный вариант ЕГЭ по химии 2022
ЕГЭ по химии — типичные ошибки
Отработка задания 14 ЕГЭ по химии
Пробный вариант ЕГЭ 2021 по химии с ответами
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Тип 3. Задачи на изменение температуры и выпадение осадка кристаллогидрата
Задача 1. 181,1 г раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II) при 10°С равна 100 г на 100 г воды.
Ответ: 69,26 г Cu(NO3)2×6H2O.
Решение (pdf файл)
Задача 2. Массовая доля сульфата натрия в насыщенном при температуре 0°С растворе составляет 4,3%. К раствору серной кислоты объемом 80 мл (массовая доля H2SO4 30%, плотность 1,22 г/мл) добавили раствор гидроксида натрия (массовая доля NaOH 32%) до полной нейтрализации. Раствор охладили до температуры 0°С. Определите массу выпавшей соли, учитывая, что образуется кристаллогидрат Na2SO4×10H2O.
Ответ: 88,55 г Na2SO4×10H2O.
Источник: Сборник задач по химии для поступающих в вузы, Г.П. Хомченко.
Решение (pdf файл)
Задача 3. Растворимость карбоната натрия при 20°С составляет 21,8 г в 100 г воды, а при 40°С – 48,8 г. Вычислите массу кристаллической соды, которая выпадет в осадок, если 200 г насыщенного при 40°С раствора охладить до 20°С.
Ответ: 155,87 г Na2CO3·10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)
Задача 4. Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Ответ: 228,62 г Na2SO4×10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)