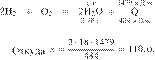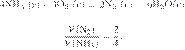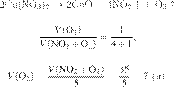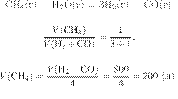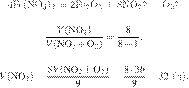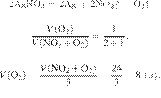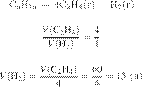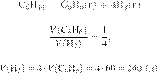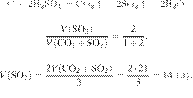Задания
Версия для печати и копирования в MS Word
Тип 27 № 11377
Дано термохимическое уравнение:
В результате реакции поглотилось 35 кДж теплоты. Сколько граммов серебра образовалось? Ответ округлите до ближайшего целого числа.
Спрятать решение
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
Раздел кодификатора ФИПИ: 4.3.3 Расчеты массы вещества или объема газов
Спрятать решение
·
·
Сообщить об ошибке · Помощь
Задания
для подготовки
1.
Задание 28 № 4768
В результате
реакции, термохимическое
уравнение которой
выделилось 1479 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Ответ округлите до
целых.
Решение.
Составим пропорцию:
Ответ просят округлить до целых.
Ответ: 110 г.
2.
Задание 28 № 6258
В результате
реакции, термохимическое
уравнение которой
выделилось 171 кДж теплоты. Вычислите
массу гидроксида натрия, который был нейтрализован соляной кислотой. Ответ
укажите в граммах с точностью до целых.
Решение.
Запишем молекулярное уравнение:
Из пропорции получаем:
Ответ: 120 г.
1/28
3.
Задание 28 № 6259
Вычислите объём
газа (н. у.), который не вступит в реакцию, если сжигать 50 л водорода в 50 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
50 л |
50 л |
0 |
|
изменение |
— 50 л |
— 25 л |
+ |
|
стало |
0 л |
25 л |
50 |
Согласно уравнению
реакции, каждые два объёма водорода реагируют с одним объёмом кислорода, и при
этом получается два объёма газообразной воды.
Тогда 50 л водорода прореагируют с
25 л кислорода, а ещё 25 л кислорода не вступят в реакцию.
Ответ просят дать с точностью до
целых.
Ответ: 25 л.
4.
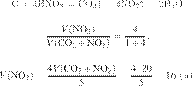
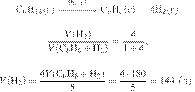
Задание 28 № 6260
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
объём (н. у.) водорода, вступившего в реакцию. Ответ укажите в литрах с точностью
до десятых.
Решение.
Составим пропорцию:
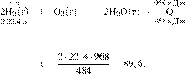
получаем:
Ответ: 89,6 л.
2/28
5.
Задание 28 № 6261
Вычислите объём
газа (н. у.), не вступит в реакцию, если сжигать 40 л угарного газа в 40 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
40 л |
40 л |
0 |
|
изменение |
— 40 л |
— 20 л |
+ |
|
стало |
0 |
20 л |
40 |
Согласно уравнению
реакции, каждые два объёма угарного газа реагируют с одним объёмом кислорода, и
при этом получается два объёма углекислого газа.
Тогда 40 л угарного газа
прореагируют с 20 л кислорода, а ещё 20 л кислорода не вступят в реакцию.
Ответ: 20 л.
6.
Задание 28 № 6262
В результате
реакции, термохимическое
уравнение которой
выделилось 264 кДж теплоты. Вычислите
массу образовавшейся при этом серной кислоты. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 294 г.
3/28
7.
Задание 28 № 6263
В результате
реакции, термохимическое
уравнение которой
выделилось 121 кДж теплоты. Вычислите
объём (н. у.) кислорода, который израсходован на сжигание водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Составим пропорцию:
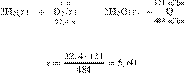
получаем:
Ответ просят дать с точностью до
десятых.
Ответ: 5,6 л.
8.
Задание 28 № 6264
Вычислите объём
азота (н. у.), который образуется при полном сгорании 20 л аммиака в избытке
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные
стехиометрическим
коэффициентам в
уравнениях реакций.
Запишем
уравнение реакции и отношение
объёмов:
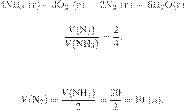
Из пропорции
имеем:
Ответ: 10 л.
4/28
9.
Задание 28 № 6265
В результате
реакции, термохимическое
уравнение которой
выделилось 28,5 кДж теплоты.
Вычислите массу азотной кислоты, которая была нейтрализована гидроксидом
калия. Ответ укажите в граммах с точностью
до десятых.
Решение.
Запишем молекулярное уравнение:
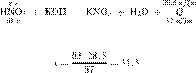
получаем:
Ответ: 31,5 г.
10.
Задание 28 № 6266
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
массу образовавшейся при этом воды. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
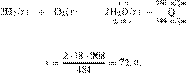
получаем:
Ответ просят дать с точностью до
целых.
Ответ: 72 г.
5/28
11.
6267
Вычислите
максимально возможный объём (н. у.) аммиака, который может быть получен исходя
из 40 л водорода и 30 л азота. Ответ укажите
в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
30 л |
40 л |
0 |
|
изменение |
— x л |
— 3x л |
+ |
|
стало |
(30-x) л |
(40-3x) л |
2x |
Согласно уравнению
реакции, каждый объём азота реагируют с тремя объёмами водорода, и при этом
образуется два объёма аммиака. Максимально возможный объём аммиака образуется,
когда один из реагентов потратится полностью.
И максимально возможный объём
аммиака равен =
Ответ просят дать с точностью до
десятых.
Ответ: 26,7 л.
12.
Задание 28 № 6395
Вычислите объём
аммиака, который можно получить из 600 л водорода, если объемная доля выхода
аммиака равна 40 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
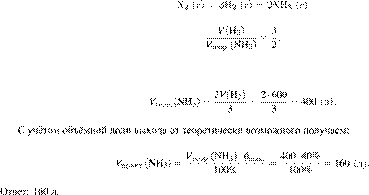
6/28
13.
6435
Вычислите объём
водорода, можно получить при разложении 250 л метана, если объемная доля выхода
водорода равна 60 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
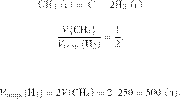
Из пропорции имеем:
С учётом объёмной доли выхода от
теоретически возможного получаем:
Ответ: 300 л.
14.
Задание 28 № 6475
Термохимическое
уравнение сгорания железа в
кислороде:
В результате
реакции выделилось 2057,5 кДж. Вычислите массу образовавшегося оксида железа(III)
Ответ дайте в граммах с точностью до целых. Решение.
Из пропорции получаем:
Ответ: 400 г.
7/28
15.
6515
Дано
термохимическое уравнение:
В реакции
поглотилось 95 кДж теплоты. Вычислите массу вступившего в реакцию углерода. Ответ
дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 10 г.
16.
Задание 28 № 6557
Вычислите объём
кислорода, который необходим для окисления 20,2 л (н. у.) водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
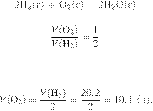
Из пропорции имеем:
Ответ: 10,1 л.
8/28
17.
6612
При полном
восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж
теплоты. Вычислите теплоту реакции
(в кДж на моль
)
Ответ дайте с
точностью до целых (в расчётах используйте целые относительные атомные массы
элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 854 кДж.
18.
Задание 28 № 6652
При полном
восстановлении оксида свинца(II) избытком водорода образовалось 41,4 г металла
и выделилось 4,4 кДж теплоты. Вычислите теплоту
реакции
(в кДж на моль
).
Ответ дайте с точностью до целых (в
расчётах используйте целые относительные атомные массы элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 22 кДж.
9/28
19.
6692
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите массу
ацетилена, которая вступила в эту реакцию, если в результате выделилось 400 кДж?
Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 52 г.
20.
Задание 28 № 6732
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите теплоту
(в кДж), которая выделится, если в реакцию вступит 117 г ацетилена. Ответ дайте
с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 900 кДж.
10/28
21.
6781
Вычислите объём
азота (н. у.), образуется при полном сгорании 67,2 л (н. у.) аммиака.
Ответ дайте в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Из пропорции имеем:
Ответ: 33,6 л.
22.
Задание 28 № 6821
При
разложении нитрата меди(II)
образовалось 12 л оксида азота(IV).
Вычислите объём образовавшегося кислорода.
Объёмы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью
до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропрорцию:
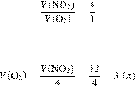
Из пропорции имеем:
Ответ: 3 л.
11/28
23.
6861
Для обжига
сульфида цинка потребовалось 240 л кислорода. Вычислите объём образовавшегося
оксида серы(IV). Объёмы газов измерены при одинаковых условиях. Ответ дайте в
литрах с точностью до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропорцию:
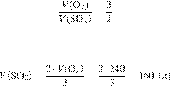
Из пропорции имеем:
Ответ: 160 л.
24.
Задание 28 № 7106
В результате реакции,
термохимическое уравнение которой
выделилось 1452 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Запишите число с
точностью до целых.
Решение.
Составим пропорцию:
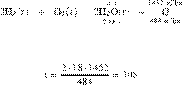
Из пропорции имеем:
Ответ: 108 г.
12/28
25.
9641
В реакцию, термохимическое уравнение
которой
вступило 88 г углекислого газа.
Вычислите количество теплоты, которое выделится при этом. Ответ дайте в кДж с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 204 кДж.
26.
Задание 28 № 9682
При полном
разложении нитрата меди(II) образовалась смесь газов общим объёмом 35 л. Вычислите
объём кислорода в этой смеси. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 7 л.
13/28
27.
9715
В результате
реакции выделилось 85,5 кДж теплоты. Вычислите массу оксида азота(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 45 г.
28.
Задание 28 № 9750
Вычислите объём
кислорода, который потребуется для полного окисления 500 л аммиака до оксида
азота(II) в присутствии катализатора. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 625 л.
14/28
29.
9784
Дано термохимическое уравнение:
В результате
реакции выделилось 226 кДж теплоты. Вычислите массу оксида углерода(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до десятых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 22,4 г.
30.
Задание 28 № 9821
Дано термохимическое уравнение:
В результате реакции
поглотилось 705 кДж. Вычислите массу оксида железа(III), вступившего в реакцию.
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 480 г.
15/28
31.
9855
В результате реакции
выделилось 1000 кДж теплоты. Вычислите массу образовавшегося оксида меди(II).
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 200 г.
32.
Задание 28 № 9889
При разложении
оксида азота образовалось 25 л азота и 12,5 л кислорода. Вычислите объём
вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
По условию объём
азота в два раза больше объёма кислорода, значит, в исходном оксиде число
атомов азота в два раза больше, чем число атомов кислорода. Запишем уравнение
реакции:
Составим пропорцию:

оксида азота, получаем:
Ответ: 25 л.
16/28
33.
9923
паровой конверсии
метана образовалась смесь оксида углерода(II) и водорода общим объёмом 800 л. Вычислите
объём израсходованного метана. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 200 л.
34.
Задание 28 № 10404
Дано термохимическое уравнение:
В результате реакции выделилось 36 кДж
теплоты. Сколько граммов хлората калия разложилось?
Примите . Ответ
округлите до ближайшего целого числа. Решение.
Из пропорции получаем:
Ответ: 98.
17/28
35.
10443
В результате
реакции выделилось 19 кДж теплоты. Сколько граммов перманганата калия
разложилось? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 79 г.
36.
Задание 28 № 10674
При полном
разложении нитрата железа(II) образовались оксид железа(III) и смесь газов общим
объёмом 36 л. Чему равен объём оксида азота(IV) в этой смеси (в л)? Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 32 л.
18/28
37.
10709
полном разложении нитрата серебра
образовались серебро и смесь газов общим объёмом 24 л.
Чему равен объём кислорода в этой
смеси (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 8 л.
38.
Задание 28 № 11089
Определите объём
водорода, необходимый для полного гидрирования 50 л ацетилена. Объёмы газов
измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
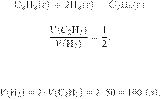
Из пропорции имеем:
Ответ: 100 л.
19/28
39.
11169
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 66 кДж теплоты. Сколько граммов гидроксида натрия вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 48 г.
40.
Задание 28 № 11234
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 64 кДж теплоты. Сколько граммов азотной кислоты вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 72 г.
20/28
41.
11272
пиролизе (высокотемпературном разложении)
октана образовались только этилен объёмом 60 л
и водород. Чему равен объём водорода
(в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 15 л.
42.
Задание 28 № 11307
При ароматизации
гексана образовались только газообразный бензол объёмом 60 л и водород. Чему
равен объём водорода (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 240 л.
21/28
43.
11342
Дано термохимическое уравнение:
В результате реакции поглотилось 63
кДж теплоты. Сколько граммов оксида меди(II) образовалось?
Примите Ответ округлите
до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
44.
Задание 28 № 11377
Дано термохимическое уравнение:
В результате
реакции поглотилось 35 кДж теплоты. Сколько граммов серебра образовалось? Ответ
округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
22/28
45.
12383
растворении
углерода в концентрированной серной кислоте образовалась смесь газов общим
объёмом 21 л. Сколько литров сернистого газа содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 14.
46.
Задание 28 № 12418
При растворении
углерода в концентрированной азотной кислоте образовалась смесь газов общим
объёмом 20 л. Сколько литров оксида азота(IV) содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 16.
23/28
47.
12617
При сжигании
углеводорода образовалось 8 л углекислого газа и 10 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 13.
48.
Задание 28 № 12652
При сжигании
углеводорода образовалось 12 л углекислого газа и 18 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 21.
24/28
49.
12866
Термохимическое уравнение горения
алюминия имеет вид
В результате
реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в
реакцию? Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ просят округлить до десятых.
Ответ: 16,2.
50.
Задание 28 № 13034
Термохимическое уравнение горения
хрома имеет вид:
В результате
реакции выделилось 342 кДж теплоты. Сколько граммов хрома вступило в реакцию?
Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 31,2.
25/28
51.
13096
Термохимическое уравнение горения
этана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 12 г этана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 570 кДж.
52.
Задание 28 № 13131
Термохимическое уравнение горения
бутана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 23,2 г бутана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 1060 кДж.
26/28
53.
13558
Какой объём
водорода потребуется для полного гидрирования 5,6 л пропена? Объёмы газов
измерены в одинаковых условиях. (Запишите число с точностью до десятых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 5,6 л.
54.
Задание 28 № 13631
При каталитической
дегидроциклизации гексана образовалась смесь паров бензола и водорода общим
объёмом 180 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 144.
27/28
55.
13666
При каталитической
дегидроциклизации гептана образовалась смесь паров толуола и водорода общим
объёмом 260 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 208.
56.
Задание 28 № 13705
Какой объём оксида серы(IV) выделится при
сжигании 64 л сероводорода в избытке кислорода?
Объёмы газов измерены в
одинаковых условиях. (Запишите число с точностью до целых.) Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 64 л.
28/28
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #химияогэ #химик #егэхимия #химияегэ #репетиторпохимии
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Все об электролизе за 40 минут | ЕГЭ ХИМИЯ 2022 | СОТКА
Химия ЕГЭ сотка

Ориентация бензольного кольца за 45 минут | ЕГЭ ХИМИЯ 2020 | Онлайн-школа СОТКА
Химия ЕГЭ сотка

Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКА
Химия ЕГЭ сотка

Разложение нитратов за 5 минут | ХИМИЯ ЕГЭ | СОТКА
Химия ЕГЭ сотка
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
12.03.2023
ЕГЭ▿высокий уровень сложности▿РЕШУ ЕГЭ(11377)
Какое деление мейоза сходно с митозом? Объясните, в чем оно выражается. К какому набору хромосом в клетке приводит мейоз.
📜Теория для решения:
Жизненный цикл клетки. Митоз. Мейоз
Посмотреть решение
- сходство с митозом наблюдается во втором делении мейоза;
- все фазы сходны, к полюсам клетки расходятся сестринские хромосомы (хроматиды);
- образовавшиеся клетки имеют гаплоидный набор хромосом.
Ответ: см. решение
Ксения Алексеевна | Просмотров: 574
Задание №11057
Укажите все цифры, на месте которых пишется НН.
Через неплотно притворё(1)ые ставни было видно изразцовую печь, свежевыкраше(2)ые полы, недавно краше(3)ые хозяевами стены, увеша(4)ые рисунками на темы детских сказок.
Ответ частично правильный.
Ответ правильный.
Задание состоит в варианте:
Бесплатные вебинары с ответами на все вопросы у нас на канале!
Смотреть
Бесплатные вебинары с ответами на все вопросы у нас на канале!
Смотреть
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Тип 3. Задачи на изменение температуры и выпадение осадка кристаллогидрата
Задача 1. 181,1 г раствора нитрата меди (II), содержащего 103,4 г соли, охладили до 10°С. Вычислите массу выкристаллизовавшейся шестиводной соли, если растворимость нитрата меди (II) при 10°С равна 100 г на 100 г воды.
Ответ: 69,26 г Cu(NO3)2×6H2O.
Решение (pdf файл)
Задача 2. Массовая доля сульфата натрия в насыщенном при температуре 0°С растворе составляет 4,3%. К раствору серной кислоты объемом 80 мл (массовая доля H2SO4 30%, плотность 1,22 г/мл) добавили раствор гидроксида натрия (массовая доля NaOH 32%) до полной нейтрализации. Раствор охладили до температуры 0°С. Определите массу выпавшей соли, учитывая, что образуется кристаллогидрат Na2SO4×10H2O.
Ответ: 88,55 г Na2SO4×10H2O.
Источник: Сборник задач по химии для поступающих в вузы, Г.П. Хомченко.
Решение (pdf файл)
Задача 3. Растворимость карбоната натрия при 20°С составляет 21,8 г в 100 г воды, а при 40°С – 48,8 г. Вычислите массу кристаллической соды, которая выпадет в осадок, если 200 г насыщенного при 40°С раствора охладить до 20°С.
Ответ: 155,87 г Na2CO3·10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)
Задача 4. Растворимость сульфата натрия при 20°С составляет 19,2 г в 100 г воды, а при 30°С – 40,8 г воды. Вычислите массу глауберовой соли Na2SO4×10H2O, которая выпадет в осадок, если 500 г насыщенного при 30°С раствора охладить до 20°С.
Ответ: 228,62 г Na2SO4×10H2O.
Источник: задачник, 11 класс, А.Н. Левкин, Н.Е. Кузнецова.
Решение (pdf файл)