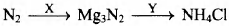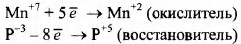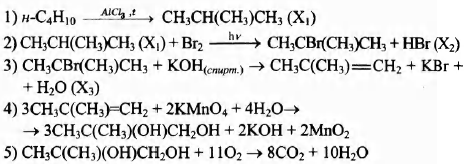Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются в ходе реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
A) Вытеснение растворимой кислотой нерастворимой кислоты, образуется кремниевая кислота и карбонат натрия, вариант: 5.
Б) Вытеснение более сильной кислотой более слабой, получится угольная кислота (которая разлагается на диоксид углерода и воду) и хлорид натрия, вариант: 4.
B) Формально при реакции обмена должен был бы получиться карбонат цинка, однако данная соль является солью слабого основания и слабой кислоты что усиливает её гидролиз, при этом при её гидролизе получается осадок (гидроксид цинка) и газ (углекислый), что также усиливает гидролиз, поэтому он становится необратимым. Вариант: 2.
Г) В зависимости от количества щелочи получится либо гидроксид цинка и хлорид калия, либо (поскольку цинк амфотерен) тетрагидроксоцинкат калия. Последнего варианта нет, поэтому выбираем гидроксид цинка и хлорид калия, вариант: 1.
Ответ: 5421.
Задания
Версия для печати и копирования в MS Word
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель
Спрятать решение
Решение.
1) Составим электронный баланс:
2) Расставлены коэффициенты в уравнении реакции:
3) Указано, что — восстановитель, а
— окислитель
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, включает все названные выше элементы | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно или отсутствуют | 0 |
| Максимальный балл | 3 |
Спрятать решение
·
·
Софья Кручинина 23.05.2016 17:43
Слева фосфора изначально 2
Михаил Ерушев
Софья, этот вариант тоже правильный.
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
1
1
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне три неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. Ti
2. Sb
3. B
4. O
5. N
2
2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
1. Ti
2. Sb
3. B
4. O
5. N
3
3
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +5. Запишите в поле ответа номера выбранных элементов.
1. Ti
2. Sb
3. B
4. O
5. N
4
4
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1. Ca(NO3)2
2. NH4NO3
3. H2O
4. BCl3
5. P2O3
5
5
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na2SO4
Б) (NH4)2HPO4
В) NO
КЛАСС
1) соль средняя
2) оксид кислотный
3) оксид несолеобразующий
4) соль кислая
6
6
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует хлор.
1) бромид калия
2) сульфат калия
3) азотная кислота
4) вода
5) оксид натрия
7
7
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид углерода (II).
1) оксид железа (II)
2) оксид серы (IV)
3) соляная кислота
4) гидроксид железа (III)
5) оксид меди (I)
8
8
В пробирку с раствором соли X добавили несколько капель вещества Y. В результате реакции наблюдали выделение желто-зеленого газа. Из предложенного перечня выберите два вещества, которые могут вступать в описанную реакцию.
1) НВr
2) КОН
3) ВаСl2
4) КМnO4
5) НСl
9
9
Задана следующая схема превращений:
Определите, какие из указанных веществ являются веществами X и Y.
1) Mg
2) СаО
3) Н2O
4) НСl
5) NH3
10
10
Установите соответствие между уравнением реакции и свойством элемента брома, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) Вг2 + КОН (охлаждение) → КВr + КВrO + Н2O
Б) Вг2 + КОН (нагревание) → КВr + КВrO3 + Н2O
В) Вг2 + H2S → НВг + S
Г) Br2 + H2O + S → HBr + H2SO4
СВОЙСТВА БРОМА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
11
11
Установите соответствие между формулой вещества и формулами реагентов, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) NaOH
Б) NO2
В) H3PO4
Г) Al2O3
ФОРМУЛЫ РЕАГЕНТОВ
1) AgNO3, MgCl2, LiOH
2) НВг, NaOH, К2O
3) AgNO3, Pb(NO3)2, H3PO4
4) S, ZnO, FeCl2
5) NaOH, Cu, H2O
12
12
Установите соответствие между названием вещества и общей формулой класса/группы, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) пропан
Б) бутен-2
В) пропин
ОБЩАЯ ФОРМУЛА
1) CnH2n+2
2) CnH2n
3) CnH2n-2
4) CnH2n-4
13
13
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентина-2.
1) пентин-1
2) метилциклобутан
3) циклопентен
4) 2-метилбутен-2
5) метилциклопентан
14
14
Из предложенного перечня выберите два вещества, каждое из которых реагирует с подкисленным раствором перманганата калия.
1) о-ксилол
2) бензол
3) тетрахлор метан
4) пентаналь
5) гексан
15
15
Из предложенного перечня веществ выберите два вещества, с которыми реагирует бутанол-2.
1) гидроксид кальция
2) пропан
3) натрий
4) железо
5) бромоводородная кислота
16
16
Из предложенного перечня выберите два вещества, с которыми реагирует диметиламин.
1) пропан
2) азотистая кислота
3) азот
4) хлороводород
5) хром
17
17
Задана следующая схема превращений веществ:
НС(O)OН —X→ НС(O)OСН3 —Y→ СН3ОН
Определите, какие из указанных веществ являются веществами Х и Y.
1. CH4
2. CH3Cl
3. CH3OH
4. CO2
5. KOH
18
18
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с эквимольным количеством бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) 2-метил пропен
Б) пропен (в присутствии органических перекисей)
В) пропен
Г) бутин-2
ПРОДУКТ РЕАКЦИИ
1) 1 -бромпропан
2) 2-бромпропан
3) 2-бромбутен-2
4) 2-бромпропен
5) 2-бром-2-метилпропан
6) 1-бром-2-метилпропан
19
19
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и калий
Б) пропанол-2 и бромоводород
В) пропанол-1 и бромоводород
Г) муравьиная кислота и метанол
ПРОДУКТ РЕАКЦИИ
1) этилат калия
2) 1-бромпропан
3) 2-бромпропан
4) мет ил ацетат
5) метил формиат
6) метилэтиловый эфир
20
20
Взаимодействие калия с бромом является процессом:
1) гетерогенным
2) гомогенным
3) обратимым
4) окислительно-восстановительным
5) разложения
21
21
Из предложенного перечня внешних воздействий выберите два, которые приводят к увеличению скорости реакции карбоната кальция с соляной кислотой.
1) охлаждение
2) нагревание
3) увеличение концентрации СО2
4) уменьшение давления в системе
5) измельчение мела
22
22
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) CuCl2
Б) Hg(NO3)2
В) CrCl3
Г) MgSO4
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) медь, хлор
2) водород, кислород
3) хром,водород, хлор
4) магний, водород, кислород
5) ртуть, кислород
23
23
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) хлорид натрия
Б) сульфат олова
В) сульфид алюминия
Г) сульфид калия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролиз по катиону
2) гидролиз по аниону
3) гидролиз по катиону и аниону
4) гидролизу не подвергается
24
24
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
A) СаСO3(тв.) [math]leftrightarrows[/math] СаО(тв.) + СO2(г)
Б) 2SO3(г) [math]leftrightarrows[/math]2SO2(r) + O2(r)
B) С(тв.) + СO2(г) [math]leftrightarrows[/math] 2СО(г)
Г) СО(г) + Сl2(г) [math]leftrightarrows[/math] СОСl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
25
25
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) фенол (р-р) и пентанол-1
Б) пропанол-1 и глицерин
В) муравьиная кислота и пропионовая кислота
Г) пальмитиновая кислота и олеиновая кислота
РЕАГЕНТ
1) Вг2(водн.)
2) Cu(OH)2
3) Na
4) H2SO4
5) NH3
26
26
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) изопрен
Б) пропен
В) этен
Г) метан
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) синтез ацетилена
2) производство каучука
3) производство этанола
4) получение хлорвинила
5) производство полипропилена
27
27
Определите массу воды, которую нужно добавить к 50 г 20%-ной раствора соляной кислоты, чтобы она стала 10%-ной.
Ответ:___________________г.
(Запишите число с точностью до целых).
28
28
Чему равен объем азота, который при н.у. необходимо взять для получения 17 г аммиака при условии количественного выхода?
Ответ:___________________л.
(Запишите число с точностью до десятых.)
29
29
Чему равен объем газа, образовавшегося в результате растворения 40 г карбоната кальция в избытке соляной кислоты?
Ответ:___________________л.
(Запишите число с точностью до сотых.)
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
30
Используя метод электронного баланса, составьте уравнение реакции
КМnO4 + РН3 + … → MnSO4 + Н3РO4 + … + Н2O
Определите окислитель и восстановитель.
Показать ответ
8КМnO4 + 5РН3 + 12H2SO4 = 8MnSO4 + 5Н3РO4 + 4K2SO4 + 12Н2O
31
Осадок, полученный при взаимодействии растворов сульфата алюминия и нитрата бария, отфильтровали. Фильтрат обработали едким натром в мольном соотношении 1:3. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
Показать ответ
1) Al2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Al(NO3)3
2) Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
3) 2Al(OH)3 = Al2O3 + 3H2O
4) Al2O3 + 6HCl = 2AlCl3 + 3H2O
32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Показать ответ
33
Смесь алюминиевых и железных опилок обработали водным раствором гидроксида натрия, при этом выделилось 13,44 л водорода (н.у.). При обработке такой же навески смеси соляной кислотой выделилось 15,68 л водорода (н.у.). Определите содержание железа в исходной смеси в %, с точностью до десятых.
34
При сгорании в кислороде навески предельной карбоновой кислоты массой 6,0 г образовался углекислый газ объёмом 4,48 л. Установите формулу кислоты.
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле.
4) напишите уравнение реакции кислоты с гидрокарбонатом калия.
Показать ответ
2) С2Н4O;
3) СН3СООН;
4) СН3СООН + КНСО3 → СН3СООК + СO2 + Н2O.
Книжный магазин Книго Мания © 2021, Узбекистан, Ташкент

- Главная
- Книги
- Русский язык. 9-11 классы. Средства выразительности на ЕГЭ и ОГЭ

Описание книги
В пособии рассматриваются изобразительно-выразительные средства языка, знание которых необходимо для успешного выполнения заданий ВПР, ОГЭ и ЕГЭ по русскому языку.
Автор приводит теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для систематизации знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.
Рассматриваемый в по…
В пособии рассматриваются изобразительно-выразительные средства языка, знание которых необходимо для успешного выполнения заданий ВПР, ОГЭ и ЕГЭ по русскому языку.
Автор приводит теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для систематизации знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.
Рассматриваемый в пособии материал полезен для развития связной речи учащихся, формирования навыка написания сочинений разных видов.
Книга адресована учащимся 9-11 -х классов, готовящимся к итоговой аттестации, учителям общеобразовательных учреждений и методистам.
3-е издание, дополненное. Книга «Русский язык. 9-11 классы. Средства выразительности на ЕГЭ и ОГЭ» автора Андрей Нарушевич оценена посетителями КнигоГид, и её читательский рейтинг составил 0.00 из 10.
Для бесплатного просмотра предоставляются: аннотация, публикация, отзывы, а также файлы для скачивания.
- Просмотров: 47
- Рецензий: 0
Информация об издании
- Переводчики: не указаны
- Серия:
Готовимся к ЕГЭ и ОГЭ - ISBN (EAN): 978-5-9966-1166-9
- Языки: не указаны
- Возрастное ограничение: не указано
- Год написания: 2019
К этой книге не добавлены цитаты
Эта книга еще не добавлена в подборки
К ЭТОЙ КНИГЕ НЕ ДОБАВЛЕНЫ персонажи
К ЭТОЙ КНИГЕ НЕ ДОБАВЛЕНЫ ТЕСТЫ
КНИГА НЕ УПОМИНАЛАСЬ В БЛОГАХ
Поэзия. Учебник
Учебник предназначен для старших классов школы (гуманитарных классов или гимназий и лицеев), им можно пользоваться не только на уроках литературы, но и на уроках русского языка. Учебник также ориентирован на студентов первых курсов гуманитарных факультетов филологических и нефилологических специальностей и на зарубежных студентов, изучающих славистику. Кроме того, он может служить основой гуманита…
Литература на английском языке
8.0
Alice in Wonderland: Level 2
One hot summer day, Alice sees a white rabbit and runs after it. She follows it down a rabbit-hole — and arrives in Wonderland. Here, caterpillars can talk and rabbits have watches. And the Queen wants to cut off everybody’s head!
Fahrenheit 451: Intermediate / 451 градус по Фаренгейту. Средний уровень. Книга для чтения
В книге представлен роман-антиутопия Рэя Брэдбери 451 ГРАДУС ПО ФАРЕНГЕЙТУ — классика научной фантастики. Издание содержит сокращенный и адаптированный текст романа, снабжено словарем, постраничными комментариями, лексико-грамматическими упражнениями, творческими заданиями, заданиями на перевод, вопросами на восприятие и для обсуждения. Пособие адресовано учащимся 9-11 классов школ с углубленным и…
To The Top 3: Teacher’s Book
To the Top is a course designed for young teenagers, taking learners from Beginner to Intermediate level. The course follows the modular approach which enables students to deal with topics in depth. Its multi-dimensional syllabus combines lexis, grammar structures, language functions, skills wok and pronunciation.
Биология. 9 класс. Учебник
Учебник для 9 класса знакомит обучающихся с основами общей биологии. Учебный материал курса учитывает возрастные особенности восприятия и мышления девятиклассников. Основные понятия цитологии, генетики, селекции, экологии и других биологических наук излагаются логично, последовательно и доступно.
Учебник соответствует Федеральному государственному образовательному стандарту основного общего обр…
ЕГЭ. Физика. 1000 задач с ответами и решениями
Задания частей 1 и 2 по физике, аналогичные заданиям из банка заданий ЕГЭ.
Сборник содержит более 1000 заданий Единого государственного экзамена по физике.
В пособии приведены ответы ко всем заданиям, а также решения всех сложных задач, требующих развернутого ответа.
Пособие будет полезно учителям, учащимся старших классов, их родителям, а также методистам и членам приемных комиссий. П…
Математика. Быстрые и качественные вычисления. Тренировочные упражнения за курс 5-11 классов
В предлагаемом пособии представлено около 3000 тренировочных устных упражнений базового уровня по всем дидактическим линиям программы по математике за курс 5-11-х классов. Книга состоит из 17 глав. В каждую главу включён теоретический материал. Предлагаемые задания объединены в группы по шесть, для одного из них приводится решение. В конце книги даны ответы ко всем заданиям. Пособие адресовано уче…
Математика. Большой справочник для подготовки к ЕГЭ
Данная книга — теоретический справочник, дополненный разобранными решениями заданий. К теоретическим сведениям или формулам подобраны примеры, аналогичные встречающимся на ЕГЭ по математике, при решении которых применяются эти сведения или формулы. В книге представлены все темы, предусмотренные ФГОС и отражённые в принятых спецификациях ЕГЭ по математике за последние годы. Пособие является частью …
Химия. ЕГЭ и ОГЭ. 9-11 классы. Универсальный задачник
Для успешного овладения всем спектром предметных умений, успешного прохождения любой формы аттестации по химии (ЕГЭ, ОГЭ, ГВЭ или контрольная работа) необходимо, кроме уверенного знания теории, умение решать разнообразные задачи. Пособие предназначено для отработки и совершенствования навыков решения химических задач и призвано помочь систематизировать материал, ликвидировать возможные пробелы, об…
История естествознания в контексте культуры
В книге прослеживается история естествознания во взаимосвязях с важнейшими компонентами культуры: религией, философией, искусством. В качестве основного стержня изложения материала взяты этапы формирования научной картины мира и её эволюция от эпохи ранних цивилизаций до настоящего времени. Издание предназначено для поддержки дисциплин естественно-научного цикла, входящих в программу средней школы…
Обществознание. ОГЭ и ЕГЭ. Задания с графиками, диаграммами и таблицами. 9-11 классы
Пособие предназначено для школьников и абитуриентов, которые готовятся к прохождению итоговой аттестации в 9 и 11 классах (ОГЭ и ЕГЭ) по обществознанию. Оно будет интересно и полезно всем учащимся, которые хотят научиться работать с различными источниками и формами представления информации: таблицами, схемами, графиками, диаграммами. Пособие может использоваться учителями для организации самостоят…
История. 9-11 класс. Карманный справочник
Справочник содержит материал, необходимый для систематизации знаний по истории и подготовки к ОГЭ и ЕГЭ, а также к другим формам контроля в 9-11-х классах.
В пособии представлены перечень основных дат и событий отечественной и всеобщей истории, словарь исторических терминов и понятий, а также имена правителей и периоды их пребывания у власти.
Русский язык. 7-11 классы. Карманный справочник
Справочник по русскому языку предназначен учащимся средних и старших классов общеобразовательных учреждений, особенно тем, кто готовится к ОГЭ и ЕГЭ.
Систематизированный теоретический материал, охватывающий весь школьный курс русского языка, представлен в схемах, таблицах и алгоритмах, что способствует развитию аналитических способностей и активизации зрительной памяти.
Справочник снабжён нескольк…
Английский язык. 9-11 классы. Карманный справочник
Пособие содержит справочный материал по основным разделам грамматики и словообразованию, необходимый для оперативного обращения к актуальной информации, обзора и систематизации знаний в разделе «Use of English» — «Практическое использование английского языка». Формат справочника и компактное изложение материала делают его незаменимым источником учебной информации на уроках, дополнительных занятиях…
Информатика и ИКТ. 9-11 класс. Карманный справочник
Справочник содержит необходимый материал для самостоятельной подготовки к ЕГЭ и ОГЭ по информатике, а также к различным формам текущего и промежуточного контроля по информатике в 9-11-х классах.
Формат пособия позволяет использовать его на уроках, внеклассных занятиях и дома.


Доступность:
Есть на складе
Издательство:
Краткое описание товара
В пособии рассматриваются изобразительно-выразительные средства языка, знание которых необходимо для успешного выполнения заданий ВПР, ОГЭ и ЕГЭ по русскому языку.
Автор приводит теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для систематизации знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.
Рассматриваемый в пособии материал полезен для развития связной речи учащихся, формирования навыка написания сочинений разных видов.
Книга адресована учащимся 9–11-х классов, готовящимся к итоговой аттестации, учителям общеобразовательных учреждений и методистам.
- Описание
- Дополнительная информация
- Отзывы (0)
В пособии рассматриваются изобразительно-выразительные средства языка, знание которых необходимо для успешного выполнения заданий ВПР, ОГЭ и ЕГЭ по русскому языку.
Автор приводит теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для систематизации знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.
Рассматриваемый в пособии материал полезен для развития связной речи учащихся, формирования навыка написания сочинений разных видов.
Книга адресована учащимся 9–11-х классов, готовящимся к итоговой аттестации, учителям общеобразовательных учреждений и методистам.
Дополнительная информация
| ISBN |
978-5-9966-1112-6 |
|---|---|
| Штрих-код |
9785996611126 |
| Автор |
Нарушевич А. Г. |
| Год |
2019 |
Автор приводит систематизированные теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для углубления знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.
В пособии рассматриваются изобразительно-выразительные средства языка, знание которых необходимо для успешного выполнения заданий ОГЭ и ЕГЭ по русскому языку. Автор приводит систематизированные теоретические сведения о фонетических, лексических и синтаксических средствах выразительности, предлагает систему упражнений для углубления знаний и закрепления материала. Тестовые задания с ответами помогут учащимся проверить свои знания и будут способствовать формированию навыков самоконтроля.Рассматриваемый в пособии материал полезен для развития связной речи учащихся, формирования навыка написания сочинений разных видов.Книга адресована учащимся 9-11-х классов, готовящимся к итоговой аттестации, учителям общеобразовательных учреждений и методистам.Издание дополненное и переработанное.
В этой статье разберем расчетные задачи из реального ЕГЭ по химии 30 мая 2021 года.
Задачи 34 из реальных КИМ ЕГЭ 2021 по химии и их подробные решения (основная волна 31.05.2021 и резервные дни).
Задача на смесь оксидов фосфора (V) и натрия / калия встречалась, судя по всему, преимущественно в вариантах реального ЕГЭ в Москве. Мне также попалась эта задача. Скажу честно, приятно удивлен, даже пришлось подумать при решении.
1. Смесь, содержащую оксид фосфора(V) и оксид натрия, в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели, а затем растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода составляет 7,36%.
Вычислите массу фосфата натрия в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение.
P₂O₅ + 3Na₂O = 2Na₃PO₄
Масса и количество атомов водорода в конечном растворе:
m(H) =447,4*0,076 = 34 г, n(H)= 34 моль
«Источник» всех атомов водорода в конечном растворе – добавленная вода. Найдем количество вещества добавленной воды:
m(H) = 312,5*0,0736 = 23 г, n(H)= 23 моль
Отсюда:
n(H₂O) = ½*n(H)= 11,5 моль, m(H₂O) = 11,5*18 = 207 г
m(исх.смеси) = 312,5 – 207 = 105,5 г
Пусть n(P₂O₅) = x моль, тогда n(P) = 2x моль, m(P₂O₅) = 142x г
n(Na2O) = y моль, тогда n(Na) = 2y моль, m(Na₂O) = 62у г
2x/2y = 7/18, x/y = 7/18, x = 7/18*y
62у + 7/18*142у = 105,5
у = 0,9, х = 0,3 моль
P₂O₅ + 3Na₂O = 2Na₃PO₄
Было: 0,35 0,9
Изм.: -0,3 -0,9 +0,6
Ост.: 0,05 0 0,6
Остаток оксида фосфора: n(P₂O₅) = 0,05 моль, n(Na₃PO₄) = 0,6 моль
P₂O₅ + 3H₂O = 2H₃PO₄
n(H₃PO₄) = 2*0,05 = 0,1 моль
2Na₃PO₄ + H₃PO₄ = 3Na₂HPO₄
Было: 0,6 0,1
Изм.: -0,2 -0,1 +0,3
Ост.: 0,4 0 0,3
m(Na₃PO₄) = 0,4*164 = 65,6 г
Ответ: m(Na₃PO₄) = 0,4*164 = 65,6 г
2. Через 400 г 36%-ного раствора нитрата железа(II) пропускали электрический ток до тех пор, пока объём газа, выделившийся на катоде, не оказался в 2 раза меньше объёма газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля нитрата железа(II) составила 10,19%. К полученному раствору добавили 120 г 40%-ного раствора карбоната аммония. Вычислите массовую долю нитрата железа(II) в конечном растворе.
Решение.
2Fe(NO3)2 + 2H2O = 2Fe + O2 + 4HNO3 (1)
2H2O = 2H2 + O2 (2)
(NH4)2CO3 + 2HNO3 = 2NH4NO3 + H2O + CO2 (3)
m(Fe(NO3)2) =400*0,36 = 144 г,
n(Fe(NO3)2) = 144/180 = 0,8 моль
Пусть количество воды, которая вступила в электролиз, равно х моль. Тогда в реакции 2 выделилось:
n2(H2) = х моль, n2(О2) = х/2 моль
n2(H2O) = х моль, m2(H2O) = 18х г
Тогда в реакции 1 образовался кислород:
n1(О2) = 2х — х/2 = 3/2х моль, m1(О2) = 32*3/2х = 48х г
n1(Fe(NO3)2) = 3х моль, m1(Fe(NO3)2) = 180*3х = 540х г
n1(Fe) = 3х моль, m1(Fe) = 56*3х = 168x г
Масса нитрата железа (II) в растворе после электролиза:
m(Fe(NO3)2) = 144 — 540х г,
Получаем уравнение:
(144 — 540х)/( 400 — 18х — 48х — 168х) = 0,1019
х = 0,2 моль
n1(HNO3) = 6*0,2 = 1,2 моль, m1(HNO3) =75,6 г
m((NH4)2CO3) = 120*0,4 = 48 г, n((NH4)2CO3) = 48/96 = 0,5 моль
В реакции (3) образуется:
n(CO2) = 0,25 моль, m(CO2) = 0,25*44 = 11 г,
Масса конечного раствора:
mр-ра = 400 — 234*0,2 + 120 — 11 = 462,2 г
m(Fe(NO3)2) = 144 — 540*0,2 = 36 г
ω(Fe(NO3)2) = 36/462,2 = 0,0779 или 7,79%
Ответ: ω(Fe(NO3)2) = 7,79%
3. Смесь бромида кальция и хлорида меди(II) растворили в воде. Полученный раствор разлили по трем колбам. К 200 г раствора в первой колбе добавили 785 г 30%-ного раствора нитрата серебра. При этом массовая доля нитрата серебра в растворе уменьшилась вдвое. К 340 г раствора во второй колбе добавили избыток раствора иодида калия, в результате чего в осадок выпало 64,94 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
4. Смесь хлорида бария и хлорида алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 300 г раствора в первой колбе добавили 164 г 10%-ного раствора фосфата натрия. При этом все исходные вещества прореагировали полностью. К 120 г раствора во второй колбе добавили 155,61 г 20%-ного раствора сульфата натрия. При этом массовая доля сульфата натрия в полученном растворе оказалась вдвое меньше, чем в исходном. Вычислите массовую долю каждой из солей в третьей колбе. Процессами гидролиза пренебречь.
Решение.
Уравнения реакций:
3BaCl2 + 2Na3PO4 = 6NaCl + Ba3(PO4)2 (1)
AlCl3 + Na3PO4 = 3NaCl + AlPO4 (2)
BaCl2 + Na2PO4 = 2NaCl + BaSO4 (3)
Количество вещества реагентов и масса продуктов реакций:
m(Na3PO4) = 164 · 0,1 = 16,4 г
n(Na3PO4) = 16,4 / 164 = 0,1 моль
mисх.(Na3PO4) = 155,61 · 0,2 = 31,122 г
Пусть в растворе во второй колбе было
n(BaCl2) = x моль, тогда
mпрореаг.(NaSO4 ) = 142х г
m(обр. р-ра) = 120 + 155,61 — 233х = 275,61 — 233х г
(31,122 — 142х) / (275,61 — 233х) = 0,1
х = 0,03 моль
m(BaCl)2 = 0,03 · 208 = 6,24 г
ω(BaCl)2 = 6,24 / 120 = 0,052 или 5,2%
В растворе в первой колбе было:
n(BaCl2) = 0,3 · 300 / 120 = 0,075 моль
n1(Na3PO4) = 0,075 · 2 / 3 = 0,05 моль
n2(Na3PO4) = 0,1 — 0,05 = 0,05 моль
n(AlCl3) = n2(NaPO4) = 0,05 моль
m(AlCl3) = 0,05 ·133,5 = 6,675 г
ω(AlCl3) = 6,675 / 300 = 0,022 или 2,2%
Ответ: ω(BaCl2) = 5,2%; ω(AlCl3) = 2,2%
5. Через 522 г 5%-ного раствора нитрата бария пропускали электрический ток до тех пор, пока на аноде не выделилось 8,4 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 96,6 г глауберовой соли (Na2SO4 ∙ 10H2O) в необходимом количестве воды. При этом массовая доля сульфата натрия в растворе уменьшилась в 4,5 раза. Вычислите растворимость безводного сульфата натрия при комнатной температуре (в г на 100 г воды).
6. Кристаллогидрат сульфата алюминия, в котором массовая доля атомов серы меньше массовой доли атомов кислорода в 5 раз, растворили в воде. При этом образовался раствор массой 722,4 г. Через образовавшийся раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л (н.у.) газа. К образовавшемуся в процессе электролиза раствору добавили 424 г 10%-ного раствора карбоната натрия. При этом массовая доля карбоната натрия в растворе уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата сульфата алюминия.
Al2(SO4)3·xH2O
В одной частице кристаллогидрата содержатся атомы серы и кислорода:
N(S) = 3, N(O) = 12 + x
Масса атомов серы и кислорода:
m(S) = 32·3 = 96 г,
m(O) = 16·(12 + x) = (192 + 16x) г
m(O)/m(S) = 5
(192 + 16x)/96 = 5
х = 18
Al2(SO4)3·18H2O
При электролизе раствора сульфата алюминия протекает реакция:
2H2O = 2H2 + O2
На аноде образуется кислород:
n(O2) = V/Vm = 35,84/22,4 = 1,6 моль
n(H2O) = 2n(O2) = 1,6⋅2 = 3,2 моль
m(H2O) = n⋅M = 3,2⋅18 = 57,6 г
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl
m(Na2CO3) = mр-ра⋅ω(Na2CO3) = 424⋅0,1 = 42,4 г
n(Na2CO3) = m/M = 42,4/106 = 0,4 моль
Пусть n(Al2(SO4)3) = x моль, тогда:
m(Al2(SO4)3) = 342x
Масса исходного кристаллогидрата:
m(Al2(SO4)3·18H2O) = 666x г
В реакцию вступило:
nпрореаг.(Na2CO3) = 3х моль,
осталось:
nост.(Na2CO3) = 0,4 — 3х моль
mост.(Na2CO3) = 106⋅(0,4 — 3х) г
n(Al(OH)3) = 2х моль, m(Al(OH)3) = 78⋅2x = 156x г
n(CO2) = 3х моль, m(CO2) = 44⋅3x = 132x г
mр-ра = 722,4 — 57,6 + 424 — 156x — 132x = (1088,8 — 288х) г
Получаем уравнение:
106⋅(0,4 — 3х) / (1088,8 — 288х) = 0,01
х = 0,1 моль
n(Al2(SO4)3·18H2O) = 0,1 моль
m(Al2(SO4)3·18H2O) = 0,1⋅666 = 66 г
Ответ: m(Al2(SO4)3·18H2O) = 66 г
7. Через 522 г 10%-ного раствора нитрата бария пропускали электрический ток до тех пор, пока на катоде не выделилось 94,08 л (н.у.) газа. К образовавшемуся раствору добавили насыщенный раствор, приготовленный при комнатной температуре растворением 100 г медного купороса (CuSO4 ∙ 5H2O) в необходимом количестве воды. При этом массовая доля сульфата меди(II) в растворе уменьшилась в 4 раза. Вычислите растворимость безводного сульфата меди(II) при комнатной температуре (в г на 100 г воды).
8. Смесь, состоящую из нитрата цинка, нитрата меди(II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди(II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди(II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди(II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе.
9.Смесь хлорида бария и гидроксида бария растворили в воде. Полученный раствор разлили по трем колбам. К 520 г раствора в первой колбе добавили избыток раствора серной кислоты. При этом образовалось 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите массовую долю хлорида бария и гидроксида бария в растворе в третьей колбе.
Решение.
Уравнения реакций:
BaCl2 + H2SO4 = 2HCl + BaSO4 (1)
Ba(OH)2 + H2SO4 = 2H2O + BaSO4 (2)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O (3)
Количество вещества реагентов и масса продуктов реакций:
n(BaSO4) = 163,1 / 233 = 0,7 моль
mисх.(HCl) = 166,5 · 0,2 = 33,3 г
nисх.(HCl) = 0,91 моль
m р-ра 2 = 130 + 166,5 = 296,5 г
mост.(HCl) = 0,1 · 296,5 = 29,65 г
nост.(HCl) = 29,65 / 36,5 = 0,81 моль
nпрореаг.(HCl) = 0,91 — 0,81 = 0,1 моль
n(Ba(OH)2) = 0,05 моль
m(Ba(OH)2) = 0,05 · 171 = 8,55 г
ω(Ba(OH)2) = 8,55 / 130 = 0,066 или 6,6%
В растворе и в первой колбе было:
n(Ba(OH)2) = 0,05 · 520 / 130 = 0,2 моль
n(BaCl2) = n(BaSO4) — n(Ba(OH)2) = 0,7 — 0,2 = 0,5 моль
m(BaCl2) = 0,5 · 208 = 104 г
ω(BaCl2) = 104 / 520 = 0,2 или 20%
Ответ:ω(Ba(OH)2) = 6,6%; ω(BaCl2) = 20%
[/su_expand]
10. Смесь сульфата железа(II) и хлорида цинка растворили в воде. Полученный раствор разлили по трем колбам. К 800 г раствора в первой колбе добавили избыток раствора нитрата бария. При этом образовалось 116,5 г осадка. К 320 г раствора во второй колбе добавили 462 г 40%-ного раствора гидроксида натрия без доступа воздуха. При этом массовая доля щелочи в растворе уменьшилась в 2 раза. Вычислите массовую долю каждой из солей в растворе в третьей колбе.
11. Смесь бромида калия и иодида калия растворили в воде. Полученный раствор разлили по трем колбам. К 250 г раствора в первой колбе добавили 430 г 40%-ного раствора нитрата серебра. После завершения реакции массовая доля нитрата серебра в образовавшемся растворе составила 8,44%. К 300 г раствора во второй колбе добавили избыток раствора нитрата меди(II), в результате чего в осадок выпало 28,65 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
12. Смесь, содержащую оксид фосфора(V) и оксид калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, затем растворили в горячей воде. В результате получили 447,4 г раствора, в котором массовая доля атомов водорода составляет 7,6%. Вычислите массу фосфата калия в полученном растворе.
Решение:
Записаны уравнения реакций:
3K2O + P2O5 = 2K3PO4 (1)
3H2O + P2O5 = 2H3PO4 (2)
2K3PO4 + H3PO4 = 2K2HPO4 (3)
Количество вещества реагентов и масса продуктов реакций:
m(H) = 447,4 · 0,076 = 34 г
n(H) = 34 моль
n(H2O) = 0,5n(H) = 17 моль
m(H2O) = 17 · 18 = 306 г
m(сплава) = 447,4 — 306 = 141,4 г
Пусть взяли х моль К2О и у моль P2O5, тогда
m(смеси) = 94х + 142у = 141,4 г
(х+ 5у) : 2у = 14,5 : 4
х = 0,9 моль; у = 0,4 моль
P2O5 — избыток
nпрореаг., 1(P2O5) = 0,3
nизб.(P2O5) = 0,1 моль
n(H3PO4) = 0,2 моль
n1(K3PO4) = 0,6 моль
nпрореаг.(K3PO4) = 0,4 моль
nост.(K3PO4) = 0,2 моль
mост.(K3PO4) = 0,2 · 212 = 42,4 г
Ответ: mост.(K3PO4) = 42,4 г
13. Смесь хлорида магния и нитрата алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 750 г раствора в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 114,8 г осадка. К 300 г раствора во второй колбе добавили 868,54 г 20%-ного раствора гидроксида натрия. При этом массовая доля щелочи в растворе уменьшилась в 1,6 раза. Вычислите массовую долю каждой из солей в третьей колбе.
Решение:
Уравнения реакций:
MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2 (1)
Al(NO3)3 + 4NaOH = 3NaNO3 + Na[Al(OH)4] (2)
MgCl2 + 2NaOH = 2NaCl + Mg(OH)2 (3)
Количество вещества реагентов и масса продуктов реакций:
n(AgCl) = 114,8 / 143,5 = 0,8 моль
n1(MgCl2 ) = 0,5n(AgCl) = 0,4 моль
m(MgCl2) = 0,4 · 95 = 38 г
ω(MgCl2) = 38 / 750 = 0,05 или 5%
n3(MgCl2) = 0,4 · 300 / 750 = 0,16 моль
n(Mg(OH)2) = 0,16 моль
m(Mg(OH)2) = 58 · 0,16 = 9,28 г
mисх.(NaOH) = 868,54 · 0,2 = 173,708 г
ωконеч.(NaOH) = 0,2 / 1,6 = 0,125
Пусть в растворе во второй колбе было
n(Al(NO3)3) = x моль, тогда
mпрореаг.(NaOH ) = 40 · (4х + 0,32) = 160х + 12,8 г
mобр. остатка = 300 + 868,54 — 9,28 = 1159,26 г
(173,708 — 160х — 12,8) / 1159,26 = 0,125
х = 0,1 моль
m(Al(NO3)3) = 0,1 · 213 = 21,3 г
ω(Al(NO3)3) = 21,3 / 300 = 0,071 или 7,1%
ω(MgCl2) = 5%; ω(Al(NO3)3) = 7,1%
Ответ: ω(MgCl2) = 5%; ω(Al(NO3)3) = 7,1%
14. Через 520 г 16,1%-ного раствора сульфата цинка пропускали электрический ток до тех пор, пока объём газа, выделившегося на катоде, не оказался равным объёму газа, выделившегося на аноде. При этом получили раствор, в котором массовая доля сульфата цинка составила 10,3%. К полученному раствору добавили 212 г 10%-ного раствора карбоната натрия. Вычислите массовую долю сульфата цинка в конечном растворе.
Решение.
2ZnSO4 + 2H2O = 2Zn + O2 + 2H2SO4 (1)
2H2O = 2H2 + O2 (2)
Na2CO3 + H2SO4= Na2SO4 + H2O + CO2 (3)
m(ZnSO4) = 520*0,161 = 83,72 г,
n(ZnSO4) = 83,72/161 = 0,52 моль
Пусть количество воды, которая вступила в электролиз, равно х моль. Тогда в реакции 2 выделилось:
n2(H2) = х моль, n2(О2) = х/2 моль
n2(H2O) = х моль, m2(H2O) = 18х г
Тогда в реакции 1 образовался кислород:
n1(О2) = х/2 моль, m1(О2) = 32*х/2 = 16х г
n1(ZnSO4) = х моль, m1(ZnSO4) = 161х г
n1(Zn) = х моль, m1(Zn) = 65х г
Масса нитрата железа (II) в растворе после электролиза:
m(ZnSO4) = 83,72 — 161х г,
Получаем уравнение:
(83,72 — 161х)/(520 — 16х — 65х — 18x) = 0,103
х = 0,2 моль
n1(H2SO4) = 0,2 моль, m1(H2SO4) = 19,6 г
m(Na2CO3) = 212*0,1 = 21,2 г, n(Na2CO3) = 21,2/106 = 0,2 моль
В реакции (3) образуется:
n(CO2) = 0,2 моль, m(CO2) = 0,2*44 = 8,8 г,
Масса конечного раствора:
mр-ра = 520 — 19,8 + 212 — 8,8 = 703,4 г
m(ZnSO4) = 83,72 — 161*0,2 = 51,52 г
ω(ZnSO4) = 51,52/703,4 = 0,0732 или 7,32%
Ответ: 7,32%
15. Раствор нитрата меди(II) массой 2 кг 730 г с массовой долей нитрата меди(II) 18,8%, содержащий в качестве примеси нитрат серебра, разлили на две колбы в соотношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, внесли медную проволоку. После окончания реакции массовая доля нитрата меди(II) в колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди(II) пренебречь.) В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
Тема .
Неорганическая химия
.
03
31. Цепочки реакций по неорганической химии
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
неорганическая химия
.0129. Составление окислительно-восстановительной реакции. Электронный баланс
.0230. Составление реакции ионного обмена. Полное и сокращённое ионное уравнение
.0331. Цепочки реакций по неорганической химии
.045. Классификация и номенклатура неорганических веществ
.056. Свойства классов неорганических соединений. Реакции в растворах. Реакции ионного обмена
.067. Свойства классов неорганических соединений. Установление возможности реакции между классами соединений
.078. Свойства классов неорганических соединений. Химия элементов
.089. Взаимосвязь классов неорганических соединений
.09Реакции
Решаем задачи
Медь растворили в концентрированной серной кислоте. Полученную соль внесли в раствор иодида калия. Образовавшееся простое вещество прореагировало с концентрированной азотной кислотой с выделением бурого газа. Полученную кислоту осторожно нагрели. Составьте уравнения четырех описанных реакций.
Показать ответ и решение
1. Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2. 2CuSO4 + 4KI = 2K2SO4 +2CuI + I2
3. I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4. 2HIO3 = H2O + I2O5
Водный раствор хлорида магния подвергли электролизу. В атмосфере газа, выделившегося на аноде, сожгли фосфор, взятый в избытке. Получившийся продукт добавили в горячий раствор гидроксида натрия. Полученный раствор перенесли в избыток концентрированной азотной кислоты. Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям:
1) MgCl2 + 2H2O = H2 + Mg(OH)2 + Cl2
2) 2P + 3Cl2 = 2PCl3
3) PCl3 + 5NaOH = Na2HPO3 + 3NaCl + 2H2O
4) Na2HPO3 + 4HNO3 = H3PO4 + 2NO2 + 2NaNO3 + H2O
К раствору нитрата кальция добавили раствор фосфата натрия. Выпавший осадок отделили, высушили и затем прокалили в присутствии углерода и оксида кремния. Полученное при этом простое вещество растворили в концентрированном растворе азотной кислоты, при этом выделился бурый газ. Полученный газ поглотили холодным раствором гидроксида бария. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2Na3PO4 + 3Ca(NO3)2 = Ca3(PO4)2 + 6NaNO3
2) Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
3) P + 5HNO3 = H3PO4 + 5NO2 + H2O
4) 4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
Через раствор сульфата железа (II) пропустили аммиак. Образовавшийся при этом осадок отделили и обработали необходимым количеством концентрированной азотной кислоты, при этом наблюдали растворение осадка и выделение бурого газа. К полученному раствору раствору добавили раствор карбоната калия, а бурый газ пропустили через раствор гидроксида кальция. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + (NH4)2SO4
2) Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
3) 3K2CO3 + 2Fe(NO3)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
4) 4NO2 + 2Ca(OH)2 = Ca(NO3)2 + Ca(NO2)2 + 2H2O
Фосфор смешали с кальцием и нагрели. Полученное при этом вещество поместили в воду. Выделившийся газ пропустили через раствор, содержащий перманганат натрия и гидроксид натрия, в результате раствор приобрел зеленую окраску. Одну из полученных солей выделили и добавили к раствору сульфита натрия. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2P + 3Ca = Ca3P2
2) Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
3) PH3 + 8NaMnO4 + 11NaOH = 8Na2MnO4 + Na3PO4 + 7H2O
4) Na2MnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + 2NaOH
Силицид кальция (Ca2Si) поместили в воду. Образовавшийся при этом газ прореагировал с кислородом. Полученное твердое вещество сплавили с фосфатом кальция и углеродом. Образовавшееся при этом простое вещество обработали концентрированной азотной кислотой. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
2) SiH4 + 2O2 = SiO2 + 2H2O
3) Ca3(PO4)2 + 5C + 3SiO2 = 2P + 3CaSiO3 + 5CO
4) P + 5HNO3 = H3PO4 + 5NO2 + H2O
В токе водорода нагрели натрий. К образовавшемуся веществу добавили воду, в результате чего образовался прозрачный раствор и выделился газ. Полученный раствор нагрели и пропустили через него газ, предварительно полученный в результате электролиза раствора поваренной соли. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Na + H2 = 2NaH
2) NaH + H2O = NaOH + H2
3) 6NaOH + Cl2 = NaClO3 + 5NaCl + 3H2O
4) 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Гидрокарбонат натрия прокалили. Полученное после прокаливания твёрдое вещество растворили в воде и смешали с раствором бромида железа (III), в результате чего выпал бурый осадок и образовался газ. Осадок отделили и прокалили. Твёрдый остаток растворили в иодоводородной кислоте. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2NaHCO3 = Na2CO3 + CO2 + H2O
2) 3Na2CO3 + 2FeBr3 + 3H2O = 2Fe(OH)3 + 6NaBr + 3CO2
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид цинка сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид натрия, в результате чего образовался белый осадок. Осадок отделили, высушили, а затем сожгли в избытке кислорода. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) ZnO + 2KOH = K2ZnO2 + H2O
2) K2ZnO2 + 2H2SO4 = ZnSO4 + K2SO4 + 2H2O
3) ZnSO4 + Na2S = ZnS + Na2SO4
4) 2ZnS + 3O2 = 2ZnO + 2SO2
Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся жёлтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зелёным. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Cr + 3Cl2 = 2CrCl3
2) 2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
4) Na2Cr2O7 + 3Cu2O + 10H2SO4 = Cr2(SO4)3 + 6CuSO4 + Na2SO4 + 10H2O
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
2) Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + Fe = 3FeO
К раствору сульфата железа(II) добавили раствор гидроксида натрия. Образовавшийся при этом осадок отделили и обработали пероксидом водорода, при этом наблюдали изменение цвета осадка. Полученное бурое вещество обработали иодоводородной кислотой. Образовавшееся при этом простое вещество поместили в раствор гидроксида калия и нагрели.
Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
1) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
2) 2Fe(OH)2 + H2O2 = 2Fe(OH)3
3) 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
4) 3I2 + 6KOH = KIO3 + 5KI + 3H2O
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением света и тепла. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl
2) Fe(NO3)3 + 3KOH = 3KNO3 + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2Al = Al2O3 + 2Fe
Кристаллы хлорида калия обработали концентрированной серной кислотой. К получившейся соли добавили гидроксид калия. К полученному придукту прилили раствор хлорида бария. Выпавший осадок отфильтровали, после чего прокалили с избытком угля. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) KCl(тв) + H2SO4(конц) = KHSO4 + HCl
2) KHSO4 + KOH = K2SO4 + H2O
3) K2SO4 + BaCl2 = 2KCl + BaSO4
4) BaSO4 + 2C = BaS + 2CO2
Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в йодоводородной кислоте. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Fe + 3Cl2 = 2FeCl3
2) FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения четырех описанных реакций
Показать ответ и решение
1) Al2O3 + 2NaOH = 2NaAlO2 + H2O
2) NaAlO2 + NH4Cl + H2O = NaCl + Al(OH)3 + NH3
3) 2NH3 + H2SO4 = (NH4)2SO4
4) (NH4)2SO4 = NH3 + NH4HSO4
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ba(OH)2 ← Ba → BaO → Ba(OH)2→(+СО2)X → Ba(OH)2
Показать ответ и решение
1) Ba + 2H2O = Ba(OH)2 + H2
2) 2Ba + O2 = 2BaO
3) BaO + H2O = Ba(OH)2
4) Ba(OH)2 + 2CO2 = Ba(HCO3)2
5) Ba(HCO3)2 + 2NaOH = Ba(OH)2 + 2NaHCO3
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
K2O → КОH → KHSO4→ K2SO4 → КОH → K[Al(OH)4];
Показать ответ и решение
1) K2O + H2O = 2KOH
2) KOH + H2SO4 = KHSO4 + H2O
3) KHSO4 + KOH = K2SO4 + H2O
4) K2SO4 + Ba(OH)2 = 2KOH + BaSO4
5) KOH + Al(OH)3 = К[Al(OH)4]
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
CuCl2 → Cu(OH)2 → CuO → Cu → CuO → CuSO4
Показать ответ и решение
1) СuCl2 + 2KOH = Cu(OH)2 + 2KCl
2) Cu(OH)2 =(t) CuO + H2O
3) 2NH3 + 3CuO = 3Cu + N2 + 3H2O
4) 2Cu + O2 = 2CuO
5) CuO + H2SO4 = CuSO4 + H2O
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ca(OH)2 → CaO → Ca(OH)2 →(+K2CO3) X → Fe(OH)3 → Fe2O3
Показать ответ и решение
1) Сa(OH)2 =(t) CaO + H2O
2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + K2CO3 = CaCO3 + 2KOH
4) 3KOH + FeCl3 = Fe(OH)3 + 3KCl
5) 2Fe(OH)3 =(t) Fe2O3 + 3H2O
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также: