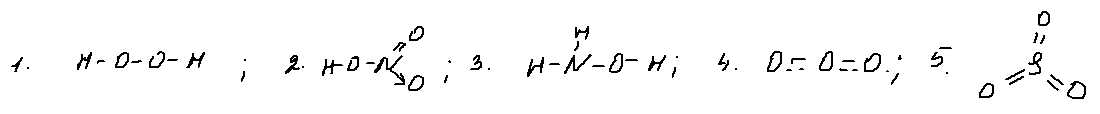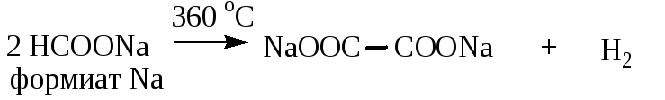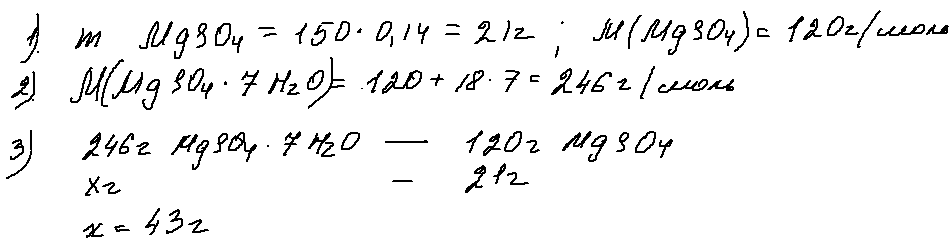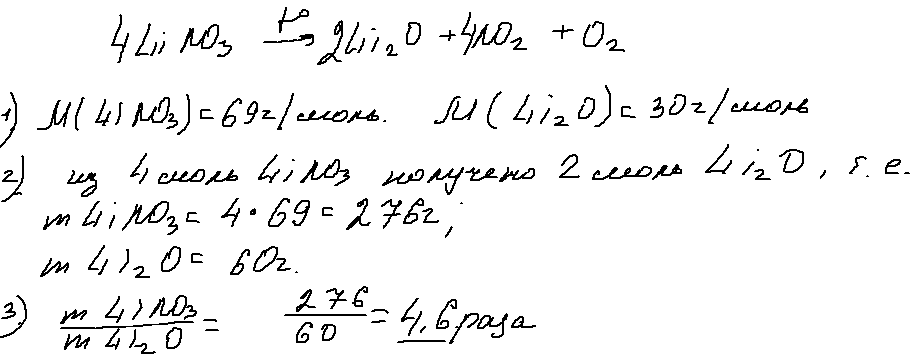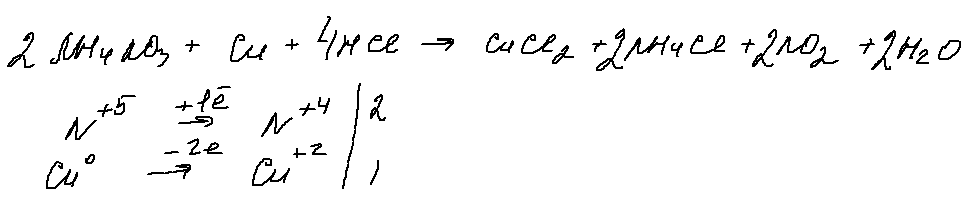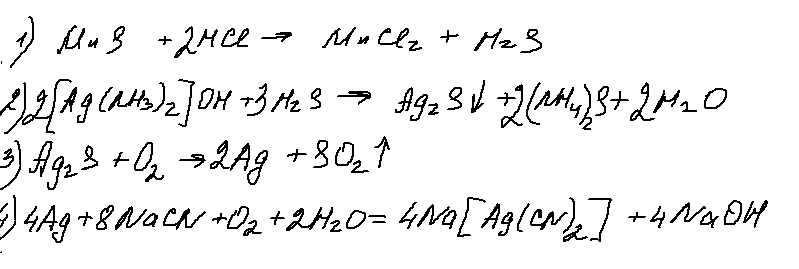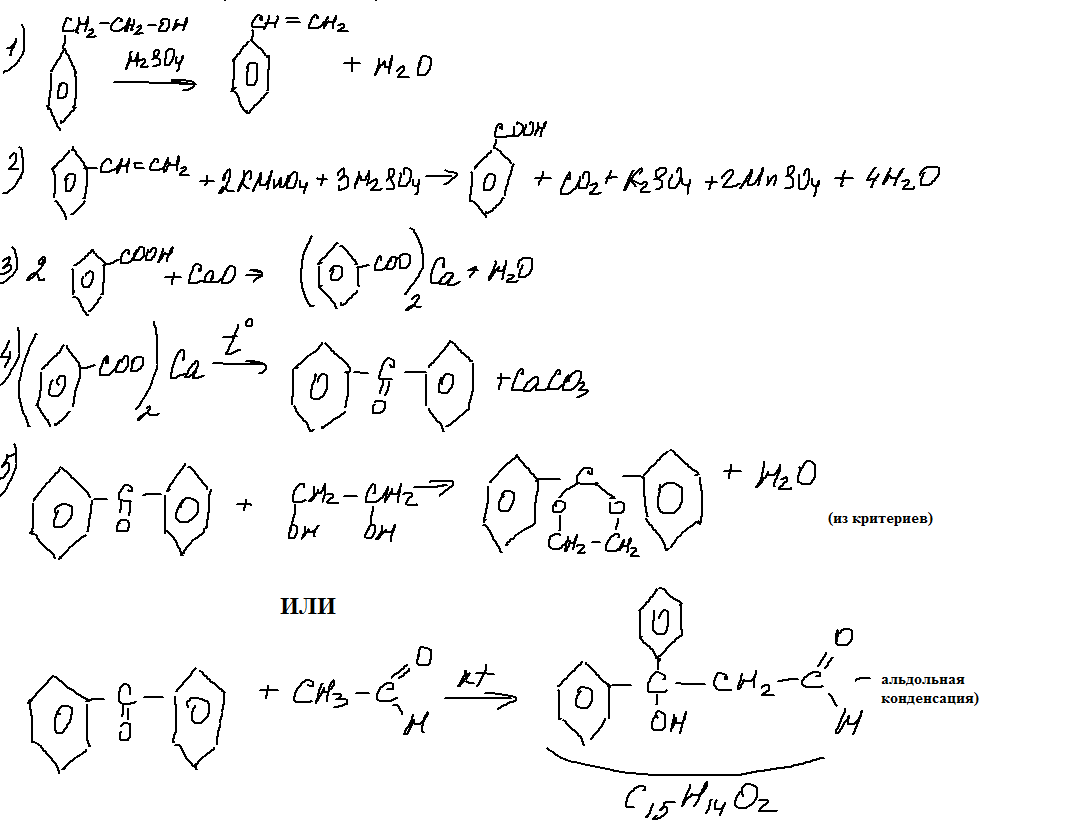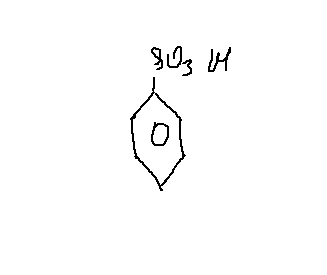Задания
Версия для печати и копирования в MS Word
Тип 9 № 13016
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| X | Y |
Спрятать решение
Решение.
1. (3)
2. (1)
Ответ: 31.
Раздел кодификатора ФИПИ: 2.8 Взаимосвязь различных классов неорганических веществ
Спрятать решение
·
·
Сообщить об ошибке · Помощь
Каталог заданий
Версия для печати и копирования в MS Word
1
Тип 9 № 13016
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| X | Y |
Раздел кодификатора ФИПИ: 2.8 Взаимосвязь различных классов неорганических веществ
Решение
·
·
Сообщить об ошибке · Помощь
Елена Шаврак. ЕГЭ по химии: новые упражнения и цепочки превращений. вопрос — хим. связь.. вопрос.
Елена Шаврак
ЕГЭ по химии: новые упражнения и цепочки превращений
Здравствуйте, уважаемые читатели!
Сегодня я хочу рассмотреть некоторые задания из нового СтатГрадовского пробника от 3 марта 2021 года. Причина — подобные упражнения ранее мне не встречались ни в одном из пробников и пособий за последние 8 лет. Про себя я данный факт обозначила как : «СтатГрад расширяет границы», причем это расширение носит как экстенсивный, так и интенсивный характер.
Итак, по порядку. Начинаю с заданий 1 варианта.
1. 4 вопрос — хим. связь.
Для выполнения этого задания запишем структурные формулы всех веществ (не учитываю валентные углы):
Только одинарные ковалентные связи есть в молекуле пероксида водорода (1) и гидроксиламина (3).
Новизна этого задания, скорее, экстенсивного характера. Т.е., несмотря на то, что ранее подобная формулировка 4 задания не встречалась в пробниках (мое субъективное мнение), для его выполнения вполне достаточно школьной базы.
2. 7 вопрос.
Для выполнения этого задания необходимо знать, что соединения меди могут выпадать в осадок при добавлении растворов трех реагентов из предложенного списка, а именно: аммиака, сероводорода и карбоната калия. Но в избытке аммиака осадок растворится вследствие образования аммиакатного комплекса меди. Одновременное образование осадка и газа — это маркерный признак совместного (или смешанного) гидролиза, протекающего при смешении растворов соли меди и карбоната. Т.о., ответы — Х- H2S, Y- K2CO3.
Новизна этого задания также условная. Аммиакатные комплексы меди (и цинка) в 7 задании встречались и ранее, но ОЧЕНЬ редко.
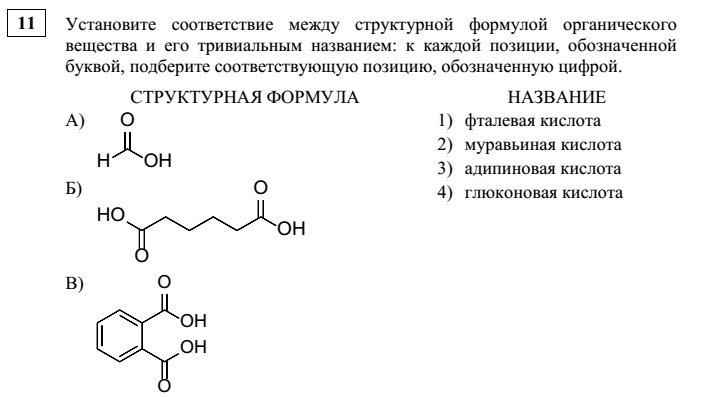
3. 11 вопрос
Практически во всех последних СтатГрадовских пробниках в 11 задании используются «скелетные» формулы органических веществ. Выскажу свою точку зрения: это хорошо, поскольку, опять же, — расширяет границы восприятия материала. Надеюсь, что, со временем, в формулировках будут использоваться классические скелетные формулы, в которых клинообразными линиями обозначаются связи, направленные вверх относительно плоскости, т.е. к наблюдателю, пунктирными линиями обозначаются связи, направленные вниз относительно плоскости, т.е. от наблюдателя.
Ответы — 231
Новизна этого задания невелика. Пожалуй, при подготовке стоит обратить внимание на отработку тривиальных названий органических соединений.
4. 17 вопрос
В 17 задании, посвященном кислородсодержащей органике, приведена практически не упоминавшаяся в пробниках и сборниках тестов реакция термического превращения формиата натрия до оксалата натрия:
Мой личный вывод: спасибо СтатГраду за актуализацию ранее невостребованной информации, относящейся, в принципе, к школьной программе (способы получения дикарбоновых кислот).
5. 27 задача.
Задача 27, в который уже раз в этом году, обращает внимание к кристаллогидратам. Решать ее можно разными способами — через моли, через пропорцию, правилом креста …
Ниже я привела один из вариантов решения., суть которого заключается в нахождении массы всей растворенной соли и последующем «заключении» ее в кристаллогидрат:
Ответ — 43 г.
6. 29 задача.
Задача 29 обращает на себя внимание формулировкой (полное отсутствие числовых данных) и «незамыленной» химией — разложением нитрата активного металла. Опять же и эту задачу можно решать несколькими способами. Ниже привожу один из них:
7. 30 задание.
«Грозное» 30 задание, в котором, при ближайшем рассмотрении, можно выделить только 1 окислитель (нитрат аммония), 1 восстановитель — медь. Для перевода нитрата в азотную кислоту, с которой будет реагировать медь, добавим соляную кислоту. Берем ее концентрированной, чтобы в результате реакции обмена получить концентрированную азотную кислоту (кстати, можно проводить реакцию с выделением оксида азота (2), для этого нужно взять разбавленную соляную кислоту). В результате получаем:
Данная реакция напоминает мне качественную реакцию на нитраты, в которой к нитрату добавляют медь и концентрированную серную кислоту и наблюдают образование бурого газа.
8. 32 задание.
Хорошее задание, ничего не скажешь! Реакция 2 — разрушение комплекса, достаточно типовая. Реакция 3 — окисление сульфида серебра (а еще и ртути) идет с образованием только одного оксида. Реакция достаточно редкая, но встречалась. А вот 4 реакция — меня лично ввела в ступор. Возможно ошибаюсь, но неоднократно от представителей ФИПИ на вебинарах звучало, что на ЕГЭ будут только гидроксокомплексы цинка и алюминия. Понемногу «пробрались» аммиакаты. Но цианидных комплексов до сих пор еще не было. Искренний респект составителям!
9. 33 цепочка.
Вот это задание заслуживает самого пристального внимания. С одной стороны — бруттоформулы в задании- это очень хорошо, поскольку способствует более глубокому проникновению в суть задания. С другой стороны- последняя реакция, представляющая собой введение ацетальной защиты (по мнению авторов пробника). Я бы написала здесь и альдольную конденсацию дифенилкетона с ацетальдегидом. Но этого не дают в школьной программе (или я ошибаюсь?).
Необходимо отметить, что еще одну цепочку с ацетальной защитой я нашла в сборнике
10. 34 задача.
Данную задачу в этой статье отрешивать не буду. Сделаю это позже. Но бросается в глаза новое усложнение — нахождение состава газовой смеси по плотности. Практически не встречалось такого в задачах , предназначенных для подготовки к ЕГЭ.
11. 35 задача.
Одно из заданий, которое мне очень понравилось в этом пробнике.
Решение
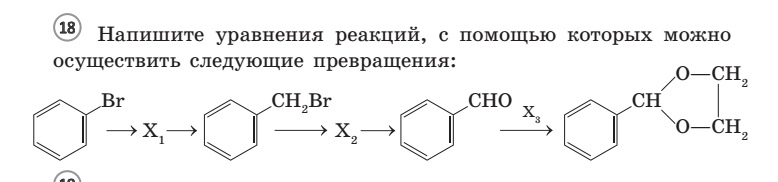
1. Схема реакции сгорания неизвестного соединения:
CxHySzOk+O2=CO2+H2O+SO2
2. Найдем молекулярную формулу неизвестного соединения:
а) n(C)=n(CO2)= 20,16/22,4=0,9 моль,
n(Н)=2n(Н2О)= 2*8,1 /18=0,9 моль,
n(S)=n(SO2)= 3,36/22,4=0,15 моль,
n(O)=(23,7-(12*0,9+0,9+32*0,15))/16=0,45 моль
б) Молекулярная формула неизвестного вещества-: С6Н6SO3. Это — бензолсульфокислота
3. Структурная формула —
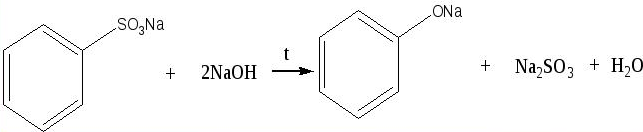
4. Уравнение реакции, происходящей при сплавлении бензолсульфоната натрия со щелочью:
Рассмотрела только первый вариант пробника, но и в нем много информации к размышлению. Резюмирую:
1. Реальный ЕГЭ по сложности раньше не всегда корреллировал со статградовскими пробниками, поэтому не факт, что задания уровня сложности рассмотренных 32-34 стоит ожидать на реальном экзамене.
2. Задания данного пробника актуализируют изучаемую, но относительно редко используемую информацию об органических и неорганических веществах (особенно — задания 4, 7, 11, 17, 27, 29, 35).
3. Для выполнения заданий 32 и 33 необходимо обладать информацией, адекватное усвоение которой возможно только в ходе изучения вузовских курса неорганической и органической химий (подчеркиваю, что это — мое субъективное мнение).
4. Великолепна задача 35. Впервые в пробниках ЕГЭ: серосодержащая органика и практически не используемый ранее при составлении заданий способ получения фенола.
5. В целом — еще раз — респект составителям, но — детей жалко. Без хорошего репетитора до уровня такого пробника не подняться.
Всего доброго!
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
Задания 30 (2021). Окислительно-восстановительные реакции.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Знайченко Е.И.
Задание №1
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция,в ходе которой образуется бесцветный раствор и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1⋅| P-3 – 8e ⟶ P+5
8⋅| N+5 +1e ⟶ N+4
P-3 (PH3) – восстановитель;
N+5 (NO2) – окислитель.
Задание №2
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрокарбонат калия, нитрат алюминия, азотная кислота, оксид фосфора(V), сульфид меди(II), гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется окрашенный раствор, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
1⋅| S-2 – 8e ⟶ S+6
8⋅| N+5 + 1e ⟶ N+4
S-2 (CuS) – восстановитель;
N+5 (HNO3) – окислитель
(допускается альтернативный вариант записи:
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O)
Задание №3
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется в растворе две соли и кислота, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 +2H2SO4
5⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 +5e ⟶ Mn+2
S+4 (SO2) – восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №4
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется зеленый раствор, не образуется осадок, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2NaMnO4 + NaNO2 +2NaOH = 2Na2MnO4 +NaNO3 +H2O
1⋅| N+3 -2e ⟶ N+5
2⋅| Mn+7 + 1e ⟶ Mn+6
N+3 (NaNO2) – восстановитель;
Mn+7 (NaMnO4) – окислитель
Задание №5
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
аммиак, перманганат калия, гидросульфат лития, нитрат стронция, йод, сульфит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Вариант ответа:
2KMnO4 + 3Na2SO3 +H2O = 2KOH + 2MnO2 + 3Na2SO4
3⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 +3e ⟶ Mn+4
S+4 (Na2SO3) – восстановитель;
Mn+7 (KMnO4) – окислитель
[adsp-pro-3]
Задание №6
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Первый вариант ответа:
2KMnO4 + 3CaSO3 + H2O = 2KOH + 2MnO2 + 3CaSO4
3⋅| S+4 -2e ⟶ S+6
2⋅| Mn+7 + 3e ⟶ Mn+4
S+4 (CaSO3) – восстановитель;
Mn+7 (KMnO4) – окислитель
Второй вариант ответа:
2H2O + 2KMnO4 + 3Mn(NO3)2 = 5MnO2 + 2KNO3 + 4HNO3
3⋅| Mn+2 -2e ⟶ Mn+4
2⋅| Mn+7 + 3e ⟶ Mn+4
Mn+2 (Mn(NO3)2) – восстановитель;
Mn+7 (KMnO4) — окислитель
Задание №7
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота (разб.), нитрат калия, медь. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой выделяется газ, не образуется осадок, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
Cu + 2KNO3 + 2H2SO4 = CuSO4 + K2SO4 +2NO2 + 2H2O
1⋅| Cu0 -2e ⟶ Cu+2
2⋅| N+5 +1e ⟶ N+4
Cu0 – восстановитель;
N+5 (KNO3) – окислитель
Задание №8
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой в растворе образуются три соли, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
3⋅|2Fe+2 – 2e- → 2Fe+3
1⋅|2Cr+6 + 6e— → 2Cr+3
Fe+2(FeSO4) – восстановитель, Cr+6(K2Cr2O7) — окислитель
Задание №9
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется простое вещество, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
2KMnO4 +16HBr = 2KBr + 2MnBr2 + 5Br2 +8H2O
5⋅| 2Br-1 -2e ⟶ Br20
2⋅| Mn+7 +5e ⟶ Mn+2
Br-1 (HBr) –восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №10
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которых образуется два кислотных оксида, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
2⋅| С0 -4e ⟶ С4
1⋅| S+6 +2e ⟶ S+4
C0 – восстановитель;
S+6 (H2SO4) – окислитель
[adsp-pro-3]
Задание №11
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия . Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется осадок, выделяется газ, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
2KMnO4 + 2NH3 = 2KOH + N2 + 2MnO2 +2H2O
2⋅| 2N-3 -6e ⟶ N20
1⋅| Mn+7 +3e ⟶ Mn+4
N-3 (NH3) – восстановитель;
Mn+7 (KMnO4) – окислитель
Задание №12
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, йод, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется кислота, одна молекула восстановителя отдает десять электронов, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
10HNO3 + I2 = 2HIO3 + 10NO2 + 4H2O
1⋅| I20 -10e ⟶2I+5
10⋅| N+5 + 1e ⟶ N+4
I20 – восстановитель;
N+5 (HNO3) – окислитель
Задание №13
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид серы(VI), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, в ходе которой образуется щелочь, выделяется газ, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
3Na2O2 +2NH3 = 6NaOH + N2
1⋅| 2N-3 -6e ⟶ N20
3⋅| 2O-1 +2e ⟶ 2O-2
N-3 (NH3) – восстановитель;
O-1 (Na2O2) – окислитель
Задание №14
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
4H2SO4 + PH3 = H3PO4 + 4SO2 +4H2O
4⋅| P-3 -8e ⟶ P+5
1⋅| S+6 +2e ⟶ S+4
P-3 (PH3) – восстановитель;
S+6 (H2SO4) – окислитель
Задание №15
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия. Допустимо использование водных растворов солей.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1⋅| S+4 -2e ⟶ S+6
1⋅| Br20 +2e ⟶ 2Br -1
S+4 (SO2) – восстановитель;
Br20 – окислитель
[adsp-pro-3]
[adsp-pro-10]
Чтобы поделиться, нажимайте
Представляем вашему вниманию задание 30 из реального ЕГЭ 2020 и резервных дней основного периода (16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 29
Реальный ЕГЭ 2020. Задание 30. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бесцветного раствора, в котором находятся только кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
S+4 – 2e = S+6 1 восстановитель
Cl20 + 2e = 2Cl-1 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с выделением газа и образованием раствора, в котором находится только кислота. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
РН3 + 8HNO3 =H3PO4 + 8NO2↑ + 4H2O
P-3 – 8e = P+5 1 восстановитель
N+5 + 1e = N+4 8 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2Cu+1 – 2e = 2Cu+2 1 восстановитель
N+5 + 1e = N+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и двух солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
2I-1 – 2e = I20 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с выделением газа и образованием двух солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8H2O
2O-1 – 2e = O20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает c образованием соли и кислоты, но без выпадения осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
(NH4)2SO3 + Cl2 + H2O= (NH4)2SO4 + 2HCl
S+4 – 2e = S+6 1 восстановитель
2Cl-1 + 2e = Cl20 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми нет выделения газа и образуется одна соль и вода. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2Fe(OH)2 + H2O2 + 3H2SO4 = Fe2(SO4)3 + 6H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
2O-1 + 2e = 2O-2 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бурый газ и образуется соль. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2↑ + 3H2O
Fe+2 – 1e = Fe+3 1 восстановитель
N+5 + 1e = N+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ с резким запахом. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Cu2O + 3H2SO4 = 2CuSO4 + SO2↑ + 3H2O
2Cu+1 – 2e = 2Cu+2 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ с резким запахом. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2FeO + 4H2SO4 = Fe2(SO4)3 + SO2↑ + 4H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми сопровождается получением простого газообразного вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 2NH3 = 2MnO2 ↓+ 2KOH + N2↑ + 2H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
или
6KMnO4 + 2NH3 +3Ba(OH)2 = 3K2MnO4 + 3BaMnO4↓ + N2↑ + 6H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 1e = Mn+6 6 окислитель
В условии задания ничего не говорится про осадок, но это НЕ противоречит условию задания, в котором сказано, что должно образоваться простое газообразное вещество, и оно образуется в этих реакциях.
Реальный ЕГЭ 2020. Задание 30. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуются три соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
2Fe+2 – 2e = 2Fe+3 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми наблюдается образование простого вещества, которое сопровождается выделением газа. В этой реакции атом-окислитель переходит в наименьшую степень окисления. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
8HI + H2SO4 = 4I2 + H2S↑ + 4H2O
2I-1 – 2e = I20 4 восстановитель
S+6 + 8e = S-2 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит образование простого вещества, которое сопровождается выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaBr + 3H2SO4 = Br2 + SO2↑ +2NaHSO4 + 2H2O
2Br-1 – 2e = Br20 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Возможен вариант 2NaBr + 2H2SO4 = Br2 + SO2↑ +Na2SO4 + 2H2O
Реальный ЕГЭ 2020. Задание 30. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит образование осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 3(NH4)2SO3 +H2O = 2MnO2↓ + 3(NH4)2SO4 + 2KOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор зелёного цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
N+3 – 2e = N+5 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми катион металла окисляется и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + SO2 + 2H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 16HCl = 5Cl2↑ + 2MnCl2 + 2KCl + 8H2O
2Cl-1 – 2e = Cl20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор жёлтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Cr+3 – 3e = Cr+6 2 восстановитель
2O-1 + 2e = 2O-2 3 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется осадок и бесцветный раствор. В результате реакции не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
3Na2SO3 + 2NaMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2NaOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор. В результате реакции не выделяется газ и не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
N+3 – 2e = N+5 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бесцветный газ, а в растворе образуется кислота. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
PH3 + 4H2SO4 = H3PO4 + 4SO2↑ + 4H2O
P-3 – 8e = P+5 1 восстановитель
S+6 + 2e = S+4 4 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бурый газ и образуется окрашенный раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
CuS + 8HNO3 = CuSO4 + 8NO2↑ + 4H2O
S-2 – 8e = S+6 1 восстановитель
N+5 + 1e = N+4 8 окислитель
Резерв
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется простое вещество и две соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
6NaBr + Na2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4Na2SO4 + 7H2O
2Br—1 – 2e = Br20 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор зелёного цвета. В результате реакции не образуется осадок и не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
KNO2 + 2KMnO4 + 2KOH = KNO3 + 2K2MnO4 + H2O
N+3 – 2e = N+5 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется осадок и бесцветный раствор. В результате реакции не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
3K2SO3 + 2KMnO4 + H2O = 3K2SO4 + 2MnO2↓ + 2KOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор. В результате реакции не выделяется газ и не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + Na2SO4 + 3H2O
N+3 – 2e = N+5 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми молекула восстановителя отдаёт три электрона. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NH3 + 3Na2O2 = N2 + 6NaOH
2N-3 – 6e = N20 1 восстановитель
2O-1 + 2e = 2O-2 3 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется простое газообразное вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NH3 + 2NaMnO4 = N2↑ + 2MnO2↓ + 2NaOH + 2H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется два газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2H2SO4 + C = 2SO2↑ + CO2↑ + 2H2O
C0 – 4e = C+4 1 восстановитель
S+6 + 2e = S+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется только кислота и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
S0 – 6e = S+6 1 восстановитель
N+5 + 1e = N+4 6 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит изменение цвета раствора. В результате реакции не образуется осадок и не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + Na2SO3 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
S+4 – 2e = S+6 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 10
Развернуть/свернуть решение
NaNO2 + NH4Cl = N2↑ + NaCl + 2H2O
N-3 – 3e = N0 1 восстановитель
N+3 + 3e = N0 1 окислитель
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также: