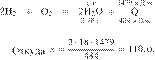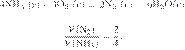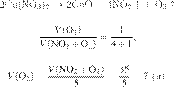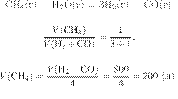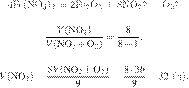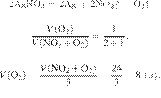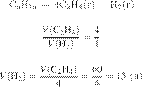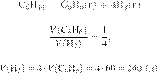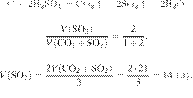Задания
Версия для печати и копирования в MS Word
Тип 27 № 13131
Термохимическое уравнение горения бутана имеет следующий вид:
Сколько теплоты выделится при полном сгорании 23,2 г бутана? Ответ дайте в кДж в виде целого числа.
Спрятать решение
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 1060 кДж.
Раздел кодификатора ФИПИ: 4.3.4 Расчеты теплового эффекта реакции
Спрятать решение
·
·
Сообщить об ошибке · Помощь
При выполнении заданий с кратким ответом впишите в поле для ответа цифру, которая соответствует номеру правильного ответа, или число, слово, последовательность букв (слов) или цифр. Ответ следует записывать без пробелов и каких-либо дополнительных символов. Дробную часть отделяйте от целой десятичной запятой. Единицы измерений писать не нужно.
Если вариант задан учителем, вы можете вписать или загрузить в систему ответы к заданиям с развернутым ответом. Учитель увидит результаты выполнения заданий с кратким ответом и сможет оценить загруженные ответы к заданиям с развернутым ответом. Выставленные учителем баллы отобразятся в вашей статистике.
Версия для печати и копирования в MS Word
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
Показать
Ответ:
2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Показать
Ответ:
3
Выберите два элемента, которые в соединениях могут иметь степень окисления –1. Запишите в поле ответа номера выбранных элементов.
Показать
Ответ:
4
Из предложенного перечня выберите два вещества, в которых между молекулами образуются водородные связи.
1) метанол
2) метан
3) ацетилен
4) вода
5) метилформиат
Запишите в поле ответа номера выбранных соединений.
Ответ:
5
Установите соответствие между названием вещества и его формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) гашёная известь
Б) гипс
В) калийная селитра
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
6
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует угарный газ.
1) оксид натрия
2) оксид железа (III)
3) концентрированная серная кислота
4) кислород
5) гидроксид хрома (III)
Запишите в поле ответа номера выбранных веществ.
Ответ:
7
Через раствор вещества Х пропустили газ Y. В результате реакции образовался осадок.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
8
Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
9
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
10
В схеме превращений
веществами Х и Y соответственно являются
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Ответ:
11
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутан
Б) ацетилен
В) циклопропан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
12
Из предложенного перечня выберите два вещества, в молекулах которых все атомы углерода находятся в sp2-гибридном состоянии.
1) бутен-2
2) циклогексан
3) бензол
4) бутадиен-1,3
5) толуол
Запишите в поле ответа номера выбранных веществ.
Ответ:
13
Из предложенного перечня выберите две пары веществ, с каждым их которых способен взаимодействовать бензол.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных пар веществ.
Ответ:
14
Из предложенного перечня выберите все вещества, с которыми не взаимодействует уксусная кислота.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Ответ:
15
Из предложенного перечня выберите два вещества, которые реагируют с аминопропановой кислотой.
1) водород
2) нитрат калия
3) метанол
4) иодоводород
5) бензол
Запишите в поле ответа номера выбранных веществ.
Ответ:
16
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом в отсутствие катализатора.
НАЗВАНИЕ ВЕЩЕСТВА
А) 2-метилбутан
Б) циклопентан
В) толуол
Г) стирол
ПРОДУКТ РЕАКЦИИ
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
17
Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
18
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
19
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию между оксидом натрия и водой.
1) обмена
2) необратимая
3) обратимая
4) соединения
5) замещения
Запишите в поле ответа номера выбранных реакций.
Ответ:
20
Из предложенного перечня выберите все способа увеличить скорость реакции горения серы в кислороде.
1) нагреть серу
2) разбавить кислород азотом
3) добавить сернистый газ
4) измельчить серу
5) облучить колбу с веществами синим светом
Запишите в поле ответа номера выбранных способов.
Ответ:
21
Установите соответствие между уравнением реакции и свойством азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СВОЙСТВО АЗОТА
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) не окислитель, не восстановитель
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
22
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл
2) металл
3) металл
4)
5)
6) металл
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
23
Установите соответствие между формулой соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) не гидролизуется
2) гидролизуется по катиону
3) гидролизуется по аниону
4) гидролизуется и по катиону, и по аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
24
Установите соответствие между способом воздействия на равновесную систему, в которой протекает реакция и направлением смещения равновесия при этом воздействии.
СПОСОБ ВОЗДЕЙСТВИЯ
А) уменьшение давления
Б) добавление кислорода
В) охлаждение
Г) добавление катализатора
НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
1) смещается в направлении прямой реакции
2) смещается в направлении обратной реакции
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
25
Установите соответствие между парами веществ и реактивом, с помощью которого можно различить вещества в каждой паре: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
26
Установите соответствие между солью металла и окраской пламени, которую они дают: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СОЛЬ
А) соли натрия
Б) соли стронция
В) соли бария
Г) соли кальция
ОКРАСКА ПЛАМЕНИ
1) кирпично-красное
2) желто-зеленое
3) фиолетовое
4) желтое
5) карминово-красное
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
27
Насыщенный раствор содержит 30% соли по массе. Сколько граммов соли нужно растворить в 350 г 20%-го раствора для получения насыщенного раствора? Ответ выразите в виде целого числа.
Ответ:
28
Термохимическое уравнение горения бутана имеет следующий вид:
Сколько теплоты выделится при полном сгорании 23,2 г бутана? Ответ дайте в кДж в виде целого числа.
Ответ:
29
Вычислите объём газа, образовавшийся в результате растворения 50 г карбоната кальция в избытке соляной кислоты. Ответ укажите в литрах с точностью до десятых.
Ответ:
30
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
31
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
32
К твёрдому нитрату натрия добавили избыток цинка и прилили концентрированный раствор гидроксида натрия. Выделившийся при нагревании газ пропустили над раскаленным оксидом меди (II). Через оставшийся раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Напишите уравнения четырёх описанных реакций.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
В уравнениях приведите структурные формулы органических веществ.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
34
Смешали 300 мл раствора серной кислоты с массовой долей 10% (плотностью 1,05 г/мл) и 200 мл раствора гидроксида калия с массовой долей 20% (плотностью 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля соли в ней составила 7%?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
35
Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием сероватого осадка. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
Завершить тестирование, свериться с ответами, увидеть решения.
Задания
для подготовки
1.
Задание 28 № 4768
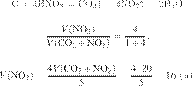
В результате
реакции, термохимическое
уравнение которой
выделилось 1479 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Ответ округлите до
целых.
Решение.
Составим пропорцию:
Ответ просят округлить до целых.
Ответ: 110 г.
2.
Задание 28 № 6258
В результате
реакции, термохимическое
уравнение которой
выделилось 171 кДж теплоты. Вычислите
массу гидроксида натрия, который был нейтрализован соляной кислотой. Ответ
укажите в граммах с точностью до целых.
Решение.
Запишем молекулярное уравнение:
Из пропорции получаем:
Ответ: 120 г.
1/28
3.
Задание 28 № 6259
Вычислите объём
газа (н. у.), который не вступит в реакцию, если сжигать 50 л водорода в 50 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
50 л |
50 л |
0 |
|
изменение |
— 50 л |
— 25 л |
+ |
|
стало |
0 л |
25 л |
50 |
Согласно уравнению
реакции, каждые два объёма водорода реагируют с одним объёмом кислорода, и при
этом получается два объёма газообразной воды.
Тогда 50 л водорода прореагируют с
25 л кислорода, а ещё 25 л кислорода не вступят в реакцию.
Ответ просят дать с точностью до
целых.
Ответ: 25 л.
4.
Задание 28 № 6260
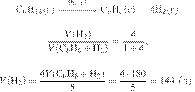
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
объём (н. у.) водорода, вступившего в реакцию. Ответ укажите в литрах с точностью
до десятых.
Решение.
Составим пропорцию:
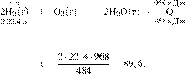
получаем:
Ответ: 89,6 л.
2/28
5.
Задание 28 № 6261
Вычислите объём
газа (н. у.), не вступит в реакцию, если сжигать 40 л угарного газа в 40 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
40 л |
40 л |
0 |
|
изменение |
— 40 л |
— 20 л |
+ |
|
стало |
0 |
20 л |
40 |
Согласно уравнению
реакции, каждые два объёма угарного газа реагируют с одним объёмом кислорода, и
при этом получается два объёма углекислого газа.
Тогда 40 л угарного газа
прореагируют с 20 л кислорода, а ещё 20 л кислорода не вступят в реакцию.
Ответ: 20 л.
6.
Задание 28 № 6262
В результате
реакции, термохимическое
уравнение которой
выделилось 264 кДж теплоты. Вычислите
массу образовавшейся при этом серной кислоты. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 294 г.
3/28
7.
Задание 28 № 6263
В результате
реакции, термохимическое
уравнение которой
выделилось 121 кДж теплоты. Вычислите
объём (н. у.) кислорода, который израсходован на сжигание водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Составим пропорцию:
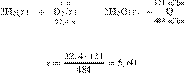
получаем:
Ответ просят дать с точностью до
десятых.
Ответ: 5,6 л.
8.
Задание 28 № 6264
Вычислите объём
азота (н. у.), который образуется при полном сгорании 20 л аммиака в избытке
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные
стехиометрическим
коэффициентам в
уравнениях реакций.
Запишем
уравнение реакции и отношение
объёмов:
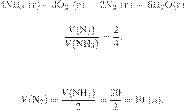
Из пропорции
имеем:
Ответ: 10 л.
4/28
9.
Задание 28 № 6265
В результате
реакции, термохимическое
уравнение которой
выделилось 28,5 кДж теплоты.
Вычислите массу азотной кислоты, которая была нейтрализована гидроксидом
калия. Ответ укажите в граммах с точностью
до десятых.
Решение.
Запишем молекулярное уравнение:
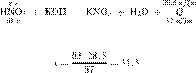
получаем:
Ответ: 31,5 г.
10.
Задание 28 № 6266
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
массу образовавшейся при этом воды. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
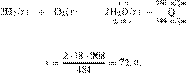
получаем:
Ответ просят дать с точностью до
целых.
Ответ: 72 г.
5/28
11.
6267
Вычислите
максимально возможный объём (н. у.) аммиака, который может быть получен исходя
из 40 л водорода и 30 л азота. Ответ укажите
в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
30 л |
40 л |
0 |
|
изменение |
— x л |
— 3x л |
+ |
|
стало |
(30-x) л |
(40-3x) л |
2x |
Согласно уравнению
реакции, каждый объём азота реагируют с тремя объёмами водорода, и при этом
образуется два объёма аммиака. Максимально возможный объём аммиака образуется,
когда один из реагентов потратится полностью.
И максимально возможный объём
аммиака равен =
Ответ просят дать с точностью до
десятых.
Ответ: 26,7 л.
12.
Задание 28 № 6395
Вычислите объём
аммиака, который можно получить из 600 л водорода, если объемная доля выхода
аммиака равна 40 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
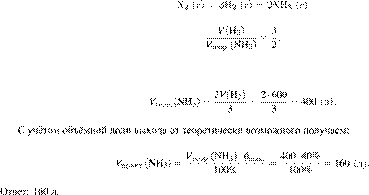
6/28
13.
6435
Вычислите объём
водорода, можно получить при разложении 250 л метана, если объемная доля выхода
водорода равна 60 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
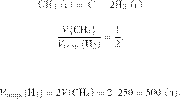
Из пропорции имеем:
С учётом объёмной доли выхода от
теоретически возможного получаем:
Ответ: 300 л.
14.
Задание 28 № 6475
Термохимическое
уравнение сгорания железа в
кислороде:
В результате
реакции выделилось 2057,5 кДж. Вычислите массу образовавшегося оксида железа(III)
Ответ дайте в граммах с точностью до целых. Решение.
Из пропорции получаем:
Ответ: 400 г.
7/28
15.
6515
Дано
термохимическое уравнение:
В реакции
поглотилось 95 кДж теплоты. Вычислите массу вступившего в реакцию углерода. Ответ
дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 10 г.
16.
Задание 28 № 6557
Вычислите объём
кислорода, который необходим для окисления 20,2 л (н. у.) водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
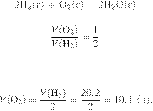
Из пропорции имеем:
Ответ: 10,1 л.
8/28
17.
6612
При полном
восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж
теплоты. Вычислите теплоту реакции
(в кДж на моль
)
Ответ дайте с
точностью до целых (в расчётах используйте целые относительные атомные массы
элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 854 кДж.
18.
Задание 28 № 6652
При полном
восстановлении оксида свинца(II) избытком водорода образовалось 41,4 г металла
и выделилось 4,4 кДж теплоты. Вычислите теплоту
реакции
(в кДж на моль
).
Ответ дайте с точностью до целых (в
расчётах используйте целые относительные атомные массы элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 22 кДж.
9/28
19.
6692
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите массу
ацетилена, которая вступила в эту реакцию, если в результате выделилось 400 кДж?
Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 52 г.
20.
Задание 28 № 6732
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите теплоту
(в кДж), которая выделится, если в реакцию вступит 117 г ацетилена. Ответ дайте
с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 900 кДж.
10/28
21.
6781
Вычислите объём
азота (н. у.), образуется при полном сгорании 67,2 л (н. у.) аммиака.
Ответ дайте в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Из пропорции имеем:
Ответ: 33,6 л.
22.
Задание 28 № 6821
При
разложении нитрата меди(II)
образовалось 12 л оксида азота(IV).
Вычислите объём образовавшегося кислорода.
Объёмы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью
до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропрорцию:
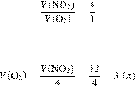
Из пропорции имеем:
Ответ: 3 л.
11/28
23.
6861
Для обжига
сульфида цинка потребовалось 240 л кислорода. Вычислите объём образовавшегося
оксида серы(IV). Объёмы газов измерены при одинаковых условиях. Ответ дайте в
литрах с точностью до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропорцию:
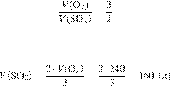
Из пропорции имеем:
Ответ: 160 л.
24.
Задание 28 № 7106
В результате реакции,
термохимическое уравнение которой
выделилось 1452 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Запишите число с
точностью до целых.
Решение.
Составим пропорцию:
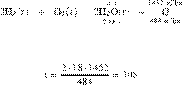
Из пропорции имеем:
Ответ: 108 г.
12/28
25.
9641
В реакцию, термохимическое уравнение
которой
вступило 88 г углекислого газа.
Вычислите количество теплоты, которое выделится при этом. Ответ дайте в кДж с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 204 кДж.
26.
Задание 28 № 9682
При полном
разложении нитрата меди(II) образовалась смесь газов общим объёмом 35 л. Вычислите
объём кислорода в этой смеси. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 7 л.
13/28
27.
9715
В результате
реакции выделилось 85,5 кДж теплоты. Вычислите массу оксида азота(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 45 г.
28.
Задание 28 № 9750
Вычислите объём
кислорода, который потребуется для полного окисления 500 л аммиака до оксида
азота(II) в присутствии катализатора. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 625 л.
14/28
29.
9784
Дано термохимическое уравнение:
В результате
реакции выделилось 226 кДж теплоты. Вычислите массу оксида углерода(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до десятых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 22,4 г.
30.
Задание 28 № 9821
Дано термохимическое уравнение:
В результате реакции
поглотилось 705 кДж. Вычислите массу оксида железа(III), вступившего в реакцию.
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 480 г.
15/28
31.
9855
В результате реакции
выделилось 1000 кДж теплоты. Вычислите массу образовавшегося оксида меди(II).
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 200 г.
32.
Задание 28 № 9889
При разложении
оксида азота образовалось 25 л азота и 12,5 л кислорода. Вычислите объём
вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
По условию объём
азота в два раза больше объёма кислорода, значит, в исходном оксиде число
атомов азота в два раза больше, чем число атомов кислорода. Запишем уравнение
реакции:
Составим пропорцию:

оксида азота, получаем:
Ответ: 25 л.
16/28
33.
9923
паровой конверсии
метана образовалась смесь оксида углерода(II) и водорода общим объёмом 800 л. Вычислите
объём израсходованного метана. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 200 л.
34.
Задание 28 № 10404
Дано термохимическое уравнение:
В результате реакции выделилось 36 кДж
теплоты. Сколько граммов хлората калия разложилось?
Примите . Ответ
округлите до ближайшего целого числа. Решение.
Из пропорции получаем:
Ответ: 98.
17/28
35.
10443
В результате
реакции выделилось 19 кДж теплоты. Сколько граммов перманганата калия
разложилось? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 79 г.
36.
Задание 28 № 10674
При полном
разложении нитрата железа(II) образовались оксид железа(III) и смесь газов общим
объёмом 36 л. Чему равен объём оксида азота(IV) в этой смеси (в л)? Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 32 л.
18/28
37.
10709
полном разложении нитрата серебра
образовались серебро и смесь газов общим объёмом 24 л.
Чему равен объём кислорода в этой
смеси (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 8 л.
38.
Задание 28 № 11089
Определите объём
водорода, необходимый для полного гидрирования 50 л ацетилена. Объёмы газов
измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
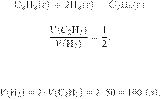
Из пропорции имеем:
Ответ: 100 л.
19/28
39.
11169
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 66 кДж теплоты. Сколько граммов гидроксида натрия вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 48 г.
40.
Задание 28 № 11234
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 64 кДж теплоты. Сколько граммов азотной кислоты вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 72 г.
20/28
41.
11272
пиролизе (высокотемпературном разложении)
октана образовались только этилен объёмом 60 л
и водород. Чему равен объём водорода
(в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 15 л.
42.
Задание 28 № 11307
При ароматизации
гексана образовались только газообразный бензол объёмом 60 л и водород. Чему
равен объём водорода (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 240 л.
21/28
43.
11342
Дано термохимическое уравнение:
В результате реакции поглотилось 63
кДж теплоты. Сколько граммов оксида меди(II) образовалось?
Примите Ответ округлите
до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
44.
Задание 28 № 11377
Дано термохимическое уравнение:
В результате
реакции поглотилось 35 кДж теплоты. Сколько граммов серебра образовалось? Ответ
округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
22/28
45.
12383
растворении
углерода в концентрированной серной кислоте образовалась смесь газов общим
объёмом 21 л. Сколько литров сернистого газа содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 14.
46.
Задание 28 № 12418
При растворении
углерода в концентрированной азотной кислоте образовалась смесь газов общим
объёмом 20 л. Сколько литров оксида азота(IV) содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 16.
23/28
47.
12617
При сжигании
углеводорода образовалось 8 л углекислого газа и 10 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 13.
48.
Задание 28 № 12652
При сжигании
углеводорода образовалось 12 л углекислого газа и 18 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 21.
24/28
49.
12866
Термохимическое уравнение горения
алюминия имеет вид
В результате
реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в
реакцию? Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ просят округлить до десятых.
Ответ: 16,2.
50.
Задание 28 № 13034
Термохимическое уравнение горения
хрома имеет вид:
В результате
реакции выделилось 342 кДж теплоты. Сколько граммов хрома вступило в реакцию?
Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 31,2.
25/28
51.
13096
Термохимическое уравнение горения
этана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 12 г этана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 570 кДж.
52.
Задание 28 № 13131
Термохимическое уравнение горения
бутана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 23,2 г бутана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 1060 кДж.
26/28
53.
13558
Какой объём
водорода потребуется для полного гидрирования 5,6 л пропена? Объёмы газов
измерены в одинаковых условиях. (Запишите число с точностью до десятых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 5,6 л.
54.
Задание 28 № 13631
При каталитической
дегидроциклизации гексана образовалась смесь паров бензола и водорода общим
объёмом 180 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 144.
27/28
55.
13666
При каталитической
дегидроциклизации гептана образовалась смесь паров толуола и водорода общим
объёмом 260 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 208.
56.
Задание 28 № 13705
Какой объём оксида серы(IV) выделится при
сжигании 64 л сероводорода в избытке кислорода?
Объёмы газов измерены в
одинаковых условиях. (Запишите число с точностью до целых.) Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 64 л.
28/28
Пробные варианты ЕГЭ 2023 по химии с ответами для проведения тренировочных работ в 11 классе.
Все варианты в формате ЕГЭ 2023 года.
Пробные варианты ЕГЭ 2023 по химии
| Широкопояс С.И. Борисов И.С. | |
| Вариант 15 | Скачать |
| Вариант 14 | Скачать |
| Вариант 13 | Скачать |
| Вариант 12 | Скачать |
| Вариант 11 | Скачать |
| Вариант 10 | Скачать |
| Вариант 9 | Скачать |
| Вариант 8 | Скачать |
| Вариант 7 | Скачать |
| Вариант 6 | Скачать |
| vk.com/chem4you | |
| Вариант 1 | Ответы |
| Вариант 2 | Ответы |
| Вариант 3 | Ответы |
| Вариант 4 | Ответы |
| Вариант 5 | Ответы |
| Вариант 6 | Ответы |
| Вариант 7 | Ответы |
| Вариант 8 | Ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| chem.family (с ответами) | |
| Вариант 1 (легкий уровень) | скачать |
| Вариант 2 (сложный уровень) | скачать |
| Вариант 3 (сложный уровень) | скачать |
| Вариант 4 (легкий уровень) | скачать |
| Вариант 5 (легкий уровень) | скачать |
| Вариант 6 (легкий уровень) | скачать |
| Вариант 7 (легкий уровень) | скачать |
| Вариант 8 (сложный уровень) | скачать |
| Купить сборники для подготовки к ЕГЭ
→ Доронькин, Февралева: ЕГЭ 2023 Химия. 10-11 классы. Тематический тренинг. Задания базового и повышенного уровней сложности → Юрий Медведев: ЕГЭ 2023 Химия. Типовые варианты экзаменационных заданий. 14 вариантов |
Экзаменационная работа состоит из двух частей, включающих в себя 34 задания.
Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева, таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы.
Для вычислений используйте непрограммируемый калькулятор.
Смотрите также:
Открытый вариант ЕГЭ 2021 по химии
Демонстрационный вариант ЕГЭ по химии 2022
ЕГЭ по химии — типичные ошибки
Отработка задания 14 ЕГЭ по химии
Пробный вариант ЕГЭ 2021 по химии с ответами
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также:
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
.011. Электронная конфигурация атома
.0217. Классификация химических реакций
.0318. Скорость химической реакции
.0419. Общие сведения об окислительно-восстановительных реакциях
.052. Закономерности изменения химических свойств элементов и их соединений по периодам и группам
.0620. Электролиз растворов и расплавов
.0721. Гидролиз солей. рН водных растворов солей, кислот, щелочей
.0822. Химическое равновесие
.0923. Расчёты параметров равновесной реакции
.1024. Качественные реакции и признаки реакций
.1125. Химия и жизнь
.123. Степень окисления и валентность химических элементов в их соединениях
.134. Типы химической связи. Тип кристаллической решётки вещества
.14Электролиз расплавов и растворов