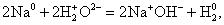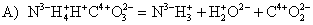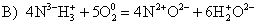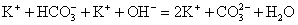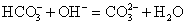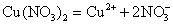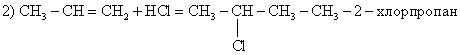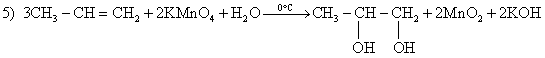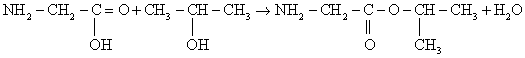Демоверсия ЕГЭ 2019 по химии
Демонстрационный вариант 2018 по химии.
Изменения
Добавлено одно задание (№30) высокого уровня с развернутым ответом. За счет изменения балльности заданий части 1 максимальный первичный балл за выполнение всей работы остался без изменений (60).
Подробнее здесь: 4ege.ru/himiya/55312-izmeneniya-v-ege-2018-po-himii.html
Демоверсия утверждена 10 ноября.
→ Демоверсия: hi_ege_demo-2018.pdf
→ Спецификация: hi_ege_specif-2018.pdf
→ Кодификатор: hi_ege_kodif-2018.pdf
→ Скачать одним архивом: himiya-ege-2018.zip
Демонстрационная версия ЕГЭ—2018 по химии
При выполнении заданий с кратким ответом впишите в поле для ответа цифру, которая соответствует номеру правильного ответа, или число, слово, последовательность букв (слов) или цифр. Ответ следует записывать без пробелов и каких-либо дополнительных символов. Дробную часть отделяйте от целой десятичной запятой. Единицы измерений писать не нужно.
Если вариант задан учителем, вы можете вписать или загрузить в систему ответы к заданиям с развернутым ответом. Учитель увидит результаты выполнения заданий с кратким ответом и сможет оценить загруженные ответы к заданиям с развернутым ответом. Выставленные учителем баллы отобразятся в вашей статистике.
Версия для печати и копирования в MS Word
1
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
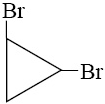
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
Ответ:
2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
3
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных элементов.
Ответ:
4
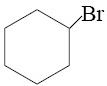
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных соединений.
Ответ:
5
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
КЛАСС/ГРУППА
1) соль средняя
2) оксид кислотный
3) оксид несолеобразующий
4) соль кислая
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
6
Из предложенного перечня веществ выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид кальция (р-р)
2) сульфат меди(II) (р-р)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Ответ:
7
В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в другую — раствор вещества Y. В результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) бромоводородная кислота
2) гидросульфид натрия
3) сероводородная кислота
4) гидроксид калия
5) гидрат аммиака
Запишите в таблицу номера выбранных веществ под соответствующими буквами
Ответ:
8
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
9
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
10
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
11
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилбензол
Б) анилин
В) 3-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
12
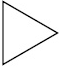
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
Запишите в поле ответа номера выбранных веществ.
Ответ:
13
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в присутствии серной кислоты будет наблюдаться изменение окраски раствора.
1) гексан
2) бензол
3) толуол
4) пропан
5) пропилен
Запишите в поле ответа номера выбранных веществ.
Ответ:
14
Из предложенного перечня выберите все вещества, с которыми реагирует формальдегид.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Ответ:
15
Из предложенного перечня выберите два вещества, с которыми реагирует метиламин.
1) пропан
2) хлорметан
3) водород
4) гидроксид натрия
5) соляная кислота
Запишите в поле ответа номера выбранных веществ.
Ответ:
16
Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются при их взаимодействии с бромом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) этан
Б) изобутан
В) циклопропан
Г) циклогексан
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Ответ:
17
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A) уксусная кислота и сульфид натрия
Б) муравьиная кислота и гидроксид натрия
В) муравьиная кислота и гидроксид меди (II) (при нагревании)
Г) этанол и натрий
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропионат натрия
2) этилат натрия
3) формиат меди (II)
4) формиат натрия
5) ацетат натрия
6) углекислый газ
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Ответ:
18
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами и
.
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам.
Ответ:
19
Из предложенного перечня типов реакций выберите все типы реакции, к которым можно отнести взаимодействие щелочных металлов с водой.
1) каталитическая
2) гомогенная
3) необратимая
4) окислительно-восстановительная
5) реакция нейтрализации
Запишите в поле ответа номера выбранных типов реакций.
Ответ:
20
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к уменьшению скорости реакции этилена с водородом.
1) понижение температуры
2) увеличение концентрации этилена
3) использование катализатора
4) уменьшение концентрации водорода
5) повышение давления в системе
Ответ:
21
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
22
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
23
Установите соответствие между названием соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) хлорид аммония
Б) сульфат калия
В) карбонат натрия
Г) сульфид алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизу не подвергается
4) гидролизуется по катиону и аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
24
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) не происходит смещения равновесия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
25
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
26
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
A) метан
Б) изопрен
В) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) получение пластмасс
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Ответ:
27
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах с точностью до десятых.
Ответ:
28
В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды. Ответ дайте в граммах с точностью до целых.
Ответ:
29
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
Ответ:
30
Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
31
Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
32
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
34
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н. у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
35
Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
Завершить тестирование, свериться с ответами, увидеть решения.
Задание 1
Определите, атомы каких из указанных в ряду
элементов в основном состоянии имеют на внешнем энергетическом уровне
четыре электрона.
1) Na
2) K
3) Si
4) Mg
5)
C
Ответ: Периодическая
система химических элементов – графическое отображение Периодического
закона. Она состоит из периодов и групп. Группа – это вертикальный
столбец химических элементов, состоит из главной и побочной подгрупп.
Если элемент находится в главной подгруппе определенной группы, то номер
группы говорит о количестве электронов на последнем слое. Следовательно,
чтобы ответить на данный вопрос необходимо открыть таблицу Менделеева
и посмотреть, какие элементы из представленных в задании расположены
в одной группе. Приходим к выводу, что такими элементами являются: Si и C, следовательно ответ будет:
3; 5.
Задание 2
Из
указанных в ряду химических элементов
1) Na
2) K
3) Si
4) Mg
5) C
выберите
три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде.
Расположите
химические элементы в порядке возрастания их металлических свойств.
Запишите
в поле ответа номера выбранных химических элементов в нужной
последовательности.
Ответ: Периодическая
система химических элементов – графическое отображение Периодического
закона. Она состоит из периодов и групп. Период – это горизонтальный
ряд химических элементов, расположенных в порядке возрастания
электроотрицательности, а значит, уменьшения металлических свойств и усиления
неметаллических. Каждый период (за исключением первого) начинается с активного
металла, который называется щелочным, и заканчивается инертным элементом,
т.е. элементом, который не образует химических соединений с другими
элементами (за редким исключением).
Глядя
на таблицу химических элементов, отмечаем, что из данных в задании
элементов, Na, Mg и Si расположены в 3 периоде. Далее необходимо
расположить эти элементы в порядке возрастания металлических свойств. Из написанного
выше определяем, если металлические свойства убывают слева на право,
значит возрастают они наоборот, справа налево. Поэтому правильными
ответами будут 3; 4; 1.

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы.
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
Задание 3
Из
числа указанных в ряду элементов
1) Na
2) K
3) Si
4) Mg
5) C
выберите
два элемента, которые проявляют низшую степень окисления –4.
Ответ: Высшая степень
окисления химического элемента в соединении численно равна номеру группы,
в которой находится химический элемент со знаком плюс. Если элемент
расположен в 1 группе, то его высшая степень окисления равна +1, во
второй группе +2 и так далее. Низшая степень окисления химического
элемента в соединениях равна 8 (высшая степень окисления, которую может
проявить химический элемент в соединении) минус номер группы, со знаком
минус. Например, элемент стоит в 5 группе, главной подгруппе;
следовательно, высшая степень окисления его в соединениях будет равна +5;
низшая степень окисления соответственно 8 – 5 = 3 со знаком
минус т.е. –3. У элементов 4 периода высшая валентность равна +4, а низшая
–4. Поэтому ищем из списка элементов данных в задании два элемента
расположенных в 4 группе главной подгруппе. Это будет C и Si
номера
правильного ответа 3; 5.
Задание 4
Из
предложенного перечня выберите два соединения, в которых присутствует
ионная связь.
1) Ca(ClO2)2
2) HClO3
3) NH4Cl
4) HClO4
5) Cl2O7
Ответ: Под химической связью понимают
такое взаимодействие атомов, которое связывает их в молекулы, ионы,
радикалы, кристаллы. Различают четыре типа химических связей: ионную,
ковалентную, металлическую и водородную.
Ионная связь –
связь, возникающая в результате электростатического притяжения разноименно
заряженных ионов (катионов и анионов), иными словами, между типичным
металлом и типичным неметаллом; т.е. элементами, резко отличающимися
друг от друга по электроотрицательности. ( > 1,7
по шкале Полинга). Ионная связь присутствует в соединениях, содержащих
металлы 1 и 2 групп главных подгрупп (за исключением Mg и Be)
и типичных неметаллов; кислорода и элементов 7 группы главной
подгруппы. Исключение составляют соли аммония, они не содержат атома
металла, вместо него ион 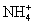
аммония между ионом аммония и кислотного остатка – связь тоже ионная.
Поэтому правильными ответами будут 1; 3.
Задание 5
Установите
соответствие между формулой вещества и классов / группой, к которому(-ой)
это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА |
КЛАСС / ГРУППА |
|
А) NH4HCO3 |
1) |
|
Б) KF |
2) |
|
В) |
3) |
|
4) |
Запишите в таблицу
выбранные цифры под соответствующими буквами.
Ответ: Для ответа на данный вопрос мы
должны вспомнить, что такое оксиды и соли. Соли – это сложные
вещества, состоящие из ионов металла и ионов кислотного остатка.
Исключение составляют соли аммония. У данных солей вместо ионов металла стоит
ион аммония. Соли бывают средними, кислыми, двойными, основными и комплексными.
Средние соли – это продукты полного замещения водорода кислоты на металл
или ион аммония; например:
H2SO4 + 2Na = H2 + Na2SO4.
Данная соль
является средней. Кислые соли – это продукт неполного замещения
водорода соли на металл; например:
2H2SO4 + 2Na = H2 + 2NaHSO4.
Данная соль
является кислой. Теперь давайте посмотрим на наше задание. В нем
содержится две соли: NH4HCO3 и KF.
Первая соль является кислой, поскольку это продукт неполного замещения водорода
в кислоте. Поэтому в табличке с ответом под буквой «А» поставим
цифру 4; другая соль (KF) не содержит
водорода между металлом и кислотным остатком, поэтому в табличке
с ответом под буквой «Б» поставим цифру 1. Оксиды – это бинарное
соединение, в состав которого входит кислород. Он стоит на втором
месте и проявляет степень окисления –2. Оксиды бывают основными (т.е. оксиды
металлов, например Na2O, CaO – им соответствуют
основания; NaOH и Ca(OH)2 ), кислотными (т.е. оксиды
неметаллов P2O5, SO3 – им соответствуют кислоты; H3PO4 и H2SO4),
амфотерными (оксиды, которые в зависимости от обстоятельств могут проявлять
основные и кислотные свойства – Al2O3, ZnO)
и несолеобразующие. Это оксиды неметаллов, которые не проявляют ни основных,
ни кислотных, ни амфотерных свойств; это CO,
N2O, NO. Следовательно, оксид NO
является несолеобразующим оксидом, поэтому в табличке с ответом под
буквой «В» поставим цифру 3. И заполненная таблица будет иметь следующий вид:

ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
Задание 6
Из предложенного
перечня выберите два вещества, с каждым из которых железо реагирует
без нагревания.
1) хлорид
кальция (р-р)
2) сульфат меди
(II) (р-р)
3) концентрированная
азотная кислота
4) разбавленная
соляная кислота
5) оксид алюминия
Ответ: Железо – активный металл. Взаимодействует с хлором, углеродом
и другими неметаллами при нагревании:
2Fe + 3Cl2 = 2FeCl3
Вытесняет из растворов солей металлы,
находящиеся в электрохимическом ряду напряжений правее железа:
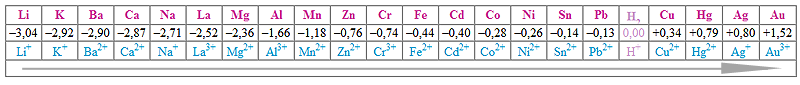
Fe +
CuSO4 = FeSO4 + Cu
Растворяется в разбавленных серной и соляной
кислотах c выделением водорода,
Fe + 2НCl = FeCl2 + H2
с раствором азотной кислоты
Fe +
4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированные серная и соляная кислота при
обычных условиях с железом не реагируют, они его пассивируют:
Исходя из этого правильными ответами будут: 2;
4.
Задание 7
В одну из пробирок с осадком
гидроксида алюминия добавили сильную кислоту Х, а в другую –
раствор вещества Y.
в результате в каждой из пробирок наблюдали растворение осадка. Из
предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные
реакции.
1)
бромоводородная кислота.
2)
гидросульфид натрия.
3)
сероводородная кислота.
4)
гидроксид калия.
5)
гидрат аммиака.
Запишите
в таблицу номера выбранных веществ под соответствующими буквами.
Ответ: Гидроксид
алюминия является амфотерным основанием, поэтому может взаимодействовать
с растворами кислот и щелочей:
1)
Взаимодействие с раствором кислоты: Al(OH)3 + 3HBr = AlCl3
+ 3H2O.
При
этом осадок гидроксида алюминия растворяется.
2)
Взаимодействие со щелочами: 2Al(OH)3 + Сa(OH)2 = Ca[Al(OH)4]2.
При
этом осадок гидроксида алюминия также растворяется.
| Ответ: |
X |
Y |
|
|
1 |
4 |
||
Задание 8
Установите
соответствие между формулой вещества и реагентами, с каждым из которых
это вещество может взаимодействовать: к каждой позиции, обозначенной
буквой, подберите соответствующую позицию, обозначенную цифрой
|
ФОРМУЛА |
РЕАГЕНТЫ |
|
А) S Б) SO3 В) Zn(OH)2 Г) ZnBr2 (р-р) |
1) AgNO3, Na3PO4, 2) BaO, H2O, 3) H2, Cl2, 4) НBr, LiOH, CH3COOH (р-р) 5) H3PO4 |
Ответ: Под буквой А стоит сера (S). Как простое вещество, сера может вступать в окислительно-восстановительные
реакции. Большинство реакций происходит с простыми веществами, металлами
и неметаллами. Окисляется растворами концентрированных серной и соляной
кислот. Взаимодействует со щелочами. Из всех реагентов, расположенных под
цифрами 1–5, больше всего под описанные выше свойства подходят простые вещества
под цифрой 3.
S + H2 = H2S
S + Cl2 = SCl2
S + O2 + SO2
Следующее
вещество – SO3, буква Б. Оксид
серы VI – сложное вещество, кислотные оксид. Данный
оксид содержит серу в степени окисления +6. Это высшая степень окисления
серы. Поэтому SO3 будет вступать в реакции,
в качестве окислителя, с простыми веществами, например с фосфором,
со сложными веществами, например с KI, H2S. При этом его
степень окисления может понизиться до +4, 0 или –2, также вступает в реакции
без изменения степени окисления с водой, оксидами металлов и гидроксидами.
Исходя из этого, SO3 будет
реагировать со всеми реагентами под цифрой 2, то есть:
SO3 + BaO = BaSO4
SO3 + H2O = H2SO4
SO3 + 2KOH
= K2SO4 + H2O
Zn(OH)2 –
амфотерный гидроксид расположен под буквой В. Обладает уникальными
свойствами – реагирует как с кислотами, так и со щелочами.
Поэтому из всех представленных реагентов можно смело выбирать реагенты под
цифрой 4.
Zn(OH)2 + HBr = ZnBr2 + H2O
Zn(OH)2 + LiOH = Li2[Zn(OH)4]
Zn(OH)2 + CH3COOH = (CH3COO)2Zn
+ H2O
И наконец, под
буквой Г расположено вещество ZnBr2 – соль,
бромид цинка. Соли реагируют с кислотами, щелочами, другими солями,
а также соли бескислородных кислот, как и данная соль, могут
взаимодействовать с неметаллами. В данном случае наиболее активные
галогены (Cl или F)
могут вытеснять менее активные (Br и I) из растворов их солей. Данным критериям
соответствуют реагенты под цифрой 1.
ZnBr2 + 2AgNO3 = 2AgBr + Zn(NO3)2
3ZnBr2 + 2Na3PO4 = Zn3(PO4)2
+ 6NaBr
ZnBr2 + Cl2 = ZnCl2 +
Br2
Варианты ответа
выглядят следующим образом:

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы.
Теоретический материал изложен в краткой и доступной форме. Каждая тема сопровождается примерами тестовых заданий. Практические задания соответствуют формату ЕГЭ. В конце пособия приведены ответы к тестам. Пособие адресовано школьникам, абитуриентам и учителям.
Купить
Задание 9
Установите
соответствие между исходными веществами, вступающими
в реакцию, и продуктами этой реакции: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ИСХОДНЫЕ |
ПРОДУКТЫ |
|
А) Б) В) Г) |
1) MgSO4 2) MgO, SO2, 3) H2S и H2O 4) SO2 и H2O 5) MgSO4, H2S 6) SO3 и H2O |
Ответ: А) Серная кислота концентрированная является
сильным окислителем. Может взаимодействовать и с металлами стоящими
в электрохимическом ряду напряжений металлов после водорода. При этом
водород, как правило, в свободном состоянии не выделяется, он
окисляется в воду, а серная кислота восстанавливается до различных соединений,
например: SO2, S
и H2S, в зависимости
от активности металла. При взаимодействии с магнием реакция будет иметь
следующий вид:
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + H2O (цифра ответа 5)
Б) При
взаимодействии серной кислоты с оксидом магния образуются соль и вода:
MgO + H2SO4 = MgSO4 + H2O (Цифра ответа 1)
В)
Концентрированная серная кислота окисляет не только металлы, но и неметаллы,
в данном случае серу, по следующему уравнению реакции:
S + 2H2SO4 (конц) = 3SO2 + 2H2O (цифра ответа 4)
Г) При горении
сложных веществ с участием кислорода образуются оксиды всех элементов,
входящих в состав сложного вещества; например:
2H2S + 3O2 = 2SO2 + 2H2O (цифра ответа 4)
Таким образом,
общий ответ будет иметь следующий вид:
Задание 10
Задана
следующая схема превращений веществ:
| Х | Y | |||
| K2CO3 | → | CO2 | → | KHCO3 |
Определите,
какие из указанных веществ являются веществами X
и Y.
1) KCl (р-р)
2) KOH (р-р)
3) H2
4) HCl (избыток)
5) CO2
Ответ: Карбонаты вступают в химическую
реакцию с кислотами, при этом образуется слабая угольная кислота, которая
в момент образования разлагается на углекислый газ и воду:
K2CO3 + 2HCl(избыток) = 2KCl +
CO2 + H2O
При пропускании через
раствор гидроксида калия избытка углекислого газа образуется гидрокарбонат
калия.
CO2 +
КОН = KHCO3
Записываем
в таблицу ответ:
Задание 11
Установите
соответствие между названием вещества и классом/группой, к которому(-ой)
это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ |
КЛАСС/ГРУППА |
|
А) Б) В) |
1) 2) 3) 4) |
Ответ: А) Метилбензол относится к гомологическому
ряду ароматических углеводородов; его формула C6H5CH3 (цифра 4)
Б) Анилин
относится к гомологическому ряду ароматических аминов. Его формула C6H5NH2. Группа NH2 – функциональная
группа аминов. (цифра 2)
В)
3-метилбутаналь относится к гомологическому ряду альдегидов. Так как
альдегиды имеют окончание -аль. Его формула:
Записываем
в таблицу ответ:

ЕГЭ. Химия. Универсальный справочник
Справочник содержит подробный теоретический материал по всем темам, проверяемым ЕГЭ по химии. После каждого раздела приводятся разноуровневые задания в форме ЕГЭ. Для итогового контроля знаний в конце справочника даются тренировочные варианты, соответствующие ЕГЭ. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данном справочнике они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену.
Справочник адресован учащимся старших классов для подготовки к ЕГЭ по химии.
Купить
Задание 12
Из предложенного
перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
Ответ: Изомеры – это вещества, имеющие
одинаковую молекулярную формулу, но различные строение и свойства. Структурные
изомеры – это тип веществ, которые идентичны друг другу по количественному
и качественному составам, но порядок атомного связывания (химического
строения) имеет различия. Для ответа на этот вопрос давайте напишем молекулярные
формулы всех веществ. Формула бутена-1 будет выглядеть так: С4Н8
1) бутан – С4Н10
2) циклобутан –
С4Н8
3) бутин-2 – С4Н6
4) бутадиен-1, 3
– С4Н6
5) метилпропен –
С4Н8
Такие же формулы
имеют циклобутан № 2 и метилпропен № 5. Они и будут структурными
изомерами бутена-1.
Записываем
в таблицу правильные ответы:
Задание 13
Из предложенного
перечня выберите два вещества, при взаимодействии которых с раствором
перманганата калия в присутствии серной кислоты будет наблюдаться
изменение окраски раствора.
1) гексан
2) бензол
3) толуол
4) пропан
5) пропилен
Ответ: Давайте попробуем ответить на этот
вопрос методом исключения. Предельные углеводороды не подвергаются
окислению данным окислителем, поэтому вычеркиваем гексан № 1 и пропан № 4.
Далее – бензольное кольцо устойчиво к действию подавляющего
большинства окислителей.
Вычеркиваем
№ 2 (бензол). У гомологов бензола алкильные группы легко окисляются под действием
таких окислительных агентов, как перманганат калия. Поэтому толуол (метилбензол)
будет подвергаться окислению по метильному радикалу. Так же
окисляется и пропилен (непредельный углеводород с двойной связью).
Правильный ответ:
Задание 14
Из предложенного
перечня выберите два вещества, с которыми реагирует формальдегид.
1) Cu
2) N2
3) H2
4) Ag2O (NH3 р-р)
5) CH3OCH3
Ответ: Формальдегид – это альдегид
муравьиной кислоты. Он вступает во многие химические реакции, но основными
являются реакции восстановления и окисления. Восстановителем может служить
водород, который присоединяется по связи: С=О, превращая его в метанол
Окисляются
альдегиды различными окислителями, в том числе и аммиачным раствором
оксида серебра (знаменитая реакция серебряного зеркала)
| Н– | С |
=О + Ag2O (NH3 р-р) =H– |
C | =O + 2Ag |
| │ | │ | |||
| Н | О | Н |
Правильный
ответ:

ЕГЭ-2018. Химия. Сдаем без проблем!
В книге содержатся материалы для успешной сдачи ЕГЭ по химии: краткие теоретические сведения по всем темам, задания разных типов и уровней сложности, методические комментарии, ответы и критерии оценивания. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данной книге они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену.
В издании в сжатой форме изложены основы предмета в соответствии с действующими образовательными стандартами и максимально подробно разобраны наиболее сложные экзаменационные вопросы повышенного уровня сложности. Кроме того, приводятся тренировочные задания, с помощью которых можно проверить уровень усвоения материала. Приложение книги содержит необходимые справочные материалы по предмету.
Купить
Задание 15
Из предложенного
перечня выберите два вещества, с которыми реагирует метиламин.
1) пропан
2) хлорметан
3) водород
4) гидроксид
натрия
5) соляная
кислота.
Ответ: Амины, являясь производными аммиака, имеют сходное с ним строение
и проявляют подобные ему свойства. Для них также характерно
образование донорно-акцепторной связи. Как и аммиак,
они вступают в реакцию с кислотами. Например, с соляной кислотой с образованием
хлорида метиламмония.
CH3–NH2 + HCl
=[CH3NH3]Cl.
Из органических
веществ метиламин вступает в реакции алкилирования с галогеналканами:
CH3–NH2 + CH3Cl = [(CH3)2NH2]Cl
С другими
веществами из данного списка амины не реагируют, поэтому правильный
ответ:
Задание 16
Установите
соответствие между названием вещества и продуктом, который преимущественно
образуется при взаимодействии этого вещества с бромом: к каждой
позиции, обозначенной буквой, выберите соответствующую позицию, обозначенную
цифрой.
|
НАЗВАНИЕ |
ПРОДУКТЫ |
||||||||||||||||||||||||
|
А) Б) В) Г) |
1)
3) Br–CH2–CH2–CH2–Br
5) CH3–CH2–Br 6) |
Ответ: А) этан – это предельный
углеводород. Для него не характерны реакции присоединения, поэтому
происходит замещение атома водорода на бром. И получается бромэтан:
CH3–СH3
+ Br2 = CH3–CH2–Br
+ HBr (ответ 5)
Б) Изобутан, так
же как и этан, – представитель предельных углеводородов, поэтому для него
характерны реакции замещения водорода на бром. В отличие от этана,
изобутан содержит не только первичные атомы углерода (соединенные с тремя
атомами водорода), но и один первичный атом углерода. А так как замещение атома водорода галогеном легче
всего идет у менее гидрогенизированного третичного атома углерода, затем у
вторичного и в последнюю очередь у первичного, бром будет
присоединяться именно к нему. В результате получим 2-бром,
2-метилпропан:
| C | H3 | C | H3 | ||
| │ | │ | ||||
| CH3– | C | –CH3 + Br2 = CH3– | C | –CH3 + HBr | (ответ 2) |
| │ | │ | ||||
| Н | B | r |
В) Циклоалканы,
к которым относится циклопропан, сильно отличаются между собой по
устойчивости цикла: наименее устойчивы трехчленные и наиболее устойчивы
пяти- и шестичленные циклы. При бромировании 3-х и 4-х членных
циклов, происходит их разрыв с образованием алканов. При этом
присоединяются сразу 2 атома брома.
|
|
+ Br2 = Br–CH2–CH2–CH2–Br |
Г) Реакция
взаимодействия с бромом у пяти и шестичленных циклов не приводит
к разрыву цикла, а сводится к реакции замещения водорода
на бром.
Таким образом,
общий ответ будет иметь вид:
Задание 17
Установите
соответствие между реагирующими веществами и углеродсодержащим продуктом,
который образуется при взаимодействии этих веществ: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ |
ПРОДУКТ |
|
А) Б) В) Г) этанол и натрий |
1) 2) 3) 4) 5) 6) |
Ответ: А) Реакция между уксусной кислотой
и сульфидом натрия относится к реакциям обмена, когда сложные
вещества обмениваются составными частями.
CH3COOH
+ Na2S
= CH3COONa
+ H2S.
Cоли уксусной кислоты называются ацетаты. Данная соль,
соответственно, называется ацетат натрия. Ответ под цифрой 5
Б) Реакция между
муравьиной кислотой и гидроксидом натрия также относится к реакциям
обмена.
HCOOH + NaOH =
HCOONa + H2O.
Соли муравьиной
кислоты называются формиаты. В данном случае образуется формиат натрия.
Ответ под цифрой 4.
В) Муравьиная
кислота, в отличие от других карбоновых кислот – удивительное
вещество. Содержит в себе помимо функциональной карбоксильной группы
–СООН, еще и альдегидную группу СОН. Поэтому они вступают в реакции
характерные для альдегидов. Например, в реакцию серебряного зеркала;
восстановления гидроксида меди (II), Cu(OH)2
при нагревании до гидроксида меди (I),
CuOH, разлагающегося при высокой температуре до оксида
меди (I), Cu2O. Образуется красивый осадок оранжевого цвета.
2Cu(OH)2
+ 2HCOOH = 2СO2 + 3H2O + Cu2O
Сама же
муравьиная кислота окисляется до углекислого газа. (правильный ответ 6)
Г) При
взаимодействии этанола с натрием образуется газообразный водород и этилат
натрия.
2C2H5OH + 2Na = 2C2H5ONa
+ H2 (ответ 2)
Таким образом,
на данное задание ответами будут:

ЕГЭ-2018. Химия. 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену
Вниманию школьников и абитуриентов предлагается новое пособие для подготовки ЕГЭ, которое содержит 10 вариантов типовых экзаменационных работ по химии.
Каждый вариант составлен в полном соответствии с требованиями единого государственного экзамена, включает задания разных типов и уровня сложности.
В конце книги даны ответы для самопроверки на все задания.
Предлагаемые тренировочные варианты помогут учителю организовать подготовку к итоговой аттестации, а учащимся — самостоятельно проверить свои знания и готовность к сдаче выпускного экзамена.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
Задание 18
Задана следующая
схема превращения веществ:
| Х | Y | |||
| CH3CH2Cl | → | CH3CH2OH | → | CH3CHO |
Определите,
какие из указанных веществ являются веществами X
и Y.
1) H2
2) CuO
3) Cu(OH)2
4) NaOH (H2O)
5) NaOH (спирт)
Ответ: Галогеноводороды обладают способностью
подвергаться гидролизу. В данном случае при взаимодействии хлорэтана
с раствором гидроксида натрия приведет к щелочному гидролизу.
| H2O | ||
|
CH3CH2Cl + NaOH |
→ |
CH3CH2OH + NaCl (ответ 4) |
Спирты при высокой
температуре в присутствии окислителей могут окисляться до соответствующих
альдегидов. В данном случае в качестве окислителя служит оксид меди II (CuO) по следующей
реакции:
СH3CH2OH
+ CuO (t) = СH3COH + Cu + H2O (ответ: 2)
Общий ответ
данного номера:
Задание 19
Из предложенного
перечня типов реакций выберите два типа реакции, к которым можно отнести
взаимодействие щелочных металлов с водой.
1)
каталитическая
2) гомогенная
3) необратимая
4)
окислительно-восстановительная
5) реакция нейтрализации
Ответ: Напишем уравнение реакции, например,
натрия с водой:
2Na +2H2O = 2NaOH + H2.
Натрий, очень
активный металл, поэтому с водой будет энергично взаимодействовать,
в некоторых случаях даже со взрывом, поэтому реакция идет без
катализаторов. Натрий – это металл, твердое вещество, вода и раствор
гидроксида натрия – жидкости, водород – газ, поэтому реакция
гетерогенная. Реакция необратимая, потому что водород уходит из реакционной
среды в виде газа. В процессе реакции изменяются степени окисления у
натрия и водорода,
поэтому
реакция относится к окислительно-восстановительным, так как натрий выступает
в роли восстановителя, а водород в роли окислителя. К реакциям
нейтрализации не относится, поскольку в результате реакции нейтрализации
образуются вещества, имеющие нейтральную реакцию среды, а здесь образуется
щелочь. Из этого можно сделать вывод, что правильными будут ответы
Задание 20
Из предложенного
перечня внешних воздействий выберите два воздействия, которые приводят к уменьшению
скорости химической реакции этилена с водородом:
1) понижение
температуры
2) увеличение
концентрации этилена
3) использование
катализатора
4) уменьшение
концентрации водорода
5) повышение
давления в системе.
Ответ: Скорость
химической реакции – это величина, показывающая, как изменяются
концентрации исходных веществ или продуктов реакции за единицу времени.
Существует понятие скорости гомогенных и гетерогенных реакций. В данном
случае дана гомогенная реакция, поэтому для гомогенных реакций скорость зависит
от следующих взаимодействий (факторов):
- концентрация
реагирующих веществ; - температура;
- катализатор;
- ингибитор.
Данная
реакция проходит при повышенной температуре, поэтому понижение температуры
приведет к уменьшению ее скорости. Ответ № 1. Далее: если увеличить
концентрацию одного из реагирующих веществ, реакция пойдет быстрее. Нам это
не подходит. Катализатор – вещество, увеличивающее скорость реакции,
– тоже не подходит. Уменьшение концентрации водорода приведет к замедлению
реакции, что нам и нужно. Значит, еще один правильный ответ – № 4. Для ответа
на пункт 4 вопроса давайте напишем уравнение данной реакции:
CH2=CH2 + H2 = CH3-CH3.
Из
уравнения реакции видно, что она идет с уменьшением объема (в реакцию
вступило 2 объема веществ – этилен + водород), а образовался
только один объем продукта реакции. Следовательно, при увеличении давления
скорость реакции должна увеличиться – тоже не подходит. Подведем
итог. Правильными оказались ответы:

ЕГЭ-2018. Химия. Тематические тренировочные задания
Пособие содержит задания, максимально приближенные к реальным, используемым на ЕГЭ, но распределенные по темам в порядке их изучения в 10-11-х классах старшей школы. Работая с книгой, можно последовательно отработать каждую тему, устранить пробелы в знаниях, а также систематизировать изучаемый материал. Такая структура книги поможет эффективнее подготовиться к ЕГЭ.
Это издание адресовано учащимся старших классов для подготовки к ЕГЭ по химии. Тренировочные задания позволят систематически, при прохождении каждой темы, готовиться к экзамену.
Купить
Задание 21
Установите
соответствие между уравнением реакции и свойством элемента азота, которое
он проявляет в этой реакции: к каждой позиции, обозначенной буквой,
подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ |
СВОЙСТВА АЗОТА |
|
А) NH4HCO3 = NH3 + H2O Б) 3CuO + 2NH3 = N2 + 3Cu + 3H2O В) 4NH3 + 5O2 = 4NO + 6H2O |
1) 2) 3) 4) |
Ответ: Посмотрим, как
изменяются степени окисления в реакциях:
в данной
реакции азот не изменяет степени окисления. Она у него в реакции
стабильна 3–. Поэтому ответ 4.
в данной
реакции азот изменяет свою степень окисления с 3– до 0, то есть
окисляется. Значит, он является восстановителем. Ответ 2.
Здесь
азот изменяет свою степень окисления с 3– до 2+. Реакция
окислительно-восстановительная, азот окисляется, значит, является
восстановителем. Правильный ответ 2.
Общий
ответ:
Задание 22
Установите
соответствие между формулой соли и продуктами электролиза водного раствора
этой соли, которые выделились на инертных электродах: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТЫ |
|
А) Б) В) Г) Cu(NO3)2 |
1) H2, O2 2) Cu, O2 3) Cu, Br2 4) H2, Cl2 5) Cu, NO2 |
Ответ: Электролиз – это
окислительно-восстановительная реакция, протекающая на электродах, при
прохождении постоянного электрического тока через раствор или расплав
электролита. На катоде всегда идёт процесс восстановления; на аноде всегда идёт процесс окисления. Если металл стоит в электрохимическом ряду
напряжений металлов до марганца, то на катоде восстанавливается вода;
от марганца до водорода возможно выделение воды и металла, если правее
водорода, то восстанавливается только металл. Процессы, протекающие
на аноде:
Если анод инертный,
то в случае бескислородных анионов (кроме фторидов) идет окисление
анионов:
В случае кислородсодержащих
анионов и фторидов идет процесс окисления воды, анион при этом не окисляется
и остается в растворе:
При электролизе растворов
щелочей идет окисление гидроксид-ионов:
Теперь давайте рассмотрим
данное задание:
А)
Na3PO4 диссоциирует
в растворе на ионы натрия и кислотного остатка
кислородсодержащей кислоты.
Катион
натрия устремляется к отрицательному электроду – катоду. Так как ион натрия
в электрохимическом ряду напряжений металлов находится до алюминия,
то от восстанавливаться не будет, будет восстанавливаться вода по
следующему уравнению:
2H2O = H2 + 2OH–.
На катоде
выделяется водород.
Анион
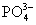
заряженному электроду – и находится в прианодном пространстве,
а на аноде окисляется вода по уравнению:
2H2O – 4e = O2↑ + 4H+
На
аноде происходит выделение кислорода. Таким образом, суммарное уравнение реакции
будет иметь следующий вид:
2Na3PO4 + 8H2O = 2H2 + O2 + 6NaOH + 2 H3PO4 (ответ 1)
Б)
при электролизе раствора КCl на катоде будет восстанавливаться вода по
уравнению:
2H2O = H2 + 2OH–.
В качестве
продукта реакции будет выделяться водород. На аноде будет окисляться Cl– до
свободного состояния по следующему уравнению:
2CI– – 2e = Cl2.
Суммарный
процесс на электродах выглядит следующим образом:
2KCl + 2H2O = 2KOH + H2 + Cl2 (ответ 4)
В)
При электролизе соли CuBr2 на катоде восстанавливается медь:
Cu2+ + 2e = Cu0.
На аноде
окисляется бром:
Суммарное
уравнение реакции будет иметь следующий вид:
Правильный ответ 3.
Г)
Гидролиз соли Cu(NO3)2 протекает
следующим образом: на катоде происходит выделение меди по следующему
уравнению:
Cu2+ + 2e = Cu0.
На аноде
выделяется кислород:
2H2O – 4e = O2↑ + 4H+
Правильный
ответ 2.
Общий
ответ на данный вопрос:

ЕГЭ. Химия. Пошаговая подготовка
Все материалы школьного курса по химии четко структурированы и разделены на 36 логических блоков (недель). Изучение каждого блока рассчитано на 2-3 самостоятельных занятия в неделю в течение учебного года. Пособие содержит все необходимые теоретические сведения, задания для самоконтроля в виде схем и таблиц, а также в форме ЕГЭ, бланки и ответы. Уникальная структура пособия поможет структурировать подготовку к ЕГЭ и пошагово изучить все темы в течение всего учебного года.
Издание содержит все темы школьного курса по химии, необходимые для сдачи ЕГЭ.
Весь материал четко структурирован и разделен на 36 логических блоков (недель), включающих необходимые теоретические сведения, задания для самоконтроля в виде схем и таблиц, а также в форме ЕГЭ. Изучение каждого блока рассчитано на 2-3 самостоятельных занятия в неделю в течение учебного года. Кроме того, в пособии приводятся тренировочные варианты, цель которых – оценить уровень знаний.
Купить
Задание 23
Установите
соответствие между названием соли и отношением этой соли к гидролизу:
к каждой позиции, обозначенной буквой, подберите соответствующую позицию,
обозначенную цифрой.
|
НАЗВАНИЕ СОЛИ |
ОТНОШЕНИЕ |
|
А) Б) В) Г) |
1) 2) 3) 4) |
Ответ: Гидролизом
называется реакция взаимодействия ионов соли с молекулами воды, приводящая
к образованию слабого электролита. Любую соль можно представить как
продукт взаимодействия кислоты и основания. По этому принципу все соли
можно разделить на 4 группы:
- Соли, образованные сильным основанием и слабой
кислотой. - Соли, образованные слабым основанием
и сильной кислотой. - Соли, образованные слабым основанием
и слабой кислотой. - Соли, образованные сильным основанием
и сильной кислотой.
Давайте теперь разберем с этой точки зрения данное задание.
А) NH4Cl – соль, образованная слабым основанием NH4OH и сильной кислотой HCl – подвергается гидролизу. В результате
образуется слабое основание и сильная кислота. Данная соль гидролизуется
по катиону 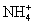
слабого основания. Ответ под цифрой 1.
Б) K2SO4 – соль, образованная сильным основанием
и сильной кислотой. Такие соли гидролизу не подвергаются, так как
не образуется слабого электролита. Ответ 3.
В) Карбонат натрия Na2CO3 – соль, образованная сильным основанием NaOH и слабой угольной кислотой H2CO3 – подвергается гидролизу. Так как соль образована двухосновной
кислотой, то гидролиз теоретически может идти в две стадии. в результате
первой стадии образуется щелочь и кислая соль – гидрокарбонат натрия:
Na2CO3 + H2O
↔NaHCO3 + NaOH;
в результате второй стадии образуется слабая
угольная кислота:
NaHCO3 +
H2O ↔ H2CO3 (H2O + CO2)
+ NaOH –
данная соль гидролизуется по аниону 
Г) Соль сульфид алюминия Al2S3 образована слабым основанием Al(OH)3
и слабой кислотой H2S. Такие соли подвергаются гидролизу. В результате
образуется слабое основание и слабая кислота. Гидролиз идет по катиону
и аниону. Правильный ответ 4.
Таким образом, общий ответ на задание имеет вид:
Задание 24
Установите
соответствие между уравнением обратимой реакции и направлением смещения
химического равновесия при увеличении давления: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ |
НАПРАВЛЕНИЕ |
|
А) Б) В) Г) |
1) 2) 3) |
Ответ: Обратимыми
называют реакции, которые одновременно могут идти в двух противоположных
направлениях: в сторону прямой и обратной реакции, поэтому в уравнениях
обратимых реакций вместо равенства ставится знак обратимости. Каждая обратимая
реакция заканчивается химическим равновесием. Это динамический процесс. Для
того чтобы вывести реакцию из состояния химического равновесия, нужно приложить
к ней определенные внешние воздействия: изменить концентрацию, температуру
или давление. Делается это по принципу Ле-Шателье: если на систему,
находящуюся в состоянии химического равновесия, подействовать извне,
изменить концентрацию, температуру или давление, то система стремится
занять такое положение, которое противодействует этому действию.
Разберем
это на примерах нашего задания.
А)
Гомогенная реакция N2(г) + 3H2(г) = 2NH3(г) является еще
и экзотермической, то есть идет с выделением теплоты. Далее в реакцию
вступило 4 объема реагирующих веществ (1 объем азота и 3 объема
водорода), а в результате образовался один объем аммиака. Таким
образом, мы определили, что реакция идет с уменьшением объема. По принципу
Ле-Шателье, если реакция идет с уменьшением объема, то увеличение
давления смещает химическое равновесие в сторону образования продукта
реакции. Правильный ответ 1.
Б)
Реакция 2H2(г) + O2(г) = 2H2O(г) аналогична
предыдущей реакции, также идет с уменьшением объема (вступило 3 объема
газа, а в результате реакции образовалось 2), поэтому увеличение
давления сместит равновесие в сторону образования продукта реакции. Ответ
1.
В)
Данная реакция H2(г) + Cl2(г) = 2HCl(г)
протекает без изменения объема реагирующих веществ (вступило 2 объема газов и образовалось 2 объема хлороводорода). На реакции, идущие без
изменения объема, давление влияния не оказывает. Ответ 3.
Г)
Реакция взаимодействия оксида серы (IV)
и хлора SO2(г) + Cl2(г) = SO2Cl2(г) является
реакцией, идущей с уменьшением объема веществ (в реакцию
вступило 2 объема газов, а образовался один объем SO2Cl2). Ответ 1.
Ответом
на это задание будет следующий набор букв и цифр:

ЕГЭ-2018. Химия. Решение задач. Сдаем без проблем!
В книге решения всех типов задач базового, повышенного и высокого уровней сложности по всем темам, проверяемым на ЕГЭ по химии. Регулярная работа с данным пособием позволит учащимся научиться быстро и без ошибок решать задачи по химии разных уровней сложности.
В пособии подробно разобраны решения всех типов задач базового, повышенного и высокого уровней сложности в соответствии с перечнем элементов содержания, проверяемых на ЕГЭ по химии. Регулярная работа с данным пособием позволит учащимся научиться быстро и без ошибок решать задачи по химии разных уровней сложности.
Издание окажет неоценимую помощь учащимся при подготовке к ЕГЭ по химии, а также может быть использовано учителями при организации учебного процесса.
Купить
Задание 25
Установите
соответствие между формулами веществ и реагентом, с помощью которого
можно различить водные растворы этих веществ: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛЫ |
РЕАГЕНТ |
|
А) Б) В) Г) |
1) Cu 2) KOH 3) HCI 4) KNO3 5) CuSO4 |
Ответ: А) Даны два
вещества, кислота и соль. Азотная кислота является сильным окислителем
и взаимодействует с металлами, стоящими в электрохимическом ряду
напряжений металлов как до водорода, так и после, причем взаимодействует
как концентрированная, так и разбавленная. Например, азотная кислота HNO3 взаимодействует с медью
с образованием соли меди, воды и оксида азота. При этом, помимо
выделения газа, раствор приобретает характерную для солей меди синюю окраску,
например:
8HNO3(р) + 3Cu
= 3Cu(NO3)2 + 2NO + 4H2O,
а соль
NaNO3 с медью не реагирует. Ответ
1.
Б)
Даны соль и гидроксид активных металлов, у которых практически все соединения
растворимы в воде, поэтому выбираем вещество из колонки реагентов,
которое при взаимодействии с одним из данных веществ выпадает в осадок.
Этим веществом будет сульфат меди. С хлоридом калия реакция не пойдет,
а вот с гидроксидом натрия выпадет красивый синий осадок, по
уравнению реакции:
CuSO4 + 2NaOH = Cu(OH)2
+ Na2SO4.
Ответ
5.
В)
Даны две соли, хлориды натрия и бария. Если все соли натрия растворимы, то
с солями бария наоборот – многие соли бария нерастворимы. По таблице
растворимости определяем, что сульфат бария нерастворим, поэтому
реактивом будет сульфат меди. Ответ 5.
Г)
Опять даны 2 соли – AlCl3 и MgCl2 – и опять хлориды. При
сливании данных растворов с HCl, KNO3 CuSO4 не образуют
никаких видимых изменений, c медью
вообще не реагируют. Остается КOH. С ним обе соли выпадают в осадок,
с образованием гидроксидов. Но гидроксид алюминия – амфотерное основание.
При добавлении избытка щелочи осадок растворяется с образованием
комплексной соли. Ответ 2.
Общий
ответ на данное задание выглядит так:
Задание 26
Установите
соответствие между веществом и основной областью его применения: к каждой
позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
|
ВЕЩЕСТВО |
ОБЛАСТЬ |
|
A) метан Б) В) |
1) 2) 3) 4) |
Ответ: А) Метан при
сгорании выделяет большое количество тепла, поэтому его можно использовать
в качестве топлива (ответ 2).
Б)
Изопрен, являясь диеновым углеводородом, при полимеризации образует каучук,
который затем превращают в резину (ответ 3).
В)
Этилен – непредельный углеводород, который вступает в реакции полимеризации,
поэтому может быть использован в качестве пластических масс (ответ 4).
Итого:
Задание 27
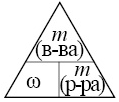
Вычислите
массу нитрата калия (в граммах), которую следует растворить в 150,0 г.
раствора с массовой долей этой соли 10% для получения раствора с массовой
долей 12%. (Запишите число с точностью до десятых).
Решим
данную задачу:
1.
Определим массу нитрата калия, содержащуюся в 150 г 10% раствора.
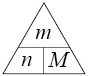
Воспользуемся волшебным треугольником:
Отсюда
масса вещества равна: ω · m(р-ра) = 0,1 ·
150 = 15 г.
2.
Пусть масса добавленного нитрата калия равна x г. Тогда
масса всей соли в конечном растворе будет равна (15 + x) г, масса раствора (150 + x),
а массовую долю нитрата калия в конечном растворе можно записать как:
ω(KNO3) = 100% – (15 + x)/(150 + x)
Далее,
по условию задачи известно, что конечный раствор должен иметь ω(KNO3) = 12%
100% – (15 + x)/(150 + x) = 12%
(15
+ x)/(150 + x) = 0,12
15
+ x = 18 + 0,12x
0,88x =
3
x = 3/0,88
= 3,4
Ответ: Для получения
12% раствора соли необходимо добавить 3,4 г
KNO3.

ЕГЭ. Химия. Универсальный справочник
Справочник содержит подробный теоретический материал по всем темам, проверяемым ЕГЭ по химии. После каждого раздела приводятся разноуровневые задания в форме ЕГЭ. Для итогового контроля знаний в конце справочника даются тренировочные варианты, соответствующие ЕГЭ. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данном справочнике они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену.
Справочник адресован учащимся старших классов для подготовки к ЕГЭ по химии.
Купить
Задание 28
В результате
реакции, термохимическое уравнение которой
2H2(г) + O2(г) = H2O (г) + 484 кДж,
выделилось
1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах).
Данная
задача может быть решена в одно действие.
Согласно
уравнению реакции, в результате ее образовалось 36 граммов воды и выделилось
484 кДж энергии. А 1454 кДж энергии выделится при образовании Х г.
воды.
| Х = |
36 г · 1452 кДж |
= 108 г |
|
484 кДж |
Ответ: При выделении
1452 кДж энергии образуется 108 г воды.
Задание 29
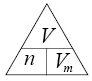
Вычислите
массу кислорода (в граммах), необходимого для полного
сжигания 6,72 л (н.у.) сероводорода.
Для
решения данной задачи напишем уравнение реакции горения сероводорода и рассчитаем
массы кислорода и сероводорода, вступивших в реакцию, по уравнению
реакции
| 2H2S | + | 3O2 | = 2SO2 + 2H2O |
|
Mr = 34 M = 34г/моль n = 2 моль m = 68 г |
Mr = 32 M = 32г/моль n = 3 моль m = 96 г |
1.
Определяем количество сероводорода, содержащегося в 6,72 л.
| n(H2S) = | V | = | 6,72 | = 0,3 моль |
| Vm | 22,4 |
2.
Определяем количество кислорода, которое прореагирует с 0,3 моль
сероводорода.
По
уравнению реакции, с 2 моль H2S реагирует 3 моль O2.
По
уравнению реакции, с 0,3 моль H2S прореагирует с Х моль О2.
Отсюда
Х = 0,45 моль.
3.
Определим массу 0,45 моль кислорода
m(O2) = n · M = 0,45 моль · 32 г/моль
= 14,4 г.
Ответ: масса кислорода
равна 14,4 грамма.
Задание 30
Из
предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит
натрия, сульфат бария, гидроксид калия) выберите вещества, между которыми
возможна окислительно-восстановительная реакция. в ответе запишите
уравнение только одной из возможных реакций. Составьте электронный баланс,
укажите окислитель и восстановитель.
Ответ: КMnO4 – известный окислитель,
окисляет вещества, содержащие элементы в низшей и промежуточной
степенях окисления. Его действия могут проходить в нейтральной, кислой
и щелочной средах. При этом марганец может восстанавливаться до различных
степеней окисления: в кислой среде – до Mn2+, в нейтральной
среде – до Mn4+, в щелочной среде – до Mn6+. В сульфите натрия содержится сера в степени окисления 4+, которая может
окислиться до 6+. И наконец, гидроксид калия определит реакцию среды. Пишем
уравнение данной реакции:
KMnO4 + Na2SO3
+ KOH = K2MnO4 + Na2SO4 + H2O
Далее
составляем схему окислительно-восстановительного процесса и расставляем
коэффициенты.
|
Mn7+ + 1e → = Mn6+ S4+ –2e → = S6+ |
2 1 |
После
расставления коэффициентов формула приобретает следующий вид:
2KMnO4 + Na2SO3
+ 2KOH = 2K2MnO4 + Na2SO4 + H2O
Следовательно,
KMnO4 – является окислителем,
а Na2SО3 –
восстановителем.

ЕГЭ. Химия
Все необходимые для сдачи ЕГЭ по химии сведения представлены в наглядных и доступных таблицах, после каждой темы – тренировочные задания для контроля знаний. С помощью этой книги учащиеся смогут в кратчайший срок повысить уровень своих знаний, за считанные дни до экзамена вспомнить все самые важные темы, потренироваться в выполнении заданий в формате ЕГЭ и стать более уверенным в своих силах. После повторения всех тем, представленных в пособии, долгожданные 100 баллов станут намного ближе!
Пособие содержит теоретические сведения по всем темам, проверяемым на ЕГЭ по химии. После каждого раздела приводятся тренировочные задания разных типов с ответами. Наглядное и доступное изложение материала позволит быстро найти нужную информацию, устранить пробелы в знаниях и в кратчайшие сроки повторить большой объем информации.
Купить
Задание 31
Из
предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит
натрия, сульфат бария, гидроксид калия) выберите вещества, между которыми
возможна реакция ионного обмена. В ответе запишите молекулярное, полное
и сокращенное ионное уравнение только одной из возможных реакций.
Ответ: Рассмотрим
реакцию обмена между гидрокарбонатом калия и гидроксидом калия
KHCO3 + KOH = K2CO3 + H2O
Если
в результате реакции в растворах электролитов образуется нерастворимое
или газообразное, или малодиссоциирующее вещество, то такая реакция
протекает необратимо. В соответствии с этим данная реакция возможна,
так как один из продуктов реакции (Н2О) – малодиссоциирующее
вещество. Запишем полное ионное уравнение.
Так
как вода – малодиссоциирующее вещество, она пишется в виде молекулы. Далее
составляем сокращенное ионное уравнение. Те ионы, которые перешли из левой
части уравнения в правое, не изменяя знака заряда, вычеркиваем.
Остальное переписываем в сокращенное ионное уравнение.
Это
уравнение и будет ответом на данное задание.
Задание 32
При
электролизе водного раствора нитрата меди(II)
получили металл. Металл обработали концентрированной серной кислотой при
нагревании. Выделяющийся в результате газ прореагировал с сероводородом
с образованием простого вещества. Это вещество нагрели с концентрированным
раствором гидроксида калия. Напишите уравнения четырех описанных реакций.
Ответ: Электролиз – это
окислительно-восстановительный процесс, проходящий на электродах при
пропускании постоянного электрического тока через раствор или расплав
электролита. В задании говорится об электролизе раствора нитрата меди. При
электролизе растворов солей вода также может принимать участие в электродных
процессах. При растворении соли в воде она распадается на ионы:
На катоде
происходят процессы восстановления. В зависимости от активности металла, могут
восстанавливаться металл, металл и вода. Так как медь в электрохимическом
ряду напряжений металлов стоит правее водорода, то на катоде будет
восстанавливаться медь:
Cu2+ + 2e = Cu0.
На аноде
будет происходить процесс окисления воды.
Медь
не реагирует с растворами серной и соляной кислот. Но
концентрированная серная кислота является сильным окислителем, поэтому может
реагировать с медью по следующему уравнению реакции:
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O.
Сероводород
(H2S) содержит серу
в степени окисления 2–, поэтому выступает в роли сильного восстановителя
и восстанавливает серу в оксиде серы IV
до
свободного состояния
2H2S + SO2 = 3S
+ 2H2O.
Образующееся
вещество, сера, взаимодействует с концентрированным раствором гидроксида
калия при нагревании с образованием двух солей: сульфида и сульфита
серы и воды.
S + KOH = K2S + K2SO3
+ H2O
Задание 33
Напишите
уравнения реакций, с помощью которых можно осуществить следующие
превращения:
При
написании уравнений реакций используйте структурные формулы органических
веществ.
Ответ: В данной цепочке предложено
выполнить 5 уравнений реакций, по числу стрелочек между веществами. В уравнении
реакции № 1 серная кислота играет роль водоотнимающей жидкости, поэтому в результате
ее должен получиться непредельный углеводород.
Следующая
реакция интересна тем, что протекает по правилу Марковникова. По этому правилу,
при соединении галогеноводородов к несимметрично построенным алкенам,
галоген присоединяется к менее гидрированному атому углерода при двойной
связи, а водород, наоборот.
В
следующем уравнении реакции, атом хлора замещается на группу –ОН
В
уравнении реакции № 4 в качестве продукта должен получиться пропен, исходя
из условия задания (в обоих случаях
в качестве продукта стоит Х1).
Условия реакции будут также одинаковыми.
В
последнем уравнении реакции предлагается окислить пропен перманганатом калия
в нейтральной среде при низкой температуре.

ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы.
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
Задание 34
При
нагревании образца карбоната кальция часть вещества разложилась. При этом
выделилось 4,48 л (н.у.) углекислого газа. Масса твердого остатка
составила 41,2 г. Этот остаток добавили к 465,5 г раствора
хлороводородной кислоты, взятой в избытке. Определите массовую долю соли
в полученном растворе.
В
ответе запишите уравнения реакций, которые указаны в условии задачи,
и приведите все необходимые вычисления (указывайте единицы измерения
искомых величин).
Ответ: Запишем краткое
условие данной задачи.
|
Дано: V(CO2) = 4,48 л m() = 41,2 г. m(HCl) = 465,5 г |
Решение: Напишем
|
|||||||||||||||
После
того как все приготовления приведены, приступаем к решению.
1)
Определяем количество СО2, содержащееся в 4,48 л. его.
n(CO2) = V/Vm = 4,48 л / 22,4 л/моль = 0,2 моль
2)
Определяем количество образовавшегося оксида кальция.
По
уравнению реакции образуется 1 моль СО2 и 1 моль СаО
Следовательно:
n(CO2) = n(CaO) и равняется
0,2 моль
3)
Определяем массу 0,2 моль СаО
m(CaO) = n(CaO) · M(CaO) = 0,2 моль · 56 г/моль = 11,2 г
Таким образом,
твердый остаток массой 41,2 г состоит из 11,2 г СаО и (41,2
г. – 11,2 г.) 30 г СаСО3
4)
Определим количество СаСО3, содержащееся в 30 г
n(CaCO3) = m(CaCO3) / M(CaCO3) = 30 г / 100 г/моль = 0,3 моль
Далее
пишем следующие два уравнения необходимые для решения данной.
Задачи:
CaO + HCl = CaCl2 + H2O
CaCO3 + HCl = CaCl2 + H2O + CO2
5) Определим количество хлорида кальция, образующееся в результате данных реакций.
В реакцию
вступило 0,3 моль CaCO3 и 0,2 моль
СаО всего 0,5 моль.
Соответственно,
образуется 0,5 моль CaCl2
6)
Рассчитаем массу 0,5 моль хлорида кальция
M(CaCl2) = n(CaCl2) · M(CaCl2) = 0,5 моль ·
111 г/моль = 55,5 г.
7)
Определяем массу углекислого газа. В реакции разложения участвовало 0,3 моль
карбоната кальция, следовательно:
n(CaCO3) = n(CO2) = 0,3 моль,
отсюда:
m(CO2) = n(CO2) · M(CO2) = 0,3 моль · 44г/моль = 13,2 г.

Находим массу раствора. Она состоит из массы соляной кислоты + масс твердого
остатка (CaCO3 + CaO) минут масса выделившегося CO2. Запишем это
в виде формулы:
m(р-ра)
= m(CaCO3 + CaO) + m(HCl) – m(CO2) = 465,5 г + 41,2 г – 13,2 г = 493,5 г.
9)
И наконец, ответим на вопрос задачи. Найдем массовую долю в % соли в растворе,
воспользовавшись следующим волшебным треугольником:
ω%(CaCI2)
= m(CaCI2)
/ m(р-ра) = 55,5 г / 493,5 г = 0,112 или 11,2%
Ответ: ω % (СaCI2) = 11.2%
Задание 35
Органическое
вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода
по массе и образуется при взаимодействии органического вещества Б с пропанолом-2.
Известно, что вещество Б имеет природное происхождение и способно
взаимодействовать как с кислотами, так и со щелочами.
На
основании данных условия выполните задания:
1)
Проведите необходимые вычисления (указывайте единицы измерения искомых
физических величин) и установите молекулярную формулу исходного
органического вещества;
2)
Составьте структурную формулу этого вещества, которая однозначно покажет
порядок связи атомов в его молекуле;
3)
Напишите уравнение реакции получения вещества А из вещества Б и пропанола-2
(используйте структурные формулы органических веществ).
Ответ: Давайте
постараемся разобраться с данной задачей. Напишем краткое условие:
|
Дано: ω(N) = 11,97% ω(H) = 9,40% ω(O) = 27,35% |
Решение: 1) |
ω(C) = 100% – 11,97% – 9,40% – 27,35% = 51,28% (ω(C) = 51,28%)
2)
Зная массовые доли всех элементов, входящих в состав молекулы, можем определить
ее молекулярную формулу.
Примем
массу вещества А за 100 г. Тогда в массы всех элементов, входящих
в его состав, будут равны: m(C) = 51,28 г;
m(N) = 11,97 г; m(H) = 9,40 г; m(O) = 27,35 г. Определим количество
каждого элемента:
n(C) = m(C) · M(C) = 51,28 г / 12 г/моль = 4,27 моль
n(N) = m(N) · M(N) = 11,97 г / 14 г/моль = 0,855 моль
n(H) = m(H) · M(H) = 9,40 г / 1 г/моль = 9,40 моль
n(O) = m(O) · M(O) = 27,35 г / 16
г/моль = 1,71 моль
Далее
разделим все эти цифры на наименьшее число (0,855), чтобы получить целочисленные
значения количества атомов; получим;
x
: y : z : m = 5 : 1 : 11 : 2.
Таким
образом молекулярная формула вещества А равна: C5H11O2N.
3)
Попробуем составить структурную формулу вещества А. Мы уже знаем, что углерод
в органической химии всегда четырехвалентен, водород – одновалентен,
кислород двухвалентен и азот трехвалентен. В условии задачи также
сказано, что вещество Б способно взаимодействовать как с кислотами, так
и со щелочами, то есть оно амфотерно. Из природных амфотерных веществ
нам известно, что аминокислоты обладают выраженной амфотерностью. Следовательно
можно предположить, что вещество Б относится к аминокислотам. Ну
и конечно, берем во внимание, что оно получается при взаимодействии
с пропанолом-2. Посчитав количество атомов углерода в пропаноле-2,
можно сделать смелый вывод, что вещество Б – аминоуксусная кислота. После
некоторого количества попыток, получилась следующая формула:
4) В заключение напишем уравнение реакции взаимодействия аминоуксусной кислоты
с пропанолом-2.

ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Купить
- 21.08.2017
Демоверсия по химии ЕГЭ 2018 от 21 августа 2017 года с кодификатором и спецификацией от ФИПИ.
- Видеоурок — решение всех заданий демоверсии ЕГЭ 2018 по химии
Изменения по химии в 2018 году:
Добавлено одно задание (№30) высокого уровня с развернутым ответом. За счет изменения балльности заданий части 1 максимальный первичный балл за выполнение всей работы остался без изменений (60).
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
На сайте fipi.ru опубликованы проекты демонстрационных вариантов ЕГЭ-2018, спецификации и кодификаторы. Скачать демонстрационные версии ЕГЭ по химии, физике, математике и другим предметам бесплатно можно по ссылке:
http://www.fipi.ru/ege-i-gve-11/demoversii-specifikacii-kodifikatory
В проекте профильного демонстрационного варианта по математике в 2018 году никаких изменений пока нет. Это не может не радовать.
В демонстрационном варианте ЕГЭ по химии-2018 есть небольшие изменения. В блоке сложных задач с развернутым ответом задание на составление уравнения окислительно-восстановительной реакции заменили на 2 новых задания плюс изменился порыдок нумерации заданий (ну да это технические мелочи).
Задание номер 30 раньше выглядело примерно так:
В общем-то, задание было довольно стандартным, и не менялось уже много лет. Для ешения этого задания требовались навыки составления ОВР, понимание взаимосвязи разных классов неорганических веществ, и умение считать.
Однако есть все шансы, что в этом году задание разобьют на два новых. Первое задание осталось под номером 30. Теперь оно выглядит примерно так:
То есть составить реакцию нужно, выбрав вещества самостоятельно из списка. Необходимо еще и выбрать среду самостоятельно. А это предполагает более глубокое понимание окислительно-восстановительных реакций, умение определять вещества-окислители и восстановители без уравнения реакции. А это навык, который у большинства школьников, по моим наблюдениям, очень хромает. Тем не менее, специальные тренажеры позволяют освоить этот навык без труда. Еще один минус нового формата — неоднзначность выбора. Даже в приведённом списке веществ можно выбрать несколько вариантов для составления ОВР, например: сульфит с перманганатом в щелочной среде или в нейтральной среде. Как будут учитывать эти варианты организаторы, станет понятно в течение года. Скорее всего, будут засчитывать любой верный вариант ответа.
И новое задание 31, на тему «Ионные уравнения химических реакций«:
Требуется выбрать из приведённого списка вещества, которые вступают в реакцию ионного обмена, и составить уравнение реакции, полное ионное и сокращённое ионное уравнения. В этом задании большинство школьников также испытывают трудности. Например, расписывают распад на ионы слабых элеткролитов, таких как сероводород H2S или плавиковая кислота HF, хотя эти вещества — слабые электролиты, а слабые электролиты практически не распадаются на ионы, поэтому в ионных уравнениях записываются в виде молекул.
Подготовку к ЕГЭ 2018 по химии для выпускников 11 классов целесообразно начинать с ознакомления с демоверсиями КИМ, опубликованными на официальном сайте ФИПИ. Так же открытый банк заданий ФИПИ содержит примеры реальных вариантов, включаемых в тесты для экзаменов.
Демоверсия ЕГЭ по химии ФИПИ 2018 год задания с ответами
Всего заданий – 35
Максимальный первичный балл за работу – 60.
Общее время выполнения работы – 210 мин.
Система оценивания выполнения отдельных заданий и экзаменационной работы ЕГЭ 2018 по химии в целом
Ответы на задания части 1 автоматически обрабатываются после сканирования бланков ответов № 1.
Ответы к заданиям части 2 проверяются предметной комиссией. За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности. Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ в заданиях 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка, – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Задания части 2 (с развёрнутым ответом) предусматривают проверку от двух до пяти элементов ответа.
Задания с развёрнутым ответом могут быть выполнены выпускниками различными способами. Наличие каждого требуемого элемента ответа оценивается 1 баллом, поэтому максимальная оценка верно выполненного задания составляет от 2 до 5 баллов в зависимости от степени сложности задания: задания 30 и 31 – 2 балла; 32 – 4 балла; 33 – 5 баллов; 34 – 4 балла; 35 – 3 балла.
Проверка заданий части 2 осуществляется на основе поэлементного анализа ответа выпускника в соответствии с критериями оценивания задания.
Смотрите также:
Спецификация
контрольных измерительных материалов
для проведения в 2018 году единого государственного экзамена
по ХИМИИ
1. Назначение КИМ ЕГЭ
Единый государственный экзамен (далее — ЕГЭ) представляет собой форму объективной оценки качества подготовки лиц, освоивших образовательные программы среднего общего образования, с использованием заданий стандартизированной формы (контрольных измерительных материалов).
ЕГЭ проводится в соответствии с Федеральным законом от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации».
Контрольные измерительные материалы позволяют установить уровень освоения выпускниками Федерального компонента государственного стандарта среднего (полного) общего образования по химии, базовый и профильный уровни.
Результаты единого государственного экзамена по химии признаются образовательными организациями среднего профессионального образования и образовательными организациями высшего профессионального образования как результаты вступительных испытаний по химии.
2. Документы, определяющие содержание КИМ ЕГЭ
Содержание КИМ ЕГЭ определяется Федеральным компонентом государственного стандарта среднего (полного) общего образования по химии (приказ Минобразования России от 05.03.2004 № 1089).
3. Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Основу подходов к разработке КИМ ЕГЭ 2018 г. по химии составили те общие методические установки, которые были определены в ходе формирования экзаменационных моделей предыдущих лет. Суть данных установок заключается в следующем.
- КИМ ориентированы на проверку усвоения системы знаний, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для общеобразовательных организаций. В стандарте эта система знаний представлена в виде требований к подготовке выпускников. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
- В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трех уровнях сложности: базовом, повышенном и высоком. Учебный материал, на основе которого строятся задания, отбирается по признаку его значимости для общеобразовательной подготовки выпускников средней школы.
- Выполнение заданий экзаменационной работы предусматривает осуществление определенной совокупности действий. Среди них наиболее показательными являются, к примеру, такие, как: выявлять классификационные признаки веществ и реакций; определять степень окисления химических элементов по формулам их соединений; объяснять сущность того или иного процесса, взаимосвязи состава, строения и свойств веществ. Умение экзаменуемого осуществлять разнообразные действия при выполнении работы рассматривается в качестве показателя усвоения изученного материала с необходимой глубиной понимания.
- Равноценность всех вариантов экзаменационной работы обеспечивается соблюдением одинакового соотношения количества заданий, проверяющих усвоение основных элементов содержания ключевых разделов курса химии.
4. Структура КИМ ЕГЭ
Каждый вариант экзаменационной работы построен по единому плану: работа состоит из двух частей, включающих в себя 40 заданий. Часть 1 содержит 35 заданий с кратким ответом, в их числе 26 заданий базового уровня сложности (порядковые номера этих заданий: 1, 2, 3, 4, …26) и 9 заданий повышенного уровня сложности (порядковые номера этих заданий: 27, 28, 29, …35).
Часть 2 содержит 5 заданий высокого уровня сложности, с развернутым ответом (порядковые номера этих заданий: 36, 37, 38, 39, 40).
……………………….