Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) пропанон и пропанол-2
Б) анилин и триэтиламин
В) пентин-2 и этилацетат
Г) бензол и гексен-2
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Установим соответствие.
А) Пропанон и пропанол-2 можно различить с помощью калия (спирт реагирует, а кетон — нет) (4).
Б) Анилин и триэтиламин можно различить с помощью бромной воды (в бензольном кольце анилина произойдет замещение атомов водорода на атомы брома, а триэтиламин не будет реагировать) (3).
В) Пентин-2 и этилацетат можно различить с помощью бромной воды (сложные эфиры не реагируют с ней, а алкины присоединяют бром по месту тройной связи) (3).
Г) Бензол и гексен-2 можно различить с помощью бромной воды (бензол не реагирует с ней, а алкены обесцвечивают бромную воду, присоединяя бром по месту двойной связи) (3).
Ответ: 4333.
Источник: Демонстрационная версия ЕГЭ—2014 по химии
Спрятать решение
·
·
Гость 13.12.2013 23:45
пентин-2 образует осадок с аммиачным раствором оксида серебра. а этилацетат-нет
Александр Иванов
Нет, пентин-2 не реагирует с аммиачным раствором оксида серебра. Вы путаете его с пентином-1
Anna Lebedeva 08.03.2014 01:29
Здравствуйте,мне на пробном ЕГЭ в В6 в оной из части было взаимодействие Fe(OH)3 и уксусной кислоты.Нужно было выбрать,что же происходит в процессе реакции: растворяется осадок или образуется раствор красного цвета??Помогите ,пожалуйста..все сайте пересмотрела и не могу определиться…
Гость 30.03.2014 21:13
Бензол реагирует с бромом, но используется катализатор FeBr3. Об этом даже в позорной википедии написано
Александр Иванов
Бензол реагирует с БРОМОМ (в присутствии катализатора), но бензол не реагирует с БРОМНОЙ ВОДОЙ.
Используйте менее «позорные» источники.
Хотя даже в позорной Википедии указывается, что для реакции бром должен быть чистым (а не водным)
Задания
Версия для печати и копирования в MS Word
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
CuO + NH4Cl → Cu + N2 + HCl + H2O
Определите окислитель и восстановитель.
Решение.
Это задание ещё не решено, приводим решение прототипа.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель.
1. Составим электронный баланс:
2. Определены коэффициенты, и составлено уравнение реакции:
3. Указаны окислитель и восстановитель:
окислитель — восстановитель —
Ответ: окислитель — восстановитель —
.
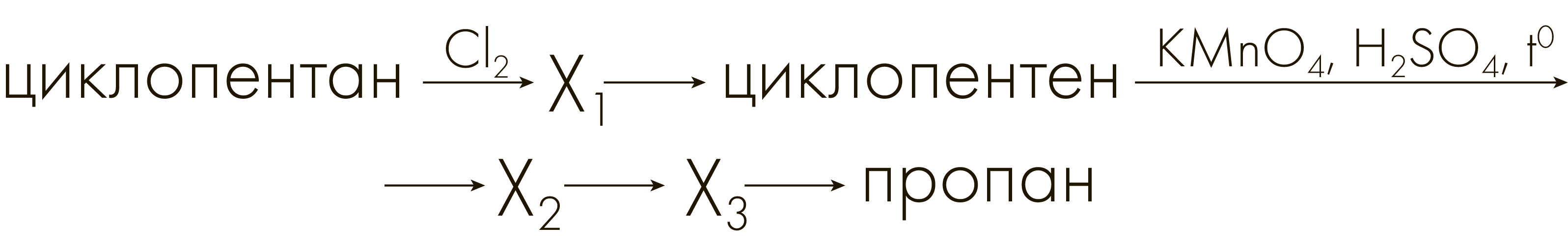
Задание №3301
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

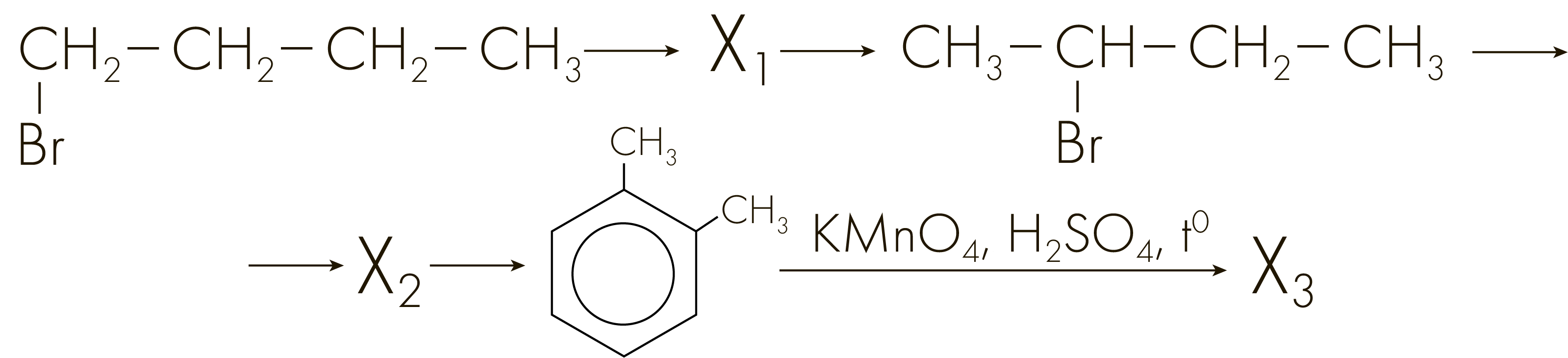
Задание №3302
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

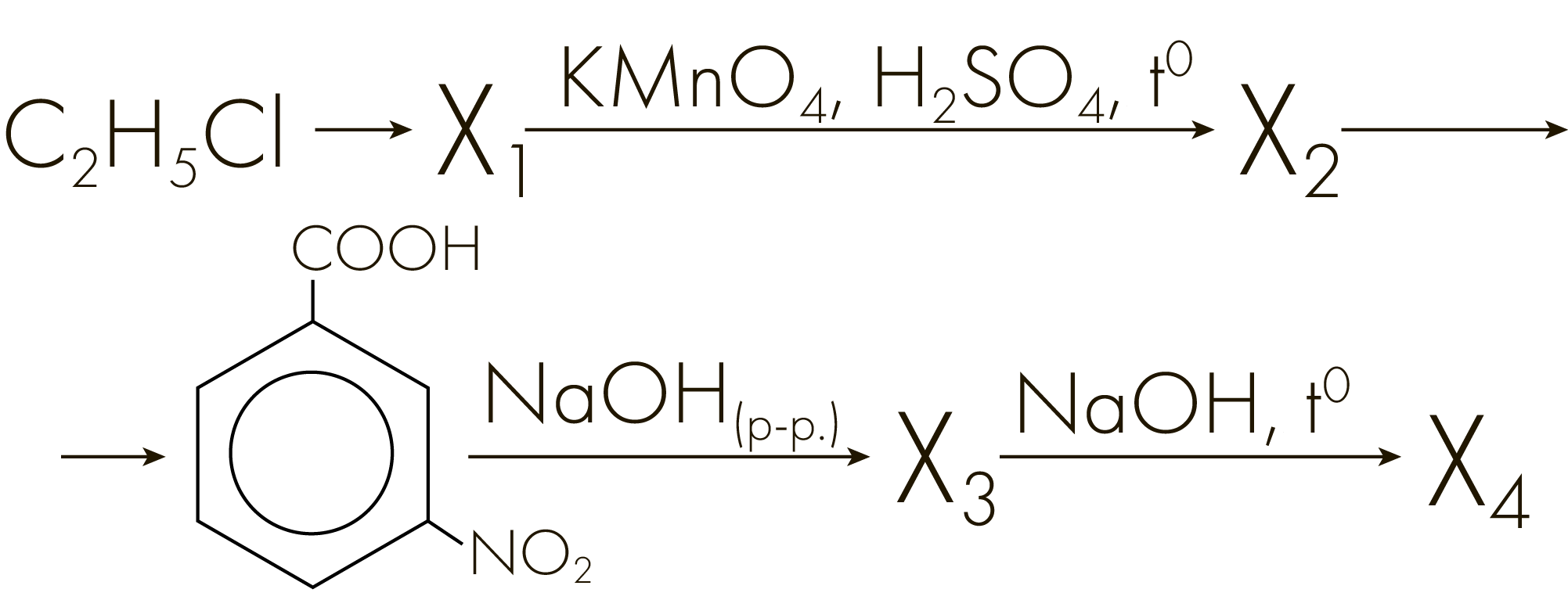
Задание №3303
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

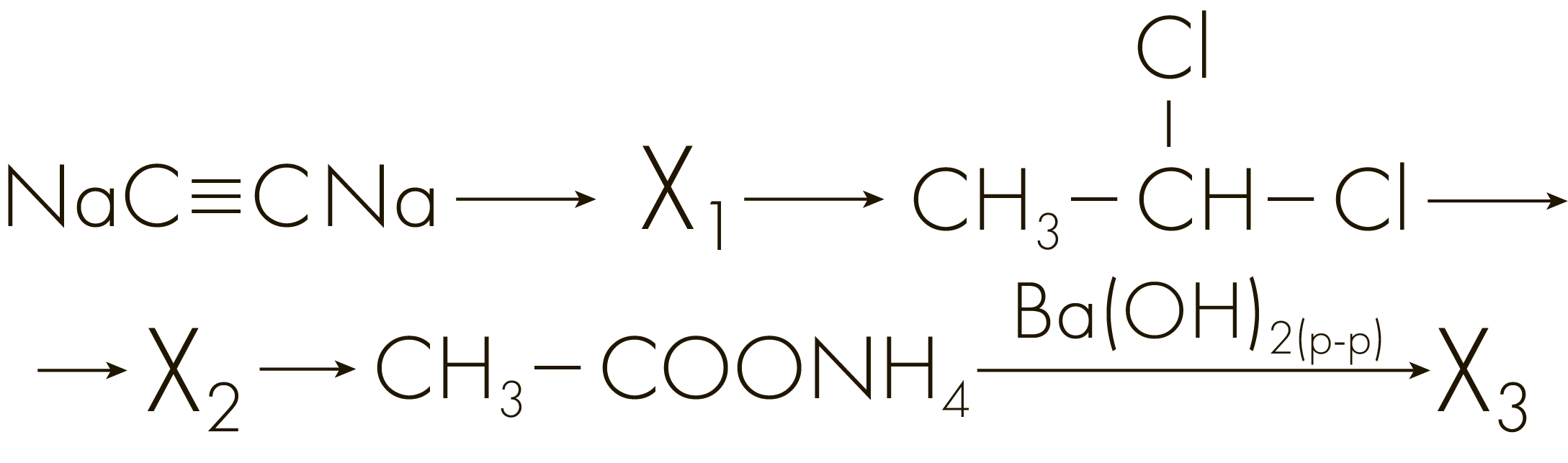
Задание №3304
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

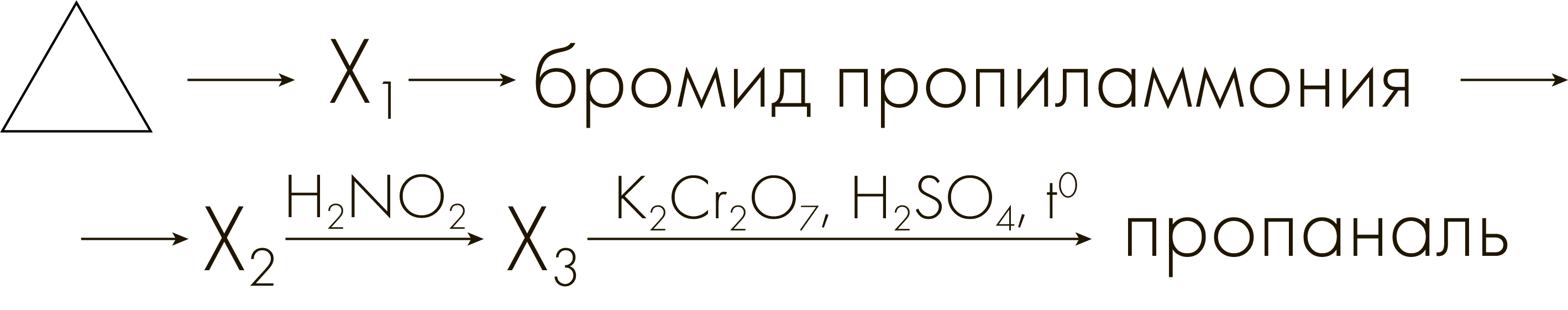
Задание №3305
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

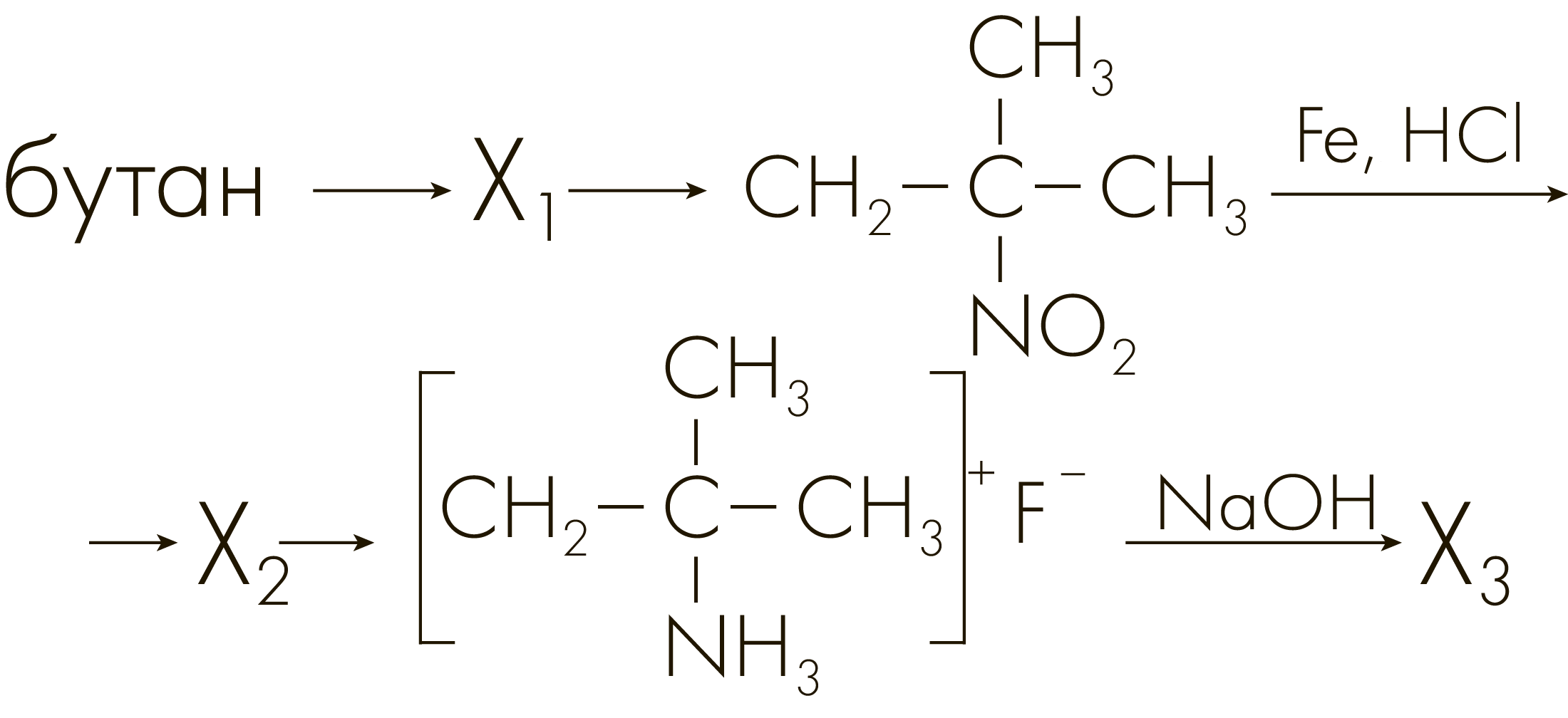
Задание №3306
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

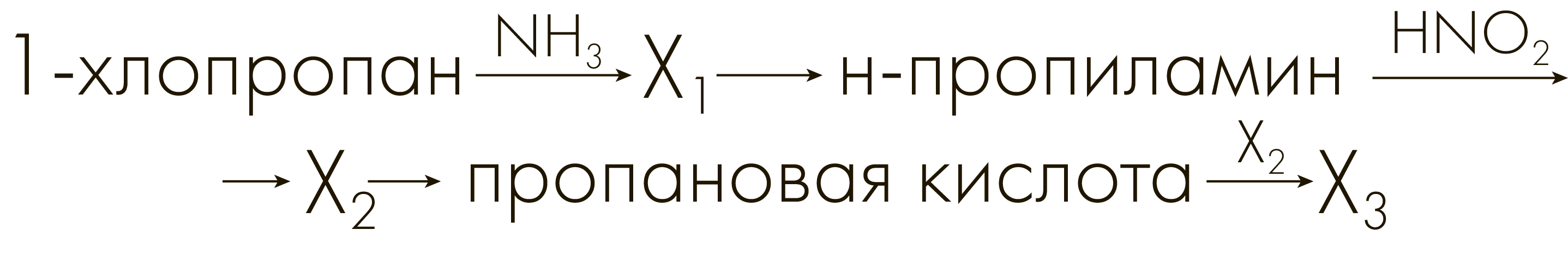
Задание №3307
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

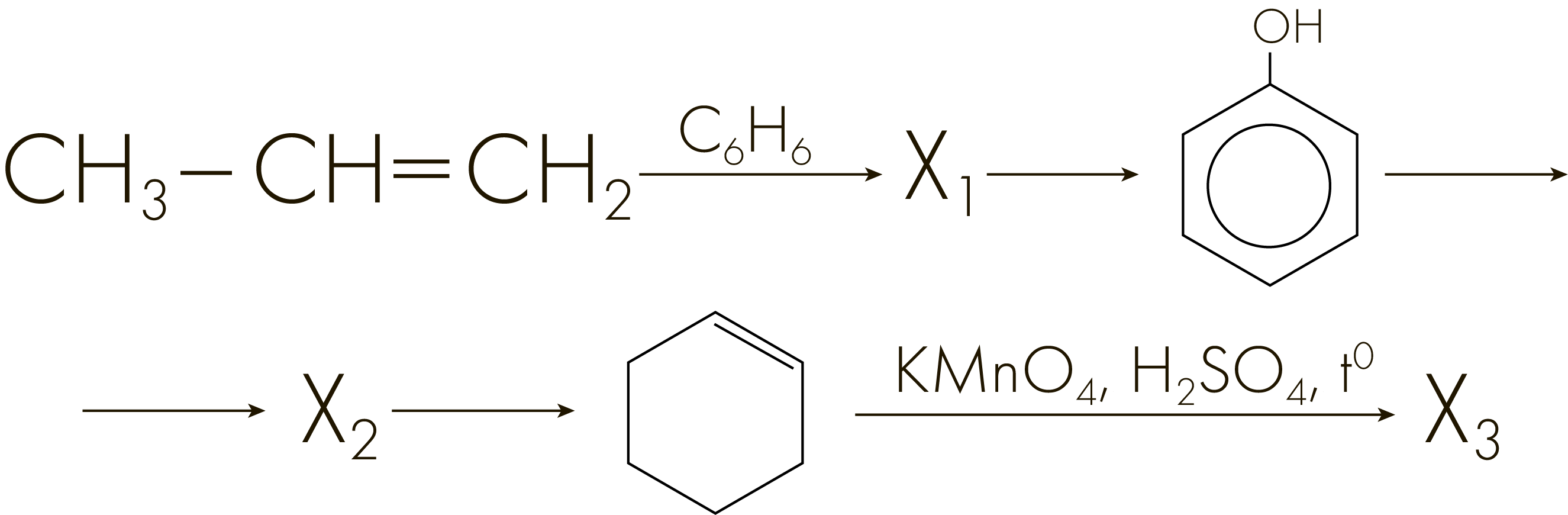
Задание №3308
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

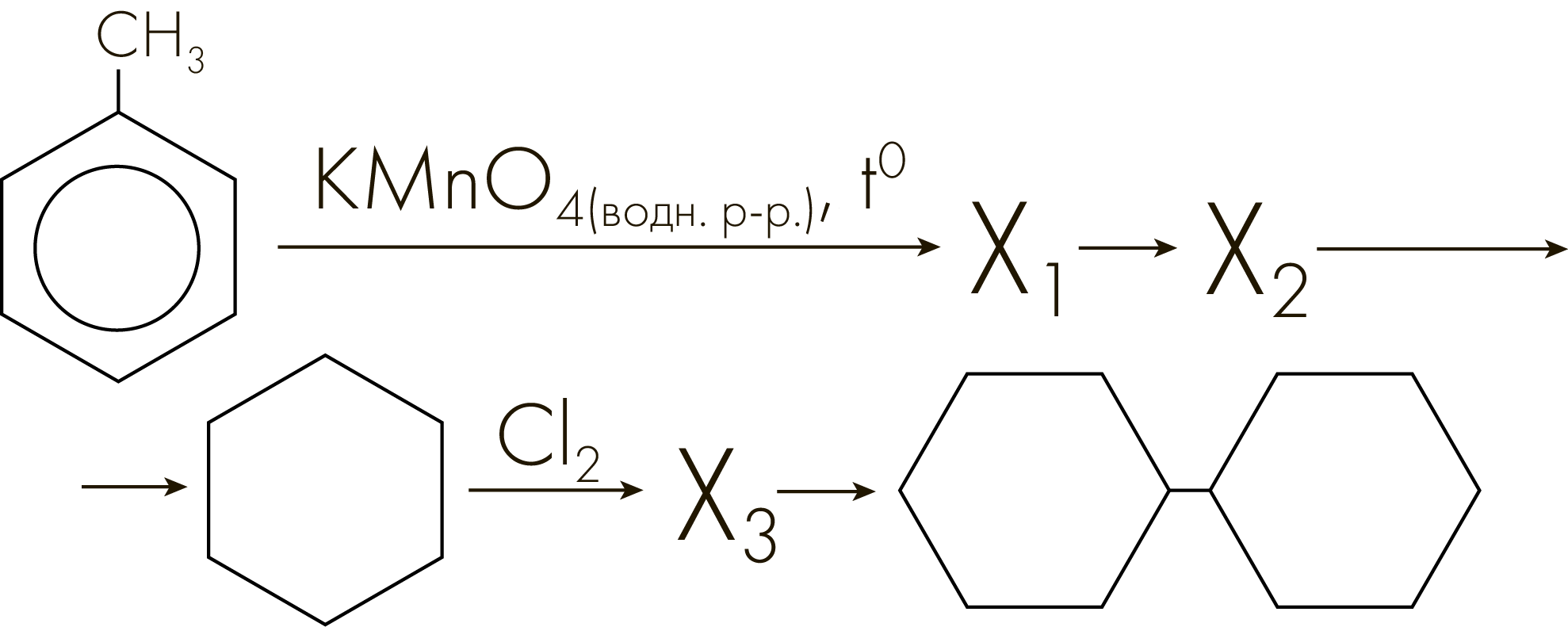
Задание №3309
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

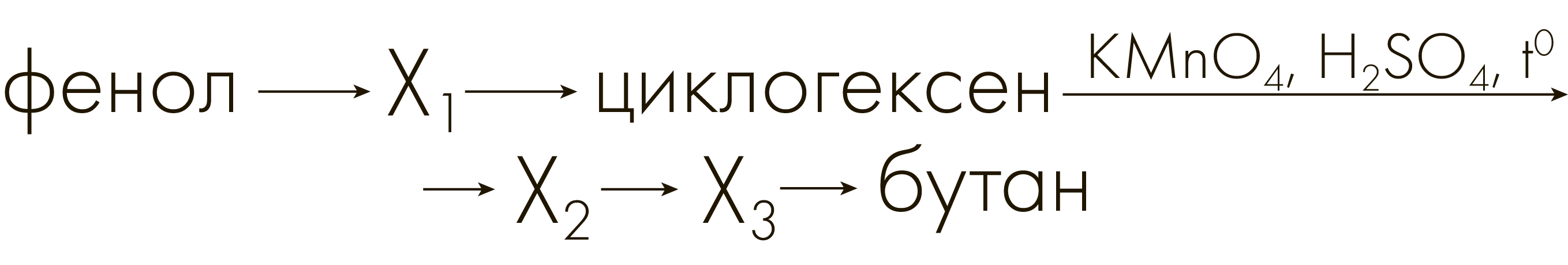
Задание №3310
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

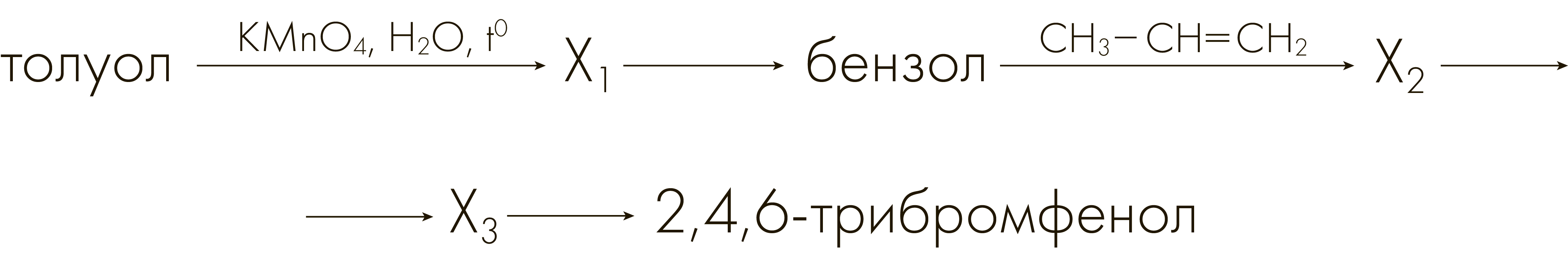
Задание №3311
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

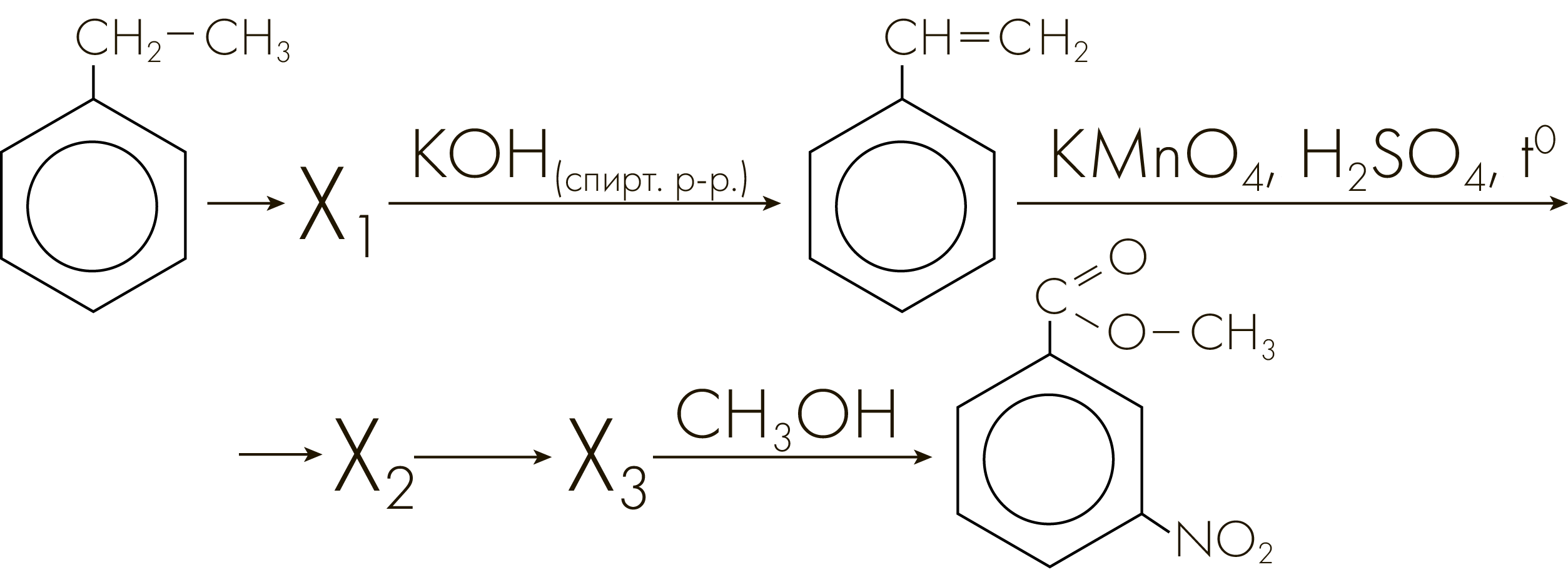
Задание №3312
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

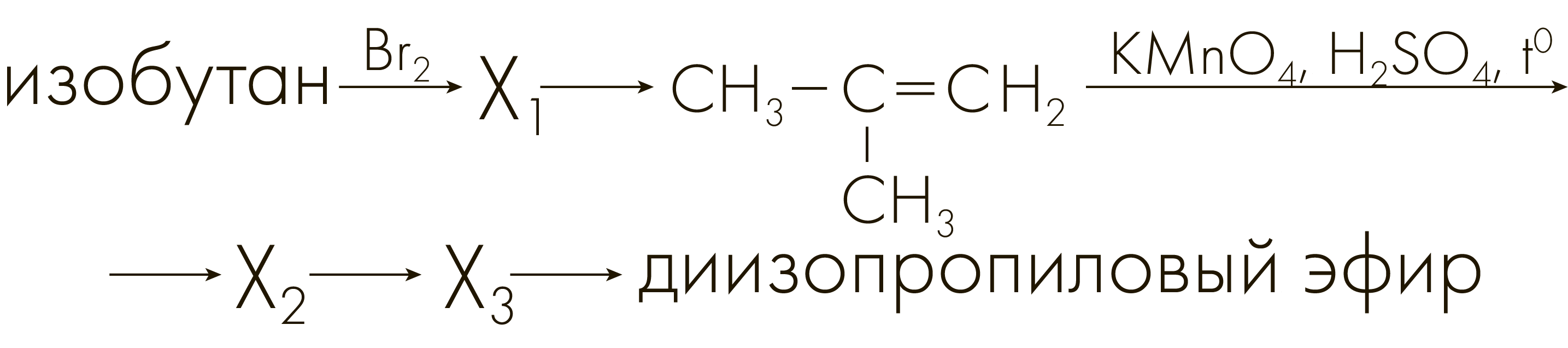
Задание №3313
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

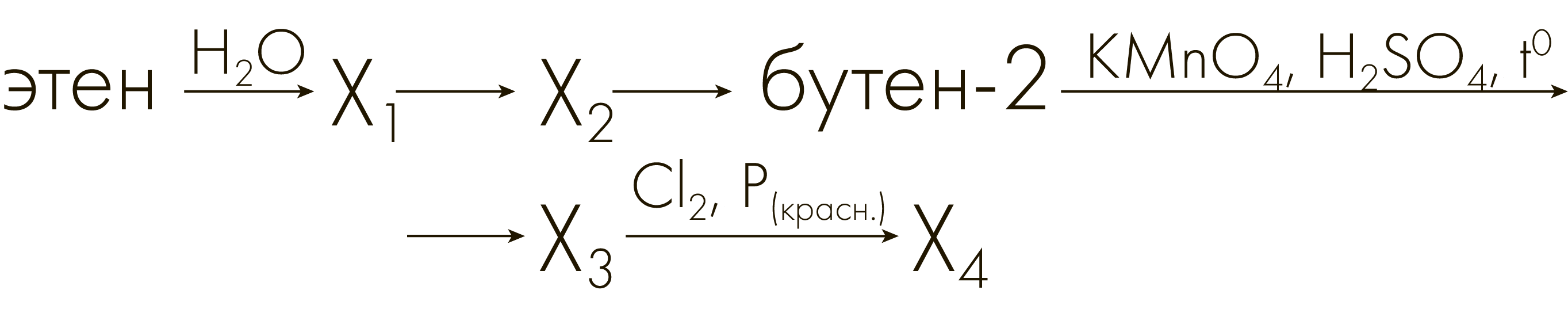
Задание №3314
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

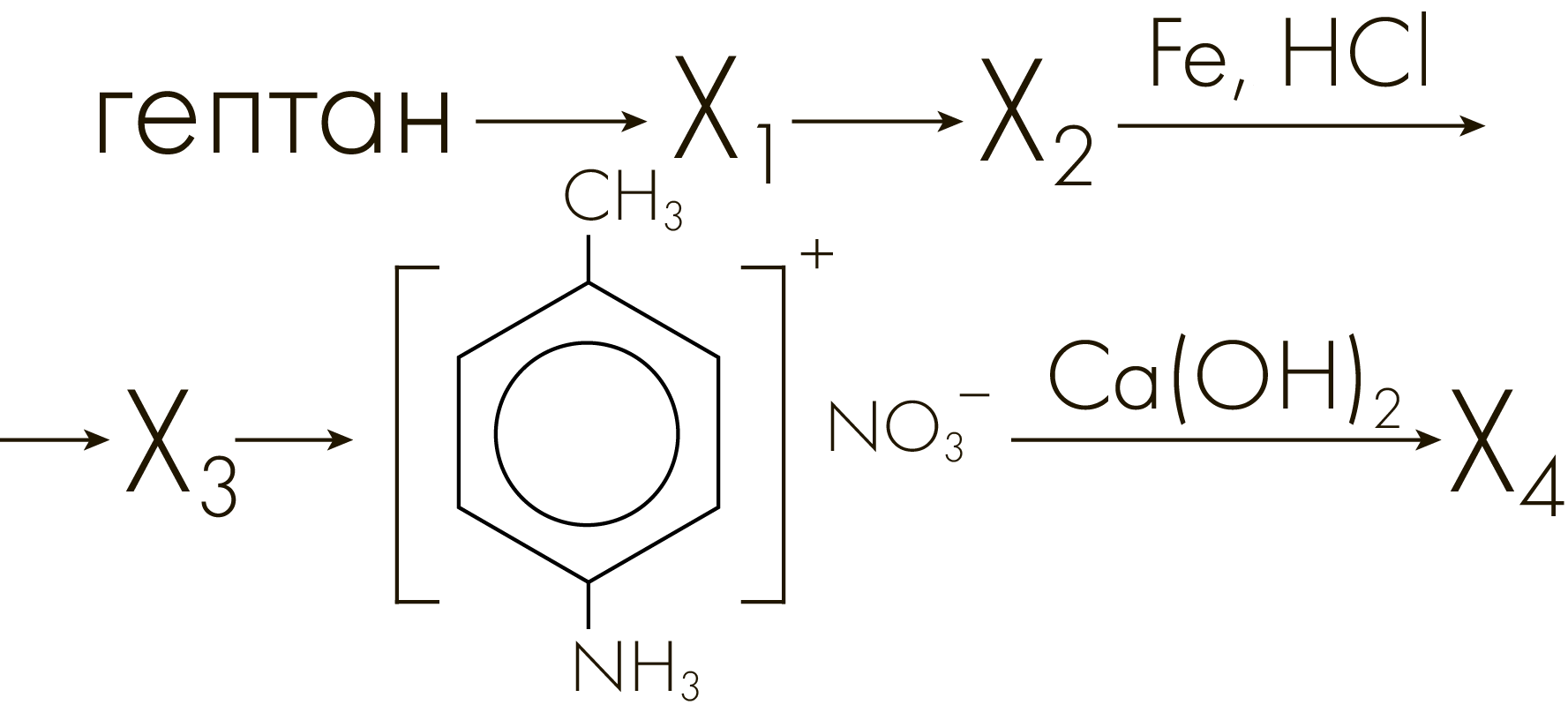
Задание №3315
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.

Задачи
на определение формулы по теме «Кислородсодержащие органические вещества»
1. Задание 35 № 4510
При сгорании
11,6 г органического вещества образуется 13,44 л углекислого газа
и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество взаимодействует с аммиачным раствором
оксида серебра, каталитически восстанавливается водородом с образованием
первичного спирта и способно окисляться подкисленным раствором перманганата
калия до карбо-новой кислоты. На основании этих данных:
1) установите
простейшую формулу исходного вещества,
2) составьте
его структурную формулу,
3) приведите
уравнение реакции его взаимодействия с водородом.
Пояснение.
1) Простейшая
формула: .
2) Структурная
формула:
3) Уравнение
реакции: .
2. Задание 35 № 4511
При сгорании
5,8 г органического вещества образуется 6,72 л углекислого газа
и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором
оксида серебра, но каталитически восстанавливается водородом с
образованием вторичного спирта и способно окисляться подкисленным
раствором перманганата калия до карбоновой кислоты и углекислого
газа. На основании этих данных:
1) установите
простейшую формулу исходного вещества,
2) составьте
его структурную формулу,
3) приведите
уравнение реакции его взаимодействия с водородом.
Пояснение.
1) Простейшая
формула: .
2) Структурная
формула:
3) Уравнение
реакции: .
Некоторое
органическое вещество, взаимодействуя с гидроксидом калия, образует
продукт, содержащий 28,57 % кислорода. Известно, что это вещество
может реагировать с метанолом и оксидом кальция, а также окрашивает
лакмус в красный цвет. На основании этих данных:
1) установите
простейшую молекулярную формулу исходного вещества,
2) составьте
его структурную формулу,
3) приведите
уравнение реакции его взаимодействия с метанолом.
Пояснение.
В красный
цвет лакмус окрашивают кислоты, что так же подтверждается тем, что вещество
вступает в реакцию со спиртом и оксидом кальция.
г/моль
1) простейшая
формула:
2) структурная
формула:
3) уравнение
реакции: .
3. Задание 35 № 4516
Некоторое
органическое вещество, взаимодействуя с гидроксидом натрия, образует
продукт, содержащий 33,82 % металла (по массе). Известно, что это вещество
может реагировать с этанолом и оксидом магния, а также окрашивает метилоранж
в розовый цвет. На основании этих данных:
1)
предложите молекулярную формулу исходного вещества,
2) составьте
его структурную формулу,
3) приведите
уравнение реакции его взаимодействия с оксидом магния.
Пояснение.
На
основании химических свойств исходного вещества предположим, что исходное вещество —
одноосновная карбоновая кислота. При взаимодействии с гидроксидом натрия
получится соль ,
содержащая 33,82 % металла. Тогда
Единственными
значениями соответствующими этой молярной массе являются и
.
Значит,
формула соли ,
а формула кислоты .
1)
Молекулярная формула: .
2) Структурная
формула:
3) Уравнение
реакции: .
Примечание: все
вычисления проделаны, исходя из предположения, что 1 моль соли содержит 1 моль
ионов натрия. Если допустить, что в состав соли входит большее число ионов
натрия, то расчеты покажут невозможность такой ситуации.
4. Задание 35 № 4517
Некоторое
органическое соединение массой 5,8 г, взаимодействуя с гидроксидом
меди (II), при нагревании образовало 14,4 г осадка оксида
меди (I). Указанное органическое соединение вступает в реакции
присоединения гидросульфита натрия и этанола. На основании этих
данных:
1) установите
простейшую молекулярную формулу соединения,
2) составьте
его структурную формулу,
3) приведите
уравнение реакции его взаимодействия с гидроксидом меди (II).
Пояснение.
Решение, которое предложили
авторы задачи:
1)
Вещество, взаимодействующее с гидроксидом меди (II) с образованием дающее
продукт присоединения с присоединяющее
этанол, относится, наиболее вероятно, к классу альдегидов. Общая формула
альдегидов что
позволяет записать уравнение реакции в общем виде:
Из уравнения
реакции видно, что что
позволяет составить уравнение:
Откуда молярная
масса альдегида M = 58 г/моль.
Решая уравнение
для молярной массы:
получаем n = 3.
Простейшая
формула Это
пропионовый альдегид.
2) Структурная
формула пропионового альдегида:
3) Взаимодействие
альдегида с гидроксидом меди (II) приводит к образованию пропионовой
кислоты, оксида меди (I) и воды:
.
5. Задание 35 № 7438
При
сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г
воды. Указанное вещество жидкое при н. у., реагирует с металлическим
натрием и масляной кислотой. На основании этих данных:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу исходного органического вещества;
3)
составьте структурную формулу этого вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4)
приведите уравнение реакции его взаимодействия с масляной кислотой.
Пояснение.
2)
Молекулярная формула: .
3)
Структурная формула: .
4)
Уравнение реакции: →
6. Задание 35 № 4639
При полном
сгорании органического вещества массой 18,0 г образовалось 20,16 л
(при н. у.) углекислого газа и 21,6 г воды. Установлено, что вещество
реагирует с натрием, а при взаимодействии с подкисленным раствором перманганата
калия превращается в кислоту. Установите молекулярную формулу
вещества, изобразите его структурную формулу и напишите уравнение реакции
с перманганатом калия и серной кислотой.
Пояснение.
1) Определены
количества элементов в сжигаемом веществе:
2) Определена
молекулярная формула вещества:
Брутто-формула: она
совпадает с молекулярной, так как количество атомов водорода соответствует
насыщенному соединению.
(Принимается
также любой другой правильный способ определения брутто- и молекулярной
формулы по продуктам сгорания.)
3) Изображена
структурная формула.
Вещество
относится к гомологическому ряду и
реагирует с натрием, следовательно это – одноатомный спирт. Он окисляется
в кислоту, следовательно это – первичный спирт, пропанол-1:
4) Написано
уравнение реакции пропанола-1 с перманганатом калия и серной кислотой:
7. Задание 35 № 6410
При взаимодействии
18,5 г жидкого органического вещества c избытком щелочного металла
выделилось 2,8 л газа (н. у.). Известно, что вещество может реагировать
с хлороводородом, а при взаимодействии с подкислённым раствором перманганата
калия превращается в кетон. Установите молекулярную формулу вещества,
изобразите его структурную формулу и напишите уравнение внутримолекулярной
дегидратации под действием серной кислоты.
Пояснение.
1) Написано
уравнение реакции в общем виде и вычислено количество вещества
водорода.
Указанные
в условии химические свойства характерны для спиртов.
Предположим,
спирт – одноатомный, обозначим его .
2) Установим
молекулярную формулу спирта:
Молекулярная
формула спирта — ,
или
3) Изобразим
структурную формулу.
Спирт окисляется
перманганатом калия до кетона, следовательно он — вторичный, бутанол-2:
4) Напишем
уравнение внутримолекулярной дегидратации бутанола-2:
8. Задание 35 № 4386
При сжигании
образца некоторого органического соединения массой 29,6 г получено
70,4 г углекислого газа и 36,0 г воды. Известно, что относительная
плотность паров этого вещества по воздуху равна 2,552. В ходе исследования
химических свойств этого вещества установлено, что при взаимодействии
этого вещества с оксидом меди (II) образуется кетон.
На основании
данных условия задания:
1) произведите
вычисления, необходимые для установления молекулярной
формулы органического
вещества;
2) запишите
молекулярную формулу исходного органического вещества;
3) составьте
структурную формулу этого вещества, которая однозначно
отражает порядок связи атомов
в его молекуле;
4) напишите
уравнение реакции этого вещества с оксидом меди (II).
Пояснение.
1) Найдено
количество вещества продуктов сгорания:
Общая формула
вещества
2) Определена
молекулярная формула вещества:
г/моль;
вычисленная формула
г/моль;
Молекулярная
формула исходного вещества
3) Составлена
структурная формула вещества:
Так как
при взаимодействии с оксидом меди (II) образуется кетон, то исходное вещество
вторичный спирт
4) Записано
уравнение реакции вещества с оксидом меди (II):
9. Задание 35 № 4426
При сгорании
2,3 г органического вещества образуется 4,4 г углекислого газа и
2,7 г воды. Указанное вещество газообразно при н. у., не реагирует
с металлическим натрием и может быть получено дегидратацией
спирта.
На основании
данных условия задания:
1) произведите
вычисления, необходимые для установления молекулярной формулы органического
вещества;
2) запишите
молекулярную формулу исходного органического вещества;
3) составьте
структурную формулу этого вещества, которая однозначно отражает порядок
связи атомов в его молекуле;
4) напишите
уравнение реакции получения этого вещества дегидратацией спирта.
Пояснение.
1) Найдено
количество вещества продуктов сгорания:
2)
Установлена молекулярная формула вещества:
простейшая
формула .
Простейшая
формула является и молекулярной, так как в ней достигнуто максимальное
возможное соотношение атомов водорода и углерода ().
Вещества уже
быть не может.
Молекулярная
формула: .
3)
Приведена структурная формула вещества:
Найденной
молекулярной формуле соответствуют два вещества: этиловый спирт и диметиловый
эфир. По условию исходное вещество газообразно при н.у. и не реагирует с
металлическим натрием. Значит, речь идёт о диметиловом эфире.
Структурная
формула: .
4)
Составлено уравнение реакции дегидратации:
10. Задание 35 № 4466
При полном
сгорании органического вещества массой 25,9 г образовалось 23,52
л (при н. у.) углекислого газа и 18,9 г воды. Относительная плотность
паров этого вещества по водороду равна 37. Установлено, что оно не реагирует
с гидрокарбонатом натрия, но взаимодействует со щелочами и даёт реакцию
«серебряного зеркала». Установите молекулярную формулу вещества, изобразите
его структурную формулу и напишите уравнение реакции с гидроксидом
калия.
Пояснение.
1) Определены
количества элементов в сжигаемом веществе.
2) Определена
молекулярная формула вещества.
Простейшая
формула: (M
= 74 г/моль).
Молярная
масса вещества: M = 37 · 2 = 74 г/моль. Молекулярная формула
совпадает с простейшей формулой,
(Принимается
также любой другой правильный способ определения молекулярной формулы по
продуктам сгорания)
3) Изображена
структурная формула.
Вещество
относится к гомологическому ряду и
реагирует со щелочью, следовательно, это карбоновая кислота или сложный
эфир.
С гидрокарбонатом
не реагирует, значит — не кислота, а сложный эфир, метилацетат или
этилформиат. Реакция «серебряного зеркала» свидетельствует о том, что искомое
вещество – сложный эфир муравьиной кислоты, этилформиат:
4) Написано
уравнение реакции этилформиата с гидроксидом калия.
11. Задание 35 № 6313
При сгорании
18,8 г органического вещества получили 26,88 л (н. у.) углекислого
газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом
натрия, так и с бромной водой.
На основании
данных условия задачи:
1) произведите
вычисления, необходимые для установления молекулярной формулы органического
вещества;
2) запишите
молекулярную формулу органического вещества;
3) составте
структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции данного вещества с бромной водой.
Пояснение.
Общая формула
вещества — СxHyOz
1) Найдем
количество вещества углекислого газа и воды:
2) Определим
молекулярную формулу вещества:
x : y : z =
1,2 : 1,2 : 0,2 = 6 : 6 : 1
Молекулярная
формула — С6H6O
3) Составим
структурную формулу вещества:
4) Составим
уравнение реакции данного вещества с бромной водой:
12. Задание 35 № 6318
Некоторое
органическое соединение содержит 62,1 % углерода и 27,6 %
кислорода по массе. Известно, что это соединение может быть получено в
результате термического разложения кальциевой соли соответствующей
карбоновой кислоты.
На основании
данных условия задачи:
1) произведите
вычисления, необходимые для установления молекулярной формулы органического
вещества;
2) запишите
молекулярную формулу органического вещества;
3) составьте
структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции получения этого вещества термическим разложением
кальциевой соли соответствующей карбоновой кислоты.
Пояснение.
Общая формула
вещества —
1) Найдем
соотношение атомов углерода, водорода и кислорода в соединении:
x : y : z =
62,1/12 : 10,3/1 : 27,6/16 = 5,175 : 10,3 : 1,725 = 3 : 6 : 1
2) Определим
молекулярную формулу вещества: .
3) Составим
структурную формулу вещества:
4) Составим
уравнение реакции получения этого вещества термическим разложением кальциевой
соли соответствующей карбоновой кислоты:
13. Задание 35 № 6323
При сгорании
5,4 г органического вещества получили 15,4 г углекислого газа и 3,6
г воды. Известно, что это вещество реагирует с раствором гидроксида натрия,
а в реакции с бромной водой образуется трибромпроизводное этого
вещества.
На основании
данных условия задачи:
1) произведите
вычисления, необходимые для установления молекулярной формулы
органического вещества;
2) запишите
молекулярную формулу органического вещества;
3) составьте
структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции данного вещества с бромной водой.
Пояснение.
Общая формула
вещества — СxHyOz
1) Найдем
количество вещества углекислого газа и воды:
2) Определим
молекулярную формулу вещества:
x : y : z =
0,35 : 0,4 : 0,05 = 7 : 8 : 1
Молекулярная
формула — С7H8O
3) Составим
структурную формулу вещества:
4) Составим
уравнение реакции данного вещества с бромной водой:
14. Задание 35 № 7076
При сгорании
некоторого органического вещества массой 7,5 г получили 10,08 л углекислого
газа (н. у.) и 4,5 г воды. Известно, что в присутствии гидроксида калия
исходное соединение подвергается гидролизу, в результате чего образуются соль
бензойной кислоты и спирт.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества в присутствии гидроксида
калия.
Пояснение.
1)
Вычислим количества веществ углекислого газа и воды, образующихся при сгорании
органического вещества, а также количества и массы входящих в них элементов:
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyOz,
тогда
2)
Молекулярная формула органического соединения — C9H10O2.
3)
Поскольку исходное органическое вещество подвергается гидролизу в присутствии
гидроксида калия, в результате чего образуется этанол, то этим веществом
является этилбензоат (этиловый эфир бензойной кислоты):
4) В
присутствии гидроксида калия этиловый эфир бензойной кислоты гидролизуется с
образованием бензоата калия и этилового спирта:
15. Задание 35 № 7077
При
сгорании некоторого органического вещества массой 1,85 г получили 1,68 л
углекислого газа (н. у.) и 1,35 г воды. Известно, что при гидролизе исходного
соединения образуется вещество, вступающее в реакцию «серебряного зеркала».
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для нахождения формулы исходного
органического вещества;
2)
установите его молекулярную формулу;
3)
составьте структурную формулу этого вещества, которая отражает порядок связей
атомов в молекуле;
4)
напишите уравнение реакции гидролиза этого вещества (кат. – H2SO4).
Пояснение.
1)
Вычислим количества веществ углекислого газа и воды, образующихся при сгорании
органического вещества, а также количества и массы входящих в них элементов:
отсюда
отсюда
Вычислим
массу и количество вещества кислорода, входящего в состав органического
соединения:
Обозначим
молекулярную формулу органического вещества как CxHyOz,
тогда
2)
Молекулярная формула органического соединения — C3H6O2.
3)
Поскольку исходное органическое вещество гидролизуется с образованием вещества,
вступающего в реакцию «серебряного зеркала», то исходным веществом является
этилформиат (этиловый эфир муравьиной кислоты):
4) В
присутствии катализатора H2SO4 этилформиат
гидролизуется с образованием муравьиной кислоты и этилового спирта:
16. Задание 35 № 9935
Органическое
вещество содержит 72 % углерода, 21,33 % кислорода и 6,67 %
водорода. Известно, что при гидролизе этого вещества под действием щёлочи
образуется две соли.
Установите
молекулярную формулу органического вещества, его структурную формулу. Запишите
реакцию этого органического вещества с избытком раствора гидроксида калия.
Пояснение.
1) Пусть
масса неизвестного вещества равна
100 г.
Тогда
2) —
молекулярная формула органического вещества.
3)
структурная формула органического вещества
Искомое
вещество — фенилпропионат.
4)
Уравнение реакции:
Время урока: 11 Марта 17:00
Дедлайн д/з: 14 Марта 23:55
На занятии по теме «Задача 34 на растворимость и кристаллогидраты» мы разберем:
📌понятие растворимость;
📌понятие кристаллогидраты;
📌задачу 34 на растворимость и КГ.
Домашнее задание
еще не выдано
Заглядывай сюда после окончания урока 😉
-
Рабочая тетрадь 4 урок
.pdf

Нужно авторизоваться
Нужно авторизоваться
Введите больше 6 символов
На почту 12345@mail.ru отправлена ссылка для сброса пароля.
Пожалуйста, подтвердите ваш номер телефона
Нужно авторизоваться
Нужно авторизоваться
Нужно авторизоваться
Введите больше 6 символов
На почту 12345@mail.ru отправлена ссылка для сброса пароля.
Пожалуйста, подтвердите ваш номер телефона
Пополнение
счёта
Курс заблокирован
К сожалению, данный курс заблокирован. Необходимо внести доплату
Вывод
средств
Ваше задание
подтверждено!
успешно
Теперь вы можете приступить
к следующему уроку
курса по математике
Перейти к уроку
Подтверждение
замены
Для смены номера телефона
мы отправили Вам код по СМС,
введите его в поле ниже.
Подтвердить
Ты включаешь автопродление — 25-го числа каждого месяца доступ к купленным курсам будет автоматически продлеваться. Деньги будут списываться с одной из привязанных к учетной записи банковских карт. Управлять автопродлением можно из раздела «Финансы»
Для активации регулярного платежа мы спишем небольшую сумму с карты и сразу её вернем
Вы дествительно хотите отменить автопродление?
Благодарим за покупку!
В ближайшее время курс будет доступен в разделе Моё обучение
Материалы будут доступны за сутки до начала урока
Чат будет доступен после выдачи домашнего задания
Укажите вашу электронную почту
Мы используем cookie. Это позволяет нам анализировать взаимодействие посетителей с сайтом и делать его лучше. Продолжая пользоваться сайтом, вы соглашаетесь с использованием файлов cookie. Для лучшей работоспособности сайта просим вас отключить AdBlock.
OK
ЕГЭ
Справочник
ЕГЭ
Биология
3.5 Закономерности наследственности, их цитологические основы. Закономерности наследования, установленные Г.Менделем, их цитологические основы (моно- и дигибридное скрещивание). Законы Т.Моргана: сцепленное наследование признаков, нарушение сцепления генов. Генетика пола. Наследование признаков, сцепленных с полом. Взаимодействие генов. Генотип как целостная система. Генетика человека. Методы изучения генетики человека. Решение генетических задач. Составление схем скрещивания.
Внимательно прочитайте текст задания и выберите верный ответ из списка
Задание 3305
С помощью какого метода
генетики человека определяют хромосомные
и геномные мутации?
Ответы:
генеалогического
биохимического
цитогенетического
— Правильный ответ
близнецового
Репетиторы
по
биологии
Найти репетитора
Другие задачи на эту тему
Задание 1697
Задание 1747
Задание 1797
Задание 1819
Задание 1846
Задание 1868
Задание 1895
Задание 1945
Задание 1995
Задание 2017
ЕГЭ
Справочник
© 2023 ЕГЭ.Справочник24. Все права защищены.
Предметы
Русский язык
Математика профильная
Физика
Химия
Информатика и ИКТ
Биология
История
География
Английский язык
Немецкий язык
Французский язык
Обществознание
Испанский язык
Литература
Математика базовая
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023



























