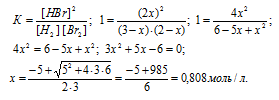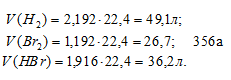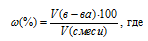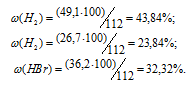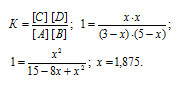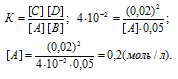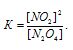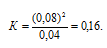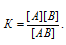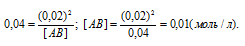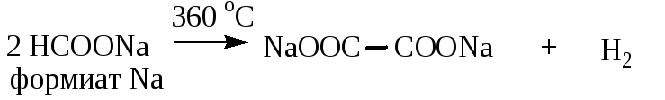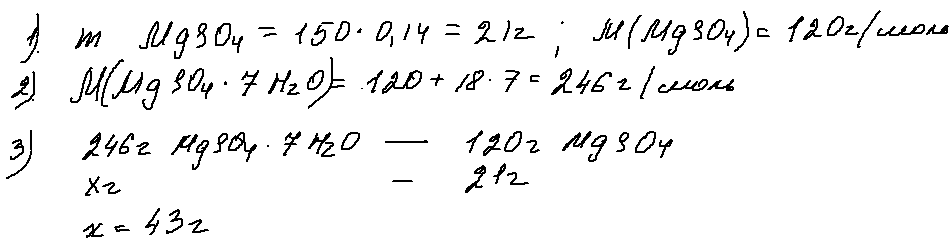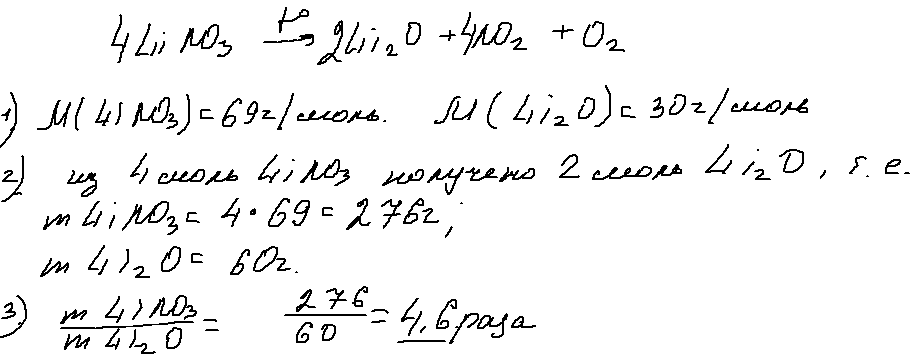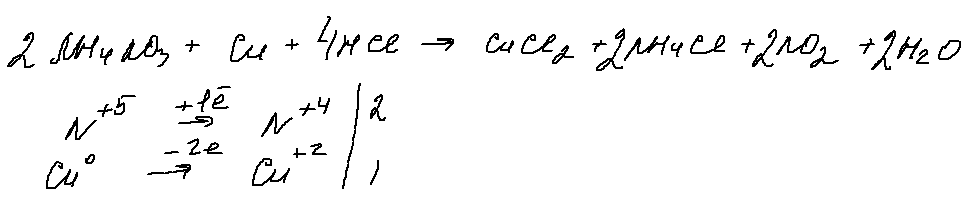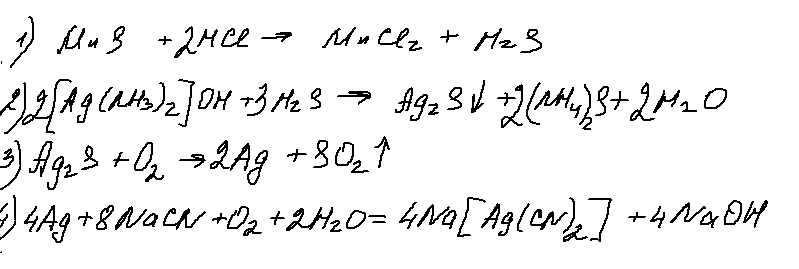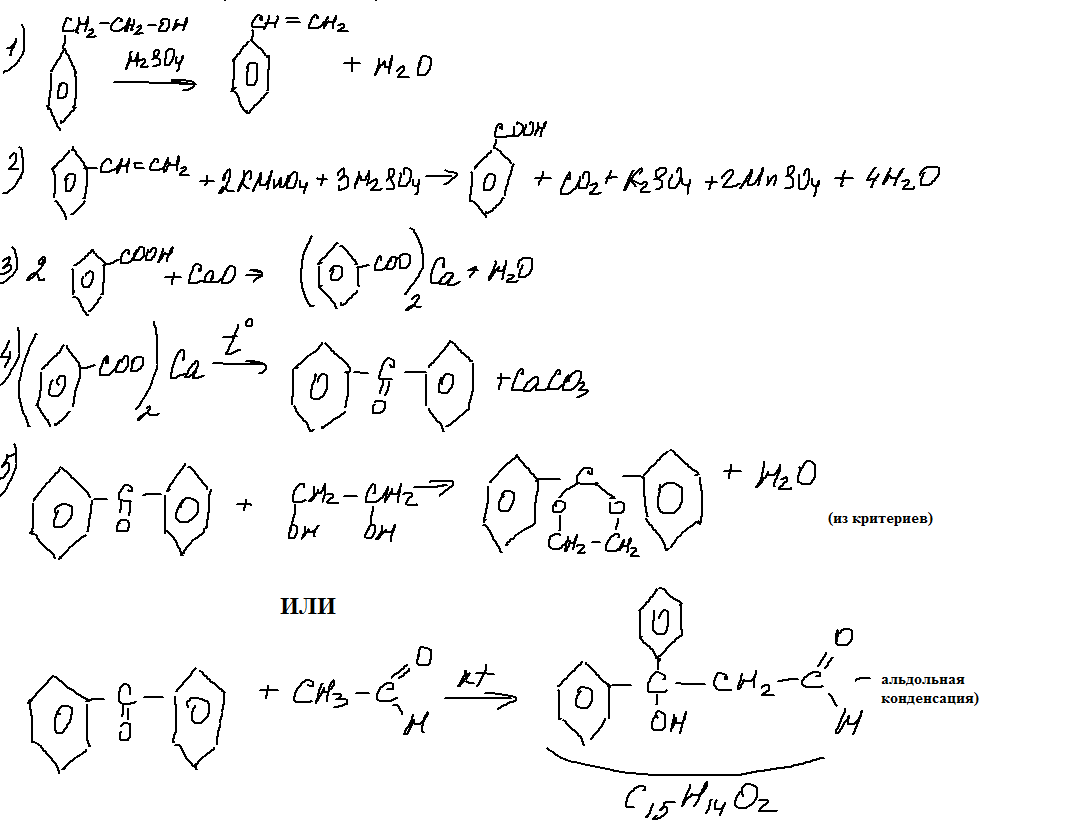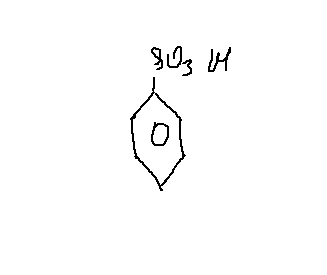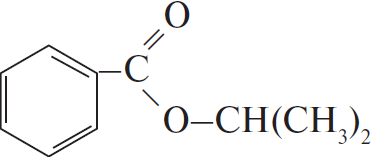Задания
Версия для печати и копирования в MS Word
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакции используйте структурные формулы органических веществ.
Спрятать решение
Решение.
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений:
1)
2)
3)
4)
5)
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакций | 5 |
| Правильно записаны 4 уравнения реакций | 4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 5 |
Спрятать решение
·
·
Гость 30.04.2014 20:41
В первой реакции условием должно быть 1000 градусов,при 1200 градусах идет разложение на простые вещества(Репетитор по химии под редакцией А.С.Егорова стр.503)
Александр Иванов
В разных источниках встречаются различные значения температур для этой реакции от 1000°С до 1500°С.
При этом «Репетитор по химии…» не самое авторитетное научное издание.
А из дальнейшего условия должно быть понятно, что в первой реакции получается ацетилен
Гость 24.08.2015 14:43
Можно ли в 3й реакции получить бутен-2? Тогда следующая реакция пойдёт с разрывом двойной связи и окислением атомов углерода при ней (получатся 2 молекулы этановой кислоты).
Александр Иванов
Ваше предложение вступает в противоречие с условием.
По условию винилацетилен реагирует с ИЗБЫТКОМ водорода.
Эдуард Циркуль 06.02.2016 15:33
Можно ли написать в качестве продукта при взаимодействии уксусной кислоты с аммиаком ацетат аммония?
lana shonia 18.06.2016 20:23
объясните пожалуйста почему в четвертой реакции получается кислота?
Антон Голышев
Есть такая реакция окисления бутана в уксусную кислоту.
Определение состава и концентраций веществ в равновесной реакционной смеси
Задача 356.
Для реакции Н2(г) + Br2(г) = 2HBr(г) при некоторой температуре К = 1. Определить состав (в процентах по объему) равновесной реакционной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей Вг2.
Решение:
Уравнение реакции имеет вид:
Н2(г) + Br2(г) = 2HBr(г)
Согласно уравнению реакции из 1 моля Н2 и 1 Br2 образуется 2 моль HBr. Обозначим количество израсходованных исходных веществ через x. Тогда равновесные концентрации реагирующих веществ будут раны:
[Н2] = (3 – х) моль/л, [Br2] = (2 – х) моль/л, [HBr] = (2х) моль/л. Подставив эти значения концентраций в выражение константы равновесия реакции, рассчитаем значение x:
Тогда равновесные концентрации веществ будут равны:
[Н2] = 3 — 0,808 = 2,192 моль/л;
[Br2] = 2 – 0,808 = 1,192 моль/л;
[HBr] = 2 . 0,808 = 1,616 моль/л.
Находим объёмы газов в равновесной системе, учитывая, что 1 моль любого газа при нормальных условиях занимает 22,4л, получим:
Тогда общий объём газовой равновесной системы будет равен 112 л (49,1 + 26,7 + 36,2 = 112).
Теперь определим состав газов (в процентах по объему) равновесной реакционной смеси по формуле:
w% — объёмная доля вещества, выраженная в процентах, V(в-ва) — объём вещества, V(смеси) — общий объём газовой смеси.
Тогда
Ответ: 43,84% Н2; 23,84% Br2; 32,32%HBr.
Задача 357.
Константа равновесия реакции равна единице. Сколько процентов вещества А подвергнется превращению, если смешать З моля вещества А и 5 молей вещества В?
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г)
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D. Обозначим равновесные концентрации веществ С и D через x. Тогда равновесные концентрации веществ будут раны: [C] = [D] = моль/л, [A] = (3 – х)моль/л, [B] = (5 – х)моль/л. Подставив эти значения концентраций в выражение кон-станты равновесия реакции, рассчитаем значение x:
Теперь рассчитаем, сколько процентов вещества А подвергнется превращению из пропорции:
3 : 100 = 1,875 : x; x = (1,875 . 100)/3 = 62,5%
Ответ: 62,5%.
Задача 358.
После смешивания газов А и В в системе А(г) + В(г) = С(г) + D(г) устанавливается равновесие при следующих концентрациях: [B] = 0,05 моль/л; [C] = 0,02 моль/л. Константа равновесия реакции равна 4.102. Найти исходные концентрации веществ А и В.
Решение:
Уравнение реакции имеет вид:
А(г) + В(г) = С(г) + D(г) .
Согласно уравнению реакции из 1 моля вещества А и 1 моля вещества В образуется по 1 молю веществ С и D.
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества С, то такое же количество образовалось вещества D, было израсходовано по 0,02 моля веществ А и В.
Сначала найдём концентрацию вещества А из выражения для константы равновесия реакции:
Отсюда рассчитаем искомые исходные концентрации веществ А и В:
[A]0 = 0,2 + 0,02 = 0,22 моль/л;
[B]0 = 0,05 + 0.02 = 0,07 моль/л.
Ответ: [A]0 = 0,22 моль/л; [B]0 = 0,07 моль/л.
Задача 359.
Найти константу равновесия реакции N2O4 ⇔ 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4.
Решение:
Уравнение реакции имеет вид: N2O4 ⇔ 2NO2. Из уравнения реакции следует, что из 1 моля N2O4 образуется 2 моля NO2. Поскольку по условию задачи 50% N2O4 диссоциировало, то количество N2O4, продиссоциировавшегося составляет 0,04 моль/л (0,08 . 0,5 = 0,04).
Тогда равновесные концентрации участвующих веществ будут равны:
[N2O4]0 = 0,08 – 0,04 = 0,04 моль/л;
[NO2]0 = 0,04 . 2 = 0,08 моль/л
Выражение для константы равновесия для данной реакции будет иметь вид:
Подставляя в это выражение данные из задачи, получим:
Ответ: 0,16
Задача 360.
В замкнутом сосуде протекает реакция АВ(г) ⇔ А(г) + В(г) Константа равновесия реакции равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Найти начальную концентрацию вещества АВ. Сколько процентов вещества АВ разложилось?
Решение:
Уравнение реакции имеет вид: АВ(г) ⇔ А(г) + В(г). Из уравнения реакции следует, что из 1 моля вещества АВ образуется 1 моль вещества А и 1 моль вещества В. Поскольку по условию задачи в каждом литре системы образовалось 0,02 моля вещества В, то столько же образовалось и вещества А, при этом было израсходовано 0,02 моля вещества АВ.
Константа равновесия данной реакции выражается уравнением
Подставляя в это выражение данные задачи, рассчитаем равновесную концентрацию вещества АВ:
Таким образом, искомая исходная концентрация вещества АВ будет равна:
[AB]0 = 0,02 + 0,01 = 0,03 моль/л
Сколько процентов вещества АВ разложилось находим из пропорции:
0,03 : 100 = 0,02 : х = (0,02 . 100)/0,03 = 66,7%
Ответ: [AB]0 = 0,03 моль/л; 66,67%.

Учебные пособия
Скачать бесплатно сборник ЕГЭ 2023 года по химии 11 класс автор Добротин Д.Ю 30 тренировочных вариантов с ответами для подготовки к ЕГЭ.
Читать онлайн и скачать сборник в формате PDF: Скачать
Сборник «ЕГЭ 2023 Химия. Типовые экзаменационные варианты. 30 вариантов», под редакцией Д.Ю. Добротина прошло научно-методическую оценку ФГБНУ «ФИПИ». Серия подготовлена разработчиками контрольных измерительных материалов единого государственного экзамена.
В данном издании представлены: 30 типовых экзаменационных вариантов, которые были составлены в соответствии с проектом демоверсии КИМ ЕГЭ по химии 2023 года, инструкция по выполнению экзаменационной работы, ответы ко всем заданиям, критерии оценивания, как отдельных заданий, так и работы в целом.
Тренировочное пособие по химии предоставляет возможность обучающимся самостоятельно и качественно подготовиться к государственной итоговой аттестации, а также объективно оценить и повысить уровень своей подготовки к экзамену. Учителя могут использовать сборник заданий для проверки уровня знаний учеников по предмету и интенсивной подготовки к ЕГЭ.
Вам будет интересно:
ОГЭ 2023 по химии, Д.Ю. Добротин. 30 экзаменационных типовых вариантов (задания и ответы)
Метки: варианты и ответы ЕГЭ Пособия ЕГЭ 2023 тренировочный вариант химия
Тема .
Неорганическая химия
.
03
31. Цепочки реакций по неорганической химии
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
неорганическая химия
.0129. Составление окислительно-восстановительной реакции. Электронный баланс
.0230. Составление реакции ионного обмена. Полное и сокращённое ионное уравнение
.0331. Цепочки реакций по неорганической химии
.045. Классификация и номенклатура неорганических веществ
.056. Свойства классов неорганических соединений. Реакции в растворах. Реакции ионного обмена
.067. Свойства классов неорганических соединений. Установление возможности реакции между классами соединений
.078. Свойства классов неорганических соединений. Химия элементов
.089. Взаимосвязь классов неорганических соединений
.09Реакции
Решаем задачи
Медь растворили в концентрированной серной кислоте. Полученную соль внесли в раствор иодида калия. Образовавшееся простое вещество прореагировало с концентрированной азотной кислотой с выделением бурого газа. Полученную кислоту осторожно нагрели. Составьте уравнения четырех описанных реакций.
Показать ответ и решение
1. Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2. 2CuSO4 + 4KI = 2K2SO4 +2CuI + I2
3. I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4. 2HIO3 = H2O + I2O5
Водный раствор хлорида магния подвергли электролизу. В атмосфере газа, выделившегося на аноде, сожгли фосфор, взятый в избытке. Получившийся продукт добавили в горячий раствор гидроксида натрия. Полученный раствор перенесли в избыток концентрированной азотной кислоты. Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям:
1) MgCl2 + 2H2O = H2 + Mg(OH)2 + Cl2
2) 2P + 3Cl2 = 2PCl3
3) PCl3 + 5NaOH = Na2HPO3 + 3NaCl + 2H2O
4) Na2HPO3 + 4HNO3 = H3PO4 + 2NO2 + 2NaNO3 + H2O
К раствору нитрата кальция добавили раствор фосфата натрия. Выпавший осадок отделили, высушили и затем прокалили в присутствии углерода и оксида кремния. Полученное при этом простое вещество растворили в концентрированном растворе азотной кислоты, при этом выделился бурый газ. Полученный газ поглотили холодным раствором гидроксида бария. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2Na3PO4 + 3Ca(NO3)2 = Ca3(PO4)2 + 6NaNO3
2) Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
3) P + 5HNO3 = H3PO4 + 5NO2 + H2O
4) 4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
Через раствор сульфата железа (II) пропустили аммиак. Образовавшийся при этом осадок отделили и обработали необходимым количеством концентрированной азотной кислоты, при этом наблюдали растворение осадка и выделение бурого газа. К полученному раствору раствору добавили раствор карбоната калия, а бурый газ пропустили через раствор гидроксида кальция. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + (NH4)2SO4
2) Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
3) 3K2CO3 + 2Fe(NO3)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
4) 4NO2 + 2Ca(OH)2 = Ca(NO3)2 + Ca(NO2)2 + 2H2O
Фосфор смешали с кальцием и нагрели. Полученное при этом вещество поместили в воду. Выделившийся газ пропустили через раствор, содержащий перманганат натрия и гидроксид натрия, в результате раствор приобрел зеленую окраску. Одну из полученных солей выделили и добавили к раствору сульфита натрия. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2P + 3Ca = Ca3P2
2) Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
3) PH3 + 8NaMnO4 + 11NaOH = 8Na2MnO4 + Na3PO4 + 7H2O
4) Na2MnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + 2NaOH
Силицид кальция (Ca2Si) поместили в воду. Образовавшийся при этом газ прореагировал с кислородом. Полученное твердое вещество сплавили с фосфатом кальция и углеродом. Образовавшееся при этом простое вещество обработали концентрированной азотной кислотой. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
2) SiH4 + 2O2 = SiO2 + 2H2O
3) Ca3(PO4)2 + 5C + 3SiO2 = 2P + 3CaSiO3 + 5CO
4) P + 5HNO3 = H3PO4 + 5NO2 + H2O
В токе водорода нагрели натрий. К образовавшемуся веществу добавили воду, в результате чего образовался прозрачный раствор и выделился газ. Полученный раствор нагрели и пропустили через него газ, предварительно полученный в результате электролиза раствора поваренной соли. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Na + H2 = 2NaH
2) NaH + H2O = NaOH + H2
3) 6NaOH + Cl2 = NaClO3 + 5NaCl + 3H2O
4) 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Гидрокарбонат натрия прокалили. Полученное после прокаливания твёрдое вещество растворили в воде и смешали с раствором бромида железа (III), в результате чего выпал бурый осадок и образовался газ. Осадок отделили и прокалили. Твёрдый остаток растворили в иодоводородной кислоте. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2NaHCO3 = Na2CO3 + CO2 + H2O
2) 3Na2CO3 + 2FeBr3 + 3H2O = 2Fe(OH)3 + 6NaBr + 3CO2
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид цинка сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид натрия, в результате чего образовался белый осадок. Осадок отделили, высушили, а затем сожгли в избытке кислорода. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) ZnO + 2KOH = K2ZnO2 + H2O
2) K2ZnO2 + 2H2SO4 = ZnSO4 + K2SO4 + 2H2O
3) ZnSO4 + Na2S = ZnS + Na2SO4
4) 2ZnS + 3O2 = 2ZnO + 2SO2
Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся жёлтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зелёным. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Cr + 3Cl2 = 2CrCl3
2) 2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
4) Na2Cr2O7 + 3Cu2O + 10H2SO4 = Cr2(SO4)3 + 6CuSO4 + Na2SO4 + 10H2O
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
2) Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + Fe = 3FeO
К раствору сульфата железа(II) добавили раствор гидроксида натрия. Образовавшийся при этом осадок отделили и обработали пероксидом водорода, при этом наблюдали изменение цвета осадка. Полученное бурое вещество обработали иодоводородной кислотой. Образовавшееся при этом простое вещество поместили в раствор гидроксида калия и нагрели.
Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
1) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
2) 2Fe(OH)2 + H2O2 = 2Fe(OH)3
3) 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
4) 3I2 + 6KOH = KIO3 + 5KI + 3H2O
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением света и тепла. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl
2) Fe(NO3)3 + 3KOH = 3KNO3 + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2Al = Al2O3 + 2Fe
Кристаллы хлорида калия обработали концентрированной серной кислотой. К получившейся соли добавили гидроксид калия. К полученному придукту прилили раствор хлорида бария. Выпавший осадок отфильтровали, после чего прокалили с избытком угля. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) KCl(тв) + H2SO4(конц) = KHSO4 + HCl
2) KHSO4 + KOH = K2SO4 + H2O
3) K2SO4 + BaCl2 = 2KCl + BaSO4
4) BaSO4 + 2C = BaS + 2CO2
Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в йодоводородной кислоте. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Fe + 3Cl2 = 2FeCl3
2) FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения четырех описанных реакций
Показать ответ и решение
1) Al2O3 + 2NaOH = 2NaAlO2 + H2O
2) NaAlO2 + NH4Cl + H2O = NaCl + Al(OH)3 + NH3
3) 2NH3 + H2SO4 = (NH4)2SO4
4) (NH4)2SO4 = NH3 + NH4HSO4
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ba(OH)2 ← Ba → BaO → Ba(OH)2→(+СО2)X → Ba(OH)2
Показать ответ и решение
1) Ba + 2H2O = Ba(OH)2 + H2
2) 2Ba + O2 = 2BaO
3) BaO + H2O = Ba(OH)2
4) Ba(OH)2 + 2CO2 = Ba(HCO3)2
5) Ba(HCO3)2 + 2NaOH = Ba(OH)2 + 2NaHCO3
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
K2O → КОH → KHSO4→ K2SO4 → КОH → K[Al(OH)4];
Показать ответ и решение
1) K2O + H2O = 2KOH
2) KOH + H2SO4 = KHSO4 + H2O
3) KHSO4 + KOH = K2SO4 + H2O
4) K2SO4 + Ba(OH)2 = 2KOH + BaSO4
5) KOH + Al(OH)3 = К[Al(OH)4]
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
CuCl2 → Cu(OH)2 → CuO → Cu → CuO → CuSO4
Показать ответ и решение
1) СuCl2 + 2KOH = Cu(OH)2 + 2KCl
2) Cu(OH)2 =(t) CuO + H2O
3) 2NH3 + 3CuO = 3Cu + N2 + 3H2O
4) 2Cu + O2 = 2CuO
5) CuO + H2SO4 = CuSO4 + H2O
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ca(OH)2 → CaO → Ca(OH)2 →(+K2CO3) X → Fe(OH)3 → Fe2O3
Показать ответ и решение
1) Сa(OH)2 =(t) CaO + H2O
2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + K2CO3 = CaCO3 + 2KOH
4) 3KOH + FeCl3 = Fe(OH)3 + 3KCl
5) 2Fe(OH)3 =(t) Fe2O3 + 3H2O
Елена Шаврак. ЕГЭ по химии: новые упражнения и цепочки превращений. вопрос — хим. связь.. вопрос.
Елена Шаврак
ЕГЭ по химии: новые упражнения и цепочки превращений
Здравствуйте, уважаемые читатели!
Сегодня я хочу рассмотреть некоторые задания из нового СтатГрадовского пробника от 3 марта 2021 года. Причина — подобные упражнения ранее мне не встречались ни в одном из пробников и пособий за последние 8 лет. Про себя я данный факт обозначила как : «СтатГрад расширяет границы», причем это расширение носит как экстенсивный, так и интенсивный характер.
Итак, по порядку. Начинаю с заданий 1 варианта.
1. 4 вопрос — хим. связь.
Для выполнения этого задания запишем структурные формулы всех веществ (не учитываю валентные углы):
Только одинарные ковалентные связи есть в молекуле пероксида водорода (1) и гидроксиламина (3).
Новизна этого задания, скорее, экстенсивного характера. Т.е., несмотря на то, что ранее подобная формулировка 4 задания не встречалась в пробниках (мое субъективное мнение), для его выполнения вполне достаточно школьной базы.
2. 7 вопрос.
Для выполнения этого задания необходимо знать, что соединения меди могут выпадать в осадок при добавлении растворов трех реагентов из предложенного списка, а именно: аммиака, сероводорода и карбоната калия. Но в избытке аммиака осадок растворится вследствие образования аммиакатного комплекса меди. Одновременное образование осадка и газа — это маркерный признак совместного (или смешанного) гидролиза, протекающего при смешении растворов соли меди и карбоната. Т.о., ответы — Х- H2S, Y- K2CO3.
Новизна этого задания также условная. Аммиакатные комплексы меди (и цинка) в 7 задании встречались и ранее, но ОЧЕНЬ редко.
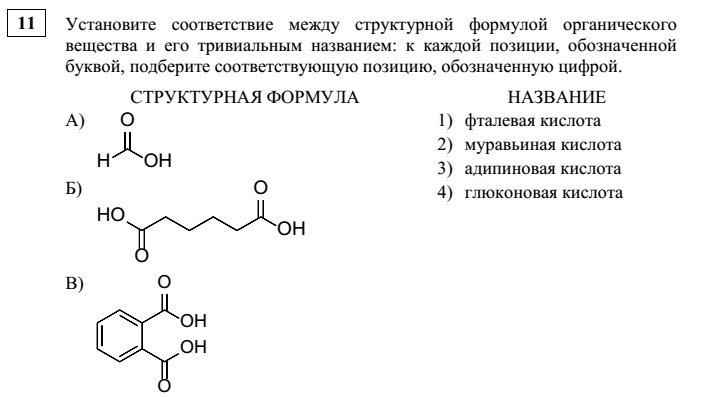
3. 11 вопрос
Практически во всех последних СтатГрадовских пробниках в 11 задании используются «скелетные» формулы органических веществ. Выскажу свою точку зрения: это хорошо, поскольку, опять же, — расширяет границы восприятия материала. Надеюсь, что, со временем, в формулировках будут использоваться классические скелетные формулы, в которых клинообразными линиями обозначаются связи, направленные вверх относительно плоскости, т.е. к наблюдателю, пунктирными линиями обозначаются связи, направленные вниз относительно плоскости, т.е. от наблюдателя.
Ответы — 231
Новизна этого задания невелика. Пожалуй, при подготовке стоит обратить внимание на отработку тривиальных названий органических соединений.
4. 17 вопрос
В 17 задании, посвященном кислородсодержащей органике, приведена практически не упоминавшаяся в пробниках и сборниках тестов реакция термического превращения формиата натрия до оксалата натрия:
Мой личный вывод: спасибо СтатГраду за актуализацию ранее невостребованной информации, относящейся, в принципе, к школьной программе (способы получения дикарбоновых кислот).
5. 27 задача.
Задача 27, в который уже раз в этом году, обращает внимание к кристаллогидратам. Решать ее можно разными способами — через моли, через пропорцию, правилом креста …
Ниже я привела один из вариантов решения., суть которого заключается в нахождении массы всей растворенной соли и последующем «заключении» ее в кристаллогидрат:
Ответ — 43 г.
6. 29 задача.
Задача 29 обращает на себя внимание формулировкой (полное отсутствие числовых данных) и «незамыленной» химией — разложением нитрата активного металла. Опять же и эту задачу можно решать несколькими способами. Ниже привожу один из них:
7. 30 задание.
«Грозное» 30 задание, в котором, при ближайшем рассмотрении, можно выделить только 1 окислитель (нитрат аммония), 1 восстановитель — медь. Для перевода нитрата в азотную кислоту, с которой будет реагировать медь, добавим соляную кислоту. Берем ее концентрированной, чтобы в результате реакции обмена получить концентрированную азотную кислоту (кстати, можно проводить реакцию с выделением оксида азота (2), для этого нужно взять разбавленную соляную кислоту). В результате получаем:
Данная реакция напоминает мне качественную реакцию на нитраты, в которой к нитрату добавляют медь и концентрированную серную кислоту и наблюдают образование бурого газа.
8. 32 задание.
Хорошее задание, ничего не скажешь! Реакция 2 — разрушение комплекса, достаточно типовая. Реакция 3 — окисление сульфида серебра (а еще и ртути) идет с образованием только одного оксида. Реакция достаточно редкая, но встречалась. А вот 4 реакция — меня лично ввела в ступор. Возможно ошибаюсь, но неоднократно от представителей ФИПИ на вебинарах звучало, что на ЕГЭ будут только гидроксокомплексы цинка и алюминия. Понемногу «пробрались» аммиакаты. Но цианидных комплексов до сих пор еще не было. Искренний респект составителям!
9. 33 цепочка.
Вот это задание заслуживает самого пристального внимания. С одной стороны — бруттоформулы в задании- это очень хорошо, поскольку способствует более глубокому проникновению в суть задания. С другой стороны- последняя реакция, представляющая собой введение ацетальной защиты (по мнению авторов пробника). Я бы написала здесь и альдольную конденсацию дифенилкетона с ацетальдегидом. Но этого не дают в школьной программе (или я ошибаюсь?).
Необходимо отметить, что еще одну цепочку с ацетальной защитой я нашла в сборнике
10. 34 задача.
Данную задачу в этой статье отрешивать не буду. Сделаю это позже. Но бросается в глаза новое усложнение — нахождение состава газовой смеси по плотности. Практически не встречалось такого в задачах , предназначенных для подготовки к ЕГЭ.
11. 35 задача.
Одно из заданий, которое мне очень понравилось в этом пробнике.
Решение
1. Схема реакции сгорания неизвестного соединения:
CxHySzOk+O2=CO2+H2O+SO2
2. Найдем молекулярную формулу неизвестного соединения:
а) n(C)=n(CO2)= 20,16/22,4=0,9 моль,
n(Н)=2n(Н2О)= 2*8,1 /18=0,9 моль,
n(S)=n(SO2)= 3,36/22,4=0,15 моль,
n(O)=(23,7-(12*0,9+0,9+32*0,15))/16=0,45 моль
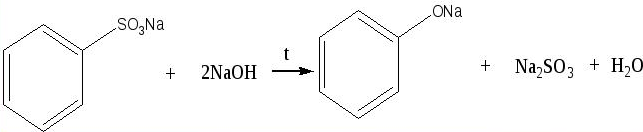
б) Молекулярная формула неизвестного вещества-: С6Н6SO3. Это — бензолсульфокислота
3. Структурная формула —
4. Уравнение реакции, происходящей при сплавлении бензолсульфоната натрия со щелочью:
Рассмотрела только первый вариант пробника, но и в нем много информации к размышлению. Резюмирую:
1. Реальный ЕГЭ по сложности раньше не всегда корреллировал со статградовскими пробниками, поэтому не факт, что задания уровня сложности рассмотренных 32-34 стоит ожидать на реальном экзамене.
2. Задания данного пробника актуализируют изучаемую, но относительно редко используемую информацию об органических и неорганических веществах (особенно — задания 4, 7, 11, 17, 27, 29, 35).
3. Для выполнения заданий 32 и 33 необходимо обладать информацией, адекватное усвоение которой возможно только в ходе изучения вузовских курса неорганической и органической химий (подчеркиваю, что это — мое субъективное мнение).
4. Великолепна задача 35. Впервые в пробниках ЕГЭ: серосодержащая органика и практически не используемый ранее при составлении заданий способ получения фенола.
5. В целом — еще раз — респект составителям, но — детей жалко. Без хорошего репетитора до уровня такого пробника не подняться.
Всего доброго!
За это задание ты можешь получить 5 баллов. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 44.9%
Ответом к заданию 32 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_2H_4 →↖{KMnO_4, H_2O, 0 °C} X_1 →↖{HCl_{(изб.)}} X_2 → CH≡CH →↖{H_2O (Hg^{2+})} Х_3 →↖{[Ag(NH_3)_2]OH} Х_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH_2=CH_2 + 2KMnO_4 + 4H_2O → 3CH_2(OH)–CH_2OH + 2MnO_2 + 2KOH$
2) $CH_2(OH)–CH_2OH + 2HCl → CH_2Cl–CH_2Cl + 2H_2O$
3) $CH_2Cl–CH_2Cl + 2KOH_{(спирт.)} → CH≡CH + 2KCl + 2H_2O$
4) $CH≡CH + H_2O →↖{Hg^{2+}}$
5) $CH_3CHO$ + $2[Ag(NH_3)_2]OH$ → 2Ag + $3NH_3$ + $H_2O$ + $CH_3COONH_4$
Ответ:
Задача 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$глюкоза → X_1 → X_2 {→}↙{AlCl_3}↖{C_6H_6} C_8H_{10} {→}↙{FeCl_3}↖{Cl_2} X_4 {→}↙{H_2SO_4}↖{KMnO_4} X_5$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_6H_{12}O_6 →↖{дрожжи} 2C_2H_5OH + 2CO_2$
2) $C_2H_5OH →↖{H_2SO_4, t > 140 °C} CH_2=CH_2 + H_2O$
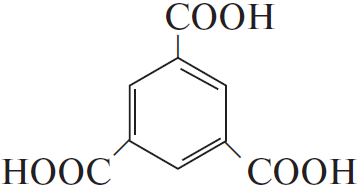
3) $CH_2=CH_2 +$ 
4) $Cl_2 +$ 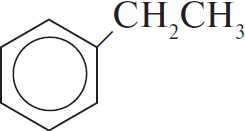
5) $12KMnO_4 + 18H_2SO_4 +$ 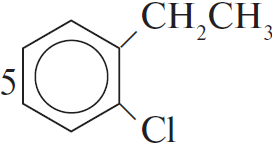
или
$12KMnO_4 + 18H_2SO_4 +$ 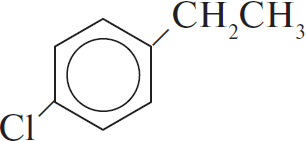
Ответ:
Задача 3
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
$н-гептан →↖{Pt, t} Х_1 →↖{Cl_2, свет}$ 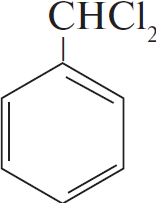
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2CH_2CH_2CH_3 →↖{Pt, t°} 4H_2 +$
2) 
3) 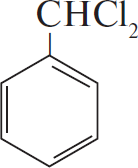
4) 5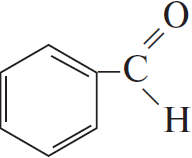
5) С6H5COOH $+ CH_3–CH(OH)–CH_3 → H_2O +$
Ответ:
Задача 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$ацетилен →↖{C_{(акт.)}, t°} Х_1 →↖{H_2, Pt} Х_2 →↖{Cl_2, hν}$ 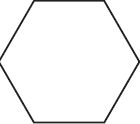
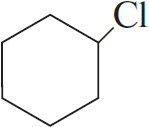
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH≡CH →↖{C_{(акт.)}, t°}$
2) 
3) 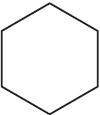
4) 
5) 3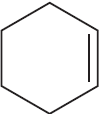
Ответ:
Задача 5
Приведите уравнения химических реакций, которые позволяют осуществить следующие превращения:
$C_2H_5OH → CH_2=CH_2 →↖{HCl} X_1 →$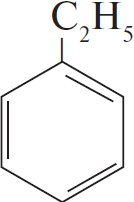
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_2H_5OH →↖{H_2SO_{4(конц.)}, t > 140 °C} CH_2=CH_2 + H_2O$
2) $CH_2=CH_2 + HCl → CH_3–CH_2Cl$
3) $CH_3–CH_2Cl +$ 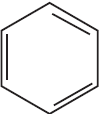
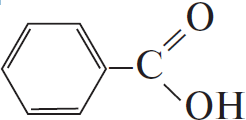
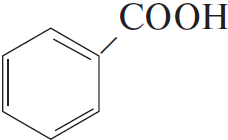
4) $5C_6H_5C_2H_5 + 12KMnO_4 + 18H_2SO_4 → 5C_6H_5COOH + 5CO_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
5) 
Ответ:
Задача 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$CH≡CH →↖{H_2O (Hg^{2+})} X_1 →↙{H_2SO_4}↖{K_2Cr_2O_7} CH_3COOH →↖{NaHCO_3} X_2 →↖{CH_3I} Х_3 →↖{H_2O (H^{+})} уксусная кислота$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH≡CH + H_2O → CH_3–CHO$
2) $3CH_3CHO + K_2Cr_2O_7 + 4H_2SO_4 → 3CH_3COOH + K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
4) $CH_3COONa + CH_3I → CH_3COOCH_3 + NaI$
5) $CH_3COOCH_3 + H_2O ⇄ CH_3COOH + CH_3OH$
Ответ:
Задача 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_3H_8 →↖{Cl_2, hν} X_1 → (CH_3)_2CHCH(CH_3)_2 → 2,3-диметил-2-хлорбутан →↖{NaOH_{(спирт.)}, t°} X_2 {→}↙{H_2O, 0 °C}↖{KMnO_4} X_3$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 + Cl_2 →↖{hν}$ 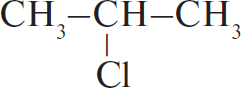
2) 2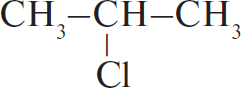
3) 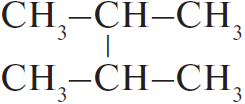
4) 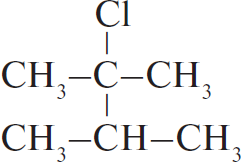
5) 3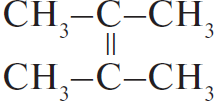
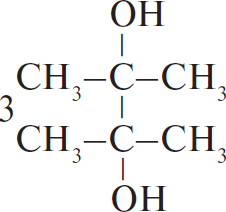
Ответ:
Задача 8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
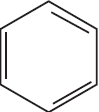
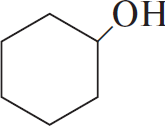
$бензол →↖{H_2, Pt, t°} X_1 →↖{Cl_2, hν} X_2 → циклогексанол {→}↙{180°С}↖{H_2SO_{4(конц.)}} Х_3 → HOOC–(CH_2)_4–COOH$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) 
2) 
3) 
4) 
5) 
Ответ:
Задача 9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$CH_3CH_2CH_2CH_2OH {→}↙{180°C}↖{H_2SO_4} X_1 →↖{HBr} X_2 →↖{KOH, H_2O} X_3 {→}↙{180°C}↖{H_2SO_4} X_4 →↖{KMnO_4, H_2SO_4, t°} X_5$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2OH → CH_3CH_2–CH=CH_2 + H_2O$
2) $CH_3CH_2–CH=CH_2 + HBr → CH_3CH_2–CHBr–CH_3$
3) $CH_3CH_2–CHBr–CH_3 + KOH_{(водн.)} → CH_3CH_2–CH(OH)–CH_3 + KBr$
4) $CH_3CH_2–CH(OH)–CH_3 → CH_3–CH=CH–CH_3 + H_2O$
5) $5CH_3–CH=CH–CH_3 + 8KMnO_4 + 12H_2SO_4 → 10CH_3–COOH + 4K_2SO_4 + 8MnSO_4 + 12H_2O$
Ответ:
Задача 10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$пропан →↖{Pt, t°} Х_1 → 1.2-дибромпропан →↖{NaOH_{(спирт. р-р)}, t°} Х_2 →↖{t°, кат.} Х_3 →↖{KMnO_4, H_2SO_4, t°}$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 → CH_3–CH=CH_2 + H_2$
2) $CH_3–CH=CH_2 + Br_2 → CH_3–CHBr–CH_2Br$
3) $CH_3–CHBr–CH_2Br + 2NaOH_{(спирт. р-р)} → CH_3–C≡CH + 2NaBr + 2H_2O$
4) $3CH_3–C≡CH →↖{C_{(акт.)}, t°}$
5) $18KMnO_4 + 27H_2SO_4 + 5$ 
Ответ:
Задача 11
Напишите уравнения реакций, которые позволяют осуществить следующие превращения:
$Al_4C_3 → X_1 → нитрометан →↖{H_2, кат.} X_2 →↖{HI} X_3 →↖{NaOH, t°} X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $Al_4C_3 + 12H_2O → 4Al(OH)_3 + 3CH_4$
2) $CH_4 + HONO_2 → CH_3NO_2 + H_2O$
3) $CH_3NO_2 + 3H_2 → CH_3NH_2 + 2H_2O$
4) $CH_3NH_2 + HI → [CH_3NH_3]^{+}I^{–}$
5) $[CH_3NH_3]^{+}I^{–} + NaOH → CH_3NH_2 + NaI + H_2O$
Ответ:
Задача 12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
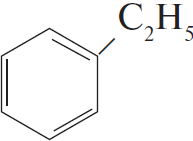
$C_6H_5COOK →↖{KOH, t°} X_1 →↖{C_2H_4, H_3PO_4, t°} X_2 →↖{Cl_2, hν} X_3 →$ 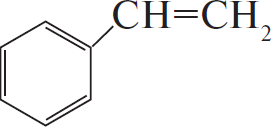
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
Вариант ответа:
1) 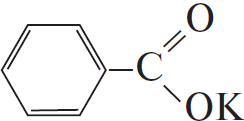
2) 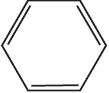

3) 
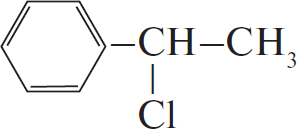
4) $C_6H_5–CH(Cl)–CH_3 + KOH_{(спирт.)} → C_6H_5–CH=CH_2 + KCl + H_2O$
5) $C_6H_5–CH=CH_2 + 2KMnO_4 + 3H_2SO_4 → K_2SO_4 + 2MnSO_4 + 4H_2O + CO_2 +$
Ответ:
Рекомендуемые курсы подготовки
Задача 2. Хлор, выделившийся при взаимодействии 43.5 г оксида марганца (IV) с раствором HCl объемом 500 мл (плотность 1.18 г/мл) с массовой долей 36%, полностью поглощен горячим раствором гидроксида калия массой 600 г с массовой долей 28%. Определите массовую долю хлората калия в полученном растворе.
Источник: Я сдам ЕГЭ! Типовые Задания. А.А. Каверина (2018), стр. 209.
Решение:
1) Определим количества веществ, вступающих в первую реакцию и запишем саму реакцию:
n(MnO2) = 43.5/87 = 0.5 моль
m(HCl) = 500×1.18×0.36 = 212.4 г
n(HCl) = 212.4/36.5 = 5.8 моль
MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
Согласно коэффициентам, количество HCl, которое необходимо для полного расходования 0.5 моль MnO2, в 4 раза больше количества MnO2:
n(HCl) = 4×n(MnO2) = 4×0.5 = 2 моль. По условию задачи имеем 5.8 моль HCl, следовательно MnO2 в недостатке, а HCl в избытке. Расчет количества хлора ведем по количеству MnO2 (так как он в недостатке):
n(Cl2) = n(MnO2) = 0.5 моль.
2) Вычислим количество вещеста KOH и запишем вторую реакцию:
m(KOH) = 600×0.28 = 168 г
n(KOH) = 168/56 = 3 моль.
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (реакция с горячим раствором щелочи)
Так как хлор в недостатке, его количество используем, чтобы найти количество вещества и массу KClO3:
n(KClO3) = n(Cl2)/3 = 0.5/3 = 0.17 моль
m(KClO3) = 0.17×122.5 = 20.83 г
3) Находим массовую долю KClO3:
m(р-ра) = m(Cl2) + m(р-ра KOH) = 0.5×71 + 600 = 635.5 г
w(KClO3 = 20.83/635.5 = 0.0328 или 3.28%