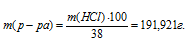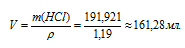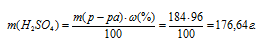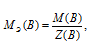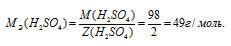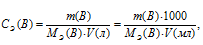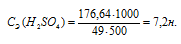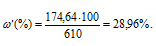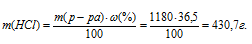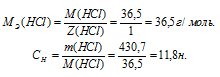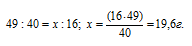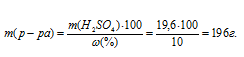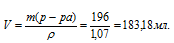Задания
Версия для печати и копирования в MS Word
Тип 7 № 435
Установите соответствие между реагирующими веществами и продуктами реакций: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
A)
Б)
B)
Г)
ПРОДУКТЫ РЕАКЦИИ
1)
2)
3)
4)
5)
6)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| A | Б | В | Г |
Спрятать решение
Решение.
Установим соответствие.
A)
переход кислой соли в среднюю.
Б) .
B)
.
Г) .
Ответ: 3415.
Раздел кодификатора ФИПИ: 2.8 Взаимосвязь различных классов неорганических веществ
Спрятать решение
·
·
Сообщить об ошибке · Помощь
Как правильно производить расчеты по приготовлению растворов
Задача 435.
Сколько миллилитров концентрированной соляной кислоты (p = 1,19 г/мл), содержащей 38% (масс.) НСI, нужно взять для приготовления 1 л 2н. раствора?
Решение:
M(НСI) = MЭ(НСI) = 36,5 г/моль.
Рассчитаем массу НСI в 1 л 2 н раствора её: 2 . 36,5 = 72,93 г.
Рассчитаем массу 38%-ного раствора по формуле:
где

Тогда
Объём раствора, который необходимо взять для приготовления 1 л 2 н раствора рассчитаем по формуле:
m(p-pa) = p . V,
где p — плотность, а V – объём раствора, получим:
Ответ: 161,28 мл.
Задача 436.
К 100 мл 96%-ной (по массе) H2SO4 (плотность 1,84 г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
Решение:
Массу раствора 100 мл 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где p — плотность, а V – объём раствора, получим:
m(p-pa) = 1,84 . 100 = 184 г.
Массу серной кислоты в данном растворе находим по формуле:
где

Тогда
Рассчитаем массу раствора полученного при смешении 100 мл 96%-ного раствора с 400 мл воды, получим:
m’(p-pa) = (100 + 400) . 1,220 = 610 г.
Определим молярную массу эквивалента H2SO4 из соотношения:
MЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 — 2.
Отсюда
Тогда эквивалентную концентрацию раствора найдём по формуле:
где
m(B)- масса растворённого вещества, MЭ(В) — молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Отсюда
Рассчитаем массовую долю полученного раствора:
Ответ: 7,2н; 28,96%.
Задача 437.
Рассчитать нормальность концентрированной соляной кислоты (плотность 1,18г/мл), содержащей 36,5% (масс.) НСI.
Решение:
Массу 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где p — плотность, а V – объём раствора, получим:
m(p-pa) = 1,18 . 1000 = 1180 г.
Рассчитаем массу соляной кислоты в растворе по формуле:
где

Тогда
Определим молярную массу эквивалента HCl из соотношения:
MЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(B) — эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
Ответ: 11,8н.
Задача 438.
Какой объем 10%-ной (по массе) серной кислоты (p = 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16,0 г NaOH?
Решение:
Уравнение реакции нейтрализации раствора NaOH раствором H2SO4 имеет вид:
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
Из уравнения реакции следует, что на нейтрализацию 1 моля NaOH затрачивается 0,5 молей NaOH, значит, эквивалентная масса серной кислоты в данной реакции равна 49 г/моль (М/2 = 98/2 = 49).
Теперь рассчитаем массу серной кислоты, необходимую для нейтрализации 16 г NaOH из пропорции:
Массу раствора, содержащего 19,6 г H2SO4, рассчитаем по формуле:
где

Тогда
Объём раствора рассчитаем по формуле:
m(p-pa) = p . V,
где — плотность, а V – объём раствора, получим:
Ответ: 183,18 мл.
Задание 1:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CuSO4
Б) KOH
В) Na2CO3
Г) Al(OH)3
Реагенты:
1) KOH, Ba(NO3)2, H2S
2) SiO2, Al, H2S
3) HNO3, NaOH, H2SO4
4) H2SiO3, Al, BaSO4
5) HNO3, BaCl2, MgCl2
Решение:
Сульфат меди(II) – это средняя соль, растворимая в воде, которая реагирует
— с щелочами(с образованием нерастворимого основания Cu(OH)2),
— солями(нитратом бария, в результате взаимодействия с которыми образуется осадок),
— кислотами(сероводородом — образуется сульфид меди(II) осадок бурого цвета);
Ответ 1.
Гидроксид калия – это растворимое основание, щелочь, которая вступает в реакции нейтрализации с кислотами и кислотными оксидами, амфотерными металлами; ответ 2.
Карбонат натрия – это средняя соль, как и все соли натрия, растворимая в воде, подобно другим солям реагирует со сложными веществами(щелочами, кислотами, другими солями) с образованием осадков, газов, воды, здесь подходит вариант ответа 5, так как в результате реакций с хлоридом бария и магния образуется два осадка в виде BaCO3 и MgCO3.
Гидроксид алюминия – амфотерное нерастворимое основание, которое реагирует
— с щелочами,
— с кислотами,
Ответ 3.
Задание 2:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) C
Б) S
В) CO2
Г) FeO
Реагенты:
1) P, Cu(OH)2, HNO3
2) H2O, KOH, CaO
3) CO, LiOH, N2
4) S, Ba, O2
5) HNO3, O2, C
Решение:
Углерод – неметалл, образующий целый раздел органической химии, благодаря которому образовались белки, жиры, углеводы, реагирует
— с неметаллами(например, серой, кислородом),
— металлами(например, барием, алюминием с образованием карбидов).
Ответ 4.
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, с кислородом, водородом, углеродом, азотной кислотой.
S + 6HNO3(к.) = H2SO4 + 6NO2 + 2H2O
S + 2HNO3(р.) = H2SO4 + 2NO
Важно! Заметьте, что в реакциях серы с разбавленной HNO3 выделяется оксид азота NO2, а с концентрированной азотной кислотой выделяется оксид азота NO.
Этот же принцип соблюдается в реакциях разбавленной и концентрированной кислот с металлами и другими неметаллами.
Ответ 5.
Углекислый газ – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой.
Ответ 2.
FeO – основный оксид железа(II) черного цвета, не токсичен, не растворим в воде, реагирует
— с кислотами,
— с щелочами(сплавление),
— с углеродом(восстановление, t > 1000 C):
FeO + C = Fe + CO
— с кислородом(происходит окисление железа, t >400 C):
6FeO + O2 = 2Fe3O4
Ответ 5.
Задание 3:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Al(OH)3
Б) P2O3
В) MgBr2
Г) P
Реагенты:
1) HBr, KOH, Ba(OH)2
2) KOH, Na3PO4, Cl2
3) HNO3, HCl, Cl2
4) O2, KOH, HNO3
5) S, HCl, O2
Решение:
Al(OH)3 – амфотерное нерастворимое основание, реагирует
— с щелочами,
— с кислотами.
Ответ 1.
P2O3 – оксид фосфора(III), в виде белых хлопьев, высокотоксичное соединение, реагирует
— с водой,
— с галогенами,
— с щелочами,
— с неметаллами(сера, кислород)
Ответ 4.
MgBr2 – бромид магния, средняя соль, растворимая в воде, взаимодействует
— с кислотами,
— с щелочами,
— с солями(при наличии осадка),
— с галогенами(стоящими выше в ПСЭ, чем бром),
Ответ 2.
Фосфор – это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами(например, с азотной):
P(красн.) + 5HNO3(к.) = H3PO4 + 5NO2 + H2O
3P + 5HNO3(р.) + 2H2O = H3PO4 + 5NO
Ответ 4.
Задание 4:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Na2S
Б) Zn(OH)2
В) P2O5
Г) S
Реагенты:
1) O2, Fe, Br2
2) Cl2, FeSO4, HI
3) Li2O, Sr(OH)2, H2O
4) NH3, Ca3(PO4)3, HNO3
5) KOH, H3PO4, HCl
Решение:
Сульфид натрия – это растворимая средняя соль, которая реагирует
— с водой,
— с кислотами,
— с солями,
— с галогенами.
Ответ 2
Гидроксид цинка – это амфотерное нерастворимое основание, проявляет все свойства амфотерного гидроксида, реагируя
— с кислотами,
— с щелочами.
Ответ 5
Оксид фосфора(V) – это солеобразующий кислотный оксид, который вступает в реакцию
— с основаниями,
— с основными оксидами,
— с солями,
— с водой(образуя ортофосфорную кислоту).
Ответ 3
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, — с кислородом(образуя оксиды),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами.
Ответ 1
Задание 5:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) NH4Br
Б) HNO3
В) Ba(OH)2
Г) Na
Реагенты:
1) HCl, CO2, K3PO4
2) AgNO3, NaOH, Ca(OH)2
3) Pb, S, C
4) CaO, Br2, Na2SO4
5) S, Cl2, H2O
Решение:
Бромид аммония(NH4Br) – это средняя соль, которая при взаимодействии с щелочами дает гидроксид аммония, являющийся неустойчивым соединением и распадается на аммиак и воду. Также он реагирует с солями(если дает осадок). Ответ 2
Азотная кислота – самая удивительная кислота, которая являясь сильным окислителем, не дает ожогов, как серная кислота. Реагирует с огромным количеством соединений, среди которых
— металлы,
— неметаллы(сера, углерод, йод, фосфор),
— основания,
— соли,
— оксиды.
Важно! HNO3 никогда не выделяет водород при взаимодействии с металлами. Всегда выделяются соединения азота – от солей аммония до NO2.
Здесь подходит вариант ответа 3.
Гидроксид бария(Ba(OH)2) – это щелочь, которая проявляет типичные свойства всех подобных веществ, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 1.
Натрий – крайне опасный щелочной металл, который нельзя даже держать в руке по причине разъедания кожных покровов. Na вступает в экзотермическую реакцию с водой при комнатной температуре, при этом реакция идет достаточно бурно с выделением чистого водорода.
Как и все щелочные металлы, он реагирует с неметаллами(сера, галогены), кислотами, солями.
Ответ 5.
Задание 6:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) сера
Б) кислород
В) хлор
Г) фосфор
Реагенты:
1) H2S, KOH, C2H6
2) O2, SO3, C2H6
3) CH4, Zn, N2
4) Hg, HNO3, Cl2
5) O2, S, Cl2
Решение:
Сера — неметалл желтого цвета, реагирует со многими веществами, например,
— с кислородом(образуя SO2, SO3),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами(ртуть, натрий, железо).
Ответ 4
Кислород(O2) – главный неметалл для реакций горения, главный окислитель, главный элемент для органической жизни. Этот неметалл способен к огромному числу реакций как с простыми, так и со сложными веществами.
В данном варианте нам подходит вариант ответа 3.
Хлор(Cl2) – галоген, способный реагировать с щелочами, некоторыми кислотами(H2S), металлами, неметаллами.
Ответ 1.
Фосфор(P) — это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами.
Ответ 5.
Задание 7:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Ba(OH)2
Б) ZnO
В) Ag
Г) NH4Cl
Реагенты:
1) C, HCl, KOH
2) O2, Br2, HNO3
3) CO, CaCl2, SO2
4) HBr, Zn(OH)2, K2CO3
5) AgNO3, Sr(OH)2, H2SO4 (конц.)
Решение:
Гидроксид бария(Ba(OH)2) — это щелочь, которая проявляет типичные свойства всех растворимых оснований, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 4
Оксид цинка(ZnO) – это амфотерный оксид, нерастворим в воде, не токсичен, реагирует с щелочами, кислотами, кислотными оксидами, неметаллами; ответ 1
Серебро(Ag) – это неактивный благородный металл, взаимодействует с азотной кислотой, серой, галогенами, кислородом(при нагревании), ответ 2
Хлорид аммония(NH4Cl) – это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5.
Задание 8:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Si
Б) SrO
В) HNO3
Г) Ca(HCO3)2
Реагенты:
1) CuSO4, O2, SO2
2) O2, Mg, NaOH
3) Cu, Ba(OH)2, MgCO3
4) CO2, ZnO, H3PO4
5) H3PO4, HBr, Ca(OH)2
Решение:
Кремний(Si) – неметалл, обладает схожими с углеродом свойствами, с трудом вступает в реакции при обычных условиях, способен реагировать
— с кислородом,
— с металлами(с образованием силицидов),
— с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + H2↑
Ответ 2
Оксид стронция(SrO) – это основный оксид, хорошо растворяется в воде, реагирует как и все основные оксиды щелочно — земельных металлов с кислотами, кислотными оксидами, солями, амфотерными соединениями; ответ 4
Азотная кислота(HNO3) – уже была расписана выше, в данном варианте выбираем пункт 3.
Гидрокарбонат кальция(Ca(HCO3)2) – это кислая соль, которая проявляет свойства растворимых кислот, при этом реагирует с гидроксидом кальция:
Ca(HСО3)2 + Cа(OН)2 = 2CaCO3 + 2H2O
Ответ 5
Задание 9:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) P4
Б) Fe2O3
В) Cu2O
Г) NH4Cl
Реагенты:
1) HCl, HNO3, K2CO3
2) O2, Zn, NaOH (р-р)
3) CaCl2, AgNO3, CO
4) O2, CO, HCl
5) H2SO4 (конц.), NaOH, Pb(NO3)2
Решение:
Фосфор(P4) – это формула белого фосфора, имеет такое обозначение за счет тетраэдрической структуры молекулы данной аллотропии; белый фосфор реагирует с кислородом, металлами, щелочами(с образованием фосфина), с кислотами.
Ответ 2
Оксид железа(Fe2O3) – это амфотерный оксид железа, красно-коричневого цвета, нерастворим в воде, реагирует с кислотами, солями, щелочами, водородом(восстановление).
Ответ 1.
Оксид меди(Cu2O) – представляет собой нерастворимый в воде оксид красно-бурого цвета, реагирует при относительно невысоких t с кислотами(серной, азотной, соляной); при высоких t
— с металлами(Al),
— с неметаллами(O, H, S, галогены),
— с аммиаком,
— c угарным газом:
Cu2O + CO = 2Cu + CO2
— с оксидами щелочных металлов:
Cu2O + BaO = BaCu2O2.
Ответ 4
Хлорид аммония(NH4Cl) — это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5
Задание 10:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CO2
Б) CuCl2
В) NH3
Г) FeS2
Реагенты:
1) HNO3, HBr, O2
2) AgNO3, Na2S, NaI
3) Mg, CaO, H2O
4) KOH, H2SO4, FeS
5) H2SO4, O2, Na2SO4
Решение:
CO2 – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой,
— с некоторыми металлами:
2Mg + CO2 = 2MgO + C
Ответ 3
Хлорид меди(CuCl2) – средняя соль, растворимая в воде, проявляет типичные свойства солей, реагируя с кислотами, щелочами, а также с солями сульфидов и йодидов, при взаимодействии с которыми выделяются соответствующие нерастворимые соединения.
Ответ 2
Аммиак(NH3) – это водорастворимый токсичный газ, проявляющий основные свойства, тем самым легко вступает в реакции с кислотами(серной, азотной), окисляется кислородом с образованием двух разных продуктов азота:
4NH3 + 3O2 = 2N2 + 6H2O(сгорание)
4NH3 + 5O2 = 4NO + 6H2O
Ответ 1
Дисульфид железа(FeS2) – это средняя соль, которая является составляющей частью минерала пирита; способна разлагаться на отдельные элементы под действием высокой t(1170 С), реагирует с азотной, серной и другими кислотами, а также окисляется кислородом до оксида Fe(III).
Ответ 1
На сегодня все!
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.»
Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания.
Примечания:
1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества.
2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации.
3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту.
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
1 | P-3 — 8e → P+5
8 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Ba2+ + 2OH— + 2H+ + 2NO3— = Ba2+ + 2NO3— + 2H2O
OH— + H+ = H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
8 | N+5 + e → N+4
1 | S-2 — 8e → S+6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
2 | Mn+7 + 5e → Mn+2
5 | S+4 — 2e → S+6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2HBr = MgBr2 + 2H2O
Mg(OH)2 + 2H+ + 2Br— = Mg2+ + 2Br— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
2 | Mn+7 + 1e → Mn+6
1 | N+3 — 2e → N+5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2
HCO3— + H+ = H2O + CO2
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
LiHSO4 + Sr(NO3)2 = SrSO4 + LiNO3 + HNO3
Li+ + HSO4— + Sr2+ + 2NO3— = SrSO4 + Li+ + H+ + 2NO3—
Sr2+ + HSO4— = SrSO4 + H+
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 3CaSO3 + H2O = 2MnO2 + 3CaSO4 + 2KOH
2 | Mn+7 + 3e → Mn+4
3 | S+4 — 2e → S+6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
K2HPO4 + 2HCl = 2KCl + H3PO4
2K+ + HPO42- + 2H+ + 2Cl— = 2K+ + 2Cl— + H3PO4
HPO42- + 2H+ = H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
1 | Cr+6 + 3e → Cr+3
3 | Fe+2 — e → Fe+3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
FeSO4 + (NH4)2CO3 = FeCO3 + (NH4)2SO4
Fe2+ + SO42- + 2NH4+ + CO32- = FeCO3 + 2NH4+ + SO42-
Fe2+ + CO32- = FeCO3
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Cu + 2KNO3 + 2H2SO4 = CuSO4 + 2NO2 + K2SO4 + 2H2O
1 | Cu0 — 2e → Cu+2
2 | N+5 + e → N+4
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
СaBr2 + (NH4)2HPO4 = CaHPO4 + 2NH4Br
Ca2+ + 2Br— + 2NH4+ + HPO42- = CaHPO4 + 2NH4+ + 2Br—
Ca2+ + HPO42- = CaHPO4
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2KMnO4 + 16HBr = 2MnBr2 + 2KBr + 5Br2 + 8H2O
2 | Mn+7 + 5e → Mn+2
5 | 2Br— — 2e → Br20
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
(CH3COO)2Ba + KHSO4 = BaSO4 + CH3COOK + CH3COOH
Ba2+ + 2CH3COO— + K+ + HSO4— = BaSO4 + CH3COO— + K+ + CH3COOH
Ba2+ + CH3COO— + HSO4— = BaSO4 + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
C + H2SO4 = 2CO2 + 2SO2 + H2O
1 | C0 — 4e → C+4
2 | S+6 + 2e → S+4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Fe3+ + 3Cl— + 3Na+ + 3HCO3— = Fe(OH)3 + 3CO2 + 3Na+ + 3Cl—
Fe3+ + 3HCO3— = Fe(OH)3 + 3CO2
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
1 | 2N-3 — 6e → N20
2 | Mn+7 + 3e → Mn+4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3NaH2PO4 + 6KOH = 2K3PO4 + Na3PO4 + 6H2O
3Na+ + 3H2PO4— + 6K+ + 6OH— = 6K+ + 2PO43- + 3Na+ + PO43- + 6H2O
H2PO4— + 2OH— = PO43- + 2H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O
1 | I20 — 10e → 2I—
10 | N+5 + 1e → N+4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
NH4F + HNO3 = NH4NO3 + HF
NH4+ + F— + H+ + NO3— = NH4+ + NO3— + HF
F— + H+ = HF
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2NH3 + 3Na2O2 = N2 + 6NaOH
1 | 2N-3 — 6e → N20
6 | O-1 + 1e → O-2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
Na+ + H2PO4— + 2Na+ + 2OH— = 3Na+ + PO43- + 2H2O
H2PO4— + 2OH— = PO43- + 2H2O
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
1 | P-3 — 8e → P+5
4 | S+6 + 2e → S+4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
1 | S+4 — 2e → S+6
1 | Br20 + 2e → 2Br—
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Al(NO3)3 + 3KHCO3 = Al(OH)3 + 3CO2 + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
Принято считать, что современный способ экзаменации слов нет, какой сложный. Ещё бы! Когда впервые в начале нулевых ЕГЭ был введён в российских школах (русский язык был первым), это было настоящим шоком для учеников, учителей и родителей.
ЕГЭ по прежнему остаётся огромной нагрузкой и стрессом для выпускников, но… Если взглянуть правде в глаза, насколько сидеть и решать тест труднее, чем стоять перед преподавателем и отвечать на вопросы?
Я учитель иностранных языков (английский и немецкий), физику и химию не знаю от слова «совсем». Но тесты ЕГЭ решаю на твёрдую «3», порог переступаю. (Некоторые считают, что переступил порог, значит «сдал на 5», на самом деле — переступить порог — это набрать минимальное количество баллов на «3». Но уже хорошо!)
Где-то методом исключения, где-то с помощью своего английского языка выхожу из положения, а где-то и наугад удачно ткну. Таким образом, я вполне себе успешно решаю физику и химию, с которыми у меня беда. А поставь меня перед преподавателем, я рот открою, и что говорить — не знаю!
А вы как считаете?
Попрошу вас проголосовать.
Пробный тренировочный вариант №6 по химии 11 класс в новом формате решу ЕГЭ 2023 года задания с ответами и решением в формате реального экзамена ЕГЭ 2023 из открытого банка тренировочных вариантов ФИПИ по новой демоверсии.
Решу ЕГЭ 2023 вариант №6 по химии 11 класс задания с ответами
Задания и ответы с варианта
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1) Cl
- 2) Сa
- 3) Mg
- 4) S
- 5) Mn
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковую конфигурацию внешнего энергетического уровня.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые в кислородсодержащем анионе состава RO способны проявлять одинаковую степень окисления.
4. Из предложенного перечня выберите два вещества, в которых присутствуют только ковалентные полярные связи.
- 1) NH4NO3
- 2) CH3OH
- 3) H2O2
- 4) C6H6
- 5) H2S
5. Среди предложенных веществ, расположенных в пронумерованных ячейках, выберите:
- А) кислоту, соответствующую оксиду состава R2O3,
- Б) среднюю соль,
- В) основную соль
6. К одной из двух пробирок с бесцветным раствором вещества Х добавили раствор дигидрофосфата бария, а к другой – окрашенный раствор вещества Y. В результате в каждой из пробирок наблюдалось выпадение в осадок соли. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) H2SO4
- 2) FeCl3
- 3) Ba(OH)2
- 4) Na2SiO3
- 5) K2CrO4
11. Из предложенного перечня выберите два вещества, которые являются гомологами по отношению друг к другу.
- 1) C3H7COOH
- 2) CH3C(O)OC3H7
- 3) CH3COOH
- 4) CH3CHO
- 5) CH3OH
13. Из предложенного перечня выберите два вещества, которые вступают в реакцию поликонденсации.
- 1) метиламин
- 2) цистеин
- 3) глюкоза
- 4) трипальмитат глицерина
- 5) линолевая кислота
17. Из предложенного перечня выберите все реакции, которые являются одновременно экзотермическими и реакциями соединения:
- 1) NaOH + HCl →
- 2) Ca + H2O →
- 3) N2 + O2 →
- 4) Fe + Cl2 →
- 5) K2O + H2O →
23. В реакторе с постоянным объемом находится смесь этилена и водорода, причем молярные концентрации веществ равны 6 моль/л и 8 моль/л в порядке перечисления. Смесь нагрели в присутствии катализатора, в результате протекания обратимой реакции в системе установилось химическое равновесие. В равновесной смеси мольное соотношение этана и этилена оказалось равно 2 : 1. Используя данные задачи, определите равновесные концентрации водорода (X) и этана (Y). Выберите из списка номера правильных ответов:
- 1) 1,0 моль/л
- 2) 2,0 моль/л
- 3) 3,0 моль/л
- 4) 4,0 моль/л
- 5) 5,0 моль/л
- 6) 6,0 моль/л
26. При некоторой температуре в 1 л воды растворяется 582,4 л (в расчете на н. у.) бромоводорода. Вычислите массовую долю бромоводорода в его насыщенном при данной температуре растворе. Ответ дайте в процентах и округлите до десятых.
27. Вычислите тепловой эффект реакции CH4 (г.) + 2O2 (г.) = 2H2O (ж.) + CO2 (г.) + Q, если при полном сгорании 13,6 г метана выделилось 756,5 кДж теплоты. Ответ запишите с точностью до целых.
28. При сжигании 33,6 г железа в избытке хлора была получена соль массой 87,75 г. Вычислите долю выхода соли в процентах от теоретического. В ответ запишите целое число.
29. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого осадка и выделением газа, входящего в состав воздуха. Запишите уравнение только одной реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня веществ выберите сильное основание и вещество, между которыми протекает реакция ионного обмена с образованием двух солей. Осадок в итоговой реакционной смеси отсутствует. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
31. Оксид железа (III) сплавили с карбонатом натрия. Плав растворили в разбавленном растворе серной кислоты, к полученному раствору добавили иодид натрия. Образовавшееся простое вещество выделили и ввели в реакцию с горячей концентрированной азотной кислотой, при этом наблюдали выделение бурого газа. Составьте уравнения четырех описанных реакций.
33. При сжигании органического вещества Х массой 19,32 г было получено 20,61 л (при н.у.) углекислого газа и 8,28 мл воды. Данное вещество может вступать с бромом только в реакцию замещения и содержит функциональные группы при нечетных атомах углерода. Также известно, что одним из продуктов взаимодействия этого вещества с избытком водного раствора гидроксида калия является метиловый спирт. На основании данных в задаче:
1. Проведите необходимые и установите молекулярную формулу неизвестного вещества Х;
2. Составьте возможную структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
3. Напишите уравнение реакции вещества Х с избытком водного раствора гидроксида калия, используя структурные формулы веществ.
34. 39,4 г смеси хлорида натрия и безводного сульфата меди (II), содержащей 8,428 · 1023 атомов, растворили в воде. Через полученный раствор массой 200 г пропускали электрический ток до тех пор, пока на аноде не выделилось 3,36 л (при н. у.) газа. К оставшемуся после электролиза раствору прилили 5%-ный раствор гидроксида бария в количестве, необходимом для полного связывания сульфат-ионов. Вычислите массовую долю щелочи в конечном растворе.
Вам будет интересно:
Разговоры о важном материалы для 1-11 классов. Волонтеры России (5 декабря 2022)
Метки: 11 класс варианты и ответы ЕГЭ тренировочный вариант химия
Чтобы поделиться, нажимайте
Представляем вашему вниманию задание 30 из реального ЕГЭ 2020 и резервных дней основного периода (16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 29
Реальный ЕГЭ 2020. Задание 30. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бесцветного раствора, в котором находятся только кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
SO2 + Cl2 + 2H2O = 2HCl + H2SO4
S+4 – 2e = S+6 1 восстановитель
Cl20 + 2e = 2Cl-1 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с выделением газа и образованием раствора, в котором находится только кислота. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
РН3 + 8HNO3 =H3PO4 + 8NO2↑ + 4H2O
P-3 – 8e = P+5 1 восстановитель
N+5 + 1e = N+4 8 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2↑ + 3H2O
2Cu+1 – 2e = 2Cu+2 1 восстановитель
N+5 + 1e = N+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и двух солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O
2I-1 – 2e = I20 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с выделением газа и образованием двух солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8H2O
2O-1 – 2e = O20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает c образованием соли и кислоты, но без выпадения осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
(NH4)2SO3 + Cl2 + H2O= (NH4)2SO4 + 2HCl
S+4 – 2e = S+6 1 восстановитель
2Cl-1 + 2e = Cl20 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми нет выделения газа и образуется одна соль и вода. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2Fe(OH)2 + H2O2 + 3H2SO4 = Fe2(SO4)3 + 6H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
2O-1 + 2e = 2O-2 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бурый газ и образуется соль. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2↑ + 3H2O
Fe+2 – 1e = Fe+3 1 восстановитель
N+5 + 1e = N+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ с резким запахом. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
Cu2O + 3H2SO4 = 2CuSO4 + SO2↑ + 3H2O
2Cu+1 – 2e = 2Cu+2 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ с резким запахом. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2FeO + 4H2SO4 = Fe2(SO4)3 + SO2↑ + 4H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми сопровождается получением простого газообразного вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 2NH3 = 2MnO2 ↓+ 2KOH + N2↑ + 2H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
или
6KMnO4 + 2NH3 +3Ba(OH)2 = 3K2MnO4 + 3BaMnO4↓ + N2↑ + 6H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 1e = Mn+6 6 окислитель
В условии задания ничего не говорится про осадок, но это НЕ противоречит условию задания, в котором сказано, что должно образоваться простое газообразное вещество, и оно образуется в этих реакциях.
Реальный ЕГЭ 2020. Задание 30. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуются три соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
2Fe+2 – 2e = 2Fe+3 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми наблюдается образование простого вещества, которое сопровождается выделением газа. В этой реакции атом-окислитель переходит в наименьшую степень окисления. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
8HI + H2SO4 = 4I2 + H2S↑ + 4H2O
2I-1 – 2e = I20 4 восстановитель
S+6 + 8e = S-2 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит образование простого вещества, которое сопровождается выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaBr + 3H2SO4 = Br2 + SO2↑ +2NaHSO4 + 2H2O
2Br-1 – 2e = Br20 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Возможен вариант 2NaBr + 2H2SO4 = Br2 + SO2↑ +Na2SO4 + 2H2O
Реальный ЕГЭ 2020. Задание 30. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит образование осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 3(NH4)2SO3 +H2O = 2MnO2↓ + 3(NH4)2SO4 + 2KOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор зелёного цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaMnO4 + NaNO2 + 2NaOH = 2Na2MnO4 + NaNO3 + H2O
N+3 – 2e = N+5 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми катион металла окисляется и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + SO2 + 2H2O
2Fe+2 – 2e = 2Fe+3 1 восстановитель
S+6 + 2e = S+4 1 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + 16HCl = 5Cl2↑ + 2MnCl2 + 2KCl + 8H2O
2Cl-1 – 2e = Cl20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор жёлтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Cr+3 – 3e = Cr+6 2 восстановитель
2O-1 + 2e = 2O-2 3 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется осадок и бесцветный раствор. В результате реакции не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
3Na2SO3 + 2NaMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2NaOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор. В результате реакции не выделяется газ и не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
N+3 – 2e = N+5 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бесцветный газ, а в растворе образуется кислота. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
PH3 + 4H2SO4 = H3PO4 + 4SO2↑ + 4H2O
P-3 – 8e = P+5 1 восстановитель
S+6 + 2e = S+4 4 окислитель
Реальный ЕГЭ 2020. Задание 30. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бурый газ и образуется окрашенный раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
CuS + 8HNO3 = CuSO4 + 8NO2↑ + 4H2O
S-2 – 8e = S+6 1 восстановитель
N+5 + 1e = N+4 8 окислитель
Резерв
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется простое вещество и две соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
6NaBr + Na2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4Na2SO4 + 7H2O
2Br—1 – 2e = Br20 3 восстановитель
2Cr+6 + 6e = 2Cr+3 1 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется раствор зелёного цвета. В результате реакции не образуется осадок и не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
KNO2 + 2KMnO4 + 2KOH = KNO3 + 2K2MnO4 + H2O
N+3 – 2e = N+5 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется осадок и бесцветный раствор. В результате реакции не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
3K2SO3 + 2KMnO4 + H2O = 3K2SO4 + 2MnO2↓ + 2KOH
S+4 – 2e = S+6 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор. В результате реакции не выделяется газ и не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NaMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + Na2SO4 + 3H2O
N+3 – 2e = N+5 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми молекула восстановителя отдаёт три электрона. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NH3 + 3Na2O2 = N2 + 6NaOH
2N-3 – 6e = N20 1 восстановитель
2O-1 + 2e = 2O-2 3 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется простое газообразное вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2NH3 + 2NaMnO4 = N2↑ + 2MnO2↓ + 2NaOH + 2H2O
2N-3 – 6e = N20 1 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется два газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2H2SO4 + C = 2SO2↑ + CO2↑ + 2H2O
C0 – 4e = C+4 1 восстановитель
S+6 + 2e = S+4 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется только кислота и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
S0 – 6e = S+6 1 восстановитель
N+5 + 1e = N+4 6 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми происходит изменение цвета раствора. В результате реакции не образуется осадок и не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Развернуть/свернуть решение
2KMnO4 + Na2SO3 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
S+4 – 2e = S+6 1 восстановитель
Mn+7 + 1e = Mn+6 2 окислитель
Реальный ЕГЭ 2020 (резерв). Задание 30. Вариант 10
Развернуть/свернуть решение
NaNO2 + NH4Cl = N2↑ + NaCl + 2H2O
N-3 – 3e = N0 1 восстановитель
N+3 + 3e = N0 1 окислитель
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку