Образовательный портал для подготовки к экзаменам
Химия
Сайты, меню, вход, новости
Задания
Версия для печати и копирования в MS Word
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
Спрятать решение
Решение.
Составим уравнение:
Ответ: 14,4 г.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2015 по химии
Спрятать решение
·
·
Раушания Рифовна 18.06.2016 13:30
А откуда здесь 6,67?Объясните пожалуйста.
Kirill Goryanchev 26.03.2017 17:52
Возможна реакция: 4H2S + O2 -> 2S + 2H2O
Почему мы именно по этой реакции должны судить?
Александр Иванов
В условии есть слово, указывающее именно на реакцию .
Это слово идёт после «для» и перед «сжигания»
Kirill Goryanchev 28.03.2017 08:25
Хорошо! Тогда пожалуйста реакция ПОЛНОГО сжигания сероводорода: 2H2S + 4O2 = 2SO3 + 2H2O. Почему бы и нет?
Александр Иванов
При сжигании серы, сероводорода, сульфидов в избытке кислорода образуется оксид серы (IV).
Для превращения оксида серы (IV) в оксид серы (VI) необходим катализатор.
Kirill Goryanchev 28.03.2017 19:34
А что мешает написать его? У нас же не сказано конкретно что без катализатора реакция идёт.
Александр Иванов
Использовано слово «сжигание», которое не подразумевает наличие катализаторов.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Вычислите массу кислорода, необходимого для полного сжигания 6,72 л (н. у.) сероводорода. Ответ дайте в граммах с точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2015 по химии
2
Рассчитайте объём (н. у.) ацетилена, который выделится при взаимодействии с водой 50 г карбида кальция, содержащего 8% примесей. Ответ укажите в литрах с точностью до десятых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
3
Вычислите массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора. Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
4
Вычислите массу железной окалины, образующейся при сгорании в кислороде 5,1 г железа. Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
5
Вычислите массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). Ответ укажите в граммах с точностью до целых.
Источник: Типовые тестовые задания по химии под редакцией Ю. Н. Медведева. 2016 г.
Пройти тестирование по этим заданиям
- 29.03.2022
Начинаем собирать реальные варианты ЕГЭ 2022 года по химии. Все варианты собираются и публикуются после проведения экзамена.
- Смотреть реальные варианты ЕГЭ 2022 по всем предметам
ОБНОВЛЕНОЕ 27.05.2022
Варианты с досрочного ЕГЭ 2022 по химии, с реальной основной волны от 26 мая 2022. Смотрим, разбираем. Все варианты будут сопровождаться видеоуроками, на которых будут разобраны примеры решения, правильные ответы и т.д.
- Другие варианты ЕГЭ по химии (включая Статград)
Есть вопросы? Пишите их ниже! Обсудим, решим, ответим.
- Вариант досрочного ЕГЭ 2022 по химии от 21.03.2022 — 5 вариантов разборов
- Открытый вариант от ФИПИ ЕГЭ 2022 по химии (аналог досрочного варианта) от 28.04.2022
Вариант №1 от 26 мая 2022
Вариант №2 от 26 мая 2022
Вариант №3 с Дальнего востока
Вариант №4 с Дальнего востока
Как прошла основная волна ЕГЭ 2022 по химии
Некоторые задания с основной волны от 26.05.2022
Тренировочный вариант ЕГЭ по химии-2023 10 декабря 2022 с ответами и решениями.
Скачать тренировочный вариант ЕГЭ по химии 10 декабря 2022 года можно здесь.
22
Тренировочный вариант ЕГЭ по химии-2023
1 / 25
Установите соответствие между волокном и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЛОКНО | ТИП ВОЛОКНА |
| А) вискоза Б) триацетатный шёлк В) лавсан |
1) натуральное 2) искусственное 3) синтетическое 4) минеральное |
Запишите в таблицу выбранные цифры под соответствующими буквами.
2 / 25
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) цинк и раствор гидроксида натрия
Б) хлорид бария и сульфат меди (II) В) сульфид натрия и сульфат меди(II) Г) сульфат алюминия и раствор аммиака |
1) выпадение белого осадка
2) выделение газа без запаха 3) выделение газа с запахом 4) выпадение чёрного осадка 5) выпадение голубого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
3 / 25
В реактор постоянного объёма поместили водород и пары воды. При этом исходная концентрация йода составляла 0,6 моль/л. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие, при котором концентрации водорода и йодоводорода составили 0,3 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию I2 (Y). Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
4 / 25
Установите соответствие между способом воздействия на равновесную систему
2СO(г) + O2(г) ↔ 2СO2(г) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) увеличение концентрации угарного газа
Б) добавление катализатора В) повышение температуры Г) повышение давления |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5 / 25
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
21. Для веществ, приведенных в перечне, определите характер среды и водных растворов.
1) ZnSO4
2) LiOH
3) KNO2
4) Ba(NO3)2
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрации веществ во всех растворах (моль/л) одинаковая.
6 / 25
Установите соответствие между веществом и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaNO3
Б) BaCl2 В) Al2(SO4)3 |
1) металл и галоген
2) водород и галоген 3) водород и кислород 4) металл, водород и кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
7 / 25
Установите соответствие между анионом и свойством, которое может проявлять сера в составе этого аниона: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АНИОН | СВОЙСТВО СЕРЫ |
| А) сульфат
Б) сульфид В) сульфит |
1) только окислитель
2) только восстановитель 3) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8 / 25
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости химической реакции ацетона с водородом.
1) повышение давления в системе
2) уменьшение концентрации водорода
3) добавление катализатора
4) понижение температуры
5) увеличение объема сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
9 / 25
Из предложенного перечня выберите все типы реакции, к которым можно отнести взаимодействие ацетальдегида с гидроксидом меди(II).
1) реакция нейтрализации
2) окислительно-восстановительная реакция
3) реакция гидратации
4) обратимая реакция
5) гетерогенная реакция
Запишите в поле ответа номера выбранных типов реакций.
10 / 25
Задана следующая схема превращений веществ:
Х → Y → циклогексен
Определите, какие из указанных веществ являются веществами X и Y.
1) бензол
2) толуол
3) фенол
4) циклогексанол
5) циклогексанон
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
11 / 25
Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) метанол
2) этанол 3) бутанол-1 4) фенол 5) этилацетат 6) метиловый эфир муравьиной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
12 / 25
Установите соответствие между реагирующими веществами и продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) 1,2-дихлорпропан и цинк
Б) 1,2-дихлорпропан и гидроксид натрия (спирт.) В) 1-хлорпропан и натрий Г) 1,1-дихлорпропан и гидроксид натрия (водный) |
1) пропаналь
2) ацетон 3) н-гексан 4) пропанол-1 5) пропен 6) пропин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
13 / 25
Из предложенного перечня выберите два вещества, которые можно получить щелочным гидролизом жиров.
1) этандиол-1,2
2) пропантриол-1,2,3
3) ацетат натрия
4) олеат натрия
5) бензоат натрия
Запишите в поле ответа номера выбранных веществ.
14 / 25
Из предложенного перечня выберите все вещества, которые можно получить при взаимодействии пропанола-1 с концентрированной серной кислотой при нагревании.
1) пропаналь
2) пропанол-2
3) пропен
4) дипропиловый эфир
5) пропиловый эфир пропионовой кислоты
Запишите номера выбранных ответов.
15 / 25
Из предложенного перечня выберите два вещества, которые являются изомерами бутанола-2.
1) этилацетат
2) бутаналь
3) диэтиловый эфир
4) метилпропанол-2
5) бутанон
Запишите номера выбранных ответов.
16 / 25
Установите соответствие между общей формулой гомологического ряда и названием вещества, которое может принадлежать к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) CnH2n
Б) CnH2n-2 В) CnH2n-8 |
1) стирол
2) изопрен 3) циклооктан 4) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
17 / 25
Задана следующая схема превращений веществ:
1) Cu
2) Cl2
3) HCl (раствор)
4) Cu(OH)2
5) AgCl
Запишите в таблицу выбранные цифры под соответствующими буквами.
18 / 25
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) РЕАКЦИИ |
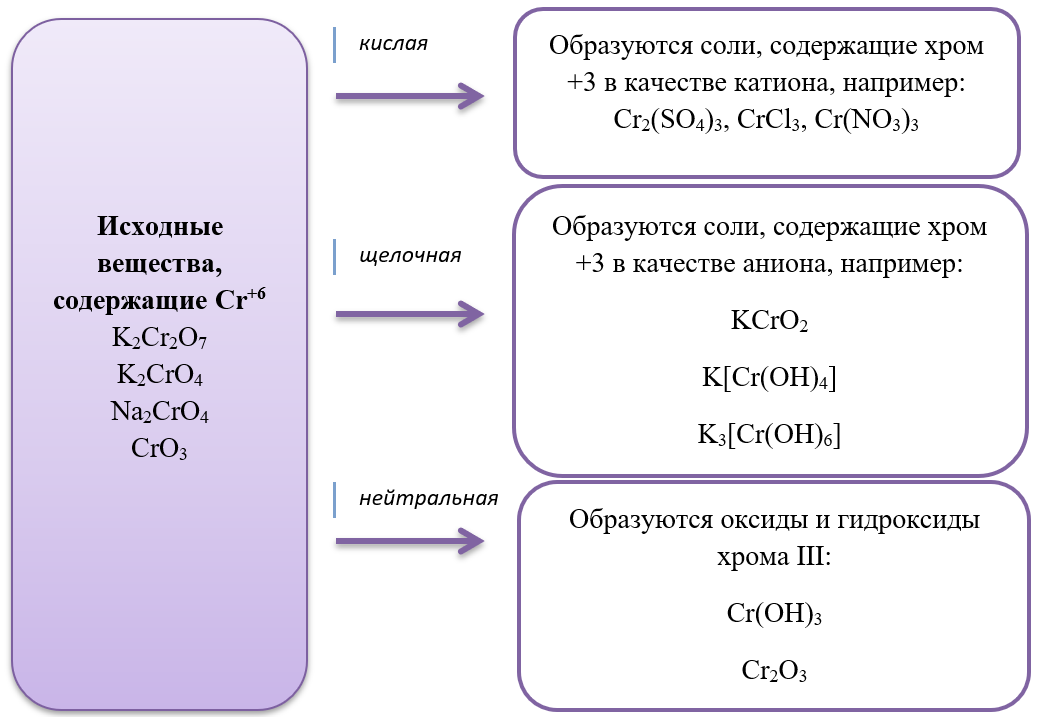
| А) K2Cr2O7 и KOH (р-р)
Б) K2CrO4 и H2SO4 (р-р) В) KCrO2 и H2SO4 (р-р) Г) Cr2(SO4)3 (изб.) и KOH (р-р) |
1) K3[Cr(OH)6]
2) K2SO4, K2Cr2O7 и H2O 3) K2CrO4 и H2O 4) Cr(OH)3 и K2SO4 5) K2SO4, Cr2(SO4)3 и H2O 6) K2SO4 и CrSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
19 / 25
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Mg
Б) ZnO В) BaCl2 Г) NaOH |
1) CO2, N2, H2SO4
2) Na2O, HNO3, CO 3) K3PO4, K2SO4, AgF 4) Li, O2, HNO3 5) NaHCO3, HBr, CO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20 / 25
Даны две пробирки с раствором вещества Х. В одну из них добавили соляную кислоту, а в другую — раствор вещества Y. При этом в каждой пробирке наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Al2S3
2) AlCl3
3) FeSO4
4) ZnSO3
5) Na2CO3
21 / 25
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия А) щёлочи; Б) кислой соли; В) кислотного оксида.
| (1) N2O | (2) Cr(OH)2 | (3) питьевая сода | |
| (4) негашёная известь | (5) угарный газ | (6) гашёная известь | |
| (7) NH4I | (8) CrO3 | (9) гидроксокарбонат меди (II) |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
22 / 25
Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, в которых присутствует ковалентная полярная химическая связь.
1) NH4Br
2) PCl3
3) Na2O2
4) BaBr2
5) NaClO3
Запишите в поле ответа номера выбранных веществ.
23 / 25
Для выполнения задания 3 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из числа указанных в ряду химических элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степени окисления. Запишите номера выбранных элементов.
24 / 25
Для выполнения задания 2 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 2 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотности образуемых ими летучих водородных соединений. Запишите номера выбранных элементов в нужной последовательности.
25 / 25
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N.
Ответом в задании 1 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего энергетического уровня. Запишите номера выбранных элементов.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) Cl; 2) F; 3) Mn; 4) Fe; 5) N
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1. Определите, атомы каких из указанных в ряду элементов имеют одинаковую конфигурацию внешнего энергетического уровня. Запишите номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке возрастания кислотности образуемых ими летучих водородных соединений. Запишите номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду химических элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степени окисления. Запишите номера выбранных элементов.
4. Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, в которых присутствует ковалентная полярная химическая связь.
1) NH4Br
2) PCl3
3) Na2O2
4) BaBr2
5) NaClO3
Запишите в поле ответа номера выбранных веществ.
5. Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия А) щёлочи; Б) кислой соли; В) кислотного оксида.
| (1) N2O | (2) Cr(OH)2 | (3) питьевая сода | |
| (4) негашёная известь | (5) угарный газ | (6) гашёная известь | |
| (7) NH4I | (8) CrO3 | (9) гидроксокарбонат меди (II) |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6. Даны две пробирки с раствором вещества Х. В одну из них добавили соляную кислоту, а в другую — раствор вещества Y. При этом в каждой пробирке наблюдали выделение газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Al2S3
2) AlCl3
3) FeSO4
4) ZnSO3
5) Na2CO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Mg
Б) ZnO В) BaCl2 Г) NaOH |
1) CO2, N2, H2SO4
2) Na2O, HNO3, CO 3) K3PO4, K2SO4, AgF 4) Li, O2, HNO3 5) NaHCO3, HBr, CO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) РЕАКЦИИ |
| А) K2Cr2O7 и KOH (р-р)
Б) K2CrO4 и H2SO4 (р-р) В) KCrO2 и H2SO4 (р-р) Г) Cr2(SO4)3 (изб.) и KOH (р-р) |
1) K3[Cr(OH)6]
2) K2SO4, K2Cr2O7 и H2O 3) K2CrO4 и H2O 4) Cr(OH)3 и K2SO4 5) K2SO4, Cr2(SO4)3 и H2O 6) K2SO4 и CrSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
9. Задана следующая схема превращений веществ:
1) Cu
2) Cl2
3) HCl (раствор)
4) Cu(OH)2
5) AgCl
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Установите соответствие между общей формулой гомологического ряда и названием вещества, которое может принадлежать к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ОБЩАЯ ФОРМУЛА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) CnH2n
Б) CnH2n-2 В) CnH2n-8 |
1) стирол
2) изопрен 3) циклооктан 4) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите два вещества, которые являются изомерами бутанола-2.
1) этилацетат
2) бутаналь
3) диэтиловый эфир
4) метилпропанол-2
5) бутанон
Запишите номера выбранных ответов.
12. Из предложенного перечня выберите все вещества, которые можно получить при взаимодействии пропанола-1 с концентрированной серной кислотой при нагревании.
1) пропаналь
2) пропанол-2
3) пропен
4) дипропиловый эфир
5) пропиловый эфир пропионовой кислоты
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите два вещества, которые можно получить щелочным гидролизом жиров.
1) этандиол-1,2
2) пропантриол-1,2,3
3) ацетат натрия
4) олеат натрия
5) бензоат натрия
Запишите в поле ответа номера выбранных веществ.
14. Установите соответствие между реагирующими веществами и продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) 1,2-дихлорпропан и цинк
Б) 1,2-дихлорпропан и гидроксид натрия (спирт.) В) 1-хлорпропан и натрий Г) 1,1-дихлорпропан и гидроксид натрия (водный) |
1) пропаналь
2) ацетон 3) н-гексан 4) пропанол-1 5) пропен 6) пропин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х Б) Х В) Х Г) Х |
1) метанол
2) этанол 3) бутанол-1 4) фенол 5) этилацетат 6) метиловый эфир муравьиной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Задана следующая схема превращений веществ:
Х → Y → циклогексен
Определите, какие из указанных веществ являются веществами X и Y.
1) бензол
2) толуол
3) фенол
4) циклогексанол
5) циклогексанон
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
17. Из предложенного перечня выберите все типы реакции, к которым можно отнести взаимодействие ацетальдегида с гидроксидом меди(II).
1) реакция нейтрализации
2) окислительно-восстановительная реакция
3) реакция гидратации
4) обратимая реакция
5) гетерогенная реакция
Запишите в поле ответа номера выбранных типов реакций.
18. Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости химической реакции ацетона с водородом.
1) повышение давления в системе
2) уменьшение концентрации водорода
3) добавление катализатора
4) понижение температуры
5) увеличение объема сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
19. Установите соответствие между анионом и свойством, которое может проявлять сера в составе этого аниона: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АНИОН | СВОЙСТВО СЕРЫ |
| А) сульфат
Б) сульфид В) сульфит |
1) только окислитель
2) только восстановитель 3) и окислитель, и восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20. Установите соответствие между веществом и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) NaNO3
Б) BaCl2 В) Al2(SO4)3 |
1) металл и галоген
2) водород и галоген 3) водород и кислород 4) металл, водород и кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
21. Для веществ, приведенных в перечне, определите характер среды и водных растворов.
1) ZnSO4
2) LiOH
3) KNO2
4) Ba(NO3)2
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрации веществ во всех растворах (моль/л) одинаковая.
22. Установите соответствие между способом воздействия на равновесную систему
2СO(г) + O2(г) ↔ 2СO2(г) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) увеличение концентрации угарного газа
Б) добавление катализатора В) повышение температуры Г) повышение давления |
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
23. В реактор постоянного объёма поместили водород и пары воды. При этом исходная концентрация йода составляла 0,6 моль/л. В результате протекания обратимой реакции
H2(г) + I2(г) ↔ 2HI(г)
в реакционной системе установилось химическое равновесие, при котором концентрации водорода и йодоводорода составили 0,3 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию I2 (Y). Выберите из списка номера правильных ответов:
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
24. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) цинк и раствор гидроксида натрия
Б) хлорид бария и сульфат меди (II) В) сульфид натрия и сульфат меди(II) Г) сульфат алюминия и раствор аммиака |
1) выпадение белого осадка
2) выделение газа без запаха 3) выделение газа с запахом 4) выпадение чёрного осадка 5) выпадение голубого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между волокном и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЛОКНО | ТИП ВОЛОКНА |
| А) вискоза Б) триацетатный шёлк В) лавсан |
1) натуральное 2) искусственное 3) синтетическое 4) минеральное |
Запишите в таблицу выбранные цифры под соответствующими буквами.
26. Какую массу 15%-ного раствора нитрата натрия надо взять, чтобы при добавлении 12 г этой же соли и одновременном выпаривании 12 г воды получить раствор с массовой долей соли 18%? Ответ выразите в граммах. (Запишите число с точностью до целых).
27. На основании термохимического уравнения реакции:
CH4 + 2O2 = CO2 + 2H2O + 893 кДж
определите объем затраченного кислорода, если известно, что при этом выделилось 357,2 кДж теплоты. Ответ выразите в литрах. (Запишите число точностью до сотых.)
28. При пропускании над нагретым оксидом меди(II) 5,6 л (н.у.) смеси аммиака с азотом было получено 19,2 г меди. Определите объемную долю примеси азота в исходной газовой смеси. (Запишите число с точностью до целых.)
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: гипохлорит натрия, хлорид хрома(II), гидроксид натрия, нитрат серебра, нитрит натрия, соляная кислота.
Допустимо использование водных растворов веществ.
29. Из предложенного перечня веществ выберите вещества, окислительно восстановительная реакция между которыми протекает с образованием желтого раствора. Запишите уравнение только с одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
CrCl2 + 2NaClO + 4NaOH = Na2CrO4 + 4NaCl + 2H2O
Cr+2 — 4e = Cr+6 | 1
Cl+ + 2e = Cl— | 2
CrCl2 — восставновитель за счет Cr+2
NaClO — окислитель за счет Cl+
30. Из предложенного перечня веществ выберите соль и вещество, между которыми возможна реакция ионного обмена, протекающая без выделения газа и выпадения осадка. Запишите молекулярное, ионное и сокращенное ионное уравнение только одной возможной реакции.
NaNO2 + HCl → NaCl + HNO2
Na+ + NO2— + H+ + Cl— → Na+ + Cl— + HNO2
NO2— + H+ → HNO2
31. Карбонат калия сплавили с кремнезёмом. Выделившийся при этом газ собрали и сожгли в нем магний. Образовавшееся простое вещество нагрели с алюминием. Продукт реакции обработали водой. Напишите уравнения четырех описанных реакций.
K2CO3 + SiO2 → K2SiO3 + CO2
2Mg + CO2 → 2MgO + C
4Al + 3C → Al4C3
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
Решение:
CH3-CH(OH)-CH3 + HBr = CH3-CHBr-CH3 + H2O
Набирается
33. При сгорании 6,7 г (н.у.) органического вещества А получили 8,96 л (н.у.) углекислого газа и 2,7 г воды. Известно, что вещество А не вступает в реакцию гидрохлорирования, а его молекула содержит два заместителя, которые максимально удалены друг от друга. Известно также, что вещество А может быть получено щелочным гидролизом тетрахлорсодержащего вещества Б.
На основании данных условий задания:
1) проведите необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин) и установите молекулярную формулу вещества А;
2) Составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) Напишите уравнение реакции получения вещества А щелочным гидролизом тетрахлорсодержащего вещества Б.
n(CO2) = 8,96 / 22,4 = 0,4 моль; n(C) = 0,4 моль
n(H2O) = 2,7 / 18 = 0,15 моль; n(H) = 0,15 · 2 = 0,3 моль
m(O) = 6,7 — 0,4 · 12 — 0,3 · 1 = 1,6 г
n(О) = 1,6/16 = 0,1 моль
СхНyOz
x:y:z = 0,4:0,3:0,1 = 4:3:1
Простейшая формула С4Н3O
Молекулярная формула вещества А — C8H6O2
Структурная формула вещества А :
34. Через 500 г раствора хлорида бария, в котором 47% от общей массы раствора составляет масса нейтронов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 896 мл (н.у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Ответы на вариант ЕГЭ по химии-2023
| № задания | Ответ | № задания | Ответ | № задания | Ответ |
| 1 | 34 | 11 | 34 | 21 | 1432 |
| 2 | 521 | 12 | 34 | 22 | 1321 |
| 3 | 15 | 13 | 24 | 23 | 63 |
| 4 | 15 | 14 | 5631 | 24 | 2141 |
| 5 | 638 | 15 | 1426 | 25 | 223 |
| 6 | 52 | 16 | 54 | 26 | 400 |
| 7 | 1235 | 17 | 25 | 27 | 17,92 |
| 8 | 3254 | 18 | 13 | 28 | 0,2 |
| 9 | 12 | 19 | 123 | ||
| 10 | 321 | 20 | 323 |
Ответы на вторую часть можете найти выше.
5 новых пробных тренировочных вариантов по химии 11 класс в формате заданий решу ЕГЭ 2022 с ответами и решением по новой демоверсии из открытого банка ФИПИ со всем изменениями 2022 года, каждый вариант содержит 34 задания от 6 марта 2022 года.
Тренировочный вариант №26: задания, ответы
Тренировочный вариант №27: задания, ответы
Тренировочный вариант №28: задания, ответы
Тренировочный вариант №29: задания, ответы
Тренировочный вариант №30: задания, ответы
Решать тренировочный вариант №26 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии содержат одинаковое число полностью заполненных подуровней. 1) Mg 2) Fe 3) N 4) Ar 5) Ca
Ответ: 25
2)Из указанных в ряду химических элементов выберите три элемента, электроотрицательность у которых выше, чем у марганца. Расположите выбранные элементы в порядке возрастания их высшей степени окисления. 1) Se 2) Ca 3) Br 4) K 5) As
Ответ: 513
3)Из предложенного перечня химических элементов выберите два элемента, которые могут иметь одинаковую степень окисления в образованных ими анионах с общей формулой ЭОх — . 1) C 2) N 3) I 4) Ti 5) K
Ответ: 23
4)Из предложенного перечня выберите два соединения, между структурными единицами которых имеют место водородные связи. 1) C2H6 2) CH3NH3Br 3) (CH3 )3N 4) (CH3 )2NH 5) CH3NH2
Ответ: 45
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) железной окалины; Б) несолеобразующего оксида; В) кислотного оксида.
Ответ: 927
6)К раствору сульфата меди(II) добавили раствор вещества Х, что привело к образованию раствора, практически не содержащего сильных электролитов. К раствору сульфата алюминия добавили избыток раствора вещества Y, что сопровождалось образованием осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сероводород 2) фтороводород 3) гидроксид калия 4) гидроксид бария 5) гидрат аммиака
Ответ: 45
11)Из предложенного перечня соединений выберите два таких, любые изомеры которых не могут содержать π-связи. 1) 1,2,4-трихлорпентан 2) циклогексанол 3) бутилацетат 4) бутанол-2 5) 2-нитропропан
Ответ: 14
12)Из предложенного перечня выберите все типы реакций, характерных как для метилциклопропана, так и для 1,3-диметилциклогексана. 1) гидрирование 2) галогенирование 3) гидрогалогенирование 4) ароматизация 5) горение
Ответ: 25
13)Из предложенного перечня выберите два реагента, с которыми не взаимодействует водный раствор метиламина. 1) сульфид свинца 2) уксусная кислота 3) сульфат хрома(III) 4) гидроксид кальция 5) нитрат железа(III)
Ответ: 14
17)Из предложенного перечня выберите все реакции, которые при наличии или отсутствии катализатора протекают с образованием разных продуктов. 1) разложение карбоната магния 2) взаимодействие уксусной кислоты и метанола 3) взаимодействие аммиака и кислорода 4) горение фосфина 5) разложение хлората натрия
Ответ: 35
18)Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции CuSO4 ∙ 5H2O(тв.) → CuSO4(тв.) + 5H2O. 1) добавление кварцевого песка 2) охлаждение системы 3) повышение температуры 4) измельчение исходного вещества 5) добавление воды.
Ответ: 34
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). 1) хлоруксусная кислота 2) перхлорат калия 3) хлорная кислота 4) метиламин
Ответ: 3124
23)В замкнутый реактор поместили смесь хлора, оксида азота(II) и нитрозилхлорида (NOCl), затем нагрели. В результате протекания обратимой реакции 2NO(г) + Cl2(г) ⇆ 2NOCl(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходную концентрацию нитрозилхлорида (X) и равновесную концентрацию оксида азота (II) (Y).
Ответ: 56
26)Какую массу 50%-ого раствора азотной кислоты (в граммах) нужно добавить к 200 г ее 5%-ного раствора, чтобы получить раствор с массовой долей азотной кислоты, равной 25%? (Запишите число с точностью до целых.)
Ответ: 160
27)Взаимодействие железа и серы описывается следующим термохимическим уравнением: Fe(тв.) + S(ромб.) = FeS(тв.) + Q. При образовании 8,8 г сульфида железа выделилось 10,01 кДж энергии. Вычислите количество энергии (в кДж), выделяющееся при расходовании 16,8 г железного порошка. (Запишите число с точностью до целых.)
Ответ: 30
28)Вычислите объем (в литрах) кислорода (н.у.), необходимый для полного обжига 8 г сульфида меди(I) при выходе реакции в 90%. (Запишите число с точностью до десятых.)
Ответ: 2,5
29)Из предложенного перечня выберите вещества, в результате окислительновосстановительной реакции, в которой атом-восстановитель меняет степень окисления с низшей на высшую. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите два вещества, при протекании ионного обмена между которыми образуется белый осадок, а в конечном растворе обнаруживаются гидроксид-ионы. Запишите молекулярное, полное и сокращенное ионные уравнения реакции с участием выбранных веществ.
31)К раствору сульфата хрома(III) добавили раствор сульфита цезия и наблюдали образование осадка и выделение бесцветного газа. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, а осадок обработали раствором, содержащим пероксид водорода и гидроксид натрия, и нагрели. В полученный при этом желтый раствор добавили раствор серной кислоты. Напишите уравнения четырех описанных реакций.
33)Смесь алюминия и сульфида алюминия, в которой соотношение числа атомов алюминия к числу атомов серы равно 5:3, растворили в 500 г разбавленного раствора соляной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 1,11 г смеси газов. К этому раствору добавили 20%- ный раствор гидроксида натрия в минимальном количестве, необходимом для получения однородного раствора без осадка. Вычислите массовую долю хлорида натрия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)Неизвестное органическое соединение содержит 29,51% углерода, 8,20% водорода, 39,34% кислорода и азот. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно получается в одну стадию из неорганического соединения и вещества, молекулы которого не образуют водородные связи. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида стронция (используйте структурные формулы органических веществ).
Решать тренировочный вариант №27 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии содержат одинаковое число спаренных s-электронов и спаренных p-электронов: 1) O 2) F 3) Li 4) N 5) Mg
Ответ: 25
2)Из указанных в ряду химических элементов выберите три элемента, являющихся металлами. Расположите выбранные элементы в порядке усиления восстановительных свойств соответствующих им простых веществ. 1) I 2) Sn 3) Mg 4) Xe 5) Rb
Ответ: 235
3)Из предложенного перечня химических элементов выберите два элемента, находящихся в одном периоде Периодической системы Д.И. Менделеева, которые образуют водородные соединения, структурная единица которых содержит два атома водорода. 1) Ga 2) Se 3) Ca 4) Be 5) S
Ответ: 23
4)Из предложенного перечня выберите два соединения, все ковалентные связи в которых образованы только по обменному механизму. 1) метан 2) хлор 3) гексагидроксохромат(III) натрия 4) бромид аммония 5) азотная кислота
Ответ: 12
6)В пробирку с бесцветным раствором вещества Х добавили раствор ацетата свинца, наблюдая при этом образование желтого осадка. Во вторую пробирку с окрашенным раствором вещества Y добавили раствор ацетата бария, что также сопровождалось образованием желтого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сероводород 2) хлорид аммония 3) хромат натрия 4) йодид калия 5) перманганат натрия
Ответ: 43
11)Из предложенного перечня соединений выберите два таких, изомеры которых могут содержать атомы углерода в sp2 -гибридизации. 1) диизопропиловый эфир 2) 1,3-диаминопропан 3) 1,2-диметилциклопропан 4) нитроэтан 5) метилпропиловый эфир
Ответ: 34
12)Из предложенного перечня выберите все углеводороды, из которых при окислении перманганатом калия в кислой среде можно получить соединение с двумя функциональными группами. 1) изопропилбензол 2) 1,2-диметилциклогексен-1 3) 1-метилциклогексен 4) 3,4-диметилгексен-3 5) 1,3-диметилбензол
Ответ: 235
13)Из предложенного перечня выберите два утверждения, справедливых и для анилина, и для глюкозы. 1) содержат атомы углерода в sp3 -гибридизации 2) являются твердыми веществами при обычных условиях 3) вступают в каталитическое гидрирование 4) содержат π-связи между атомами углерода 5) реагируют с бромом
Ответ: 35
17)Из предложенного перечня выберите все соединения, взаимодействие которых с концентрированным раствором азотной кислоты не относится к окислительно-восстановительным реакциям. 1) оксид серы(IV) 2) гидроксид меди(II) 3) фосфид алюминия 4) карбонат железа(II) 5) хромат калия
Ответ: 25
18)Из приведенного перечня выберите все реакции, скорость протекания которых при обычных условиях выше, чем скорость взаимодействия гранул цинка с 10%-ным водным раствором соляной кислоты. 1) взаимодействие таких же гранул цинка с 2%-ным водным раствором уксусной кислоты 2) взаимодействие раствора нитрата бария с раствором серной кислоты 3) взаимодействие цинковой пыли с 10%-ным водным раствором соляной кислоты 4) взаимодействие натрия с серой 5) взаимодействие железа с концентрированной серной кислотой
Ответ: 23
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов. 1) нитрат фениламмония (0,01 моль/л) 2) азотная кислота (0,02 моль/л) 3) гидроксид цезия (0,1 моль/л) 4) фенолят натрия (0,01 моль/л)
Ответ: 3412
23)В замкнутый реактор поместили смесь оксидов азота(II) и (IV) с кислородом, затем нагрели. В результате протекания обратимой реакции 2NO(г) + O2(г) ⇆ 2NO2(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходную концентрацию оксида азота(II) (X) и равновесную концентрацию оксида азота(IV) (Y).
Ответ: 15
26)В первой колбе, содержащей 100 мл воды, растворили 2,24 л хлороводорода, а во второй колбе, содержащей 200 г воды, растворили 672 мл хлороводорода. Рассчитайте массовую хлороводорода (в %) в растворе, полученном при смешении содержимого этих двух колб. (Запишите ответ с точностью до десятых.)
Ответ: 1,6
27)Обжиг сульфида свинца происходит согласно термохимическому уравнению: 2PbS(тв.) + 3O2 (г.) = 2PbO(тв.) + 2SO2 (г.) + Q При образовании 4,46 г оксида свинца(II) выделилось 8,32 кДж энергии. Рассчитайте объем израсходованного кислорода (л, н.у.), если при этом выделилось 374,4 кДж энергии. (Запишите число с точностью до десятых.)
Ответ: 30,2
28)Вычислите массу (в граммах) оксида азота(IV), который выделится при полном окислении 5,88 г сульфида хрома(III), содержащего 15% кварца, под действием концентрированной азотной кислоты. (Запишите число с точностью до десятых.)
Ответ: 27,6
29)Из предложенного перечня выберите вещества, в результате окислительновосстановительной реакции между которыми выделяется газ тяжелее кислорода и образуется окрашенный раствор. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня выберите два вещества, при протекании реакции ионного обмена между которыми образуются сильный и слабый электролиты. Запишите молекулярное, полное и сокращенное ионные уравнения реакции с участием выбранных веществ.
31)Навеску манганата бария обработали большим избытком концентрированной соляной кислоты. К образовавшемуся раствору добавили сульфат аммония. Выпавший осадок отфильтровали, высушили и прокалили при высокой температуре с избытком кокса. Получившуюся соль внесли в избыток концентрированной азотной кислоты и нагревали до окончания реакции. Напишите уравнения четырех описанных реакций.
33)Смесь оксида железа(II) и оксида железа(III) массой 8,28 г растворили в 100 г концентрированной азотной кислоты, взятой в избытке. Полученный раствор упаривали до тех пор, пока твердый остаток не стал представлять собой одно единственное вещество. Данное вещество растворили в воде, а к образовавшемуся раствору добавили избыток раствора сульфида калия. При этом наблюдали образование осадка без выделения газа. Полученный в результате этого осадок отфильтровали и взвесили. Его масса оказалась равна 10,92 г. Определите массовую долю соли в растворе после растворения смеси оксидов. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При сжигании 2,28 г неизвестного органического вещества А в качестве единственных продуктов сгорания были получены 1,8 г воды и 2,688 л углекислого газа (н.у.). Известно, что вещество А может быть синтезировано в одну стадию из углеводорода Б, который может реагировать с гидроксидом диамминсеребра в мольном соотношении 1:2 соответственно. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А из вещества Б. (используйте структурные формулы органических веществ).
Решать тренировочный вариант №28 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в основном состоянии имеют одинаковую конфигурацию третьего энергетического уровня: 1) Ti 2) Mn 3) Zn 4) Cr 5) Sc
Ответ: 24
2)Из указанных в ряду химических элементов выберите три элемента, электроотрицательность которых больше, чем у брома, и расположите их в порядке убывания атомного радиуса. 1) As 2) N 3) Cl 4) Be 5) F
Ответ: 325
3)Из предложенного перечня химических элементов выберите два элемента, находящихся в одном периоде Периодической системы, которые могут иметь одинаковую степень окисления в образованных ими анионах с общей формулой ЭО2 — . 1) Se 2) Br 3) S 4) Al 5) Cl
Ответ: 45
4)Из предложенного перечня выберите два соединения, в частицах которых присутствуют все типы химической связи, что и в молекуле этандиовой кислоты. 1) трибромметан 2) пероксид водорода 3) пероксид бария 4) серная кислота 5) бутин-2
Ответ: 25
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) средней соли; Б) основного гидроксида; В) кислотного гидроксида.
Ответ: 579
6)В две пробирки поместили одинаковые медные пластинки. В первую пробирку добавили раствор вещества Х и наблюдали уменьшение массы пластинки после окончания реакции. Во вторую пробирку добавили раствор вещества Y и наблюдали увеличение массы пластинки после окончания процесса. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) соляная кислота 2) уксусная кислота 3) ацетат серебра 4) ацетат свинца 5) азотная кислота
Ответ: 53
11)Из предложенного перечня формул выберите две таких, которые не могут соответствовать веществам с двумя функциональными группами. 1) C3H7O2N 2) C2H2O2 3) C3H9N 4) C4H4O4 5) C6NH7
Ответ: 35
12)Из предложенного перечня выберите все соединения, которые могут вступить в реакцию замещения под действием металлического натрия и не являются газами. 1) метанол 2) пентен-1 3) гексин-1 4) пропин 5) гексадиин-1,3
Ответ: 135
13)Из предложенного списка соединений выберите те, при гидролизе которых можно получить трисахариды. 1) крахмал 2) нейлон 3) сахароза 4) рибоза 5) целлюлоза
Ответ: 15
17)Из предложенного перечня процессов выберите все такие, которые сопровождаются выделением газа. 1) взаимодействие ацетата железа(II) и азотной кислоты 2) сплавление карбоната калия и оксида цинка 3) нагревание раствора нитрата калия 4) взаимодействие раствора сульфата железа(III) и сернистого газа 5) взаимодействие горячих растворов нитрата аммония и нитрита бария
Ответ: 125
18)Из предложенного перечня реакций выберите все такие, скорость протекания которых можно ускорить как нагреванием, так и повышением давления в системе. 1) разложение карбоната магния 2) окисление алюминия хлором 3) обжиг пирита 4) взаимодействие натрия с водой 5) окисление сульфита натрия в растворе кислородом воздуха
Ответ: 235
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов. 1) хлорид калия (0,1 моль/л) 2) триметиламин (0,2 моль/л) 3) бромид метиламмония (0,01 моль/л) 4) этандиовая кислота (0,03 моль/л)
Ответ: 4312
23)В замкнутый реактор, содержащий катализатор, поместили пары метанола, смесь угарного газа и водорода, затем нагрели. В результате протекания обратимой реакции CO(г) + 2H2(г) ⇆ CH3OH(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите исходные концентрации водорода (X) и метанола (Y).
Ответ: 64
26)К раствору соляной кислоты с массовой долей воды 63,5% добавили 200 мл воды и получили раствор с массовой долей хлороводорода 18,25%. Вычислите массу исходного раствора. (Запишите ответ с точностью до целых.)
Ответ: 200
27)Взаимодействие лития с водой происходит согласно термохимическому уравнению: 2Li(тв) + 2H2O(ж) = 2LiOH(p-p) + Н2(г) + Q При образовании 12 г гидроксида лития выделилось 102 кДж энергии. Рассчитайте объем израсходованной воды в мл, если при этом выделилось 51 кДж энергии. (Запишите ответ с точностью до десятых.)
Ответ: 4,5
28)Рассчитайте массовую долю неона в смеси с углекислым газом общей массой 2400 мг, которая может прореагировать минимум с 61 г 5%-ного раствора силиката натрия. (Запишите ответ с точностью до десятых.)
Ответ: 8,3
29)Из предложенного перечня веществ выберите два таких, окислительновосстановительная реакция между которыми протекает с образованием белого осадка бинарного соединения. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Навеску оксида фосфора(III) добавили к раствору, содержащему перекись водорода и гидроксид бария. Полученный раствор выпарили досуха, остаток прокалили с песком и углем. Выделившийся газ пропустили над оксидом железа(III), а образовавшийся при этом твердый остаток, представляющий собой одно вещество, растворили в разбавленной бромоводородной кислоте. При этом наблюдали образование желто-коричневого раствора. Напишите уравнения четырех описанных реакций.
33)Навеску смеси октагидрата гидроксида бария (Ba(OH)2 ·8H2O) и бромида цезия растворили в воде. В полученный раствор с массовой долей соли 5% пропустили углекислый газ до прекращения поглощения. Образовавшийся раствор разделили на две колбы. Первую колбу нагревали до окончания реакции. Во вторую колбу добавили 200 г 2%-ного раствора сульфата железа(III), причем реагенты прореагировали полностью. Вычислите массовую долю щелочи в исходном растворе, если известно, что отношение объемов газов, выделившихся из первой и второй колб, равно 7:6, а отношение масс бромида цезия во второй колбе и добавленного сульфата железа(III) равно 891:500. Растворимостью газов в воде пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При полном сгорании в кислороде неизвестного органического соединения массой 6,95 г в качестве единственных продуктов сгорания образовалось 7,84 л углекислого газа, 700 мг азота и 4,05 г воды. Определите молекулярную формулу данного соединения и установите его строение, если известно, что оно может быть получено в одну стадию из вещества с молекулярной формулой С7Н6О. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с нитрующей смесью.
Решать тренировочный вариант №29 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, атомы которых в возбужденном состоянии не содержат валентных электронов на трех подуровнях: 1) I 2) Ge 3) S 4) Tl 5) Sb
Ответ: 24
2)Из указанных в ряду химических элементов выберите три элемента, находящихся в одном периоде Периодической системы, и расположите выбранные элементы в порядке увеличения числа валентных электронов на внешнем энергетическом уровне. 1) As 2) P 3) Mo 4) Cr 5) Ga
Ответ: 451
3)Из предложенного перечня химических элементов выберите два, у каждого из которых сумма степеней окисления в высшем оксиде и водородном соединении равна шести. 1) S 2) Ti 3) Cl 4) Te 5) Al
Ответ: 35
4)Из предложенного перечня суждений о строении и химических связях выберите два таких, которые справедливы и для тетрагидроксоалюмината натрия, и для хлорида аммония. 1) содержат неполярную ковалентную связь 2) имеют немолекулярное строение 3) образуют водородные связи 4) содержат ковалентную связь, образованную по донорно-акцепторному механизму 5) имеют атомную кристаллическую решетку
Ответ: 24
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) двухосновной кислоты; Б) сильной кислоты; В) амфотерного гидроксида.
Ответ: 352
6)Навески порошков Х и Y внесли в пробирки с избытком концентрированной серной кислотой. В случае вещества Х масса конечного раствора равна массе исходного. В случае вещества Y масса конечного раствора больше массы исходного. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) аморфный углерод 2) сера 3) фосфор 4) хлорид калия 5) медь
Ответ: 54
11)Из предложенного перечня формул выберите две таких, которые могут соответствовать веществам как с циклическим, так и с разветвленным строением. 1) C4H4 2) C3H6 3) C3H8 4) C5H8 5) C4H8
Ответ: 45
12)Из предложенного перечня веществ выберите все углеводороды, которые вступают в реакцию гидратации с образованием продуктов, способных вступать в реакцию гидрирования. 1) 1,2-дифенилэтен 2) стирол 3) толуол 4) бутин-1 5) циклогексен
Ответ: 124
13)Из предложенного перечня выберите два утверждения, справедливых для любого дисахарида, но несправедливых для любого дипептида. 1) относятся к слабым электролитам 2) реагируют с горячим раствором серной кислоты 3) при полном сгорании в кислороде образуют только два продукта 4) содержат σ-связи углерод-кислород 5) в продуктах их кислотного гидролиза нет органических солей
Ответ: 35
17)Из предложенного перечня процессов выберите все, протекание которых сопровождается выделением тепла. 1) разложение карбоната бария 2) взаимодействие растворов серной кислоты и гидроксида кальция 3) образование оксида азота(II) из простых веществ 4) образование йодоводорода из простых веществ 5) восстановление железа из железной окалины под действием алюминия
Ответ: 25
18)Из предложенного перечня реакций выберите все, которые при одинаковых условиях протекают быстрее взаимодействия гранулы цинка и 5%-ного раствора соляной кислоты. 1) магний + вода 2) медь + 10%-ный р-р HCl 3) магний(порошок) + 5%-ный р-р HCl 4) гидроксид натрия(р-р) + 5%-ный р-р СН3СООН 5) аммиак (р-р) + 1%-ный р-р H2SO4
Ответ: 345
21)Для смесей, приведённых в перечне, определите характер среды их водных растворов. 1) аммиак (0,09 моль/л) + метиламин (0,01 моль/л) 2) уксусная кислота (1%) + ацетон (1%) 3) гидроксид натрия (0,1 моль/л) + перхлорат калия (1 г/л) 4) нитрат калия (0,2 моль/л) + сахароза (1%)
Ответ: 2413
26)Газообразный аммиак объемом 4,48 л (н.у.) растворили в 166,6 мл воды, затем добавили его 10%-ный раствор, что привело к образованию раствора с массовой долей растворенного вещества 5%. Вычислите массу (в граммах) добавленного 10%-ного раствора аммиака. (Запишите ответ с точностью до целых.)
Ответ: 102
27)При расходовании 8 г кислорода на окисление оксида серы(IV) выделилось 71 кДж энергии. Вычислите количество энергии, выделяющееся при образовании 24 г оксида серы(VI). (Запишите ответ с точностью до десятых)
Ответ: 42,6
28)Рассчитайте выход кислорода, если при прокаливании навески перманганата натрия массой 7,1 г было получено 6,5 г твердого остатка. (Запишите ответ с точностью до целых)
Ответ: 75
29)Из предложенного перечня веществ выберите два таких, окислительновосстановительная реакция между которыми протекает с образованием четырех продуктов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, в реакции ионного обмена между которыми образуется нерастворимый гидроксид. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Навеску брома добавили в раствор, полученный при пропускании газа, выделившегося при взаимодействии серы и концентрированной серной кислоты, в недостаток гидроксида бария. При этом наблюдали обесцвечивание смеси и выпадение осадка. Полученный осадок отделили, высушили и прокалили при очень высокой температуре в потоке водорода. Напишите уравнения четырех описанных реакций.
33)Навеску нитрата меди(II) и нитрата серебра массой 31,55 г растворили в 400 мл воды и подвергли полученный раствор электролизу с инертными электродами. Процесс остановили, когда в растворе не осталось катионов металла. В ходе электролиза через цепь прошло 0,275 моль электронов. Вычислите массовую долю азотной кислоты в образовавшемся растворе, если известно, что в ходе процесса на катоде не выделялся газ. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)Неизвестное органическое соединение состоит из трех элементов и содержит 60% углерода по массе. При этом массовая доля кислорода в 4 раза больше, чем водорода. Известно, что данное соединение при гидролизе дает единственный продукт, обладающий линейным строением. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение взаимодействия этого вещества с гидроксидом калия.
Решать тренировочный вариант №30 решу ЕГЭ 2022 по химии 11 класс:
1)Из указанных в ряду химических элементов выберите два элемента, число валентных электронов у которых совпадает с числом полностью заполненных подуровней: 1) S 2) Al 3) Br 4) Fe 5) Si
Ответ: 35
2)Из предложенного перечня выберите три элемента, неспособных образовывать оксиды. Расположите выбранные элементы в порядке уменьшения атомного радиуса. 1) He 2) F 3) N 4) B 5) Kr
Ответ: 521
3)Из предложенного перечня химических элементов выберите два таких, которые могут иметь одинаковые степени окисления в образованных ими анионах с общей формулой ЭОх — . 1) Se 2) Fe 3) Cs 4) Cr 5) Sr
Ответ: 24
4)Из предложенного перечня выберите два соединения, имеющих немолекулярное строение, ковалентные связи в которых образованы только по обменному механизму. 1) нитрат диметиламмония 2) пероксид стронция 3) фторид аммония 4) силан 5) оксид кремния(IV)
Ответ: 25
6)При пропускании сероводорода через пробирку с раствором вещества Х наблюдали образование осадка, растворимого в горячем растворе щелочи. При пропускании сероводорода в пробирку с раствором вещества Y наблюдали образование осадка, нерастворимого в щелочах и концентрированной соляной кислоте. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) нитрат алюминия 2) хлорид цинка 3) ацетат серебра 4) сульфат марганца 5) бромид железа(III)
Ответ: 53
11)Из предложенного перечня формул выберите две таких, которые не могут соответствовать веществам с двумя π-связями в молекуле. 1) C6H11N 2) C5H12O 3) C5H8 4) C3H6O3 5) C3H4O4
Ответ: 24
12)Из предложенного перечня выберите все углеводороды, из которых можно в одну стадию получить дикарбоновую кислоту или ее соль. 1) циклопентен 2) 1,4-диметилбензол 3) бутен-2 4) бензол 5) ацетилен
Ответ: 125
13)Из предложенного перечня выберите два реагента, с которыми реагирует триолеин, но не реагирует сахароза. 1) серная кислота (1%-ный р-р) 2) гидроксид меди(II) 3) бромная вода 4) водород 5) анилин
Ответ: 34
17)Из предложенного перечня реакции выберите все, относящиеся к окислительно-восстановительным и в результате протекания которых образуется простое вещество. 1) взаимодействие хлорида железа(III) и сульфида натрия 2) разложение дихромата аммония при сильном нагревании 3) взаимодействие твердого хлорида аммония и концентрированной серной кислоты 4) взаимодействие горячих растворов сульфата аммония и нитрита калия 5) взаимодействие растворов сульфата меди(II) и йодида калия.
Ответ: 1245
18)Из предложенного перечня реакций выберите все, которые можно замедлить как охлаждением, так и увеличением объема реакционного сосуда. 1) окисление меди азотной кислотой 2) взаимодействие сероводорода и сернистого газа 3) нитрование бензола 4) электролиз раствора хлорида калия 5) нитрование этана.
Ответ: 25
21)Для смесей, приведённых в перечне, определите характер среды их водных растворов. 1) фенол (0,1%) + изопропанол (0,2%) 2) муравьиная кислота (10 г/л) + хлороводород (1%) 3) фосфат натрия (0,01 моль/л) + карбонат калия (1 г/л) 4) гидроксид бария (0,1 моль/л) + сахароза (10 г/л)
Ответ: 1232
23)В замкнутый реактор, содержащий катализатор, поместили смесь паров метанола, водорода и угарного газа, затем нагрели. В результате протекания обратимой реакции СO(г) + 2Н2(г) ⇆ СН3ОН(г) в системе установилось равновесие. Используя данные, приведенные в таблице, определите равновесные концентрации водорода (X) и метанола (Y).
Ответ: 54
26)В результате упаривания 200 г 10%-ного раствора нитрата калия масса раствора уменьшилась на 15%. Какую массу 25%-ного раствора нитрата калия (в граммах) необходимо добавить к полученному в результате упаривания раствору для получения раствора с массовой долей соли равной 20%? (Запишите число с точностью до целых).
Ответ: 280
27)При нейтрализации 49 г неизвестной кислоты раствором щелочи при определенных условиях выделяется 48 кДж теплоты. Вычислите количество теплоты, выделяющееся при нейтрализации 9,8 г данной кислоты в тех же условиях. (Запишите ответ с точностью до десятых).
Ответ: 9,6
28)Вычислите минимальную массу (в граммах) порошка технического алюминия (массовая доля примеси 3%), необходимую для полного восстановления в щелочном растворе 1,515 г нитрата калия. Считать, что реакция протекает с выходом 85%. (Запишите число с точностью до сотых.)
Ответ: 1,31
29)Из предложенного перечня веществ выберите такие, окислительновосстановительная реакция между которыми протекает с образованием нерастворимого в воде соединения желтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30)Из предложенного перечня веществ выберите два таких, реакция ионного обмена между которыми может сопровождаться образованием раствора, практически не содержащего сильных электролитов. Запишите молекулярное, полное и сокращенное ионное уравнения данной реакции с участием выбранных веществ.
31)Сернистый газ пропустили через трубку с пероксидом натрия. Содержимое трубки растворили в воде с образованием нейтрального раствора, который подвергли электролизу. Образовавшийся раствор нагрели до кипения и внесли последовательно навеску питьевой соды, затем сульфат алюминия. Напишите уравнения четырех описанных реакций.
33)В стакан с 26%-ным раствором хлорида железа(III) внесли навеску железной стружки и нагревали некоторое время. В момент, когда количество ионов Fe2+ стало равно 0,24 моль, остаток стружки отделили от раствора магнитной сепарацией. В образовавшийся раствор пропустили газообразный хлор до момента, когда отношение количеств ионов Fe2+ и Fe3+ стало равно 1:4. Отделенную ранее железную стружку смешали с дополнительным количеством железа и внесли в полученный раствор. После образования однородного раствора без осадка добавили 260 г раствора сульфида калия. Образовавшийся при этом осадок представлял собой единственное соединение, а раствор над осадком имел нейтральную среду. Вычислите массовую долю воды в конечном растворе, если известно, что всего в ходе эксперимента использовали 13,44 г железной стружки. Испарением воды в ходе всех процессов пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При полном сгорании неизвестного органического соединения А массой 1,98 г образовалось 2,016 л углекислого газа (н.у.) и 1,62 г воды. Известно, что в молекуле данного соединения все атомы углерода находятся в состоянии sp3 -гибридизации, а также то, что молекула вещества А содержит в своем составе в два раз больше атомов углерода, чем молекула вещества Б — продукта окисления некоторого алкена раствором перманганата калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения А из вещества Б.
Другие тренировочные варианты ЕГЭ 2022 по химии 11 класс
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Задание 21118
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21510
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21837
Введите ответ в поле ввода
Решение
→
Задание 21914
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 22201
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 20384
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 20549
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 20631
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 20700
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 20433
Установление соответствия
Решение
→
Задание 20989
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21432
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21422
Установление соответствия
Решение
→
Задание 20814
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21642
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 21672
Внимательно прочитайте текст задания и выберите верный ответ из списка
Решение
→
Задание 22183
Введите ответ в поле ввода
Решение
→
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl










 Азот на ЕГЭ
Азот на ЕГЭ