Пропан C3H8 — органическое вещество класса алканов. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа как побочная продукция при различных химических реакциях.
Несмотря на более высокую цену, пропан во многом удобнее природного газа (метана), т.к. в отличие от метана сжижается при комнатной температуре и сравнительно невысоком давлении (12-15 атм), а метан при комнатной температуре не сжижается, и его приходится хранить сжатым под высоким давлением (200-250 атм), либо транспортировать в жидком виде при криогенных температурах.
Поэтому баллоны для пропана значительно легче и дешевле метановых, и содержат гораздо больше газа (например, 50-литровый метановый баллон весит 55 кг и вмещает 9 кг газа, а пропановый такого же объема весит 19 кг и вмещает 22 кг газа, кроме того, баллон для метана в 3-4 раза дороже.
Кокс каменноу́гольный — твёрдый пористый продукт серого цвета, получаемый путём коксования каменного угля при температурах 950—1100°С без доступа кислорода. При коксовании происходит удаление из каменного угля воды, углекислого и угарного газа, углеводородов, соединений азота и фосфора, они переходят в газообразное состояние и улетучиваются. Кокс — это относительно чистый углерод, который применяется для восстановления железа в металлургии.
Каменноугольный кокс в доменном производстве закладывают в доменную печь вместе известняком и железными окатышами, кокс служит топливом и восстановителем при выплавке в доменной печи чугуна. Чугун — это сплав железа с углеродом, содержание углерода более 2,14%. Стоит отметить, что из чугуна второй стадией можно получить сталь, например в кислородно-конвертерном процессе, путем продувки сквозь расплавленный чугун кислород. Углерод при этом выжигается, окисляется.
ацетон (диметилкето́н, пропано́н-2)
— популярный растворитель. Это вещество позволяет справляться с задачами обезжиривания поверхностей, растворения хлоркаучука, полиакрилатов, сополимеров винилхлорида, эпоксидных смол, полистирола, масел, природных смол, различных органических веществ. Именно ацетон используется с целью растворения ацетатов целлюлозы и нитратов.
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
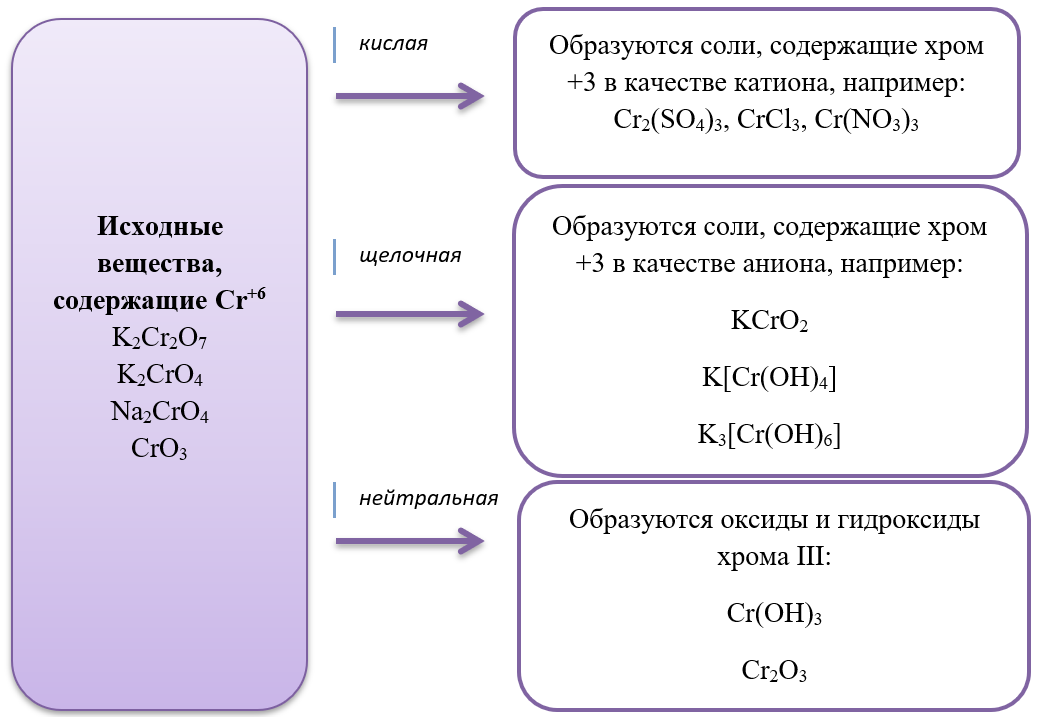
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
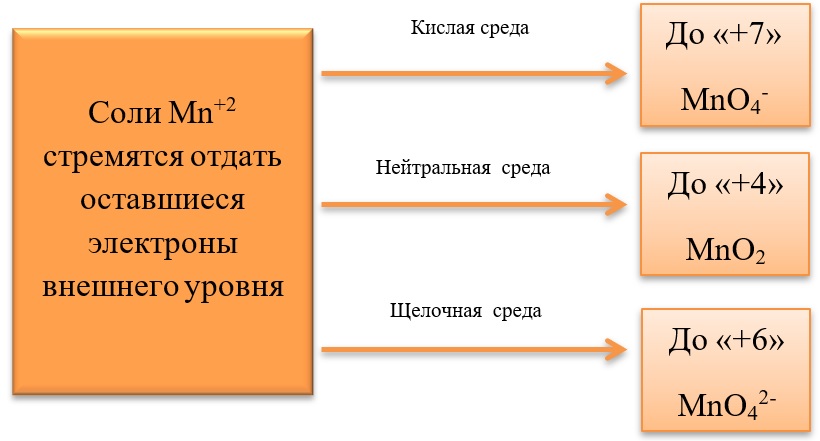
17) Соединения марганца
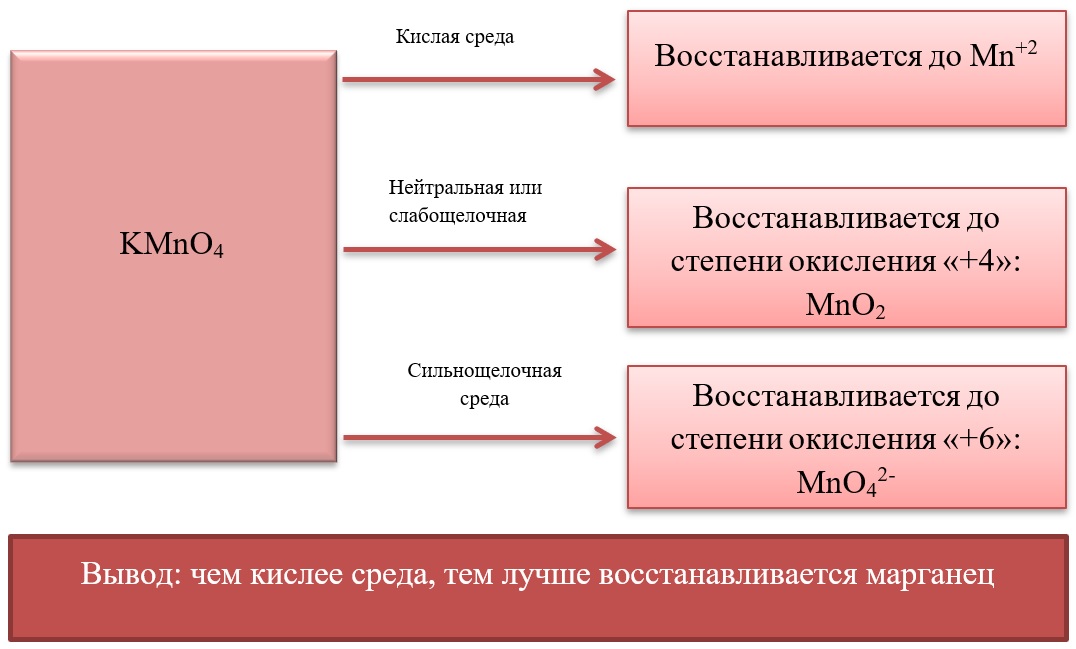
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
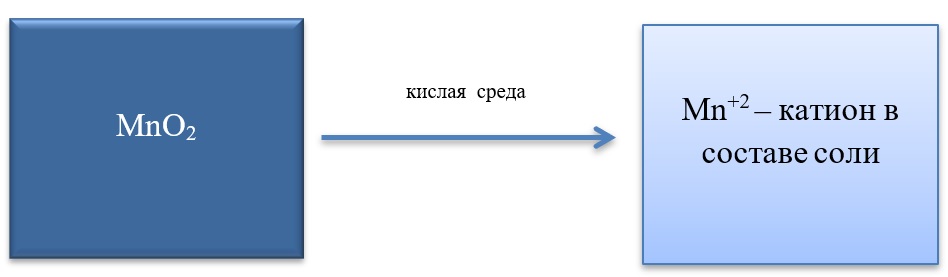
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
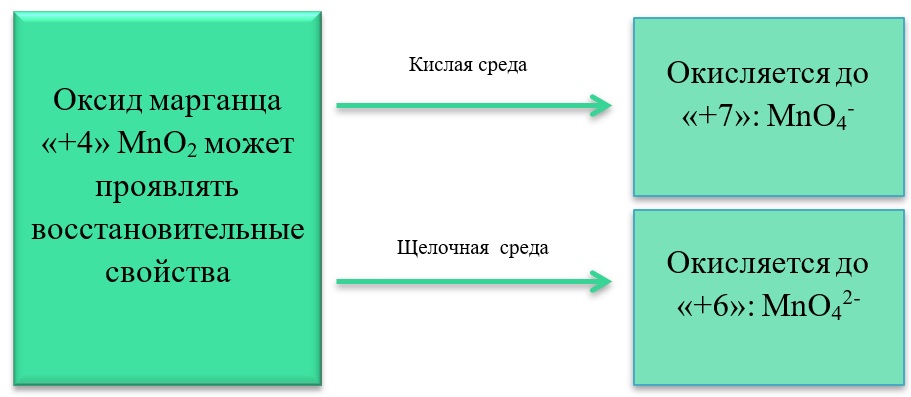
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также:
Тема .
Неорганическая химия
.
03
31. Цепочки реакций по неорганической химии
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
неорганическая химия
.0129. Составление окислительно-восстановительной реакции. Электронный баланс
.0230. Составление реакции ионного обмена. Полное и сокращённое ионное уравнение
.0331. Цепочки реакций по неорганической химии
.045. Классификация и номенклатура неорганических веществ
.056. Свойства классов неорганических соединений. Реакции в растворах. Реакции ионного обмена
.067. Свойства классов неорганических соединений. Установление возможности реакции между классами соединений
.078. Свойства классов неорганических соединений. Химия элементов
.089. Взаимосвязь классов неорганических соединений
.09Реакции
Решаем задачи
Медь растворили в концентрированной серной кислоте. Полученную соль внесли в раствор иодида калия. Образовавшееся простое вещество прореагировало с концентрированной азотной кислотой с выделением бурого газа. Полученную кислоту осторожно нагрели. Составьте уравнения четырех описанных реакций.
Показать ответ и решение
1. Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2. 2CuSO4 + 4KI = 2K2SO4 +2CuI + I2
3. I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4. 2HIO3 = H2O + I2O5
Водный раствор хлорида магния подвергли электролизу. В атмосфере газа, выделившегося на аноде, сожгли фосфор, взятый в избытке. Получившийся продукт добавили в горячий раствор гидроксида натрия. Полученный раствор перенесли в избыток концентрированной азотной кислоты. Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
Ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям:
1) MgCl2 + 2H2O = H2 + Mg(OH)2 + Cl2
2) 2P + 3Cl2 = 2PCl3
3) PCl3 + 5NaOH = Na2HPO3 + 3NaCl + 2H2O
4) Na2HPO3 + 4HNO3 = H3PO4 + 2NO2 + 2NaNO3 + H2O
К раствору нитрата кальция добавили раствор фосфата натрия. Выпавший осадок отделили, высушили и затем прокалили в присутствии углерода и оксида кремния. Полученное при этом простое вещество растворили в концентрированном растворе азотной кислоты, при этом выделился бурый газ. Полученный газ поглотили холодным раствором гидроксида бария. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2Na3PO4 + 3Ca(NO3)2 = Ca3(PO4)2 + 6NaNO3
2) Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
3) P + 5HNO3 = H3PO4 + 5NO2 + H2O
4) 4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
Через раствор сульфата железа (II) пропустили аммиак. Образовавшийся при этом осадок отделили и обработали необходимым количеством концентрированной азотной кислоты, при этом наблюдали растворение осадка и выделение бурого газа. К полученному раствору раствору добавили раствор карбоната калия, а бурый газ пропустили через раствор гидроксида кальция. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + (NH4)2SO4
2) Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + 3H2O
3) 3K2CO3 + 2Fe(NO3)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KNO3
4) 4NO2 + 2Ca(OH)2 = Ca(NO3)2 + Ca(NO2)2 + 2H2O
Фосфор смешали с кальцием и нагрели. Полученное при этом вещество поместили в воду. Выделившийся газ пропустили через раствор, содержащий перманганат натрия и гидроксид натрия, в результате раствор приобрел зеленую окраску. Одну из полученных солей выделили и добавили к раствору сульфита натрия. Напишите уравнения четырех описанных реакций.
Показать ответ и решение
1) 2P + 3Ca = Ca3P2
2) Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
3) PH3 + 8NaMnO4 + 11NaOH = 8Na2MnO4 + Na3PO4 + 7H2O
4) Na2MnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + 2NaOH
Силицид кальция (Ca2Si) поместили в воду. Образовавшийся при этом газ прореагировал с кислородом. Полученное твердое вещество сплавили с фосфатом кальция и углеродом. Образовавшееся при этом простое вещество обработали концентрированной азотной кислотой. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
2) SiH4 + 2O2 = SiO2 + 2H2O
3) Ca3(PO4)2 + 5C + 3SiO2 = 2P + 3CaSiO3 + 5CO
4) P + 5HNO3 = H3PO4 + 5NO2 + H2O
В токе водорода нагрели натрий. К образовавшемуся веществу добавили воду, в результате чего образовался прозрачный раствор и выделился газ. Полученный раствор нагрели и пропустили через него газ, предварительно полученный в результате электролиза раствора поваренной соли. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Na + H2 = 2NaH
2) NaH + H2O = NaOH + H2
3) 6NaOH + Cl2 = NaClO3 + 5NaCl + 3H2O
4) 2NaCl + 2H2O = 2NaOH + H2 + Cl2
Гидрокарбонат натрия прокалили. Полученное после прокаливания твёрдое вещество растворили в воде и смешали с раствором бромида железа (III), в результате чего выпал бурый осадок и образовался газ. Осадок отделили и прокалили. Твёрдый остаток растворили в иодоводородной кислоте. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2NaHCO3 = Na2CO3 + CO2 + H2O
2) 3Na2CO3 + 2FeBr3 + 3H2O = 2Fe(OH)3 + 6NaBr + 3CO2
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид цинка сплавили с твёрдым гидроксидом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид натрия, в результате чего образовался белый осадок. Осадок отделили, высушили, а затем сожгли в избытке кислорода. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) ZnO + 2KOH = K2ZnO2 + H2O
2) K2ZnO2 + 2H2SO4 = ZnSO4 + K2SO4 + 2H2O
3) ZnSO4 + Na2S = ZnS + Na2SO4
4) 2ZnS + 3O2 = 2ZnO + 2SO2
Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся жёлтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зелёным. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Cr + 3Cl2 = 2CrCl3
2) 2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
3) 2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
4) Na2Cr2O7 + 3Cu2O + 10H2SO4 = Cr2(SO4)3 + 6CuSO4 + Na2SO4 + 10H2O
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения четырёх описанных реакций
Показать ответ и решение
1) 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
2) Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + Fe = 3FeO
К раствору сульфата железа(II) добавили раствор гидроксида натрия. Образовавшийся при этом осадок отделили и обработали пероксидом водорода, при этом наблюдали изменение цвета осадка. Полученное бурое вещество обработали иодоводородной кислотой. Образовавшееся при этом простое вещество поместили в раствор гидроксида калия и нагрели.
Напишите уравнения четырёх описанных реакций.
Показать ответ и решение
1) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
2) 2Fe(OH)2 + H2O2 = 2Fe(OH)3
3) 2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
4) 3I2 + 6KOH = KIO3 + 5KI + 3H2O
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением света и тепла. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) FeCl3 + 3AgNO3 = Fe(NO3)3 + 3AgCl
2) Fe(NO3)3 + 3KOH = 3KNO3 + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 2Al = Al2O3 + 2Fe
Кристаллы хлорида калия обработали концентрированной серной кислотой. К получившейся соли добавили гидроксид калия. К полученному придукту прилили раствор хлорида бария. Выпавший осадок отфильтровали, после чего прокалили с избытком угля. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) KCl(тв) + H2SO4(конц) = KHSO4 + HCl
2) KHSO4 + KOH = K2SO4 + H2O
3) K2SO4 + BaCl2 = 2KCl + BaSO4
4) BaSO4 + 2C = BaS + 2CO2
Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовался бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в йодоводородной кислоте. Напишите уравнения четырех описанных реакций
Показать ответ и решение
1) 2Fe + 3Cl2 = 2FeCl3
2) FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся при этом среднюю соль прокалили. Запишите уравнения четырех описанных реакций
Показать ответ и решение
1) Al2O3 + 2NaOH = 2NaAlO2 + H2O
2) NaAlO2 + NH4Cl + H2O = NaCl + Al(OH)3 + NH3
3) 2NH3 + H2SO4 = (NH4)2SO4
4) (NH4)2SO4 = NH3 + NH4HSO4
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ba(OH)2 ← Ba → BaO → Ba(OH)2→(+СО2)X → Ba(OH)2
Показать ответ и решение
1) Ba + 2H2O = Ba(OH)2 + H2
2) 2Ba + O2 = 2BaO
3) BaO + H2O = Ba(OH)2
4) Ba(OH)2 + 2CO2 = Ba(HCO3)2
5) Ba(HCO3)2 + 2NaOH = Ba(OH)2 + 2NaHCO3
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
K2O → КОH → KHSO4→ K2SO4 → КОH → K[Al(OH)4];
Показать ответ и решение
1) K2O + H2O = 2KOH
2) KOH + H2SO4 = KHSO4 + H2O
3) KHSO4 + KOH = K2SO4 + H2O
4) K2SO4 + Ba(OH)2 = 2KOH + BaSO4
5) KOH + Al(OH)3 = К[Al(OH)4]
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
CuCl2 → Cu(OH)2 → CuO → Cu → CuO → CuSO4
Показать ответ и решение
1) СuCl2 + 2KOH = Cu(OH)2 + 2KCl
2) Cu(OH)2 =(t) CuO + H2O
3) 2NH3 + 3CuO = 3Cu + N2 + 3H2O
4) 2Cu + O2 = 2CuO
5) CuO + H2SO4 = CuSO4 + H2O
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
Ca(OH)2 → CaO → Ca(OH)2 →(+K2CO3) X → Fe(OH)3 → Fe2O3
Показать ответ и решение
1) Сa(OH)2 =(t) CaO + H2O
2) CaO + H2O = Ca(OH)2
3) Ca(OH)2 + K2CO3 = CaCO3 + 2KOH
4) 3KOH + FeCl3 = Fe(OH)3 + 3KCl
5) 2Fe(OH)3 =(t) Fe2O3 + 3H2O
- 29.03.2022
Начинаем собирать реальные варианты ЕГЭ 2022 года по химии. Все варианты собираются и публикуются после проведения экзамена.
- Смотреть реальные варианты ЕГЭ 2022 по всем предметам
ОБНОВЛЕНОЕ 27.05.2022
Варианты с досрочного ЕГЭ 2022 по химии, с реальной основной волны от 26 мая 2022. Смотрим, разбираем. Все варианты будут сопровождаться видеоуроками, на которых будут разобраны примеры решения, правильные ответы и т.д.
- Другие варианты ЕГЭ по химии (включая Статград)
Есть вопросы? Пишите их ниже! Обсудим, решим, ответим.
- Вариант досрочного ЕГЭ 2022 по химии от 21.03.2022 — 5 вариантов разборов
- Открытый вариант от ФИПИ ЕГЭ 2022 по химии (аналог досрочного варианта) от 28.04.2022
Вариант №1 от 26 мая 2022
Вариант №2 от 26 мая 2022
Вариант №3 с Дальнего востока
Вариант №4 с Дальнего востока
Как прошла основная волна ЕГЭ 2022 по химии
Некоторые задания с основной волны от 26.05.2022
За это задание ты можешь получить 2 балла. На решение дается около 7 минут. Уровень сложности: повышенный.
Средний процент выполнения: 48.6%
Ответом к заданию 8 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) $NH_4Cl$ и $NaNO_2$ Б) $(NH_4)_2Cr_2O_7$ (нагревание) В) Mg и $HNO_3$ (оч. разб.) Г) Ag и $HNO3$ (конц.) |
1) $NO_2$ 2) $N_2$ 3) $NH_4NO_2$ 4) $(NH_4)_2CrO_4$ 5) NO 6) $NH_4NO_3$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) $NH_4Cl + NaNO_2 = N_2 + 2H_2O + NaCl$
Б) $(NH_4)_2Cr_2O_7 →↖{t°C} N_2 + Cr_2O_3 + 4H_2O$
В) $4Mg + 10HNO_3 → 4Mg(NO_3)_2 + NH_4NO_3 + 3H_2O$
Г) $Ag+2HNO_{3(конц.)} =AgNO_3+NO_2+H_2O$
Ответ: 2261
Задача 2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $H_2SO_4$ (конц.) и C Б) $H_2SO_4$ (конц.) и S В) $H_2SO_4$ (конц.) и Cu Г) $H_2SO_4$ (конц.) и Ag |
1) $CO_2$, $SO_2$ и $H_2O$ 2) $Ag_2SO_4$, $SO_2$ и $H_2O$ 3) $SO_2$ и $H_2O$ 4) $CuSO_4$ и $H_2$ 5) $CuSO_4$, $SO_2$ и $H_2O$ 6) $Ag_2SO_4$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Окисляющие кислоты окисляют углерод в углекислый газ (1)
Б) овр, где сера принимает среднюю степень окисления +4, ответ (3)
В) так как кислота конц., а металл неактивный, то в продуктах должен быть сернистый газ как продукт восстановления серной кислоты, ответ (5)
Г) рассуждаем так же, как в В, ответ (2)
Ответ: 1352
Задача 3
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al и KOH (р-р) Б) Al и $H_2SO_4$ (разб.) В) $Al_2S_3$ и $H_2O$ Г) Al (без плёнки) и $H_2O$ |
1) гидроксид алюминия и сера 2) гидроксид алюминия и сероводород 3) тетрагидроксоалюминат калия и водород 4) сульфат алюминия и водород 5) сульфит алюминия и водород 6) гидроксид алюминия и водород |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Алюминий — амфотерный металл, поэтому в реакциях с раствором щелочей он даёт комплексные соли — тетрагидроксоалюминаты, в данном случае — калия, при этом также выделяется водород.
Б) В реакции с разбавленной серной кислотой алюминий не проявляет способность к пассивации и реагирует как типичный металл — замещая водород. Продукт реакции — сульфат алюминия и водород.
В) $Al_2S_3$ — сульфид алюминия — соль с катионом слабого основания и анионом слабой кислоты, подвергается полному гидролизу, при этом образуется осадок гидроксида алюминия и газообразный сероводород.
Г) Взаимодействуя с водой (реакция идёт при нагревании), алюминий замещает водород, который выделяется в виде простого вещества, при этом образуется нерастворимый гидроксид алюминия.
Ответ: 3426
Задача 4
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $HNO_3$ (конц.) Б) Fe и $H_2SO_4$ (разб.) В) Fe, $O_2$ и $H_2O$ Г) FeS и $O_2$ |
1) оксид железа(III) и оксид серы(IV) 2) гидроксид железа(II) 3) гидроксид железа(III) 4) сульфат железа(II) и водород 5) нитрат железа(II), оксид азота(II) и вода 6) нитрат железа(III), оксид азота(IV) и вода |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Fe и $HNO_{3(конц.)}$. Железо в реакциях с окисляющими кислотами точно окисляется до степени окисления +3. А вот продукты восстановления азотки могут быть разные в пределах подходящих продуктов по табличке. Но ориентируемся на степень окисления железа в первую очередь. Продукты реакции: нитрат железа (III), оксид азота (IV) и вода.
Б) Fe и $H_2SO_{4(разб.)}$. Разбавленная серная кислота не проявляет особенных свойств и реагирует с металлами как большинство других кислот — металл замещает водород, в данном случае образуется сульфат железа (II) и водород.
В) Fe, $O_2$ и $H_2O$. Реагируя с водой в присутствии кислорода железо ржавеет — образуется осадок гидроксида железа(III).
Г) При горении FeS образуется два оксида: оксид железа (III) и оксид серы (IV).
Ответ: 6431
Задача 5
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) Fe и $Cl_2$ Б) Fe и HCl (конц.) В) Cu и $HNO_3$ (конц.) Г) Cu и $HNO_3$ (разб.) |
1) $FeCl_2$ 2) $FeCl_3$ 3) $FeCl_2$ и $H_2$ 4) $Cu(NO_3)_2$ и $H_2$ 5) $Cu(NO_3)_2$, NO и $H_2O$ 6) $Cu(NO_3)_2$, $NO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2Fe + 3Cl_2 = 2FeCl_3$
Б) $Fe + 2HCl_{(конц.)} = FeCl_2 + H_2$
В) $Cu + 4HNO_{3(конц.)} = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
Г) $3Cu + 8HNO_{3(разб.)} = 3Cu(NO_3)_2 + 2NO + 4H_2O$
Ответ: 2365
Задача 6
Установите соответствие между реагирующими веществами и формулой газа, выделяющегося при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ФОРМУЛА ГАЗА |
| А) Zn и HCl (конц.) Б) Cu и $H_2SO_4$ (конц.) В) Mg и $H_2SO_4$ (разб.) Г) Ag и $HNO_3$ (конц.) |
1) $H_2$ 2) NO 3) $NO_2$ 4) $SO_2$ 5) $Cl_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А: Здесь цинк, являясь активным металлом, вытесняет водород из кислоты, образует соль, а водород выделяется в чистом виде.
Б: Концентрированная серная кислота — кислота окисляющая и реагирует с металлами за счет окислительных свойств S(VI). Неактивные металлы, как медь, восстанавливают серу только до сернистого газа.
В: Реакция похожа на первую: активный металл вытесняет водород из кислоты, поскольку разбавленная серная кислота реагирует с металлами за счет выделения водорода, как неокисляющие кислоты.
Г: Серебро неактивный металл, значит концентрированная(!) азотка восстановится только до $NO_2$.
Ответ: 1413
Задача 7
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Na_2SiO_3$ и $CO_2$ (водн. р-р) Б) $Na_2SiO_3$ и HCl В) $AlCl_3$ и $Na_2CO_3$ (водн. р-р) Г) $AlCl_3$ и NaOH (водн. р-р) |
1) $Al(OH)_3$ и NaCl 2) $Al(OH)_3$, NaCl и $CO_2$ 3) $SiO_2$ и $NaHCO_3$ 4) NaCl и $H_2SiO_3$ 5) $H_2SiO_3$ и $Na_2CO_3$ 6) NaCl, $SiO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) При реакции силиката и углекислого газа в водном растворе вода тоже вступает в реакцию, тогда получается кремниевая кислота и карбонат калия.
Б) В данном случае реагирует сильная кислота и соль, поэтому протекает обычный обмен, образуется хлорид натрия и кремниевая кислота.
В) В данном случае вода снова вступает в реакцию, происходит гидролиз карбоната алюминия, получается гидроксид алюминия (III), алюминий не меняет степень окисления, хлорид натрия и углекислый газ.
Г) В этой реакции протекает обмен.
Ответ: 5421
Задача 8
Установите соответствие между реагирующими веществами и продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) Ca и $HNO_3$ (оч. разб.) Б) Cu и $HNO_3$ (конц.) В) Fe и $HNO_3$ (конц.) (н. у.) Г) Al и $HNO_3$ (конц.) (н. у.) |
1) оксид азота(II) 2) оксид азота(IV) 3) аммиак 4) не взаимодействуют 5) нитрат аммония |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $4Ca + 10HNO_{3(оч. разб.)} = 4Ca(NO_3)_2 + NH_4NO_3 + 3H_2O$
Б) $Cu + 4HNO_3 = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
В) Fe и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Г) Al и $HNO_{3(конц)}$ при нормальных условиях не реагирует, происходит пассивация
Ответ: 5244
Задача 9
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $КHCO_3$ и $Ca(OH)_2$ Б) $КHCO_3$ и HCl В) $КHCO_3$ (нагревание) Г) $КHCO_3$, $CO_2$ и $H_2O$ |
1) $Ca(HCO_3)_2$ и КOH 2) $CaCO_3$, КOH и $H_2O$ 3) $CO_2$, $H_2O$ и КCl 4) КCl и $H_2CO_3$ 5) $К_2CO_3$, $H_2O$ и $CO_2$ 6) не реагируют |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Кислая соль слабой кислоты и щелочь реагируют с образованием новой нерастворимой соли, новой щелочи и воды.
Б) Кислая соль слабой кислоты с
сильной кислотой образуется среднюю соль и слабую кислоту (угольная кислота неустойчива и сразу распадается на оксид и воду).
В) При нагревании кислой соли образуется средняя соль и кислота, но угольная сразу распадается на воду и газ.
Г) Должна идти реакция обратная предыдущей, но это невозможно, так как кислая соль не может реагировать с слабой кислотой.
Ответ: 2356
Задача 10
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Cl_2$ и NaOH (хол. р-р) Б) C и $H_2SO_4$ (конц.) В) C и FeO Г) Cu и $H_2SO_4$ (конц.) |
1) $CuSO_4$, $SO_2$ и $H_2O$ 2) NaCl, NaClO и $H_2O$ 3) Fe и CO 4) $CuSO_4$ и $H_2$ 5) $CO_2$, $H_2O$ и $SO_2$ 6) NaCl, $NaClO_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Взаимодействие $Cl_2$ с холодным раствором NaOH — реакция диспропорционирования, хлор и понижает, и повышает свою степень окисления. Поскольку среда щелочная, а раствор холодный, то получаются соли — соляной кислоты (хлорид натрия NaCl) и хлорноватистой кислоты (гипохлорит натрия NaClO), а также вода, которые предложены во второй строке.
Б) В реакции углерода с концентрированной серной кислотой углерод является восстановителем и окисляется до углекислого газа $СО_2$, а серная кислота — окислителем и восстанавливается до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
В) Взаимодействие оксидов среднеактивных и малоактивных металлов с углеродом — один из способов получения чистых металлов, в реакции углерода с оксидом железа (II) образуется железо Fe и угарный газ СО.
Г) В реакции меди с концентрированной серной кислотой медь является восстановителем и окисляется до сульфата меди (II), а серная кислота — окислителем и восстанавливается до до оксида серы (IV) $SO_2$, оставшиеся водород и кислород образуют воду.
Ответ: 2531
Задача 11
Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $Al(OH)_3$ и $H_2SO_4$ Б) $Al(OH)_3$ и NaOH (р-р) В) $Al(OH)_3$ и NaOH (сплавление) Г) $Al(OH)_3$ (нагревание) |
1) $Al_2(SO_4)_3$ и $H_2$ 2) $Al_2(SO_4)_3$ и $H_2O$ 3) $NaAlO_2$ и $H_2$ 4) $NaAlO_2$ и $H_2O$ 5) $Na[Al(OH)_4]$ 6) $Al_2O_3$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) В реакции кислоты и основания образуется соль и вода. Продукты взаимодействия $Al(OH)_3$ + $H_2SO_4$ = $Al_2(SO_4)_3$ и $H_2O$.
Б) $Al(OH)_3$ — амфотерный гидроксид, поэтому способен реагировать с щелочами. Если реакция протекает в растворе, то образуется комплексная соль — тетрагидроксоалюминат натрия $Na[Al(OH)_4]$.
В) Если в реакции амфотерного гидроксида со щёлочью отсутствует вода (происходит сплавление), то образуется средняя соль и вода. Продукт сплавления гидроксида алюминия с гидроксидом натрия — алюминат натрия $NaAlO_2$ и вода $H_2О$.
Г) При нагревании слабые основания разлагаются на оксид и воду. Продукты разложения $Al(OH)_3$ = $Al_2O_3$ + $H_2O$.
Ответ: 2546
Задача 12
Установите соответствие между реагирующими веществами и продуктом(-ами), который(-ые) преимущественно образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) $Al_2O_3$ и KOH (сплавление) Б) $Al_2O_3$ и KOH (р-р) В) $Al_2O_3$ и $K_2CO_3$ (сплавление) Г) $Al_2O_3$ и HCl (р-р) |
1) $KAlO_2$ 2) $KAlO_2$ и $H_2O$ 3) $KAlO_2$ и $CO_2$ 4) $K[Al(OH)_4]$ 5) $AlCl_3$ и $H_2O$ 6) $AlCl_3$ и $H_2$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
A) $2KOH + Al_2O_3$ =(сплавление) $2KAlO_2 + H_2O$
Б) $Al_2O_3 + 2KOH + 3H_2O = 2K[Al(OH)_4]$
В) $Al_2O_3 + K_2CO_3 = CO_2 + 2KAlO_2$
Г) $Al_2O_3 + 6HСl$(р-р) $= 2AlCl_3 + 3H_2O$
Ответ: 2435
Задача 13
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) $K_2HPO_4 + H_3PO_4$ Б) $PH_3 + HNO_{3(конц.)}$ В) $KH_2PO_4 + KOH$ Г) $P + HNO_{3(конц.)}$ |
1) $KH_2PO_4$ 2) $K_3PO_4$ 3) $К_2HPO_4, H_2O$ 4) $NO_2, H_2O, H_3PO_4$ 5) $NO_2, H_2O, P_2O_5$ 6) $PH_3, NO_2, H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Гидрофосфат калия $K_2HPO_4$ — дизамещённая соль трёхосновной фосфорной кислоты, может реагировать с $H_3PO_4$, образуя $KH_2PO_4$:
$К_2HPO_4 + H_3PO_4 = 2КH_2PO_4$ (ответ А — 1)
Б) Фосфин $PH_3$ проявляет восстановительные свойства и при взаимодействии с окислителями будет переходить в соединения $P^{+5}$:
$PH_3 + 8HNO_3 = H_3PO_4 + 8NO_2↑ + 4H_2O$ (ответ Б — 4)
В) Дигидрофосфат калия $KH_2PO_4$ — кислая соль трёхосновной кислоты, может реагировать со щелочами с образованием гидрофосфата или фосфата, в зависимости от соотношения реагентов:
$KH_2PO_4 + KOH = K_2HPO_4 + H_2O$ (ответ В — 3) или
$KH_2PO_4 + 2KOH = K_3PO_4 + H_2O$
Г) Фосфор окисляется сильными окислителями до степени окисления +5:
$P + 5HNO_3 = H_3PO_4 + 5NO_2↑ + H_2O$ (ответ Г — 4)
Ответ: 1434
Задача 14
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Zn и $H_2SO_4$ (разб.) Б) ZnO и $H_2SO_4$ (разб.) В) Zn и $H_2SO_4$ (конц.) Г) ZnS и $O_2$ (изб., нагревание) |
1) $ZnSO_4$ и $H_2O$ 2) ZnO и $SO_2$ 3) $ZnSO_4$, $H_2S$ и $H_2O$ 4) ZnO и $SO_3$ 5) $ZnSO_4$ и $H_2$ 6) ZnS, $SO_2$ и $H_2O$ |
Запишите выбранные цифры под соответствующими буквами.
Решение
А) Цинк Zn — активный металл. Может реагировать с неметаллами, кислотами с выделением водорода (за исключением азотной и концентрированной серной кислот), солями и оксидами менее активных металлов и некоторыми другими окислителями.
Серная кислота $H_2SO_{4(разб.)}$ — сильная двухоснóвная кислота, проявляет все общие свойства кислот: диссоциация, окрашивание индикаторов, взаимодействие с металлами, находящимися в ряду активности левее водорода с выделением водорода, взаимодействие с оснóвными и амфотерными оксидами и гидроксидами, а также солями, если соблюдаются условия протекания реакций обмена.
$Zn + H_2SO_{4(разб.)} = ZnSO_4 + H_2$
Вывод: ответ А — 5.
Б) Оксид цинка ZnO — амфотерный оксид, $H_2SO_4$ — сильная кислота. Возможна реакция
$ZnO + H_2SO_{4(разб.)} = ZnSO_4 + H_2O$
Вывод: ответ Б — 1.
В) Концентрированная серная кислота $H_2SO_4$ является сильным окислителем. Окислительные свойства проявляет сера в степени окисления +6. С малоактивными восстановителями (тяжёлые металлы, неметаллы) восстанавливается до степени окисления +4, с активными металлами — преимущественно до степени окисления –2.
$4Zn + 5H_2SO_{4(конц.)} = 4ZnSO_4 + H_2S + 4H_2O$
Вывод: ответ В — 3.
Г) При обжиге сульфидов всегда образуется оксид серы(IV) и, как правило, оксид второго элемента в высокой устойчивой степени окисления.
$2ZnS + 3O_2 = 2ZnO + 2SO_2$
Вывод: ответ Г — 2.
Ответ: 5132
Задача 15
Установите соответствие между формулой вещества и продуктами термического разложения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ РАЗЛОЖЕНИЯ |
| А) KNO3 Б) Fe(NO3)3 В) Ni(NO3)2 Г) Hg(NO3)2 |
1) нитрит металла, кислород 2) оксид металла, кислород, оксид азота(IV) 3) металл, оксид азота(IV), кислород 4) металл, оксид азота(II), кислород 5) металл, азот, кислород 6) оксид металла, оксид азота(I), кислород |
Запишите выбранные цифры под соответствующими буквами.
Решение
Продукты термического разложения солей азотной кислоты и металлов определяются положением металла в ряду активности. При разложении солей, образованных металлами, расположенными левее магния (кроме лития), образуются нитрит металла и кислород. Если металл расположен от магния до меди или это литий, то образуются оксид металла, оксид азота(IV) и кислород. Продукты разложения солей менее активных, чем медь, металлов — металл, оксид азота(IV) и кислород.
А) $2KNO_3 = 2KNO_2 + O_2$
Вывод: ответ А — 1.
Б) $4Fe(NO_3)_3 = 2Fe_2O_3 + 12NO_2 + 3O_2$
Вывод: ответ Б — 2.
В) $2Ni(NO_3)_2 = 2NiO + 4NO_2 + O_2$
Вывод: ответ В — 2.
Г) $Hg(NO_3)_2 = Hg + 2NO_2 + O_2$
Вывод: ответ Г — 3.
Ответ: 1223
Рекомендуемые курсы подготовки
Задание 1:
Газ, выделившийся при взаимодействии хлороводородной кислоты с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — хлороводородная (соляная) кислота реагирует с перманганатом калия:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O — в результате выделяется тот газ (хлор), который нужен для следующей реакции.
Вторая реакция — идет между хлором и железом (хлор окисляет железо до степени окисления +3):
2Fe + 3Cl2 = 2FeCl3.
Следующий этап — хлорид железа растворили (FeCl3 хорошо растворяется в воде (92 г/ 100 мл), и добавили к нему сульфид натрия
Это не ионно-обменная реакция, а ОВР, так как хлорид Fe (III) является сильным окислителем:
2FeCl3 + 3Na2S = S↓ + 2FeS + 6NaCl — эффектом реакции является выделение желтого осадка в виде чистой серы, которую возьмут для взаимодействия с горячей азотной кислотой.
Последняя реакция в этом блоке — сера плюс концентрированная HNO3:
S + HNO3 (конц.,гор.) = H2SO4 + 6NO2↑ + 2H2O
Задание 2:
Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного продукта электролиза, отфильтровали и прокалили. Вещество, образовавшееся на катоде, растворили в концентрированной азотной кислоте при нагревании. Продукт, выделившийся на аноде, пропустили через холодный раствор гидроксида калия. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция в списке — это электролиз водного раствора хлорида железа; на катоде выделяется Fe и H2; на аноде — Cl2.
4FeCl3 +6H2O = 2Fe + 3H2 + 6Cl2 + 2Fe(OH)3 ↓
Вторая реакция — взяли бурый осадок из предыдущей реакции электролиза и прокалили; это процесс разложения нерастворимого основания гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Следующая реакция проходит между веществом, которое образовалось на катоде и растворили его в концентрированной азотной кислоте; естественно, речь идет о железе:
Fe + 6HNO3 (конц.) = Fe(NO3)3 + 3NO2↑ + 3H2O
Последняя реакция — продукт, который выделился на аноде пропустили через холодную щелочь (это важное дополнение, так как с горячей образуются другие продукты реакции); это взаимодействие хлора с KOH:
Cl2 + 2KOH = KClO + KCl + H2O — данный тип ОВР называется диспропорционированием (один и тот же элемент и окисляется, и восстанавливается).
Задание 3:
Йод обработали концентрированной азотной кислотой при нагревании. Раствор осторожно выпарили и остаток нагрели, получив оксид, который взаимодействует с угарным газом с образованием двух веществ — простого и сложного. Образовавшееся при этом простое вещество растворили в теплом растворе гидроксида калия. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — йод и азотная кислота, достаточно простая реакция с образованием йодноватой кислоты, газа с оттенком «лисьего хвоста» и воды:
I2 + 10HNO3 = 2HIO3 + 10NO2↑ + 4H2O (t)
Следующий этап — выпарили раствор, и остаток нагрели; это касается разложения йодноватой кислоты:
2HIO3 = I2O5 + H2O (t)
Третья реакция — полученный в предыдущей реакции оксид пропустили через угарный газ:
I2O5 + 5CO = I2 + 5CO2 — как и сказано в условии, получаем одно простое и одно сложное вещества.
Последняя реакция из списка — простое вещество (I2) растворили в теплом растворе щелочи (KOH):
I2 + 6KOH = 5KI + KIO3 +3H2O.
Задание 4:
Оксид железа (III) сплавили с поташом. Полученный продукт добавили в воду. Образовавшийся осадок отделили и растворили в йодоводородной кислоте. Выделившееся простое вещество реагирует с тиосульфатом натрия. Напишите уравнения четырех описанных реакций.
Решение:
Первая реакция может вызвать сложности из — за незнания тривиального названия «поташ«, который представляет собой карбонат калия:
Fe2O3 + K2CO3 = 2KFeO2 + CO2↑ — это непростая реакция сплавления, которую надо запомнить.
Следующая реакция — добавление к полученному продукту воды:
KFeO2 + 2H2O = KOH + Fe(OH)3↓
Третья реакция — осадок в виде гидроксида железа (III) растворили в йодоводородной кислоте, в результате выделяется чистый йод:
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Последний этап — взаимодействие йода с тиосульфатом натрия с образованием йодида натрия и тетратионата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Задание 5:
Кремний сожгли в атмосфере хлора. Продукт реакции обработали водой. Выделившийся осадок отделили, прокалили и обработали плавиковой кислотой. Напишите уравнения четырех описанных реакций.
Решение:
Первый этап — сожгли кремний в атмосфере хлора, эта реакция представляет взаимодействие двух простых веществ:
Si + 2Cl2 = SiCl4
Следующая реакция — тетрахлорсилан (SiCl4) обработали водой:
SiCl4 + 3H2O = H2SiO3 + 4HCl — эффектом этой реакции является выпадение бесцветного студенистого осадка кремниевой кислоты.
Третья реакция — разложение кремниевой кислоты:
H2SiO3 = SiO2 + H2O
Четвертая реакция — взаимодействие кремнезема с плавиковой кислотой:
SiO2 + 4HF = SiF4 + 2H2O — эта реакция объясняет, почему плавиковую кислоту не хранят в стеклянной посуде (HF реагирует с диоксидом кремния, соответственно, разъедает стекло).
Задание 6:
В раствор гидроксида натрия внесли оксид хрома (VI). Раствор выпарили, твердый остаток обработали серной кислотой и из полученного раствора при охлаждении выделили соль оранжевого цвета. При растворении соли в бромоводородной кислоте образуется простое вещество, которое может взаимодействовать с сероводородом. Напишите уравнения четырех описанных реакций.
Решение:
Первая реакция — оксид хрома (VI), который является кислотным оксидом, прореагирует с щелочью:
CrO3 + 2NaOH = Na2CrO4 + H2O — эффектом этой реакции является образование вещества желтого цвета — хромата натрия.
Далее нужно написать взаимодействие хромата натрия с серной кислотой — это необычная ионно-обменная реакция, которую нужно запомнить:
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O — цвет раствора изменился с желтого на оранжевый (это цвет дихромата натрия).
Третья реакция — взаимодействие Na2Cr2O7 с бромоводородной кислотой:
Na2Cr2O7 + 14HBr = 2NaBr + 2CrBr3 + 3Br2 + 7H2O
Четвертая реакция — выделили простое вещество, который прореагировал с сероводородом (бром замещает серу):
Br2 + H2S = 2HBr + S.
Задание 7:
Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделяется газ с запахом тухлых яиц. Составьте уравнения четырех описанных реакций.
Решение:
Первая реакция — сернистый газ реагирует с бромной водой, поэтому надо добавить воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
Вторая и третья реакции представляют собой нейтрализацию полученного раствора (серная кислота и бромоводородная кислота):
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
2HBr + Ba(OH)2 = BaBr2 + 2H2O
Четвертая реакция — осадок реагирует с коксом при прокаливании; это взаимодействие с углеродом:
BaSO4 + 4C = BaS + 4CO↑
Последняя реакция — продукт прокаливания обработали HCl и выделился газ с запахом тухлых яиц (это сероводород):
BaS + 2HCl = BaCl2 + H2S↑.
На сегодня все!


 Азот на ЕГЭ
Азот на ЕГЭ