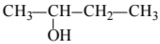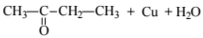Установите соответствие между реагирующими веществами и продуктами их взаимо действия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
Гидроксид бериллия амфотерный, значит, с щелочами при сплавлении дает соль и воду — 6, с щелочами в растворе — гидроксокомплексы — 3, с кислотными оксидами — соответствующие соли и воду — 4, 2.
Ответ: 6342.
Спрятать решение
·
·
Галина Дмитриевна Максимова 11.06.2016 11:51
Скажите, пожалуйста, реакции в) и г) разве могут происходить? С кислотными оксидами реагируют только щелочи. Спасибо.
Михаил Ерушев
Галина, с кислотными оксидами реагируют также амфотерные гидроксиды. Поэтому реакции будут проходить.
Игорь Сраго 24.05.2018 14:45
Как правило, амфотерные гидроксиды реагируют только с теми кислотными оксидами, которым соответствуют сильные кислоты. Гидроксиды бериллия и цинка(II), правда, реагируют с CO2, образуя гидроксокарбонаты (а не средние соли), но это их частное свойство, например, гидроксиды алюминия и хрома(III) с CO2 (и SO2) не реагируют. Диоксиду серы соответствует слабая кислота, поэтому вряд ли правильно считать, что Г) соответствует 2).
Полина Оленева
Не могу согласиться с Вашим первым утверждением. Например, посмотрим на взаимодействие с амфотерными основаниями кислотного оксида кремния (IV) — кислотного оксид слабой кремниевой кислоты (более подробно см. «Химия элементов» Гринвуд, Эрншо, Москва, БИНОМ. Лаборатория знаний, 2015. Том 1, раздел «кремний», стр. 322-324).
Взаимодействие амфотерного гидроксида бериллия с кислотным оксидом приведёт к образованию соответствующей соли и воды.
Задание 1:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CuSO4
Б) KOH
В) Na2CO3
Г) Al(OH)3
Реагенты:
1) KOH, Ba(NO3)2, H2S
2) SiO2, Al, H2S
3) HNO3, NaOH, H2SO4
4) H2SiO3, Al, BaSO4
5) HNO3, BaCl2, MgCl2
Решение:
Сульфат меди(II) – это средняя соль, растворимая в воде, которая реагирует
— с щелочами(с образованием нерастворимого основания Cu(OH)2),
— солями(нитратом бария, в результате взаимодействия с которыми образуется осадок),
— кислотами(сероводородом — образуется сульфид меди(II) осадок бурого цвета);
Ответ 1.
Гидроксид калия – это растворимое основание, щелочь, которая вступает в реакции нейтрализации с кислотами и кислотными оксидами, амфотерными металлами; ответ 2.
Карбонат натрия – это средняя соль, как и все соли натрия, растворимая в воде, подобно другим солям реагирует со сложными веществами(щелочами, кислотами, другими солями) с образованием осадков, газов, воды, здесь подходит вариант ответа 5, так как в результате реакций с хлоридом бария и магния образуется два осадка в виде BaCO3 и MgCO3.
Гидроксид алюминия – амфотерное нерастворимое основание, которое реагирует
— с щелочами,
— с кислотами,
Ответ 3.
Задание 2:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) C
Б) S
В) CO2
Г) FeO
Реагенты:
1) P, Cu(OH)2, HNO3
2) H2O, KOH, CaO
3) CO, LiOH, N2
4) S, Ba, O2
5) HNO3, O2, C
Решение:
Углерод – неметалл, образующий целый раздел органической химии, благодаря которому образовались белки, жиры, углеводы, реагирует
— с неметаллами(например, серой, кислородом),
— металлами(например, барием, алюминием с образованием карбидов).
Ответ 4.
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, с кислородом, водородом, углеродом, азотной кислотой.
S + 6HNO3(к.) = H2SO4 + 6NO2 + 2H2O
S + 2HNO3(р.) = H2SO4 + 2NO
Важно! Заметьте, что в реакциях серы с разбавленной HNO3 выделяется оксид азота NO2, а с концентрированной азотной кислотой выделяется оксид азота NO.
Этот же принцип соблюдается в реакциях разбавленной и концентрированной кислот с металлами и другими неметаллами.
Ответ 5.
Углекислый газ – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой.
Ответ 2.
FeO – основный оксид железа(II) черного цвета, не токсичен, не растворим в воде, реагирует
— с кислотами,
— с щелочами(сплавление),
— с углеродом(восстановление, t > 1000 C):
FeO + C = Fe + CO
— с кислородом(происходит окисление железа, t >400 C):
6FeO + O2 = 2Fe3O4
Ответ 5.
Задание 3:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Al(OH)3
Б) P2O3
В) MgBr2
Г) P
Реагенты:
1) HBr, KOH, Ba(OH)2
2) KOH, Na3PO4, Cl2
3) HNO3, HCl, Cl2
4) O2, KOH, HNO3
5) S, HCl, O2
Решение:
Al(OH)3 – амфотерное нерастворимое основание, реагирует
— с щелочами,
— с кислотами.
Ответ 1.
P2O3 – оксид фосфора(III), в виде белых хлопьев, высокотоксичное соединение, реагирует
— с водой,
— с галогенами,
— с щелочами,
— с неметаллами(сера, кислород)
Ответ 4.
MgBr2 – бромид магния, средняя соль, растворимая в воде, взаимодействует
— с кислотами,
— с щелочами,
— с солями(при наличии осадка),
— с галогенами(стоящими выше в ПСЭ, чем бром),
Ответ 2.
Фосфор – это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами(например, с азотной):
P(красн.) + 5HNO3(к.) = H3PO4 + 5NO2 + H2O
3P + 5HNO3(р.) + 2H2O = H3PO4 + 5NO
Ответ 4.
Задание 4:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Na2S
Б) Zn(OH)2
В) P2O5
Г) S
Реагенты:
1) O2, Fe, Br2
2) Cl2, FeSO4, HI
3) Li2O, Sr(OH)2, H2O
4) NH3, Ca3(PO4)3, HNO3
5) KOH, H3PO4, HCl
Решение:
Сульфид натрия – это растворимая средняя соль, которая реагирует
— с водой,
— с кислотами,
— с солями,
— с галогенами.
Ответ 2
Гидроксид цинка – это амфотерное нерастворимое основание, проявляет все свойства амфотерного гидроксида, реагируя
— с кислотами,
— с щелочами.
Ответ 5
Оксид фосфора(V) – это солеобразующий кислотный оксид, который вступает в реакцию
— с основаниями,
— с основными оксидами,
— с солями,
— с водой(образуя ортофосфорную кислоту).
Ответ 3
Сера – неметалл желтого цвета, реагирует с большим количеством веществ, в том числе, — с кислородом(образуя оксиды),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами.
Ответ 1
Задание 5:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) NH4Br
Б) HNO3
В) Ba(OH)2
Г) Na
Реагенты:
1) HCl, CO2, K3PO4
2) AgNO3, NaOH, Ca(OH)2
3) Pb, S, C
4) CaO, Br2, Na2SO4
5) S, Cl2, H2O
Решение:
Бромид аммония(NH4Br) – это средняя соль, которая при взаимодействии с щелочами дает гидроксид аммония, являющийся неустойчивым соединением и распадается на аммиак и воду. Также он реагирует с солями(если дает осадок). Ответ 2
Азотная кислота – самая удивительная кислота, которая являясь сильным окислителем, не дает ожогов, как серная кислота. Реагирует с огромным количеством соединений, среди которых
— металлы,
— неметаллы(сера, углерод, йод, фосфор),
— основания,
— соли,
— оксиды.
Важно! HNO3 никогда не выделяет водород при взаимодействии с металлами. Всегда выделяются соединения азота – от солей аммония до NO2.
Здесь подходит вариант ответа 3.
Гидроксид бария(Ba(OH)2) – это щелочь, которая проявляет типичные свойства всех подобных веществ, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 1.
Натрий – крайне опасный щелочной металл, который нельзя даже держать в руке по причине разъедания кожных покровов. Na вступает в экзотермическую реакцию с водой при комнатной температуре, при этом реакция идет достаточно бурно с выделением чистого водорода.
Как и все щелочные металлы, он реагирует с неметаллами(сера, галогены), кислотами, солями.
Ответ 5.
Задание 6:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) сера
Б) кислород
В) хлор
Г) фосфор
Реагенты:
1) H2S, KOH, C2H6
2) O2, SO3, C2H6
3) CH4, Zn, N2
4) Hg, HNO3, Cl2
5) O2, S, Cl2
Решение:
Сера — неметалл желтого цвета, реагирует со многими веществами, например,
— с кислородом(образуя SO2, SO3),
— с водородом(H2S),
— с углеродом(CS2),
— с галогенами(SCl2 – при расплаве, SF6 – при комнатной t),
— металлами(ртуть, натрий, железо).
Ответ 4
Кислород(O2) – главный неметалл для реакций горения, главный окислитель, главный элемент для органической жизни. Этот неметалл способен к огромному числу реакций как с простыми, так и со сложными веществами.
В данном варианте нам подходит вариант ответа 3.
Хлор(Cl2) – галоген, способный реагировать с щелочами, некоторыми кислотами(H2S), металлами, неметаллами.
Ответ 1.
Фосфор(P) — это типичный неметалл, имеет три аллотропические модификации в виде белого(ядовитого), красного и черного фосфора, вступает в реакции со многими веществами, в частности, реагирует
— с неметаллами(кислородом, водородом, серой, галогенами),
— с металлами(образует фосфиды),
— с водой(водяным паром при t > 500 C),
— с щелочами,
— с сильными кислотами.
Ответ 5.
Задание 7:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Ba(OH)2
Б) ZnO
В) Ag
Г) NH4Cl
Реагенты:
1) C, HCl, KOH
2) O2, Br2, HNO3
3) CO, CaCl2, SO2
4) HBr, Zn(OH)2, K2CO3
5) AgNO3, Sr(OH)2, H2SO4 (конц.)
Решение:
Гидроксид бария(Ba(OH)2) — это щелочь, которая проявляет типичные свойства всех растворимых оснований, вступая в реакцию с кислотами, кислотными оксидами, солями.
Ответ 4
Оксид цинка(ZnO) – это амфотерный оксид, нерастворим в воде, не токсичен, реагирует с щелочами, кислотами, кислотными оксидами, неметаллами; ответ 1
Серебро(Ag) – это неактивный благородный металл, взаимодействует с азотной кислотой, серой, галогенами, кислородом(при нагревании), ответ 2
Хлорид аммония(NH4Cl) – это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5.
Задание 8:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) Si
Б) SrO
В) HNO3
Г) Ca(HCO3)2
Реагенты:
1) CuSO4, O2, SO2
2) O2, Mg, NaOH
3) Cu, Ba(OH)2, MgCO3
4) CO2, ZnO, H3PO4
5) H3PO4, HBr, Ca(OH)2
Решение:
Кремний(Si) – неметалл, обладает схожими с углеродом свойствами, с трудом вступает в реакции при обычных условиях, способен реагировать
— с кислородом,
— с металлами(с образованием силицидов),
— с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + H2↑
Ответ 2
Оксид стронция(SrO) – это основный оксид, хорошо растворяется в воде, реагирует как и все основные оксиды щелочно — земельных металлов с кислотами, кислотными оксидами, солями, амфотерными соединениями; ответ 4
Азотная кислота(HNO3) – уже была расписана выше, в данном варианте выбираем пункт 3.
Гидрокарбонат кальция(Ca(HCO3)2) – это кислая соль, которая проявляет свойства растворимых кислот, при этом реагирует с гидроксидом кальция:
Ca(HСО3)2 + Cа(OН)2 = 2CaCO3 + 2H2O
Ответ 5
Задание 9:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) P4
Б) Fe2O3
В) Cu2O
Г) NH4Cl
Реагенты:
1) HCl, HNO3, K2CO3
2) O2, Zn, NaOH (р-р)
3) CaCl2, AgNO3, CO
4) O2, CO, HCl
5) H2SO4 (конц.), NaOH, Pb(NO3)2
Решение:
Фосфор(P4) – это формула белого фосфора, имеет такое обозначение за счет тетраэдрической структуры молекулы данной аллотропии; белый фосфор реагирует с кислородом, металлами, щелочами(с образованием фосфина), с кислотами.
Ответ 2
Оксид железа(Fe2O3) – это амфотерный оксид железа, красно-коричневого цвета, нерастворим в воде, реагирует с кислотами, солями, щелочами, водородом(восстановление).
Ответ 1.
Оксид меди(Cu2O) – представляет собой нерастворимый в воде оксид красно-бурого цвета, реагирует при относительно невысоких t с кислотами(серной, азотной, соляной); при высоких t
— с металлами(Al),
— с неметаллами(O, H, S, галогены),
— с аммиаком,
— c угарным газом:
Cu2O + CO = 2Cu + CO2
— с оксидами щелочных металлов:
Cu2O + BaO = BaCu2O2.
Ответ 4
Хлорид аммония(NH4Cl) — это средняя соль, хорошо растворимая в воде, имеет все свойства растворимых солей, плюс в реакциях со щелочами выделяет аммиак и воду за счет неустойчивости гидроксида аммония, ответ 5
Задание 10:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Формула вещества:
А) CO2
Б) CuCl2
В) NH3
Г) FeS2
Реагенты:
1) HNO3, HBr, O2
2) AgNO3, Na2S, NaI
3) Mg, CaO, H2O
4) KOH, H2SO4, FeS
5) H2SO4, O2, Na2SO4
Решение:
CO2 – составляющая часть воздуха и выделяемого нашим организмом газа в результате энергетического обмена, этот газ является солеобразующим кислотным оксидом, который взаимодействует
— с основными оксидами,
— основаниями,
— водой,
— с некоторыми металлами:
2Mg + CO2 = 2MgO + C
Ответ 3
Хлорид меди(CuCl2) – средняя соль, растворимая в воде, проявляет типичные свойства солей, реагируя с кислотами, щелочами, а также с солями сульфидов и йодидов, при взаимодействии с которыми выделяются соответствующие нерастворимые соединения.
Ответ 2
Аммиак(NH3) – это водорастворимый токсичный газ, проявляющий основные свойства, тем самым легко вступает в реакции с кислотами(серной, азотной), окисляется кислородом с образованием двух разных продуктов азота:
4NH3 + 3O2 = 2N2 + 6H2O(сгорание)
4NH3 + 5O2 = 4NO + 6H2O
Ответ 1
Дисульфид железа(FeS2) – это средняя соль, которая является составляющей частью минерала пирита; способна разлагаться на отдельные элементы под действием высокой t(1170 С), реагирует с азотной, серной и другими кислотами, а также окисляется кислородом до оксида Fe(III).
Ответ 1
На сегодня все!
При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1. произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. запишите молекулярную формулу исходного органического вещества;
3. составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. напишите уравнение реакции этого вещества с оксидом меди(II).
Показать ответ
Элементы ответа.
1. Найдено количество вещества продуктов сгорания:
Общая формула вещества – CxHyOz
n(CO2) = 35,2 / 44 = 0,8 моль; n(С) = 0,8 моль
n(H2O) = 18,0 / 18 = 1,0 моль; n(H) = 1,0 · 2 = 2,0 моль
m(O) = 14,8 – 0,8 · 12 – 2 = 3,2 г; n(O) = 3,2 ⁄ 16 = 0,2 моль
2. Определена молекулярная формула вещества:
x : y : z = 0,8 : 2 : 0,2 = 4 : 10 : 1
Вычисленная формула – C4H10O
Mвыч(C4H10O) = 74 г/моль
Mист(CxHyOz) = 37 · 2 = 74 г/моль
Молекулярная формула исходного вещества – C4H10O
3. Составлена структурная формула вещества:
4. Записано уравнение реакции вещества с оксидом меди(II):
Подборка тренировочных вариантов ЕГЭ 2022 по химии с ответами.
Тренировочные варианты ЕГЭ 2022 по химии
| vk.com/repetitor_po_himii_i_biologii | |
| Вариант 1 | Ответы |
| vk.com/chem4you | |
| скачать вариант 1 | ответы |
| скачать вариант 2 | ответы |
| скачать вариант 3 | ответы |
| скачать вариант 4 | ответы |
| скачать вариант 5 | ответы |
| скачать вариант 6 | ответы |
| скачать вариант 7 | ответы |
| скачать вариант 8 | ответы |
| скачать вариант 9 | ответы |
| скачать вариант 10 | ответы |
| скачать вариант 11 | ответы |
| скачать вариант 12 | ответы |
| скачать вариант 13 | ответы |
| скачать вариант 14 | ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| Вариант 7 | скачать |
| Вариант 8 | скачать |
| Вариант 9 | скачать |
| Вариант 10 | скачать |
| Вариант 12 | скачать |
| Вариант 13 | скачать |
| Вариант 14 | скачать |
| Широкопояс (Источник: vk.com/naukadljatebja) | |
| Variant 1 | скачать |
| Variant 2 | скачать |
| Variant 3 | скачать |
| Variant 4 | скачать |
| Variant 5 | скачать |
| Variant 6 | скачать |
| Variant 7 | скачать |
| Variant 8 | скачать |
| Variant 9 | скачать |
| Variant 10 | скачать |
| Variant 11 | скачать |
| Variant 12 | скачать |
| Variant 13 | скачать |
| Variant 14 | скачать |
| Variant 15 | скачать |
| Variant 16 | скачать |
| Variant 17 | скачать |
| Variant 18 | скачать |
| Variant 19 | скачать |
| Variant 20 | скачать |
| Variant 21 | скачать |
| Variant 22 | скачать |
| Variant 23 | скачать |
| Variant 24 | скачать |
| Variant 25 | скачать |
| Variant 26 | скачать |
| Variant 27 | скачать |
| Variant 28 | скачать |
| Variant 29 | скачать |
| Variant 30 | скачать |
| vk.com/shkolkovo_him | |
| вариант 1 | разбор |
| вариант 2 | разбор |
| вариант 3 | ответы |
| вариант 4 | ответы |
| вариант 5 | ответы |
| vk.com/repetitor_korsakova | |
| variant 1 | otvet |
| variant 2 | otvet |
| variant 3 | otvet |
| СтатГрад | |
| Вариант 1-2 | критерии оценивания |
| Вариант 3-4 | критерии оценивания |
| vk.com/schoolzhukova | скачать вариант
ответы |
| → купить сборники типовых вариантов ЕГЭ по химии |
Варианты в соответствии с новой демоверсией ЕГЭ 2022 по химии.
→ Тренировочные варианты ЕГЭ 2021 по химии
Подходы к отбору содержания, разработке структуры КИМ ЕГЭ
Отбор содержания заданий КИМ для проведения ЕГЭ по химии в 2022 г. в целом осуществляют с сохранением установок, на основе которых формировались экзаменационные модели предыдущих лет. В числе этих установок наиболее важными с методической точки зрения являются следующие.
КИМ ориентированы на проверку усвоения системы знаний и умений, формирование которых предусмотрено действующими программами по химии для общеобразовательных организаций. Во ФГОС эта система знаний и умений представлена в виде требований к предметным результатам освоения учебного предмета. С данными требованиями соотносится уровень предъявления в КИМ проверяемых элементов содержания.
Экзаменационные варианты по химии содержат задания, различные по форме предъявления условия и виду требуемого ответа, по уровню сложности, а также по способам оценки их выполнения. Как и в предыдущие годы, задания КИМ ЕГЭ 2022 г. построены на материале основных разделов школьного курса химии: общей, неорганической и органической, изучение которых обеспечивает овладение учащимися системой химических знаний.
К числу главных составляющих этой системы относятся: ведущие понятия о химическом элементе, веществе и химической реакции; основные законы и теоретические положения химии; знания о системности и причинности
химических явлений, генезисе веществ, способах познания веществ.
В стандарте эта система знаний представлена в виде требований к уровню подготовке выпускников. В целях обеспечения возможности дифференцированной оценки учебных достижений выпускников КИМ ЕГЭ осуществляют проверку освоения основных образовательных программ по химии на трёх уровнях сложности: базовом, повышенном и высоком.
При разработке КИМ особое внимание было уделено реализации требований к конструированию заданий различного типа. Каждое задание строилось таким образом, чтобы его содержание соответствовало требованиям к уровню усвоения учебного материала и формируемым видам учебной деятельности.
Учебный материал, на основе которого строились задания, отбирался по признаку его значимости для общеобразовательной подготовки выпускников средней школы. Большое внимание при конструировании заданий было уделено усилению деятельностной и практико-ориентированной составляющей их содержания. Данный подход позволяет усилить дифференцирующую способность экзаменационной модели, так как требует от обучающихся последовательного выполнения нескольких мыслительных операций с опорой на понимание причинно- следственных связей, умений обобщать знания, применять ключевые понятия и др.
Смотрите также:
Автор статьи — профессиональный репетитор О. В. Овчинникова.

Трудность такого задания в том, что школьники слабо представляют себе экспериментальную, не «бумажную» химию. Не все понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно. Вот кратких словарь таких понятий.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). Она не имеет отношения к навесу над крыльцом
- Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются!
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор.
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
- Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком. - Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Пересыщенный раствор – это раствор, в котором при данной температуре растворено больше вещества, чем в насыщенном.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
-
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
- Литий реагирует с азотом при комнатной температуре, образуя твёрдый нитрид лития:
- При взаимодействии нитридов с водой образуется аммиак:
- Аммиак реагирует с кислотами, образуя средние и кислые соли. Слова в тексте «до прекращения химических реакций» означают, что образуется средняя соль, ведь первоначально получившаяся кислая соль далее будет взаимодействовать с аммиаком и в итоге в растворе будет сульфат аммония:
- Обменная реакция между сульфатом аммония и хлоридом бария протекает с образованием осадка сульфата бария:
- После удаления осадка фильтрат содержит хлорид аммония, при взаимодействии которого с раствором нитрита натрия выделяется азот, причём эта реакция идёт уже при 85 градусах:
-
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили, фильтрат упарили, полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
- Алюминий окисляется азотной кислотой, образуя нитрат алюминия. А вот продукт восстановления азота может быть разным, в зависимости от концентрации кислоты. Но надо помнить, что при взаимодействии азотной кислоты с металлами не выделяется водород! Поэтому простым веществом может быть только азот:
- Если к раствору нитрата алюминия добавить карбонат натрия, то идёт процесс взаимного гидролиза (карбонат алюминия не существует в водном растворе, поэтому катион алюминия и карбонат-анион взаимодействуют с водой). Образуется осадок гидроксида алюминия и выделяется углекислый газ:
- Осадок — гидроксид алюминия, при нагревании разлагается на оксид и воду:
- В растворе остался нитрат натрия. При его сплавлении с солями аммония идёт окислительно-восстановительная реакция и выделяется оксид азота (I) (такой же процесс происходит при прокаливании нитрата аммония):
- Оксид азота (I) — является активным окислителем, реагирует с восстановителями, образуя азот:
-
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
- Оксид алюминия — амфотерный оксид, при сплавлении со щелочами или карбонатами щелочных металлов образует алюминаты:
- Алюминат натрия при растворении в воде образует гидроксокомплекс:
- Растворы гидроксокомплексов реагируют с кислотами и кислотными оксидами в растворе, образуя соли. Однако, сульфит алюминия в водном растворе не существует, поэтому будет выпадать осадок гидроксида алюминия. Обратите внимание, что в реакции получится кислая соль — гидросульфит калия:
- Гидросульфит калия является восстановителем и окисляется бромной водой до гидросульфата:
- Полученный раствор содержит гидросульфат калия и бромоводородную кислоту. При добавлении щелочи нужно учесть взаимодействие с ней обоих веществ:
-
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
- Сульфид цинка реагирует с соляной кислотой, при этом выделяется газ — сероводород:
- Сероводород — в водном растворе реагирует со щелочами, образуя кислые и средние соли. Поскольку в задании говорится про избыток гидроксида натрия, следовательно, образуется средняя соль — сульфид натрия:
- Сульфид натрия реагирует с хлоридом двухвалентного железа, образуется осадок сульфида железа (II):
- Обжиг — это взаимодействие твёрдых веществ с кислородом при высокой температуре. При обжиге сульфидов выделяется сернистый газ и образуется оксид железа (III):
- Сернистый газ реагирует с кислородом в присутствии катализатора, образуя серный ангидрид:
-
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
- При восстановлении оксида кремния магнием образуется кремний, который реагирует с избытком магния. При этом получается силицид магния:
Можно записать при большом избытке магния суммарное уравнение реакции:
- При растворении в воде полученной смеси растворяется силицид магния, образуется гидроксид магния и силан (окисд магния реагирует с водой только при кипячении):
- Силан при сгорании образует оксид кремния:
- Оксид кремния — кислотный оксид, он реагирует со щелочами, образуя силикаты:
- При действии на растворы силикатов кислот, более сильных, чем кремниевая, она выделяется в виде осадка:
Задания С2 из вариантов ЕГЭ по химии для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
- На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.
- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Ответы к заданиям для самостоятельного решения:
или
Читаем дальше: Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Задача 31 на ЕГЭ по химии. Особенности и подводные камни» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
09.03.2023
3 сентября 2022
В закладки
Обсудить
Жалоба
Сборник экзаменационных заданий прошлых лет.
Выдержка из формулировки каждого варианта этого задания: «Напишите уравнения четырёх описанных реакций».
→ Задания: 31_zadania.pdf
→ Решения: 31_reshenia.pdf
Источник: vk.com/examtop
Задания 34 (2019). Расчет массовой доли химического соединения в смеси.
Источник текстов условий задач — паблик Вконтакте И.С. Ермолаева «ЕГЭ по химии на максимум».
Авторы решений: Широкопояс С.И, Борисов И.С.
Задание №1
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа (III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 2 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 22,07%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и во второй (II) колбах:
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3Na2SO4 + 3CO2 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе, составив пропорцию:
31,8 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 127,2 г.
Вычислим общее количество карбоната натрия:
ν(Na2CO3) = m/M = 127,2/106 = 1,2 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям карбоната натрия и углекислого газа одно и то же, равное 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 1:2. Тогда пусть в первой реакции выделилось х моль газа, тогда во второй реакции выделилось 2х моль. Составим уравнение:
х + 2x = 1,2 г;
х = 0,4 моль газа выделилось в первой колбе,
2x = 0,8 моль газа выделилось во второй колбе.
Количество нитрата натрия, образовавшегося по второй реакции, находим по стехиометрическому соотношению из второго уравнения:
ν(NaNO3) = 2νII(CO2) = 0,8 · 2 = 1,6 моль.
Вычислим массу нитрата натрия, образовавшегося по реакции (II):
m(NaNO3) = ν · M = 1,6 · 85 = 136 г.
Масса раствора во второй колбе складывается из масс растворов азотной кислоты и карбоната натрия за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы части раствора карбоната магния, которую ввели в реакцию с азотной кислотой, и углекислого газа, выделившегося по второй реакции:
mII(р-ра Na2CO3) = (m(H2O) + m(Na2CO3))/1,2 · 0,8 = (400 + 127,2)/1,2 · 0,8 = 351,47 г,
mII(CO2) = ν · M = 0,8 · 44 = 35,2 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов карбоната натрия и азотной кислоты с учетом вычета массы выделившегося CO2:
mII(конечного р-ра) = m(р-ра HNO3) + mII(р-ра Na2CO3) − mII(CO2) = 300 + 351,47 − 35,2 = 616,27 г.
Ответим на вопрос задачи и найдем массовую долю нитрата натрия:
ω(NaNO3) = 100% · m(NaNO3)/mII(конечного р-ра) · 100% = 136/616,27 · 100% = 22,07%.
Задание №2
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившийся из второй колбы, оказался в 1,5 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 13,34%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaCl + 3H2S (I)
Na2S + 2HCl = 2NaCl + H2S (II)
Из условия мы видим, что смешав 100 г воды и 15,6 г сульфида натрия мы получаем насыщенный раствор, масса которого, очевидно, будет равна 115,6 г (100 г + 15,6 г)
Вычислим массу сульфида натрия (mисх.(Na2S)) в исходном растворе:
15,6 г Na2S – 115,6 г раствора (из данных о растворимости);
mисх.(Na2S) – 289 г раствора.
Тогда, mисх.(Na2S) = 289 · 15,6/115,6 = 39 г.
Вычислим общее количество сульфида натрия:
ν(Na2S) = m/M = 39/78 = 0,5 моль.
Пусть количество сульфида натрия, содержавшегося в первой колбе равно x моль, тогда, в соответствии с первым уравнением реакции, количество сероводорода, выделившегося из первой колбы, также будет равно х моль. В условии сказано, что объем газа, выделившегося из второй колбы в 1,5 раза больше объема газа, выделившегося из первой. Это означает, что и количество моль выделившегося газа тоже будет в полтора раза больше, то есть 1,5 х моль. В соответствии с уравнением реакции (II), количество сульфида натрия во второй колбе равно количеству вещества сероводорода, то есть тоже 1,5х моль.
Мы знаем, что общее количество сульфида натрия равно 0,5 моль. Тогда, мы можем записать уравнение:
х + 1,5х = 0,5;
2,5x = 0,5;
х = 0,2.
То есть, в первой колбе содержалось количество вещества сульфида натрия равное:
νI(Na2S) = x моль = 0,2 моль,
в свою очередь, во второй колбе содержалось количество вещества сульфида натрия равное:
νII(Na2S) = 1,5x моль = 1,5 · 0,2 моль = 0,3 моль.
В соответствии с уравнением реакции (II) количество вещества хлорида натрия во второй колбе будет равно:
νII(NaCl) = 2νII(Na2S) = 0,3 · 2 = 0,6 моль.
Тогда: mII(NaCl) = ν · M = 0,6 · 58,5 = 35,1 г.
Для расчета массы конечного раствора во второй колбе нужно сложить массы растворов добавленной соляной кислоты и массы раствора сульфида натрия во второй колбе, а также вычесть массу выделившегося из второй колбы сероводорода.
Вычислим массу раствора сульфида натрия во второй колбе, зная, что весь исходный раствор сульфида натрия до разделения имел массу 289 г и содержал 0,5 моль сульфида натрия, а во второй колбе до прибавления соляной кислоты содержалось 0,3 моль сульфида натрия. Запишем пропорцию:
0,5 моль Na2S − 289 г раствора;
0,3 моль Na2S − mII(р-ра Na2S);
mII(р-ра Na2S) = 289/0,5 · 0,3 = 173,4 г.
В соответствии с уравнением реакции (II) количество выделившегося сероводорода из второй колбы равно количеству вещества Na2S во второй колбе.
νII(H2S) = νII(Na2S) = 0,3 моль,
тогда масса выделившегося из второй колбы сероводорода будет равна:
mII(H2S) = ν · M = 0,3 · 34 = 10,2 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов сульфида натрия и соляной кислоты с учетом вычета массы выделившегося H2S:
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра Na2S) − mII(H2S) = 100 + 173,4 − 10,2 = 263,2 г.
Ответим на вопрос задачи и найдем массовую долю хлорида натрия:
ω(NaCl) = 100% · mII(NaCl)/mII(конечного р-ра) = 100% · 35,1/263,2 = 13,34%.
Задание №3
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 19,93%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
2AlCl3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 6KCl + 3CO2 (I)
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl (II)
Вычислим массу хлорида алюминия (y г) в исходном растворе:
53,4 г соли – 153,4 г раствора (по условию растворимости)
y г соли – 306,8 г раствора
y = 106,8 г.
Вычислим общее количество хлорида алюминия:
ν(AlCl3) = m/M = 106,8/133,5 = 0,8 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям хлорида алюминия и гидроксида алюминия одно и то же, равное 1:1. По условию задачи соотношение масс осадков, которые выделились в реакциях (I и II), равно 1:3. Тогда пусть в первой реакции образовалось х моль осадка, во второй колбе образовалось 3х моль. Составим уравнение:
х + 3x = 0,8
х = 0,2 моль Al(OH)3 образовалось в первой колбе,
3x = 0,6 моль Al(OH)3 образовалось во второй колбе.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения:
ν(NH4Cl) = 3νII(Al(OH)3) = 0,6 · 3 = 1,8 моль.
Масса хлорида аммония, образовавшегося во второй колбе:
m(NH4Cl) = ν · M = 1,8 · 53,5 = 96,3 г.
Масса раствора во второй колбе складывается из масс растворов аммиака и хлорида алюминия за вычетом осадка гидроксида алюминия. Обратим внимание на то, что масса раствора хлорида алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы части раствора хлорида алюминия, которую ввели в реакцию с раствором аммиака (реакция (II)) и образовавшегося гидроксида алюминия:
mII(р-ра AlCl3) = 306,8/0,8 · 0,6 = 230,1 г,
mII(Al(OH)3) = ν · M = 0,6 · 78 = 46,8 г.
Масса раствора во второй колбе рассчитывается из масс растворов хлорида алюминия и аммиака с учетом вычета образовавшегося осадка Al(OH)3:
mII(конечного р-ра) = m(р-ра NH3) + mII(р-ра AlCl3) − mII(Al(OH)3) = 300 + 230,1 − 46,8 = 483,3 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония во второй колбе:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 96,3/483,3 · 100% = 19,93%.
Видеоразбор решения данной задачи на моем ютуб-канале:
Задание №4
Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твердого гидроксида натрия и нагрели до прекращения выделения газа. К раствору во второй колбе добавили 250 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившегося из первой колбы, оказался в 3 раза больше объема газа, выделившегося из второй колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 26,62%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
(NH4)2CO3 + 2NaOH = Na2CO3 + 2NH3 + 2H2O (I)
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2 + H2O (II)
Вычислим массу карбоната аммония (y г) в исходном растворе:
96 г соли – 100 г воды (по условию растворимости);
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 240 г.
Вычислим общее количество карбоната аммония:
ν((NH4)2CO3) = m/M = 240/96 = 2,5 моль.
Далее обратим внимание на то, что в первой реакции соотношение по молям исходной соли и газа (NH3) равно 1:2, а во второй реакции соотношение соли и газа (CO2) равно 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 3:1. Тогда, если в первой реакции выделилось 3х моль газа, то во второй − х моль. Соответственно, карбоната аммония в первой реакции затрачено 1,5х моль, а во второй реакции − х моль. Составим уравнение:
х + 1,5x = 2,5
х = 1 моль (NH4)2CO3 затратилось по второй реакции,
1,5x = 1,5 моль (NH4)2CO3 затратилось по первой реакции.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения:
ν(NH4Cl) = 2νII((NH4)2CO3) = 1 · 2 = 2 моль.
Вычислим массу хлорида аммония, образовавшегося по второй реакции:
m(NH4Cl) = ν · M = 2 · 53,5 = 107 г.
Масса раствора во второй колбе складывается из масс растворов соляной кислоты и карбоната аммония за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната аммония во второй колбе пропорциональна количеству чистого вещества. Вычислим массы углекислого газа и части раствора карбоната аммония, которую ввели в реакцию с соляной кислотой:
mII(р-ра (NH4)2CO3) = (mII((NH4)2CO3 + m(H2O))/2,5 · 1 = (240 + 250)/2,5 · 1 = 196 г,
m(CO2) = ν · M = 1 · 44 = 44 г.
Масса конечного раствора во второй колбе рассчитывается из масс растворов карбоната натрия и соляной кислоты с учетом вычета массы углекислого газа:
mII(конечного р-ра) = m(HCl) + mII(р-ра (NH4)2CO3) − m(CO2) = 250 + 196 − 44 = 402 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 107/402 · 100% = 26,62%.
Задание №5
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 200 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л газа (н.у.). К раствору во второй колбе добавили 222 г 25% раствора хлорида кальция. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида кальция в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 3,1%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (I)
Na2CO3 + CaCl2 = 2NaCl + CaCO3 (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 100 г воды;
y г соли – 200 г воды (плотность воды равна 1 г/мл);
y = 63,6 г.
Вычислим количества исходного карбоната натрия и углекислого газа, выделившегося в первой реакции:
ν(Na2CO3) = m/M = 63,6/106 = 0,6 моль,
ν(CO2) = V/Vm = 4,48/22,4 = 0,2 моль.
Далее вычислим количество карбоната натрия, которое ввели во вторую реакцию:
νII(Na2CO3) = 0,6 − 0,2 = 0,4 моль.
Вычислим исходное количество хлорида кальция:
m(CaCl2) = ν · M = 222 · 0,25 = 55,5 г,
ν(CaCl2) = m/M = 55,5/111 = 0,5 моль.
Вычислим массу избытка хлорида кальция, который остался во второй колбе после прохождения реакции:
ν(CaCl2) = 0,5 − 0,4 = 0,1 моль,
m(CaCl2) = ν · M = 0,1 · 111 = 11,1 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и карбоната натрия за вычетом осадка карбоната кальция. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы карбоната кальция и части раствора карбоната натрия, которую ввели в реакцию с хлоридом кальция:
mII(р-ра Na2CO3) = (m(H2O) + m(Na2CO3))/ 0,6 · 0,4 = (200 + 63,6)/0,6 · 0,4 = 175,73 г,
m(CaCO3) = ν · M = 0,4 · 100 = 40 г,
mII(конечного р-ра) = m(CaCl2) + mII(р-ра Na2CO3) — m(CaCO3) = 222 + 175,73 − 40 = 357,73 г.
Ответим на вопрос задачи и найдем массовую долю хлорида кальция:
ω(CaCl2) = m(CaCl2)/m(конечного р-ра) · 100% = 11,1/357,73 · 100% = 3,1%.
[adsp-pro-3]
Задание №6
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа (II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 3,11%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + BaCl2 = FeCl2 + BaSO4 (I)
FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + 2NH4Cl (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 130,4 г раствора;
y г соли – 326 г раствора;
y = 76 г.
Вычислим общее количество сульфата железа (II):
ν(FeSO4) = m/M = 76/152 = 0,5 моль.
Поскольку ν(BaSO4) = νI(FeSO4), тогда количество осадка сульфата бария в первой колбе:
ν(BaSO4) = νI(FeSO4) = m/M = 46,6/233 = 0,2 моль.
Вычислим количества сульфата железа (II) и аммиака, которые ввели во вторую реакцию:
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,5 − 0,2 = 0,3 моль,
m(NH3) = w(NH3) · m(р-ра)/100 = 50 · 34/100 = 17 г,
ν(NH3) = m/M = 17/17 = 1 моль.
Поскольку ν(NH3) = 2νII(FeSO4), тогда вычислим количество и массу аммиака, оставшегося после реакции с сульфатом железа (II):
νост.(NH3) = ν(NH3) − 2νII(NH3) = 1 − 0,3 · 2 = 0,4 моль,
mост.(NH3) = ν · M = 0,4 · 17 = 6,8 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и аммиака за вычетом осадка гидроксида железа (II). Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массы гидроксида железа (II) и части раствора сульфата железа (II), которую ввели в реакцию с раствором аммиака:
mII(р-ра FeSO4) = 326/0,5 · 0,3 = 195,6 г,
mII(Fe(OH)2) = ν · M = 0,3 · 90 = 27 г,
mII(конечного р-ра) = mII(р-ра FeSO4) + m(NH3) − mII(Fe(OH)2) = 195,6 + 50 − 27 = 218,6 г.
Ответим на вопрос задачи и найдем массовую долю аммиака:
ω(NH3) = mост.(NH3)/ m(конечного р-ра) · 100% = 6,8/218,6 · 100% = 3,11%.
Задание №7
Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 14,48%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Al2(SO4)3 + 6NH3 + 6H2O = 2Al(OH)3 + 3(NH4)2SO4 (I)
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 (II)
Вычислим массу сульфата алюминия (y г) в исходном растворе:
34,2 г соли – 100 г воды (по условию растворимости);
y г соли – 300 г воды (плотность воды равна 1 г/мл);
y = 102,6 г.
Вычислим общее количество сульфата алюминия:
ν(Al2(SO4)3) = m/M = 102,6/342 = 0,3 моль.
Вычислим количество осадка гидроксида алюминия в первой колбе:
νI(Al(OH)3) = m/M = 15,6/78 = 0,2 моль.
Поскольку νI(Al(OH)3) = 2νI(Al2(SO4)3),
то νI(Al2(SO4)3) = 0,1 моль.
Вычислим количества сульфата алюминия и гидроксида натрия, которые ввели во вторую реакцию:
νII(Al2(SO4)3) = ν(Al2(SO4)3) − νI(Al2(SO4)3) = 0,3 − 0,1 = 0,2 моль,
mII(NaOH) = m(р-ра NaOH) · w(NaOH)/100% = 320 · 0,25 = 80 г,
νII(NaOH) = m/M = 80/40 = 2 моль.
Обратим внимание на то, что гидроксид натрия находится в большом избытке относительно сульфата алюминия, поэтому следует учитывать растворение гидроксида алюминия в растворе щелочи с образованием комплексного соединения:
Al(OH)3 + NaOH = Na[Al(OH)4] (III)
Рассчитаем количество щелочи, которое необходимо для превращения сульфата алюминия в комплекс (исходя из коэффициентов реакции (II)):
νIII(NaOH) = 0,2 · 6 + 0,4 = 1,6 моль.
Количество щелочи, необходимое для реакции меньше, чем у нас имеется по задаче, гипотеза про образование комплексного соединения верна. Далее вычислим массу сульфата натрия:
m(Na2SO4) = ν · M = 0,6 · 142 = 85,2 г.
Масса раствора во второй колбе складывается из масс растворов сульфата алюминия и гидроксида натрия. Осадков и газов в итоге не получилось, из массы раствора ничего не вычитаем. Обратим внимание на то, что масса раствора сульфата алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата алюминия, которую ввели в реакцию с раствором щелочи:
mII(р-ра Al2(SO4)3) = (m(H2O) + m(Na2CO3)/0,3 · 0,2 = (300 + 102,6)/0,3 · 0,2 = 268,4 г,
mII(конечного р-ра) = m(р-ра NaOH) + mII(р-ра Al2(SO4)3) = 320 + 268,4 = 588,4 г.
Ответим на вопрос задачи и найдем массовую долю сульфата натрия:
ω(Na2SO4) = m(Na2SO4)/mII(конечного р-ра) · 100% = 85,2/588,4 · 100% = 14,48%.
Задание №8
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили 395,4 г насыщенного раствора карбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. К раствору во второй колбе добавили 252 г 30%-ного раствора азотной кислоты. (Объемы газов измерены при одинаковых условиях). Определите массовую долю азотной кислоты в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 6,14%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2CO3 + Ca(NO3)2 = CaCO3 + 2NaNO3 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 131,8 г раствора (по условию растворимости);
y г соли – 395,4 г раствора;
y = 95,4 г.
Вычислим общее количество карбоната натрия:
ν(Na2CO3) = m/M = 95,4/106 = 0,9 моль.
Вычислим общее количество карбоната кальция:
ν(CaCO3) = m/M = 50/100 = 0,5 моль.
Вычислим массу и количество вещество исходного количества азотной кислоты:
m(HNO3) = m(р-ра HNO3) · w(HNO3)/100% = 252 · 0,3 = 75,6 г,
ν(HNO3) = m/M = 75,6/63 = 1,2 моль.
По уравнению реакции (I) νI(Na2CO3) = ν(CaCO3), следовательно,
νII(Na2CO3) = ν(Na2CO3) − νI(Na2CO3) = 0,9 – 0,5 = 0,4 моль.
По уравнению реакции (II) 2νII(Na2CO3) = νII(HNO3), следовательно,
νII(HNO3) = 2 · 0,4 = 0,8 моль.
Вычислим массу оставшейся азотной кислоты:
mост.(HNO3) = (1,2 − 0,8) · 63 = 25,2 г.
Масса раствора во второй колбе складывается из масс растворов карбоната натрия и азотной кислоты за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора карбоната натрия, которую ввели в реакцию с раствором азотной кислоты:
mII(р-ра Na2CO3) = 395,4/0,9 · 0,4 = 175,73 г,
m(CO2) = ν · M = 0,4 · 44 = 17,6 г,
mII(конечного р-ра) = m(р-ра HNO3) + mII(р-ра Na2CO3) − m(CO2) = 252 + 175,73 − 17,6 = 410,13 г.
Ответим на вопрос задачи и найдем массовую долю азотной кислоты:
ω(HNO3) = mост.(HNO3)/mII(конечного р-ра) · 100% = 25,2/410,13 · 100% = 6,14%.
Задание №9
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа (II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,24%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 (I)
FeSO4 + Ba(NO3)2 = Fe(NO3)2 + BaSO4 (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 100 г воды;
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 76 г.
Вычислим общее количество сульфата железа (II):
ν(FeSO4) = m/M = 76/152 = 0,5 моль.
Вычислим количество гидроксида железа (II):
ν(Fe(OH)2) = m/M = 18/90 = 0,2 моль.
Вычислим исходные массу и количество вещества нитрата бария:
m(Ba(NO3)2) = m(р-ра Ba(NO3)2) · w(р-ра Ba(NO3)2)/100% = 870 · 0,15 = 130,5 г,
ν(Ba(NO3)2) = m/M = 130,5/261 = 0,5 моль.
Поскольку по уравнению реакции II ν(Fe(OH)2) = νI(FeSO4) = 0,2 моль,
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,5 – 0,2 = 0,3 моль,
νII(FeSO4) = νII(Ba(NO3)2) = 0,3 моль, тогда масса оставшегося нитрата бария:
νост.(Ba(NO3)2) = ν(Ba(NO3)2) − νII(Ba(NO3)2) = 0,5 – 0,3 = 0,2 моль,
mост.(Ba(NO3)2) = ν · M = 0,2 · 261 = 52,2 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и нитрата бария за вычетом осадка сульфата бария. Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата железа (II), которую ввели в реакцию с раствором нитрата бария:
mII(р-ра FeSO4) = (m(H2O) + m(FeSO4))/0,5 · 0,3 = (250 + 76)/0,5 · 0,3 = 195,6 г,
νII(Ba(NO3)2) = ν(BaSO4) = 0,3 моль, тогда масса образовавшегося сульфата бария:
m(BaSO4) = ν · M = 0,3 · 233 = 69,9 г,
mII(конечного р-ра) = m(р-ра Ba(NO3)2) + mII(р-ра FeSO4) − m(BaSO4) = 870 + 195,6 − 69,9 = 995,7 г.
Ответим на вопрос задачи и найдем массовую долю нитрата бария:
ω(Ba(NO3)2) = mост.(Ba(NO3)2)/mII(конечного р-ра) · 100% = 52,2/995,7 · 100% = 5,24%.
Задание №10
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди (II). (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида меди (II) в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 4,54%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Na2S + 2HCl = 2NaCl + H2S (I)
Na2S + CuCl2 = 2NaCl + CuS (II)
Вычислим массу сульфида натрия (y г) в исходном растворе:
15,6 г соли – 100 г воды;
y г соли – 250 г воды (плотность воды равна 1 г/мл);
y = 39 г.
Вычислим исходное количество сульфида натрия:
ν(Na2S) = m/M = 39/78 = 0,5 моль.
Вычислим количество сероводорода, выделившееся по реакции (I):
ν(H2S) = V/Vm = 4,48/22,4 = 0,2 моль.
Вычислим массу и исходное количество хлорида меди (II):
m(CuCl2) = m(р-ра CuCl2) · w(CuCl2)/100% = 450 · 15/100 = 67,5 г,
ν(CuCl2) = m/M = 67,5/135 = 0,5 моль.
По реакции (I) νI(Na2S) = ν(H2S) = 0,2 моль, следовательно, в реакции (II)
νII(Na2S) = ν(Na2S) − νI(Na2S) = 0,5 – 0,2 = 0,3 моль.
По реакции (II) с сульфидом натрия хлорид меди (II) взаимодействуют в соотношении 1:1, т.е. νII(Na2S) = νII(CuCl2) = 0,3 моль.
Вычислим массу оставшегося хлорида меди (II):
mост.(CuCl2) = (0,5 − 0,3) · 135 = 27 г.
Масса раствора во второй колбе складывается из масс растворов сульфида натрия и хлорида меди (II) за вычетом осадка сульфида меди (II). Обратим внимание на то, что масса раствора сульфида натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфида натрия, которую ввели в реакцию с раствором хлорида меди (II):
mII(р-ра Na2S) = (m(H2O) + m(Na2S))/0,5 · 0,3 = (250 + 39)/0,5 · 0,3 = 173,4 г,
m(CuS) = ν · M = 0,3 · 96 = 28,8 г,
mII(конечного р-ра) = m(р-ра CuCl2) + mII(р-ра Na2S) − m(CuS) = 450 + 173,4 − 28,8 = 594,6 г.
Ответим на вопрос задачи и найдем массовую долю хлорида меди (II):
ω(CuCl2) = mост.(CuCl2)/mII(конечного р-ра) · 100% = 27/594,6 · 100% = 4,54%.
[adsp-pro-3]
Задание №11
Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 160 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната натрия. При этом образовалось 30 г осадка. К раствору во второй колбе добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 11,2%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl (I)
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl (II)
Вычислим массу хлорида кальция (y г) в исходном растворе:
55,5 г соли – 100 г воды;
y г соли – 160 г воды (плотность воды равна 1 г/мл);
y = 88,8 г.
Вычислим исходное количество хлорида кальция:
ν(CaCl2) = m/M = 88,8/111 = 0,8 моль.
Вычислим количество карбоната кальция:
ν(CaCO3) = m/M = 30/100 = 0,3 моль.
Вычислим массу и исходное количество нитрата серебра:
m(AgNO3) = m(р-ра (AgNO3)) · w(AgNO3)/100% = 595 · 0,4 = 238 г,
ν(AgNO3) = m/M = 238/170 = 1,4 моль.
По уравнению реакции (I) ν(CaCO3) = νI(CaCl2) = 0,3 моль, следовательно,
νII(CaCl2) = ν(CaCl2) − νI(CaCl2) = 0,8 – 0,3 = 0,5 моль.
По уравнению реакции (II) 2νII(CaCl2) = ν(AgNO3) = 2 · 0,5 = 1 моль.
Вычислим массу оставшегося нитрата серебра:
mост.(AgNO3) = (1,4 − 1) · 170 = 68 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и нитрата серебра за вычетом осадка хлорида серебра. Обратим внимание на то, что масса раствора хлорида кальция во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида кальция, которую ввели в реакцию с раствором нитрата серебра:
mII(р-ра CaCl2) = (m(H2O) + m(CaCl2))/0,8 · 0,5 = (160 + 88,8)/0,8 · 0,5 = 155,5 г.
По уравнению реакции (II) ν(AgNO3) = ν(AgCl) = 1 моль, тогда
m(AgCl) = ν · M = 1 · 143,5 = 143,5 г;
mII(конечного р-ра) = m(р-ра AgNO3) + mII(р-ра CaCl2) − m(AgCl) = 595 + 155,5 − 143,5 = 607 г.
Ответим на вопрос задачи и найдем массовую долю нитрата серебра в конечном растворе:
ω(AgNO3) = mост.(AgNO3)/mII(конечного р-ра) · 100% = 68/607 · 100% = 11,2%.
Задание №12
Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,57%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
NaHCO3 + Ba(OH)2 = BaCO3 + NaOH + H2O (I)
2NaHCO3 + H2SO4 = Na2SO4 + 2CO2 + 2H2O (II)
Вычислим массу гидрокарбоната натрия (y г) в исходном растворе:
12,6 г соли – 112,6 г раствора;
y г соли – 450,4 г раствора;
y = 50,4 г.
Вычислим общее количество гидрокарбоната натрия:
ν(NaHCO3) = m/M = 50,4/84 = 0,6 моль.
Вычислим количество карбоната бария:
ν(BaCO3) = m/M = 39,4/197 = 0,2 моль.
Вычислим массу и исходное количество серной кислоты:
m(H2SO4) = m(р-ра H2SO4) · w(H2SO4)/100% = 245 · 20%/100% = 49 г,
ν(H2SO4) = m/M = 49/98 = 0,5 моль.
По уравнению реакции (II) ν(BaCO3) = νI(NaHCO3) = 0,2 моль, следовательно,
νII(NaHCO3) = ν(NaHCO3) − νI(NaHCO3) = 0,6 – 0,2 = 0,4 моль.
По уравнению реакции (II) νII(NaHCO3) = 2νII(H2SO4), следовательно,
во второй колбе реагирует νII(H2SO4) = νII(NaHCO3)/2 = 0,4/2 = 0,2 моль.
Вычислим количество массу оставшейся серной кислоты:
νост.(H2SO4) = 0,5 – 0,2 = 0,3 моль,
mост.(H2SO4) = ν · M = 0,3 · 98 = 29,4 г.
Масса раствора во второй колбе складывается из масс растворов гидрокарбоната натрия и серной кислоты за вычетом углекислого газа. Обратим внимание на то, что масса раствора гидрокарбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора гидрокарбоната натрия, которую ввели в реакцию с раствором серной кислоты:
mII(р-ра NaHCO3) = 450,4/0,6 · 0,4 = 300,27 г,
m(CO2) = ν · M = 0,4 · 44 = 17,6 г.
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра NaHCO3) − m(CO2) = 245 + 300,27 − 17,6 = 527,67 г.
Ответим на вопрос задачи и найдем массовую долю серной кислоты:
ω(H2SO4) = mост.(H2SO4)/mII(конечного р-ра) · 100% = 29,4/527,67 · 100% = 5,57%.
Задание №13
Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 767 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 344,4 г осадка. К раствору во второй колбе добавили 960 г 40%-ного раствора гидроксида натрия. Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 14,83%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl (I)
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl (II)
Вычислим массу сульфата алюминия (y г) в исходном растворе:
53,4 г соли – 153,4 г раствора;
y г соли – 767 г раствора;
y = 267 г.
Вычислим исходное количество хлорида алюминия:
ν(AlCl3) = m/M = 267/133,5 = 2 моль.
Вычислим количество хлорида серебра, образовавшегося в первой колбе:
ν(AgCl) = m/M = 344,4/143,5 = 2,4 моль.
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH) · w(NaOH)/100% = 960 · 40%/100% = 384 г,
ν(NaOH) = m/M = 384/40 = 9,6 моль.
Обратим внимание на то, что гидроксид натрия находится в большом избытке относительно хлорида алюминия. Поэтому следует учитывать растворение гидроксида алюминия в растворе щелочи с образованием комплексного соединения:
Al(OH)3 + NaOH = Na[Al(OH)4] (III)
Рассчитаем количество щелочи, которое необходимо для превращения хлорида алюминия в комплекс.
По уравнению реакции (I) ν(AgCl) = 3νI(AlCl3), следовательно,
νI(AlCl3) = m/M = 2,4/3 = 0,8 моль.
Количество хлорида алюминия, прореагировавшего по второй реакции, составляет:
νII(AlCl3) = ν(AlCl3) − νI(AlCl3) = 2 – 0,8 = 1,2 моль.
Для образования комплекса необходимо количество NaOH, равное 4νII(AlCl3). Отсюда
νIII(NaOH) = 1,2 · 3 + 1,2 = 4,8 моль.
Количество щелочи, необходимое для реакции меньше, чем у нас имеется по задаче, гипотеза про образование комплексного соединения верна. Далее вычислим массу хлорида натрия, если
ν(NaCl) = 3νII(AlCl3) = 1,2 · 3 = 3,6 моль,
m(NaCl) = ν · M = 3,6 · 58,5 = 210,6 г.
Масса раствора во второй колбе складывается из масс растворов хлорида алюминия и гидроксида натрия. Осадков и газов в итоге не образовалось, из массы раствора ничего не вычитаем. Обратим внимание на то, что масса раствора хлорида алюминия во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида алюминия, которую ввели в реакцию с раствором гидроксида натрия:
mII(р-ра AlCl3) = m(р-ра AlCl3) /2 · 1,2 = 767/2 · 1,2 = 460,2 г,
m(конечного р-ра) = m(р-ра NaOH) + mII(р-ра AlCl3) = 960 + 460,2 = 1420,2 г.
Ответим на вопрос задачи и найдем массовую долю хлорида натрия:
ω(NaCl) = m(NaCl)/m(конечного р-ра) · 100% = 210,6/1420,2 · 100% = 14,83%.
Задание №14
Растворимость безводного сульфата железа (II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа (II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 5,26%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
FeSO4 + 2NH3 + 2H2O = Fe(OH)2 + 2NH4Cl (I)
FeSO4 + BaCl2 = FeCl2 + BaSO4 (II)
Вычислим массу сульфата железа (II) (y г) в исходном растворе:
30,4 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 121,6 г.
Вычислим количество сульфата железа (II):
ν(FeSO4) = m/M = 121,6/152 = 0,8 моль.
Вычислим количество гидроксида железа (II):
ν(Fe(OH)2) = m/M = 27/90 = 0,3 моль.
Вычислим массу и исходное количество хлорида бария:
m(BaCl2) = m(р-ра) · w(BaCl2)/100% = 780 · 20%/100% = 156 г,
ν(BaCl2) = m/M = 156/208 = 0,75 моль.
По уравнению реакции (I) ν(Fe(OH)2) = νI(FeSO4) = 0,3 моль, следовательно, во второй реакции
νII(FeSO4) = ν(FeSO4) − νI(FeSO4) = 0,8 – 0,3 = 0,5 моль.
По уравнению реакции (II) νII(FeSO4) = νII(BaCl2) = 0,5 моль.
Вычислим количество вещества и массу оставшегося хлорида бария:
νост.(BaCl2) = 0,75 – 0,5 = 0,25 моль,
mост.(BaCl2) = ν · M = 0,25 · 208 = 52 г.
Масса раствора во второй колбе складывается из масс растворов сульфата железа (II) и хлорида бария за вычетом осадка сульфата бария. Обратим внимание на то, что масса раствора сульфата железа (II) во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора сульфата железа (II), которую ввели в реакцию с раствором хлорида бария:
mII(р-ра FeSO4) = (m(FeSO4)) + m(FeSO4))/0,8 · 0,5 = (400 + 121,6)/0,8 · 0,5 = 326 г,
m(BaSO4) = ν · M = 0,5 · 233 = 116,5 г.
mII(конечного р-ра) = m(р-ра BaCl2) + mII(р-ра FeSO4) − m(BaSO4) = 780 + 326 – 116,5 = 989,5 г.
Ответим на вопрос задачи и найдем массовую долю хлорида бария:
ω(BaCl2) = mост.(BaCl2)/mII(конечного р-ра) · 100% = 52/989,5 · 100% = 5,26%.
Задание №15
Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 1,43%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl (I)
CaCl2 + Na2CO3 = CaCO3 + 2NaCl (II)
Вычислим массу хлорида кальция (y г) в исходном растворе:
55,5 г соли – 100 г воды;
y г соли – 300 г воды (плотность воды равна 1 г/мл);
y = 166,5 г.
Вычислим исходное количество хлорида кальция:
ν(CaCl2) = 166,5/111 = 1,5 моль.
Вычислим количество хлорида серебра:
ν(AgCl) = 143,5/143,5 = 1 моль.
Вычислим массу и исходное количество карбоната натрия:
m(Na2CO3) = m(р-ра Na2CO3) · m(Na2CO3)/100% = 1272 · 10%/100% = 127,2 г,
ν(Na2CO3) = m/M = 127,2/106 = 1,2 моль.
По уравнению реакции (I) ν(AgCl) = 2νI(CaCl2) = 1 моль, следовательно,
νI(CaCl2) = 1/2 = 0,5 моль,
νII(CaCl2) = ν(CaCl2) − νI(CaCl2) = 1,5 – 0,5 = 1 моль.
По уравнению реакции (II)
νII(CaCl2) = νII(Na2CO3) = 1 моль.
Зная νII(Na2CO3), вычислим массу оставшегося карбоната натрия:
mост.(Na2CO3) = ν · M = (1,2 − 1) · 106 = 21,2 г.
Масса раствора во второй колбе складывается из масс растворов хлорида кальция и карбоната натрия за вычетом осадка карбоната кальция. Обратим внимание на то, что масса раствора хлорида кальция во второй колбе пропорциональна количеству чистого вещества. Вычислим массу части раствора хлорида кальция, которую ввели в реакцию с раствором карбоната натрия:
mII(р-ра CaCl2) = ((m(H2O) + m(CaCl2))/1,5 · 1 = (300 + 166,5)/1,5 · 1 = 311 г.
По уравнению реакции (II) νII(CaCl2) = ν(CaCO3) = 1 моль,
m(CaCO3) = ν · M = 1 · 100 = 100 г.
mII(конечного р-ра) = m(р-ра Na2CO3) + mII(р-ра CaCl2) − m(CaCO3) = 1272 + 311 − 100 = 1483 г.
Ответим на вопрос задачи и найдем массовую долю карбоната натрия:
ω(Na2CO3) = mост.(Na2CO3)/mII(конечного р-ра) · 100% = 21,2/1483 · 100% = 1,43%.
[adsp-pro-3]
Задание №16
Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа (III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 2 раза больше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 22,07%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и второй (II) колбах:
Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3Na2SO4 + 3CO2 (I)
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O (II)
Вычислим массу карбоната натрия (y г) в исходном растворе:
31,8 г соли – 100 г воды;
y г соли – 400 г воды (плотность воды равна 1 г/мл);
y = 127,2 г.
Вычислим количество карбоната натрия:
ν(Na2CO3) = 127,2/106 = 1,2 моль.
Далее обратим внимание на то, что в обеих реакциях соотношение по молям карбоната натрия и углекислого газа одно и то же, равное 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 2:1. Тогда пусть в первой реакции выделилось х моль газа, во второй 2х моль. Составим уравнение:
х + 2x = 1,2;
х = 0,4 моль;
следовательно, в первой колбе выделилось 0,4 моль CO2, во второй колбе – 0,8 моль CO2.
Количество нитрата натрия находим по стехиометрическому соотношению из второго уравнения:
ν(NaNO3) = 2νII(CO2) = 0,8 · 2 = 1,6 моль.
Вычислим массу нитрата натрия:
m(NaNO3) = ν · M = 1,6 · 85 = 136 г.
Масса раствора во второй колбе складывается из масс растворов азотной кислоты и карбоната натрия за вычетом углекислого газа. Обратим внимание на то, что масса раствора карбоната натрия во второй колбе пропорциональна количеству чистого вещества. Вычислим массы углекислого газа и части раствора карбоната натрия, которую ввели в реакцию с азотной кислотой:
mII(р-ра Na2CO3) = (m(H2O) + m(р-ра Na2CO3)/1,2 · 0,8 = (400+127,2)/1,2 · 0,8 = 351,47 г.
mII(CO2) = ν · M = 0,8 · 44 = 35,2 г.
mII(конечного р-ра) = m(р-ра NaNO3) + mII(р-ра Na2CO3) − mII(CO2) = 300 + 351,47 − 35,2 = 616,27 г.
Ответим на вопрос задачи и найдем массовую долю нитрата натрия:
ω(NaNO3) = m(NaNO3)/mII(конечного р-ра) · 100% = 136/616,27 · 100% = 22,07%.
Задание №17
Растворимость безводного сульфита аммония при некоторой температуре составляет 58 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита аммония к 120 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 120 г раствора соляной кислоты, также взятой в избытке. При этом объем газа, выделившегося из второй колбы, оказался в 4 раза меньше объема газа, выделившегося из первой колбы. (Объемы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Ответ: 12,56%
Пояснение:
Запишем уравнения протекающих реакций в первой (I) и во второй (II) колбах:
(NH4)2SO3 + 2HNO3 = (NH4)2SO4 + 2NO2 + H2O (I)
(NH4)2SO3 + 2HCl = 2NH4Cl + SO2 + H2O (II)
Вычислим массу сульфита аммония (y г) в исходном растворе:
58 г соли – 100 г воды;
y г соли – 120 г воды (плотность воды равна 1 г/мл);
y = 69,6 г.
Вычислим количество сульфита аммония:
ν((NH4)2SO3) = m/M = 69,6/116 = 0,6 моль.
Далее обратим внимание на то, что в первой реакции соотношение по молям сульфита аммония и газа равно 1:2, а во второй реакции – 1:1. По условию задачи соотношение объемов газов, которые выделились в реакциях (I) и (II), равно 4:1. Тогда пусть в первой реакции выделилось 4х моль газа, во второй колбе − х моль. Тогда по реакции (I) прореагировало 2x моль сульфита аммония, по реакции (II) – x моль сульфита аммония. Составим уравнение:
х + 2x = 0,6;
х = 0,2 моль сульфита аммония прореагировало во второй колбе,
2x = 0,4 моль сульфита аммония прореагировало в первой колбе.
Количество хлорида аммония находим по стехиометрическому соотношению из второго уравнения.
По уравнению реакции (II) ν(NH4Cl) = 2νII((NH4)2SO3), следовательно,
ν(NH4Cl) = 0,2 · 2 = 0,4 моль.
Вычислим массу хлорида аммония:
m(NH4Cl) = ν · M = 0,4 · 53,5 = 21,4 г.
Масса раствора во второй колбе складывается из масс растворов сульфита аммония и соляной кислоты за вычетом сернистого газа. Обратим внимание на то, что масса раствора сульфита аммония во второй колбе пропорциональна количеству чистого вещества. Вычислим массы сернистого газа и части раствора сульфита аммония, которую ввели в реакцию с соляной кислотой:
mII(р-ра (NH4)2SO3) = (m(H2O) + m((NH4)2SO3)/0,6 · 0,2 = (120 + 69,6)/0,6 · 0,2 = 63,2 г,
m(SO2) = ν · M = 0,2 · 64 = 12,8 г.
mII(конечного р-ра) = m(р-ра HCl) + mII(р-ра (NH4)2SO3) − m(SO2) = 120 + 63,2 − 12,8 = 170,4 г.
Ответим на вопрос задачи и найдем массовую долю хлорида аммония:
ω(NH4Cl) = m(NH4Cl)/mII(конечного р-ра) · 100% = 21,4/170,4 · 100% = 12,56%.