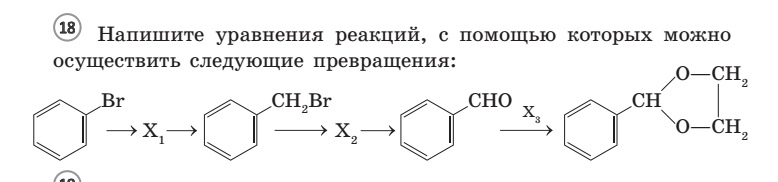
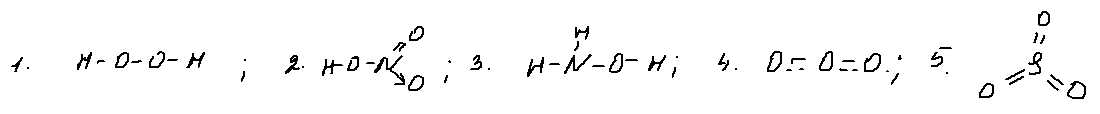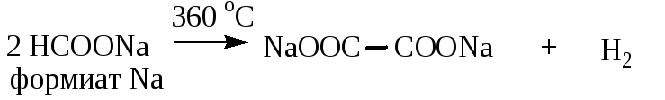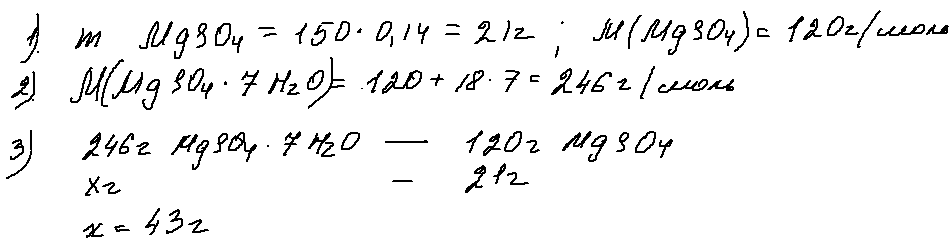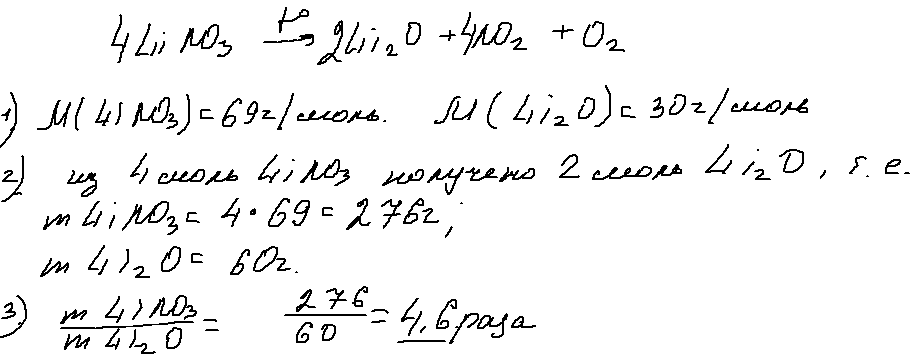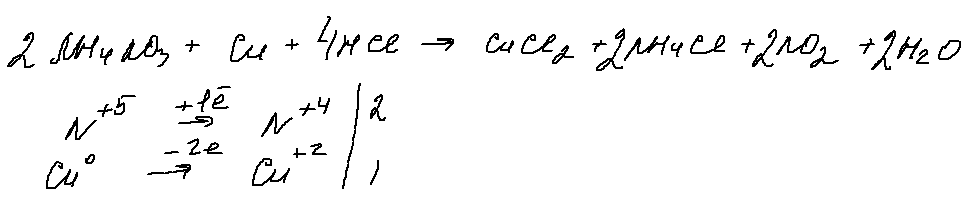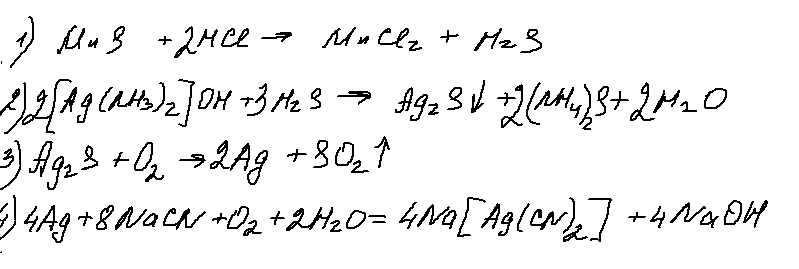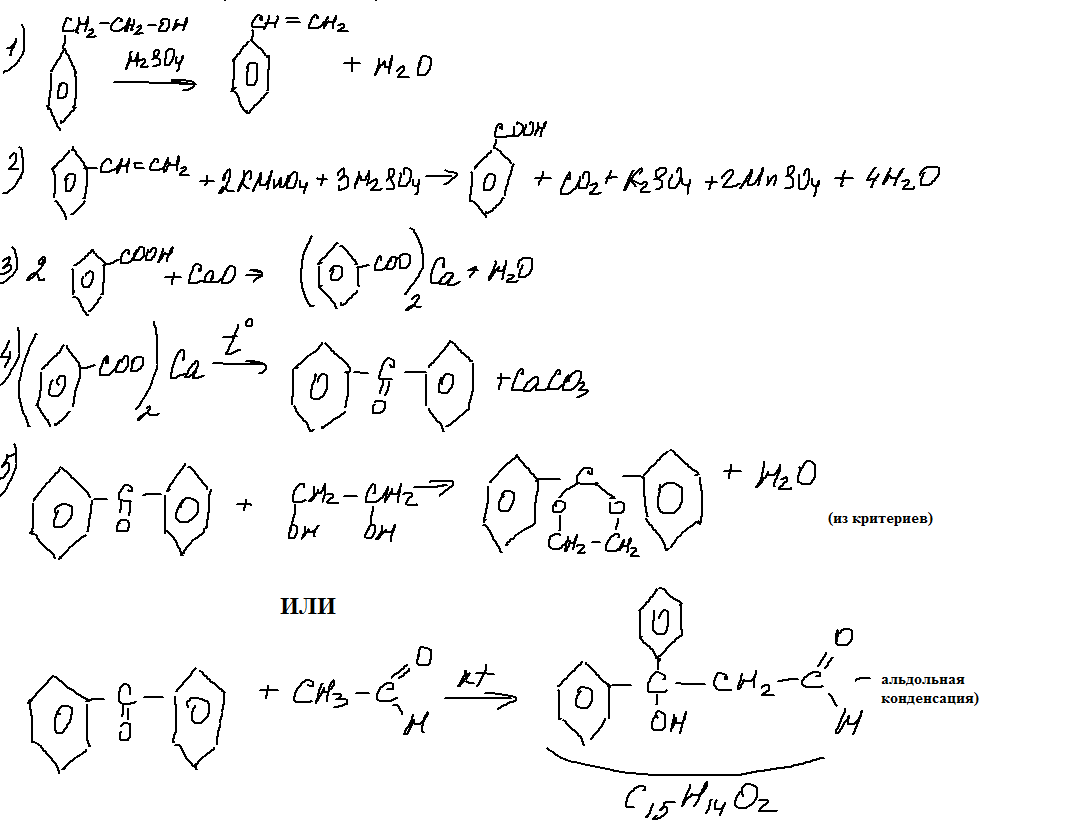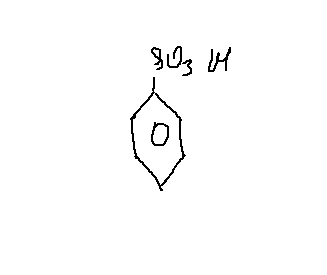Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) муравьиная кислота с бромной водой
Б) уксусная кислота с бромом
В) этилат натрия с водой
Г) этилат натрия с бромэтаном
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.
Решение.
Установим соответствие.
1) Муравьиная кислота, в отличие от других карбоновых кислот, обесцвечивает бромную воду с образованием бромоводорода и углекислого газа. Ответ 6.
2) При реакции уксусной кислоты с бромом идет замещение протона в альфа положении к группе на бром. Ответ 2.
3) Взаимодействие этилата натрия с водой — реакция обмена, в ходе которой образуется этанол и гидроксид натрия. Ответ 5.
4) Взаимодействие этилата натрия с бромэтаном — реакция обмена, в ходе которой образуется диэтиловый эфир и бромид натрия. Ответ 3.
Ответ: 6253.
Елена Шаврак. ЕГЭ по химии: новые упражнения и цепочки превращений. вопрос — хим. связь.. вопрос.
Елена Шаврак
ЕГЭ по химии: новые упражнения и цепочки превращений
Здравствуйте, уважаемые читатели!
Сегодня я хочу рассмотреть некоторые задания из нового СтатГрадовского пробника от 3 марта 2021 года. Причина — подобные упражнения ранее мне не встречались ни в одном из пробников и пособий за последние 8 лет. Про себя я данный факт обозначила как : «СтатГрад расширяет границы», причем это расширение носит как экстенсивный, так и интенсивный характер.
Итак, по порядку. Начинаю с заданий 1 варианта.
1. 4 вопрос — хим. связь.
Для выполнения этого задания запишем структурные формулы всех веществ (не учитываю валентные углы):
Только одинарные ковалентные связи есть в молекуле пероксида водорода (1) и гидроксиламина (3).
Новизна этого задания, скорее, экстенсивного характера. Т.е., несмотря на то, что ранее подобная формулировка 4 задания не встречалась в пробниках (мое субъективное мнение), для его выполнения вполне достаточно школьной базы.
2. 7 вопрос.
Для выполнения этого задания необходимо знать, что соединения меди могут выпадать в осадок при добавлении растворов трех реагентов из предложенного списка, а именно: аммиака, сероводорода и карбоната калия. Но в избытке аммиака осадок растворится вследствие образования аммиакатного комплекса меди. Одновременное образование осадка и газа — это маркерный признак совместного (или смешанного) гидролиза, протекающего при смешении растворов соли меди и карбоната. Т.о., ответы — Х- H2S, Y- K2CO3.
Новизна этого задания также условная. Аммиакатные комплексы меди (и цинка) в 7 задании встречались и ранее, но ОЧЕНЬ редко.
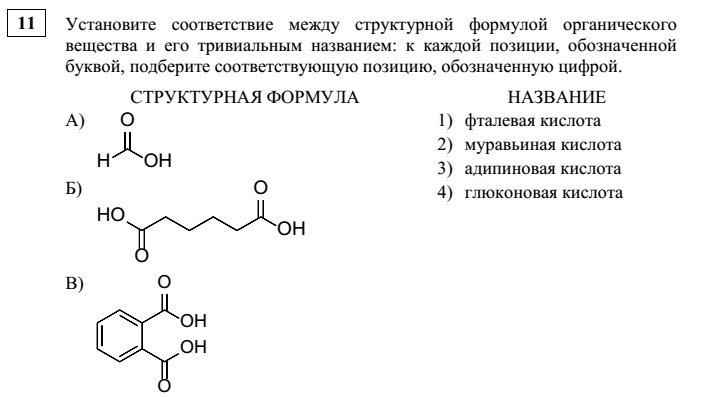
3. 11 вопрос
Практически во всех последних СтатГрадовских пробниках в 11 задании используются «скелетные» формулы органических веществ. Выскажу свою точку зрения: это хорошо, поскольку, опять же, — расширяет границы восприятия материала. Надеюсь, что, со временем, в формулировках будут использоваться классические скелетные формулы, в которых клинообразными линиями обозначаются связи, направленные вверх относительно плоскости, т.е. к наблюдателю, пунктирными линиями обозначаются связи, направленные вниз относительно плоскости, т.е. от наблюдателя.
Ответы — 231
Новизна этого задания невелика. Пожалуй, при подготовке стоит обратить внимание на отработку тривиальных названий органических соединений.
4. 17 вопрос
В 17 задании, посвященном кислородсодержащей органике, приведена практически не упоминавшаяся в пробниках и сборниках тестов реакция термического превращения формиата натрия до оксалата натрия:
Мой личный вывод: спасибо СтатГраду за актуализацию ранее невостребованной информации, относящейся, в принципе, к школьной программе (способы получения дикарбоновых кислот).
5. 27 задача.
Задача 27, в который уже раз в этом году, обращает внимание к кристаллогидратам. Решать ее можно разными способами — через моли, через пропорцию, правилом креста …
Ниже я привела один из вариантов решения., суть которого заключается в нахождении массы всей растворенной соли и последующем «заключении» ее в кристаллогидрат:
Ответ — 43 г.
6. 29 задача.
Задача 29 обращает на себя внимание формулировкой (полное отсутствие числовых данных) и «незамыленной» химией — разложением нитрата активного металла. Опять же и эту задачу можно решать несколькими способами. Ниже привожу один из них:
7. 30 задание.
«Грозное» 30 задание, в котором, при ближайшем рассмотрении, можно выделить только 1 окислитель (нитрат аммония), 1 восстановитель — медь. Для перевода нитрата в азотную кислоту, с которой будет реагировать медь, добавим соляную кислоту. Берем ее концентрированной, чтобы в результате реакции обмена получить концентрированную азотную кислоту (кстати, можно проводить реакцию с выделением оксида азота (2), для этого нужно взять разбавленную соляную кислоту). В результате получаем:
Данная реакция напоминает мне качественную реакцию на нитраты, в которой к нитрату добавляют медь и концентрированную серную кислоту и наблюдают образование бурого газа.
8. 32 задание.
Хорошее задание, ничего не скажешь! Реакция 2 — разрушение комплекса, достаточно типовая. Реакция 3 — окисление сульфида серебра (а еще и ртути) идет с образованием только одного оксида. Реакция достаточно редкая, но встречалась. А вот 4 реакция — меня лично ввела в ступор. Возможно ошибаюсь, но неоднократно от представителей ФИПИ на вебинарах звучало, что на ЕГЭ будут только гидроксокомплексы цинка и алюминия. Понемногу «пробрались» аммиакаты. Но цианидных комплексов до сих пор еще не было. Искренний респект составителям!
9. 33 цепочка.
Вот это задание заслуживает самого пристального внимания. С одной стороны — бруттоформулы в задании- это очень хорошо, поскольку способствует более глубокому проникновению в суть задания. С другой стороны- последняя реакция, представляющая собой введение ацетальной защиты (по мнению авторов пробника). Я бы написала здесь и альдольную конденсацию дифенилкетона с ацетальдегидом. Но этого не дают в школьной программе (или я ошибаюсь?).
Необходимо отметить, что еще одну цепочку с ацетальной защитой я нашла в сборнике
10. 34 задача.
Данную задачу в этой статье отрешивать не буду. Сделаю это позже. Но бросается в глаза новое усложнение — нахождение состава газовой смеси по плотности. Практически не встречалось такого в задачах , предназначенных для подготовки к ЕГЭ.
11. 35 задача.
Одно из заданий, которое мне очень понравилось в этом пробнике.
Решение
1. Схема реакции сгорания неизвестного соединения:
CxHySzOk+O2=CO2+H2O+SO2
2. Найдем молекулярную формулу неизвестного соединения:
а) n(C)=n(CO2)= 20,16/22,4=0,9 моль,
n(Н)=2n(Н2О)= 2*8,1 /18=0,9 моль,
n(S)=n(SO2)= 3,36/22,4=0,15 моль,
n(O)=(23,7-(12*0,9+0,9+32*0,15))/16=0,45 моль
б) Молекулярная формула неизвестного вещества-: С6Н6SO3. Это — бензолсульфокислота
3. Структурная формула —
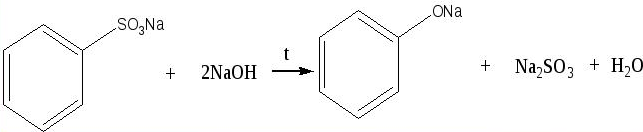
4. Уравнение реакции, происходящей при сплавлении бензолсульфоната натрия со щелочью:
Рассмотрела только первый вариант пробника, но и в нем много информации к размышлению. Резюмирую:
1. Реальный ЕГЭ по сложности раньше не всегда корреллировал со статградовскими пробниками, поэтому не факт, что задания уровня сложности рассмотренных 32-34 стоит ожидать на реальном экзамене.
2. Задания данного пробника актуализируют изучаемую, но относительно редко используемую информацию об органических и неорганических веществах (особенно — задания 4, 7, 11, 17, 27, 29, 35).
3. Для выполнения заданий 32 и 33 необходимо обладать информацией, адекватное усвоение которой возможно только в ходе изучения вузовских курса неорганической и органической химий (подчеркиваю, что это — мое субъективное мнение).
4. Великолепна задача 35. Впервые в пробниках ЕГЭ: серосодержащая органика и практически не используемый ранее при составлении заданий способ получения фенола.
5. В целом — еще раз — респект составителям, но — детей жалко. Без хорошего репетитора до уровня такого пробника не подняться.
Всего доброго!
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
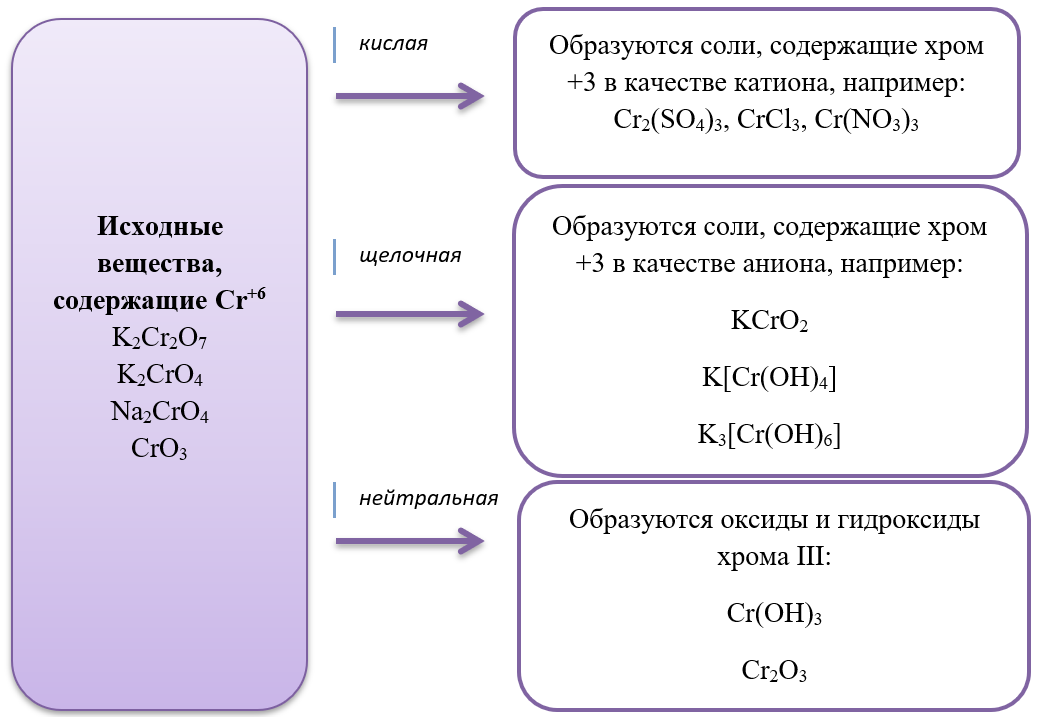
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
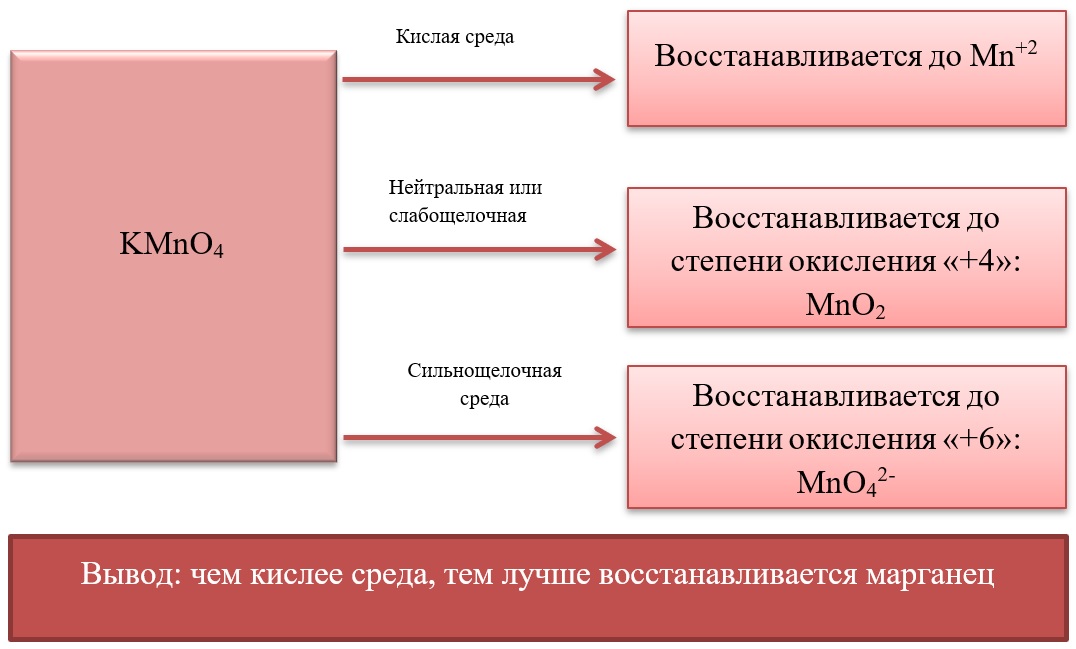
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
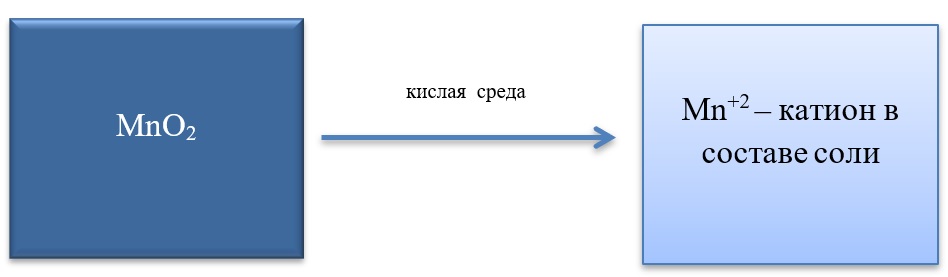
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
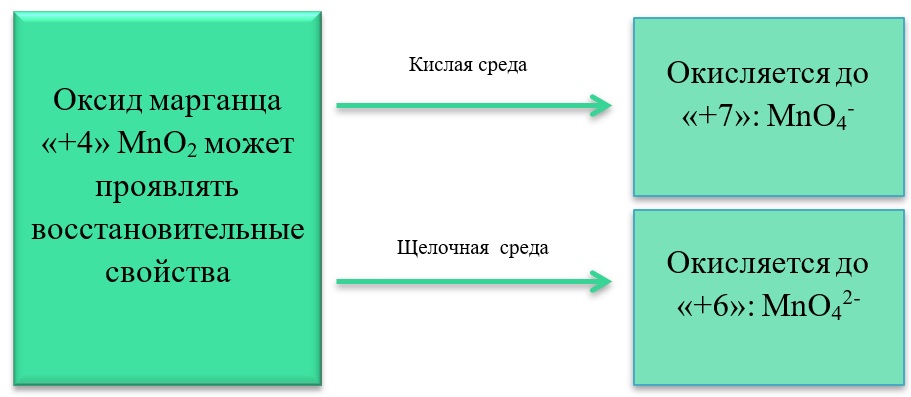
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
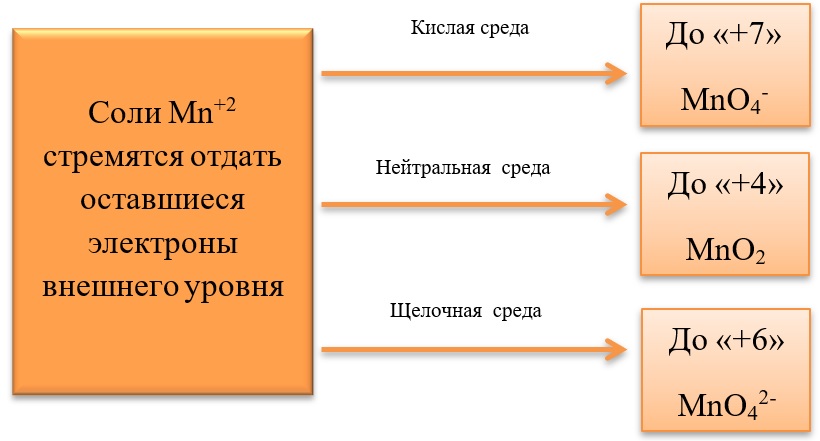
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
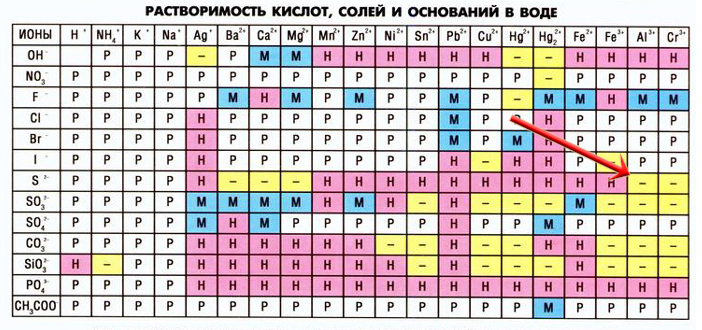
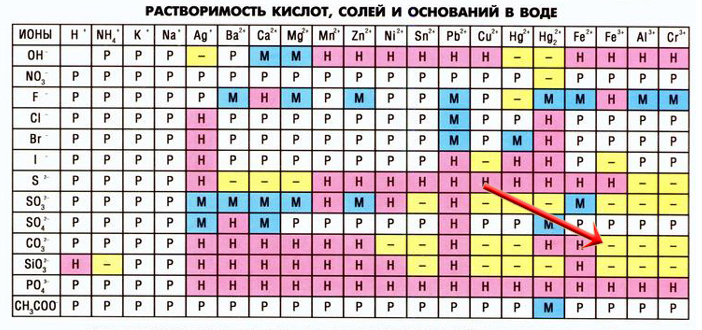
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
Варианты ЕГЭ по химии
Об экзамене
Химию нельзя сдать на высокий балл, просто выучив теорию. Химию надо любить. И любить всем сердцем, чтобы тот безграничный объем информации ровным слоем уложился в голове. А когда мы говорим о будущем, о профессиях, которые будут востребованы долгие годы, то практически все направления, которые связаны с химией, с рынка труда никуда не уйдут. Потребность в “химических мозгах” стабильно растет. Поэтому если вы чувствуете, что есть хоть какая-то предрасположенность к данной науке, не поленитесь и попробуйте себя. И если все получится, то вам откроется безграничное поле для новых открытий и свершений. Меняйте себя и мир вокруг!
Структура
Часть 1 содержит 29 заданий с кратким ответом, часть 2 содержит 5 заданий высокого уровня сложности, с развернутым ответом (порядковые номера этих заданий: 30, 31, 32, 33, 34). На выполнение всех заданий отводится 3,5 часа.
Дополнительные материалы и оборудование
К каждому варианту экзаменационной работы прилагаются следующие материалы:
− Периодическая система химических элементов Д.И. Менделеева;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.
Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор.
Пояснения к оцениванию заданий
За правильный ответ на каждое из заданий 1–8, 12–16, 20, 21, 27–29 ставится 1 балл. Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка, – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Задания части 2 (с развёрнутым ответом) предусматривают проверку от трёх до пяти элементов ответа. Задания с развёрнутым ответом могут быть выполнены выпускниками различными способами. Наличие каждого требуемого элемента ответа оценивается 1 баллом, поэтому максимальная оценка верно выполненного задания составляет от 3 до 5 баллов в зависимости от степени сложности задания: задание 30 – 3 балла; 31 – 4 балла; 32 – 5 баллов; 33 – 4 балла; 34 – 4 балла. Проверка заданий части 2 осуществляется на основе сравнения ответа выпускника с поэлементным анализом приведённого образца ответа.
| Тема | Результат | Задания | |||
|---|---|---|---|---|---|
| 1. | Строение атома | Не изучена | Отработать | ||
| 2. | Закономерности изменения химических свойств и их соединений | Не изучена | Отработать | ||
| 3. | Электроотрицательность, степень окисления, валентность | Не изучена | Отработать | ||
| 4. | Химическая связь. Кристаллическая решетка | Не изучена | Отработать | ||
| 5. | Номенклатура неорганических веществ | Не изучена | Отработать | ||
| 6. | Химические свойства металлов и неметаллов | Не изучена | Отработать | ||
| 7. | Химические свойства оксидов | Не изучена | Отработать | ||
| 8. | Химические свойства кислот, оснований, солей | Не изучена | Отработать | ||
| 9. | Взаимосвязь неорганических веществ | Не изучена | Отработать | ||
| 10. | Окислительно-восстановительные реакции | Не изучена | Отработать | ||
| 11. | Химические свойства неорганических веществ | Не изучена | Отработать | ||
| 12. | Классификация и номенклатура органических веществ | Не изучена | Отработать | ||
| 13. | Гомологи и изомеры | Не изучена | Отработать | ||
| 14. | Химические свойства углеводородов и их получение | Не изучена | Отработать | ||
| 15. | Химические свойства кислородсодержащих соединений и их получение | Не изучена | Отработать | ||
| 16. | Химические свойства азотсодержащих органических соединений и их получение | Не изучена | Отработать | ||
| 17. | Взаимосвязь углеводородов и кислородсодержащих органических веществ | Не изучена | Отработать | ||
| 18. | Химические свойства углеводородов. Механизмы реакций | Не изучена | Отработать | ||
| 19. | Химические свойства кислородсодержащих соединений | Не изучена | Отработать | ||
| 20. | Классификация химических реакций | Не изучена | Отработать | ||
| 21. | Скорость реакции | Не изучена | Отработать | ||
| 22. | Электролиз | Не изучена | Отработать | ||
| 23. | Гидролиз | Не изучена | Отработать | ||
| 24. | Химическое равновесие | Не изучена | Отработать | ||
| 25. | Качественные реакции | Не изучена | Отработать | ||
| 26. | Металлургия, правила работы в лаборатории, производство | Не изучена | Отработать | ||
| 27. | Задача на вычисление массовой доли в растворе | Не изучена | Отработать | ||
| 28. | Задача на расчет по уравнению реакции | Не изучена | Отработать | ||
| 29. | Задача на расчет по уравнению реакции | Не изучена | Отработать | ||
| Часть 2 | |||||
| 30. | Окислительно-восстановительные реакции | Отработать | |||
| 31. | Взаимосвязь неорганических веществ | Отработать | |||
| 32. | Взаимосвязь органических веществ | Отработать | |||
| 33. | Расчетная задача | Отработать | |||
| 34. | Задача на выведение молекулярной формулы вещества | Отработать |
Любой учитель или репетитор может отслеживать результаты своих учеников по всей группе или классу.
Для этого нажмите ниже на кнопку «Создать класс», а затем отправьте приглашение всем заинтересованным.
Ознакомьтесь с подробной видеоинструкцией по использованию модуля.
Рубрика «Химия варианты»
Тренировочный вариант ЕГЭ 2023 по химии №3 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №3 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами
Читать далее
Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №2 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами
Читать далее
Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами
Тренировочный вариант ЕГЭ 2023 по химии №1 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2023. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Смотрите также: Демоверсия ЕГЭ 2023 по химии с ответами
Читать далее
Демоверсия ЕГЭ 2023 по химии с ответами
Демоверсия ЕГЭ 2023 по химии с ответами. Демонстрационный вариант ЕГЭ 2023 г. ХИМИЯ, 11 класс. Единый государственный экзамен по ХИМИИ. скачать Кодификатор — скачать Спецификация — скачать Смотрите также: Демоверсия ЕГЭ 2022 по химии с ответами
Читать далее
Реальный вариант ЕГЭ по химии 2022
Реальный вариант ЕГЭ по химии 2022. Реальные варианты егэ химия 2022 скачать
Читать далее
Открытый вариант КИМ ЕГЭ по химии 2022
Открытый вариант КИМ ЕГЭ по химии 2022. Открытые варианты КИМ ЕГЭ 2022 ФИПИ. Реальный вариант с досрочного ЕГЭ 2022 по химии. Опубликованы открытые варианты контрольных измерительных материалов единого государственного экзамена 2022 года скачать
Читать далее
Тренировочный вариант ЕГЭ 2022 по химии №9 с ответами
Тренировочный вариант ЕГЭ 2022 по химии №9 с ответами «ЕГЭ 100 БАЛЛОВ». Пробные варианты ЕГЭ по химии 2022. ЕГЭ химия. https://vk.com/ege100ballov https://vk.com/chemistry_100 скачать Примеры некоторых заданий из варианта Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Ca 2) O 3) S 4) Cr 5) Se Ответом в заданиях 1–3 является последовательность цифр, под …
Читать далее
Тренировочный вариант №2 ЕГЭ 2022 по химии ChemFamily
Тренировочный вариант №2 ЕГЭ 2022 по химии ChemFamily. Авторский вариант ГЭ 2022 по химии с ответами. https://vk.com/gofor200 скачать Смотрите также: Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily
Читать далее
Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily
Тренировочный вариант №1 ЕГЭ 2022 по химии ChemFamily. Авторский вариант ГЭ 2022 по химии с ответами. https://vk.com/gofor200 скачать Смотрите также: Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова
Читать далее
Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова
Досрочный ЕГЭ 2022 по химии от 21.03.2022 Елена Тарасова. Досрочный вариант ЕГЭ по химии 2022. Полный разбор скачать
Читать далее
Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Тренировочный вариант по химии №7, №8 решу ЕГЭ 2023. Новые тренировочные варианты Добротина ЕГЭ 2023 по химии для 11 класса вариант 7 и вариант 8 в формате реального экзамена ЕГЭ, пробные варианты с ответами и решением для подготовки ФИПИ.
Скачать вариант №7
Скачать вариант №8
Вариант №7 Добротин ЕГЭ 2023 по химии с ответами
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1) O
- 2) Si
- 3) Cr
- 4) Sc
- 5) Cl
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат ровно один неспаренный электрон.
2. Из указанных в ряду химических элементов выберите три элемента, которые в находятся в малых периодах. Расположите выбранные элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, у каждого из которых значение высшей степени окисления численно совпадает со значением низшей степени окисления.
4. Из предложенного перечня выберите два вещества, для каждого из которых характерны высокая температура плавления, хорошая растворимость в воде и наличие ковалентной полярной связи.
- 1) SiO2
- 2) HCl
- 3) NaOH
- 4) KBr
- 5) Na2SO4
5. Среди предложенных веществ, расположенных в пронумерованных ячейках, выберите:
- А) соль серной кислоты,
- Б) щелочь,
- В) комплексную соль
6. К одной из пробирок с раствором гидроксида кальция добавили раствор соли X, а через другую пропустили газ Y. В результате в каждой из пробирок наблюдалось выпадение белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) CuCl2
- 2) NH3
- 3) FeCl3
- 4) CO2
- 5) NaHCO3
11. Из предложенного перечня выберите два вещества, в которых все атомы углерода находятся в состоянии sp2-гибридизации.
- 1) щавелевая кислота
- 2) толуол
- 3) стирол
- 4) ацетон
- 5) пропен
12. Из предложенного перечня выберите все вещества, из которых в одну стадию может быть получен алкин.
- 1) карбид кальция
- 2) 2,3-дибром-2,3-диметилбутан
- 3) бензол
- 4) хлорэтен
- 5) этиленгликоль
13. Из предложенного перечня выберите два продукта гидролиза метилового эфира аминоуксусной кислоты в солянокислой среде.
- 1) CH3Cl
- 2) CH3OH
- 3) CH3COONH4
- 4) NH2CH2COOH
- 5) [HOOC–CH2–NH3]Cl
17. Из предложенного перечня выберите все вещества, термическое разложение которых относится к окислительно-восстановительным реакциям:
- 1) гидрокарбонат калия
- 2) перманганат калия
- 3) карбонат магния
- 4) нитрит аммония
- 5) гидроксид алюминия
18. Из предложенного перечня выберите все воздействия, которые не влияют на скорость реакции, протекающей по схеме: Cuଶା + Zn = Cu + Z
- 1) понижение давления
- 2) понижение температуры
- 3) уменьшение концентрации ионов цинка
- 4) добавление металлической меди
- 5) добавление воды в реакционную колбу
23. В реактор постоянного объема поместили оксид серы (IV) и оксид серы (VI). В результате протекания обратимой реакции 2SO3 (г) ⇆ O2 (г) + 2SO2 (г) в системе установилось химическое равновесие. Исходная концентрация оксида серы (VI) равна 2 моль/л, а равновесные концентрации кислорода и оксида серы (IV) равны 0,5 моль/л и 1,8 моль/л соответственно. Определите равновесную концентрацию оксида серы (VI) (X) и исходную концентрацию оксида серы (IV) (Y). Выберите из списка номера правильных ответов:
- 1) 0,2 моль/л
- 2) 0,5 моль/л
- 3) 0,8 моль/л
- 4) 1,0 моль/л
- 5) 1,3 моль/л
- 6) 2,8 моль/л
26. Вычислите массу соли (в граммах), которую нужно добавить к 182 г 5% раствора этой же соли, чтобы получить 13,55%-ный раствор. Ответ запишите с точность до целых.
27. При сгорании 8,4 г этилена выделяется 423,3 кДж теплоты. Вычислите количество теплоты, которое выделится при сгорании 0,896 м3 (при н.у.) этилена. Ответ запишите с точностью до целых.
28. Вычислите массу угля, содержащего 4% негорючих примесей, необходимую для полного восстановления 116 г железной окалины. Примите, что в ходе реакции образуется угарный газ. Ответ дайте в граммах с точностью до целых.
29. Из предложенного перечня выберите два вещества, между которыми протекает окислительно-восстановительная реакция. В ходе этой реакции образуется белый осадок, а окислитель принимает один электрон (в расчете на один атом). Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня веществ выберите два вещества, принадлежащих к одинаковой группе веществ, между которыми протекает реакция ионного обмена. Раствор одного из реагентов окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
31. На концентрированную соляную кислоту подействовали бихроматом натрия. Образовавшееся при этом простое вещество прореагировало с кремнием при нагревании. Продукт реакции добавили к необходимому количеству раствора гидроксида калия. Через полученный раствор пропустили избыток углекислого газа и наблюдали образование осадка. Составьте уравнения четырех описанных реакций.
33. Для полного сжигания порции некоторого органического вещества Х необходимо 7,39 л (н. у.) кислорода, при этом образуется углекислый газ, 1,46 г хлороводорода и 1,8 г воды. Известно, что вещество Х может быть получено при взаимодействии углеводорода Y симметричного строения с избытком хлороводорода. На основании данных задачи:
- 1. Проведите необходимые вычисления и установите молекулярную формулу органического вещества Х;
- 2. Составьте структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
- 3. Напишите уравнение реакции вещества Y с подкисленным серной кислотой раствором перманганата калия, используя структурную формулу вещества.
34. 66,1 г смеси медного купороса (CuSO4 · 5H2O) и десятиводного сульфата натрия, содержащую 2,0408 · 1025 протонов, внесли в дистиллированную воду и получили раствор, в котором массовая концентрация ионов меди равна 4%. От этого раствора отобрали порцию массой 64 г и добавили к ней 3,92 г железных опилок. Вычислите массовые доли веществ в полученном растворе после окончания реакций.
Вариант №8 ЕГЭ 2023 по химии с ответами
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- 1) С
- 2) F
- 3) O
- 4) Sn
- 5) Ge
Задание 1. Определите, в атомах каких из указанных в ряду элементов общее число p-электронов не превышает общее число s-электронов.
Задание 2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения основных свойств соответствующих им высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание 3. Из числа указанных в ряду элементов выберите два элемента, высшая степень окисления которых численно не совпадает с номером группы.
Задание 4. Из предложенного перечня выберите два элемента, атомы которых образуют с водородом более длинную ковалентную связь по сравнению с остальными.
- 1) O
- 2) Se
- 3) I
- 4) F
- 5) Br
Задание 6. К одной из пробирок, содержащей раствор гидроксида натрия, добавили раствор вещества Х, а к другой – раствор соли Y. В результате в первой пробирке выделился газ с резким запахом, а во второй выпал белого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) BaCl2
- 2) H2SO4
- 3) Ca(HCO3)2
- 4) K2S
- 5) NH4Cl
Задание 7. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Задание 11. Из предложенного перечня веществ выберите два вещества, в молекулах которых содержится система сопряженных связей.
- 1) ацетилен
- 2) толуол
- 3) циклопентан
- 4) изопрен
- 5) пентадиен-1,4
Задание 12. Из предложенного перечня выберите все вещества, которые взаимодействуют с пропеновой кислотой, но не взаимодействуют с этиленгликолем.
- 1) водород
- 2) гидроксид меди (II)
- 3) метанол
- 4) бромная вода
- 5) гидрокарбонат калия
Задание 13. Из предложенного перечня выберите два вещества, которые не вступают в реакцию этерификации.
- 1) целлюлоза
- 2) фенилаланин
- 3) глюкоза
- 4) метиламин
- 5) анилин
Задание 14. Установите соответствие между органическими веществами и органическими продуктами их взаимодействия с подкисленным раствором перманганата калия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Задание 17. Выберите все пары веществ, между которыми протекает окислительновосстановительная реакция.
- 1) хромат калия и ацетат серебра
- 2) сероводород и бром ная вода
- 3) оксид азота (IV) и вода
- 4) оксид меди (II) и азотная кислота (конц.)
- 5) оксид меди (II) и иодоводород
Задание 18. Выберите все металлы, которые при комнатной температуре реагируют с водой со значительной скоростью:
- 1) Ca
- 2) Ag
- 3) Fe
- 4) Rb
- 5) Li
Задание 19. Установите соответствие между формулой иона и свойством, которое он может проявлять в окислительно-восстановительных реакциях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Задание 20. Установите соответствие между формулами солей и продуктами, которые выделятся на графитовом катоде при электролизе их водных растворов: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Задание 23. В реактор постоянного объема поместили аммиак и нагрели его в присутствии катализатора. В результате протекания обратимой реакции в системе установилось химическое равновесие. Известно, что исходная концентрация аммиака равна 0,8 моль/л, а в равновесной смеси количество вещества аммиака составляет 60% от суммарного количества веществ газов. Определите равновесные концентрации азота (X) и водорода (Y). Выберите из списка номера правильных ответов:
- 1) 0,10 моль/л
- 2) 0,24 моль/л
- 3) 0,30 моль/л
- 4) 0,48 моль/л
- 5) 0,60 моль/л
- 6) 0,80 моль/л
Задание 26. К 400 г 12%-го раствора соли добавили раствор этой же соли и получили 520 г 18%-го раствора. Вычислите массовую долю соли в добавленном растворе. Ответ запишите с точностью до целых.
Задание 27. Вычислите тепловой эффект реакции 2CH3OH + 3O2 = 4H2O + 2CO2 + Q, если при сгорании некоторого количества метанола образовалось 63,84 л (н. у.) углекислого газа и выделилось 2069,1 кДж теплоты. Ответ запишите с точностью до целых.
Задание 28. В ходе спиртового брожения глюкозы массой 72 г получено 12,096 л (н. у.) углекислого газа. Вычислите долю выхода углекислого газа в процентах от теоретического. Ответ дайте в процентах с точностью до десятых.
Задание 29. Из предложенного перечня выберите вещества, между которыми в щелочной среде протекает окислительно-восстановительная реакция. В ходе этой реакции наблюдается образование раствора желтого цвета. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 30. Из предложенного перечня веществ выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с использованием выбранных веществ.
Задание 31. Серебро растворили в концентрированной азотной кислоте при нагревании. Выделившийся газ пропустили над нагретым цинком. Полученное твердое вещество обработали раствором гидроксида калия. Через полученный раствор пропустили избыток сероводорода и наблюдали выпадение осадка. Составьте уравнения четырех описанных реакций.
Задание 32.
Задание 33. При сгорании бескислородного органического вещества Х массой 31,79 г получено 7,62 л (н.у.) углекислого газа, 1,53 мл воды и бромоводород. Продукт гидролиза вещества Х в присутствии избытка щелочи содержит две функциональные группы, находящиеся на максимальном расстоянии друг от друга, и не взаимодействует с гидроксидом меди (II). На основании данных в задаче:
- 1. Проведите необходимые вычисления и установите молекулярную формулу органического вещества Х;
- 2. Составьте структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
- 3. Напишите уравнение реакции гидролиза вещества Х в присутствии избытка гидроксида натрия, используя структурную формулу вещества.
Задание 34. 186,25 г 16%-го раствора хлорида калия подвергли электролизу (с инертными электродами). Процесс прекратили, когда на катоде выделилось 13,44 л (при н. у.) газа. Через оставшийся раствор пропустили сероводород, при этом в конечном растворе общее число атомов калия и серы оказалось равным 3,311 · 1023. Вычислите массовые доли веществ в конечном растворе.
Смотрите также на нашем сайте:
ЕГЭ по химии 11 класс 2023. Новый тренировочный вариант №5 — №221107 (задания и ответы)
Метки: 11 класс ЕГЭ химия