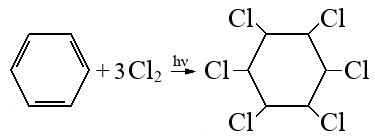Чтобы поделиться, нажимайте
Открытый вариант ЕГЭ по химии 2021 от ФИПИ с ответами
Скачать Открытый вариант ЕГЭ по химии 2021 от ФИПИ (условия без ответов)
Ответы:
Первая часть:
- 35
- 341
- 35
- 34
- 213
- 24
- 21
- 3224
- 3653
- 54
- 312
- 45
- 25
- 35
- 13
- 2523
- 5634
- 41
- 13
- 245
- 321
- 2256
- 1231
- 1113
- 2414
- 423
- 136,7
- 252,8
- 16,8
Вторая часть:
- 5MgI2 + 2NaMnO4 + 8H2SO4 = 5I2 + 5MgSO4 + 2MnSO4 + Na2SO4 + 8H2O
2I— – 2e = I20 5
Mn+7 + 5e = Mn+2 2
Иод в степени окисления -1 (или MgI2) является восстановителем.
Марганец в степени окисления +7 (или NaMnO4) является окислителем.
- Na2CO3 + 2CH3COOH = 2CH3COONa + CO2 + H2O
2Na+ + CO32- + 2CH3COOH = 2CH3COO— + 2Na+ + CO2 + H2O
CO32- + 2CH3COOH = 2CH3COO— + CO2 + H2O
- 1) S +6HNO3 = H2SO4 + 6NO2 + 2H2O
2) 4Cu + 2NO2 = 4CuO + N2
3) CuO + 2HCl = CuCl2 + H2O
4) 2CuCl2 + 4HI = 2CuI + I2 + 4HCl
- 114,8 г
Видео-объяснение смотрите на Ютуб по ссылке или ниже
- 1. n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 20,16 л / 22,4 л/моль = 0,9 моль
n (С) = n (СО2) = 0,9 моль
m (C) = 0,9 моль ∙ 12 г/моль = 10,8 г
n (HCl) = 20,16 л / 22,4 л/моль = 0,9 моль
n (H) = n (HCl) = 0,9 моль
m (H) = 0,9 моль ∙ 1 г/моль = 0,9 г
m (Cl) = 0,9 моль ∙ 35,5 г/моль = 31,95 г
m (C) + m (H) + m (Cl) = 10,8 г + 0,9 г + 31,95 г = 43,65 г
m (O) = 43,65 г – 43,65 г = 0
n (C) : n (H) : n (Cl) = 0,9 : 0,9 : 0,9 = 1 : 1 : 1 = 6 : 6 : 6
Следовательно молекулярная формула C6H6Cl6
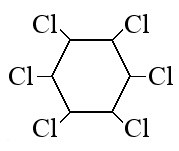
- Структурная формула
- Уравнение реакции
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
Пробные и тренировочные варианты по химии в формате ЕГЭ 2021 из различных источников.
→ открытый вариант ЕГЭ по химии 2021 ФИПИ
Тренировочные варианты ЕГЭ 2021 по химии
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 (ЕГЭ 100БАЛЛОВ) | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| variant 7 | скачать |
| variant 8 | скачать |
| variant 9 | скачать |
| variant 10 | скачать |
| variant 11 | скачать |
| variant 12 | скачать |
| variant 13 | скачать |
| variant 14 | скачать |
| variant 15 | скачать |
| variant 16 | скачать |
| vk.com/chem4you | |
| Вариант 1 | ответы |
| Вариант 2 | ответы |
| Вариант 3 | ответы |
| Вариант 4 | ответы |
| Вариант 5 | ответы |
| Вариант 6 | ответы |
| Вариант 7 | ответы |
| Вариант 8 | ответы |
| Сергей Широкопояс (есть ссылка на ответы) | |
| Вариант 15 | скачать |
| Вариант 16 | скачать |
| Вариант 17 | скачать |
| Вариант 18 | скачать |
| Вариант 19 | скачать |
| Вариант 20 | скачать |
| Вариант 21 | скачать |
| Вариант 22 | скачать |
| Реальные задания ЕГЭ 2020 по химии | скачать |
→ Сборники тренировочных вариантов ЕГЭ по химии, одобренные ФИПИ.
В сборнике представлены:
• 30 типовых экзаменационных вариантов, составленных в соответствии с проектом демоверсии КИМ ЕГЭ по химии 2021 года;
• инструкция по выполнению экзаменационной работы;
• ответы ко всем заданиям;
• критерии оценивания.
Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
Учителя могут использовать типовые экзаменационные варианты для организации контроля результатов освоения школьниками образовательных программ среднего общего образования и интенсивной подготовки обучающихся к ЕГЭ.
Смотрите также:
Разбор задания 7 ЕГЭ по химии
Тренировочные задания ОГЭ по химии
Решение задач повышенной трудности задача 34 в КИМах ЕГЭ по химии
Тест по теме «Соли» Химия 10 (11) класс
Как решать задание 25 в ЕГЭ-2021 по химии
Новый реальный открытый вариант ЕГЭ 2021 по химии 11 класс от сайта ФИПИ (fipi) задания, ответы (решения) и разбор варианта. Контрольные измерительные материалы единого государственного экзамена 2021 года для подготовки.
Открытый вариант ЕГЭ 2021 по химии 11 класс ФИПИ: скачать вариант
Экзаменационная работа состоит из двух частей, включающих в себя 35 заданий. Часть 1 содержит 29 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом. На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
Решать открытый вариант ЕГЭ 2021 по химии 11 класс онлайн ФИПИ:
Сложные задания и ответы с открытого варианта ЕГЭ 2021:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. 1) S 2) V 3) Mg 4) Al 5) H Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите номера выбранных элементов.
Ответ: 35
2)Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите номера выбранных элементов в нужной последовательности.
Ответ: 341
3)Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления. Запишите номера выбранных элементов.
Ответ: 35
4)Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку и содержат ковалентные неполярные связи. 1) оксид меди(II) 2) оксид углерода(II) 3) пропан 4) белый фосфор 5) гидроксид натрия
Ответ: 34
6)Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует графит. 1) соляная кислота 2) серная кислота (конц.) 3) сульфат магния 4) водород 5) гидроксид калия (р-р)
Ответ: 24
7)В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сульфат алюминия 2) нитрат магния 3) фтороводородная кислота 4) силикат калия 5) гидроксид цинка
Ответ: 21
10)Задана схема превращений веществ: 2 KI Na Br X Y ⎯⎯⎯→ ⎯⎯⎯→ Определите, какие из указанных веществ являются веществами X и Y. 1) HI 2) KIO3 3) NaBr 4) NaI 5) I2 Запишите в таблицу номера выбранных веществ под соответствующими буквами
Ответ: 54
12)Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров. 1) 1,1-дибромэтен 2) бутен-1 3) 2,3-дибромпропен 4) 1,2-дибромэтен 5) бутен-2 Запишите номера выбранных ответов.
Ответ: 45
13)Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с избытком раствора брома образуется вещество состава C4H8Br2. 1) 2-метилбутен-1 2) метилпропен 3) бутадиен-1,3 4) бутин-1 5) метилциклопропан
Ответ: 25
14)Из предложенного перечня выберите два вещества, которые могут взаимодействовать с водородом. 1) этанол 2) этиленгликоль 3) формальдегид 4) глицерин 5) фенол
Ответ: 35
15)Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота. 1) соляная кислота 2) метан 3) гидроксид натрия 4) бензол 5) медь
Ответ: 13
19)Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации. 1) серная кислота 2) оксид серы(VI) 3) сероводород 4) сульфат магния 5) сульфат аммония
Ответ: 13
20)Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления. 1) оксид магния 2) оксид серы(IV) 3) медь 4) сероводород 5) фосфин
Ответ: 245
27)Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
Ответ: 136,7
28)Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции NH4NO2(кр.) = N2(г) + 2H2O(г) + 316 кДж. (Запишите число с точностью до десятых.)
Ответ: 252,8
29)Вычислите объём (в литрах при н.у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
Ответ: 16,8
32)Серу растворили в концентрированной азотной кислоте при нагревании. Выделившийся при этом бурый газ пропустили над нагретым порошком меди. Полученное твёрдое вещество растворили в соляной кислоте. Затем к образовавшемуся раствору добавили иодоводородную кислоту, при этом наблюдали образование осадка и изменение цвета раствора. Напишите уравнения четырёх описанных реакций.
Ответ: 1. S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 2. 2NO2 + 4Cu = 4CuO + N2 3. CuO + 2HCl = CuCl2 + H2O 4. 2CuCl2 + 4НI = 2CuI + I2 + 4НCl
34)Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода. Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2 -гибридизации, а в молекуле вещества А — в sp3 -гибридизации. На основании данных условия задачи: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Видео разбор открытого варианта ЕГЭ 2021 по химии ФИПИ:
Другие тренировочные варианты ЕГЭ 2021 по химии 11 класс:
Тренировочные варианты ЕГЭ по химии 11 класс задания с ответами
14.04.2021 варианты ХИ2010501-ХИ2010504 ответы и задания по химии 11 класс ЕГЭ 2021
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
1) S 2) V 3) Mg 4) Al 5) H
1. Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку и содержат ковалентные неполярные связи.
1) оксид меди(II)
2) оксид углерода(II)
3) пропан
4) белый фосфор
5) гидроксид натрия
Запишите номера выбранных ответов.
5. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) NaHSO3 | 1) пероксиды |
| Б) Na2O2 | 2) кислые соли |
| В) Na2ZnO2 | 3) средние соли |
| 4) основные оксиды |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует графит.
1) соляная кислота
2) серная кислота (конц.)
3) сульфат магния
4) водород
5) гидроксид калия (р-р)
Запишите номера выбранных ответов.
7. В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфат алюминия
2) нитрат магния
3) фтороводородная кислота
4) силикат калия
5) гидроксид цинка
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Cu | 1) H2SiO3, CrCl3, K2SO4 |
| Б) CuO | 2) H2SO4 (p-p), HNO3 (конц.), HCl (р-р) |
| В) Fe(OH)3 | 3) H2SO4 (конц.), HNO3 (p-p), O2 |
| Г) NH4Cl | 4) AgNO3, Ba(OH)2, KOH |
| 5) CH4, KMnO4, NaH |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Установите соответствие между реагирующими веществами и продуктом(-ами), который(-е) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) CO2 и Сa(OH)2 (изб.) | 1) FeI2 и K2SO4 |
| Б) Fe2(SO4)3 и KI (p-p) | 2) Fe(OH)3, K2SO4 и HI |
| В) CO2 (изб.) и Сa(OH)2 | 3) CaCO3 и H2O |
| Г) Ca(HCO3)2 и Сa(OH)2 | 4) CaCO3, CO2 и H2O |
| 5) Ca(HCO3)2 | |
| 6) FeI2, I2 и K2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) HI
2) KIO3
3) NaBr
4) NaI
5) I2
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
11. Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) анилин | 1) аминокислоты |
| Б) аланин | 2) кетоны |
| В) ацетон | 3) амины |
| 4) спирты |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
1) 1,1-дибромэтен
2) бутен-1
3) 2,3-дибромпропен
4) 1,2-дибромэтен
5) бутен-2
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с избытком раствора брома образуется вещество состава C4H8Br2.
1) 2-метилбутен-1
2) метилпропен
3) бутадиен-1,3
4) бутин-1
5) метилциклопропан
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, которые могут взаимодействовать с водородом.
1) этанол
2) этиленгликоль
3) формальдегид
4) глицерин
5) фенол
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота.
1) соляная кислота
2) метан
3) гидроксид натрия
4) бензол
5) медь
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между схемой реакции и органическим продуктом, который преимущественно образуется в результате этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
| А) CH3C≡CH + H2O (Hg2+) → | 1) пропан |
| Б) CH3CHClCH2Cl + Zn → | 2) пропанон |
| В) CH3CCl2CH3 + NaOH(водн.) → | 3) пропанол-1 |
| Г) CH3CH2CH2Cl + NaOH(водн.) → | 4) пропанол-2 |
| 5) пропен | |
| 6) пропаналь |
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Установите соответствие между веществом и продуктом реакции этого вещества с бромоводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТ РЕАКЦИИ |
| А) этиленгликоль | 1) аминоуксусная кислота |
| Б) ацетат аммония | 2) ацетон |
| В) изопропанол | 3) 2-бромпропан |
| Г) этилат натрия | 4) этанол |
| 5) 1,2-дибромэтан | |
| 6) уксусная кислота |
Запишите в поле ответа выбранные цифры в нужной последовательности.
18. Задана следующая последовательность превращений веществ:
CH4 → X → Y → C6H12
Определите, какие из указанных веществ являются веществами Х и Y.
1) бензол
2) этан
3) толуол
4) ацетилен
5) хлорметан
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации.
1) серная кислота
2) оксид серы(VI)
3) сероводород
4) сульфат магния
5) сульфат аммония
Запишите номера выбранных ответов.
20. Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления.
1) оксид магния
2) оксид серы(IV)
3) медь
4) сероводород
5) фосфин
Запишите в поле ответа номера выбранных воздействий.
21. Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 | 1) +4 → +5 |
| Б) 2NH3 + 3CuO = N2 + 3Cu + 3H2O | 2) –3 → 0 |
| В) 3NO2 + H2O = 2HNO3 + NO | 3) –2 → 0 |
| 4) –3 → +2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) Ca(NO3)2 | 1) металл, водород, кислород |
| Б) Li2SO4 | 2) водород, кислород |
| В) BaCl2 | 3) металл, водород, галоген |
| Г) AgNO3 | 4) металл, галоген |
| 5) водород, галоген | |
| 6) металл, кислород |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) Hg(NO3)2 | 1) кислая |
| Б) NaNO3 | 2) нейтральная |
| В) Na3PO4 | 3) щелочная |
| Г) AuCl3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему
CH3CH2COOCH(CH3)2(ж) + H2O(ж) ←→ CH3CH2COOH(ж) + (CH3)2CHOH(ж) − Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры | 1) смещается в сторону прямой реакции |
| Б) добавление твёрдой щёлочи | 2) смещается в сторону обратной реакции |
| В) добавление воды | 3) практически не смещается |
| Г) понижение давления |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) уксусная кислота и этанол | 1) Br2 (водн.) |
| Б) бутин-1 и бутин-2 | 2) лакмус |
| В) метан и пропилен | 3) фенолфталеин |
| Г) этилен и ацетилен | 4) Ag2O (NH3 р-р) |
| 5) KCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) анилин | 1) в качестве моторного топлива |
| Б) ацетилен | 2) газовая сварка металлов |
| В) толуол | 3) в качестве растворителя |
| 4) производство красителей и лекарств |
Запишите в поле ответа выбранные цифры в нужной последовательности.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответа указывать не нужно. При проведении расчётов для всех элементов, кроме хлора, используйте значения относительных атомных масс, выраженные целыми числами (Ar(Cl) = 35,5).
27. Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
28. Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции
NH4NO2(кр.) = N2(г) + 2H2O(г) + 316 кДж.
(Запишите число с точностью до десятых.)
29. Вычислите объём (в литрах при н.у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ: уксусная кислота, сульфат лития, перманганат натрия, карбонат натрия, серная кислота, иодид магния. Допустимо использование водных растворов веществ.
30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и солей. Запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
5MgI2 + 2NaMnO4 + 8H2SO4 = 5MgSO4 + Na2SO4 + 2MnSO4 + 5I2 + 8H2O
2I–1 − 2𝑒̅ = I2 |5
Mn+7 + 5𝑒̅ = Mn+2 |2
MgI2 (I–1) – восстановитель, NaMnO4 (Mn+7) – окислитель.
31. Из предложенного перечня выберите сильный и слабый электролиты, между которыми возможна реакция ионного обмена, протекающая с образованием газа. Запишите молекулярное, полное и сокращённое ионные уравнения только одной возможной реакции.
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 + H2O
2Na+ + CO32– + 2CH3COOH = 2Na+ + 2CH3COO– + CO2 + H2O
CO32– + 2CH3COOH = 2CH3COO– + CO2 + H2O
32. Серу растворили в концентрированной азотной кислоте при нагревании. Выделившийся при этом бурый газ пропустили над нагретым порошком меди. Полученное твёрдое вещество растворили в соляной кислоте. Затем к образовавшемуся раствору добавили иодоводородную кислоту, при этом наблюдали образование осадка и изменение цвета раствора. Напишите уравнения четырёх описанных реакций.
1. S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
2. 2NO2 + 4Cu = 4CuO + N2
3. CuO + 2HCl = CuCl2 + H2O
4. 2CuCl2 + 4НI = 2CuI + I2 + 4НCl
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
1. Запишем уравнения реакций:
(1) Сa(NO3)2 = Ca(NO2)2 + O2
(2) 2Ca(NO3)2 = 2CaO + 4NO2 + O2
(3) 4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2. Масса исходного гидроксида калия
m(KOH) = mр-ра · ω (KOH) = 133,6 · 0,4 = 53,44 г
3. Вычислим количества вещества газов в реакции (2)
Пусть n2(O2) = x моль, тогда n2(NO2) = 4x моль
В реакцию (3) кислород и оксид азота (IV) вступают в таком же соотношении, следовательно:
n3(O2) = x моль, тогда n3(NO2) = 4x моль
m3(O2) = 32x г, тогда m3(NO2) = 4x · 46 = 184х г
При этом в реакцию вступило:
nпрореаг.(KOH) = 4х моль
mпрореаг.(KOH) = 4х·56 = 224х г
mост.(KOH) = 53,44 — 224х г
Масса конечного раствора:
mр-ра = 133,6 + 32х + 184х = 133,6 + 216х
Получаем выражение:
ω2(KOH) = mост.(KOH) / mр-ра ·
0,2 = (53,44 – 224x) / (133,6 + 216х)
x = 0,1 моль
n2(O2) = 0,1 моль, n2(NO2) = 0,4 моль
Следовательно, в реакцию (2) вступило:
n2(Сa(NO3)2) = 0,2 моль
По условию:
V1(O2) : V2(исх. смеси газов) = n1(O2) : (n1(O2) + n2(O2) + n2(NO2)) = 1 : 2
Отсюда n1(O2) = 0,5 моль
n1(Сa(NO3)2) = 0,5 моль
nобщ.(Сa(NO3)2) = 0,5 + 0,2 = 0,7 моль
mобщ.(Сa(NO3)2) = n · M = 0,7 · 164 = 114,8 г
35. При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода. Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества А — в sp3-гибридизации. На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
1. Общая формула вещества СxHyСlzOt
n(CO2) = V : VM = 20,16 : 22,4 = 0,9 моль= n(C)
n(HCl) = V : VM = 20,16 : 22,4 = 0,9 моль= n(Cl) = n(H)
m(O) = 43,65 – 12 · 0,9 – 1 · 0,9 – 35,5 · 0,9 = 0
𝑥 ∶ 𝑦 ∶ 𝑧 = 0,9 ∶ 0,9 ∶ 0,9 = 1 ∶ 1 ∶ 1 = 6 ∶ 6 ∶ 6
Молекулярная формула С6H6Cl6
2. Структурная формула
3. Уравнение реакции
Открытый вариант КИМ ЕГЭ по химии 2021 ФИПИ Разбор и ответы. Опубликованы открытые варианты контрольных измерительных материалов ЕГЭ 2021 года
ege-him-fipi-2021-otkritiyvar1
скачать
1) 35
2) 341
3) 35
4) 34
5) 213
6) 24
7) 21

9) 3653
10) 54
11) 312
12) 45
13) 25
14) 35
15) 13
16) 2523
17) 5634
18) 41
19) 13
20) 245
21) 321
22) 2256
23) 1231
24) 1113
25) 2414
26) 423
27) 136,7
28) 252,8
29) 16,8
Смотрите также:
- Тренировочный вариант ЕГЭ 2021 по химии №12 с ответами
- Тренировочный вариант ЕГЭ 2021 по химии №11 с ответами
- 01.05.2021
Официальный открытый вариант ЕГЭ 2021 по химии от ФИПИ.
- Открытые варианты ЕГЭ 2021 по другим предметам
Вариант №1 был опубликован ФИПИ 29 апреля 2021 года. Входит в серию открытых вариантов по всем предметам в формате ЕГЭ 2021 года.
- Другие тренировочные варианты по химии
Напоминаем, что в 2021 году нет досрочной волны ЕГЭ. И такой открытый вариант — это некая альтернатива досрочному ЕГЭ 2021 по химии (ФИПИ ранее традиционно всегда выкладывал досрочный вариант по химии)
- Тренировочные работы Статград 2020-2021
Данный открытый вариант также является неким аналогом демоверсии ФИПИ по химии. Однако, открытый вариант не содержит правильных ответов (как и досрочный вариант).
Есть вопросы? Задавайте их ниже в комментариях!
Некоторые задания из открытого варианта №1
ЗАДАНИЕ 7
В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- сульфат алюминия
- нитрат магния
- фтороводородная кислота
- силикат калия
- гидроксид цинка
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
ЗАДАНИЕ 12
Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
- 1,1-дибромэтен
- бутен-1
- 2,3-дибромпропен
- 1,2-дибромэтен
- бутен-2
Запишите номера выбранных ответов.
ЗАДАНИЕ 19
Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации.
- серная кислота
- оксид серы(VI)
- сероводород
- сульфат магния
- сульфат аммония
Запишите номера выбранных ответов.
Видеоразбор открытого варианта №1 по химии
Мы постарались разобрать на видео детально каждое задание из открытого вариант, предоставить правильное решение и правильный ответ (ответы ко всем заданиям).
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Открытый вариант КИМ ЕГЭ по химии 2021 ФИПИ Разбор и ответы. Опубликованы открытые варианты контрольных измерительных материалов ЕГЭ 2021 года
ege-him-fipi-2021-otkritiyvar1
скачать
1) 35
2) 341
3) 35
4) 34
5) 213
6) 24
7) 21
3224
9) 3653
10) 54
11) 312
12) 45
13) 25
14) 35
15) 13
16) 2523
17) 5634
18) 41
19) 13
20) 245
21) 321
22) 2256
23) 1231
24) 1113
25) 2414
26) 423
27) 136,7
28) 252,8
29) 16,8
Смотрите также:
- Тренировочный вариант ЕГЭ 2021 по химии №12 с ответами
- Тренировочный вариант ЕГЭ 2021 по химии №11 с ответами
Тренировочный вариант ЕГЭ 2021 по химии с ответами.
→ Скачать вариант
→ Скачать ответы
Источник: Chem4you
Работа содержит один пробный вариант ЕГЭ по химии, спецификацию, подобную демоверсии 2021 года и ответы к тренировочному варианту.
Смотрите также:
2 варианта досрочного ЕГЭ 2020 по химии с ответами от ФИПИ
Задание № 27 ЕГЭ по химии — 30 практических заданий
ЕГЭ по химии — типичные ошибки
Отработка задания 14 ЕГЭ по химии
Проверочная работа по химии 11 класс
Официальная демоверсия от ФИПИ на 2021 год.
Изменения структуры и содержания КИМ отсутствуют.
Обновлено 14 ноября. Демоверсия утверждена.
|
№ |
Требования к уровню подготовки выпускников, проверяемому на ЕГЭ |
Уровень сложности задания |
Макс. балл за выполнение задания |
Время выполнения (мин.) |
|
Часть 1 |
||||
|
1 |
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояния атомов |
Б |
1 |
2-3 |
|
2 |
Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов — меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА-VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов |
Б |
1 |
2-3 |
|
3 |
Электроотрицательность. Степень окисления и валентность химических элементов |
Б |
1 |
2-3 |
|
4 |
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
Б |
1 |
2-3 |
|
5 |
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
Б |
1 |
2-3 |
|
6 |
Характерные химические свойства простых веществ — металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ — неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: основных, амфотерных, кислотных |
Б |
1 |
2-3 |
|
7 |
Характерные химические свойства дов. Характерные химические свойства кислот. Характерные химические свойства комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация Сильные и слабые электролиты. Реакции ионного обмена |
Б |
2 |
2-3 |
|
8 |
Характерные химические свойства неорганических веществ:
|
П |
2 |
5-7 |
|
9 |
Характерные химические свойства неорганических веществ: простых веществ — металлов: щелочных, щёлочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа);
|
п |
2 |
5-7 |
|
10 |
Взаимосвязь неорганических веществ |
Б |
1 |
2-3 |
|
11 |
Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
Б |
1 |
2 |
|
12 |
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
Б |
1 |
2 |
|
13 |
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Ионный (правило В.В. Марковникова) и радикальные механизмы реакций в органической химии |
Б |
1 |
2 |
|
14 |
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории). |
Б |
1 |
2 |
|
15 |
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
Б |
1 |
2 |
|
16 |
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов. |
П |
2 |
5-7 |
|
17 |
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
П |
2 |
5-7 |
|
18 |
Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
Б |
1 |
2-3 |
|
19 |
Классификация химических реакций в неорганической и органической химии |
Б |
1 |
2 |
|
20 |
Скорость реакции, её зависимость от различных факторов |
Б |
1 |
2 |
|
21 |
Реакции окислительно-восстановительные |
Б |
1 |
5-7 |
|
22 |
Электролиз расплавов и растворов (солей, щелочей, кислот) |
П |
2 |
5-7 |
|
23 |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
П |
2 |
5-7 |
|
24 |
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
П |
2 |
5-7 |
|
25 |
Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
П |
2 |
5-7 |
|
26 |
Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
Б |
1 |
5-7 |
|
27 |
Расчёты с использованием понятия «массовая доля вещества в растворе» |
Б |
1 |
2 |
|
28 |
Расчёты объёмных отношений газов при химических реакциях. Расчёты по термохимическим уравнениям |
Б |
1 |
2 |
|
29 |
Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
Б |
1 |
2 |
|
Часть 2 |
||||
|
30 |
Реакции окислительно-восстановительные |
В |
2 |
10-15 |
|
31 |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена. |
В |
2 |
10-15 |
|
32 |
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ |
В |
4 |
10-15 |
|
33 |
Реакции, подтверждающие взаимосвязь органических соединений |
В |
5 |
10-15 |
|
34 |
Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворенного вещества. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
В |
4 |
10-15 |
|
35 |
Установление молекулярной и структурной формулы вещества |
В |
3 |
10-15 |
| Всего заданий – 35; из них по уровню сложности: Б – 21; П – 8; В – 6.
Максимальный первичный балл за работу – 58. Общее время выполнения работы – 210 мин. |