Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
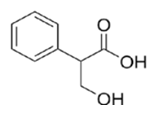
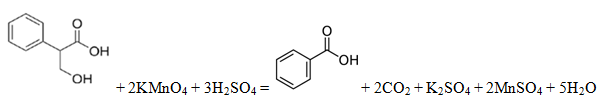
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
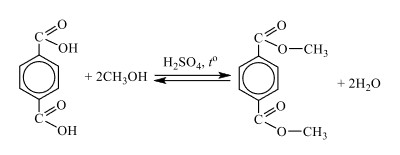
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
ЕГЭ по химии состоит из двух частей и 34 заданий.
Первая часть содержит 29 заданий с кратким ответом, в их числе 20 заданий базового уровня сложности: №1–9, 12–17, 20–21, 27–29. Девять заданий повышенного уровня сложности: №9–11,17–19, 22–26.
Вторая часть содержит 5 заданий высокого уровня сложности с развёрнутым ответом: №30–34
Задания базового уровня сложности с кратким ответом проверяют усвоение содержания важнейших разделов школьного курса химии: теоретические основы химии, неорганическая химия, органическая химия, методы познания в химии, химия и жизнь.
Задания повышенного уровня сложности с кратким ответом ориентированы на проверку обязательных элементов содержания основных образовательных программ по химии не только базового, но и углубленного уровня. В сравнении с заданиями предыдущей группы они предусматривают выполнение большего разнообразия действий по применению знаний в изменённой, нестандартной ситуации (например, для анализа сущности изученных типов реакций), а также умения систематизировать и обобщать полученные знания.
Задания с развёрнутым ответом, в отличие от заданий двух предыдущих типов, предусматривают комплексную проверку усвоения на углубленном уровне нескольких элементов содержания из различных содержательных блоков.
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
В этой статье вместе с преподавательницей Вебиума Таисией Фламель разбираем демоверсию ЕГЭ 2023 по химии. Расскажем об:
- Изменениях в КИМе — новых формулировках заданий и способах их решения;
- Уровне сложности — стал ли ЕГЭ по химии 2023 года сложнее;
- Как решать изменившиеся задания.
В конце статьи — видео с подробным разбором демоверсии ЕГЭ 2023 по химии.
Как пользоваться сайтом ФИПИ и где смотреть демоверсии, спецификации и кодификаторы рассказали в этой статье.
Изменения в ЕГЭ 2023 по химии
Серьёзных изменений в ЕГЭ по химии в 2023 году нет, но есть нюансы, на которые стоит обратить внимание:
33 и 34 задания
Изменён порядок этих заданий, их поменяли местами. Теперь 33 задание — это задача по органике, а 34 задача — по неорганике. На сложность задания это не повлияло, но будьте внимательны при выполнении этих номеров и заполнении бланков! Многие допускают досадные ошибки, путая номера заданий, и теряют драгоценные баллы.
9 задание
Повышен уровень сложности. Но пока, как именно это будет сделано, составители ЕГЭ не уточнили. Формулировка задания такая же, как в ЕГЭ 2022 года. Возможно будут: более сложные, специфические и менее распространённые реакции или будет больше пропусков в цепочке превращений (больше X и Y). Чтобы быть в курсе изменений, подписывайтесь на наш телеграм-канал.
12 задание
Это задание было усложнено ещё в 2022 году. В нём присутствуют и углеводороды, и кислородсодержащие соединения, а также незафиксированное количество ответов. В 2023 году оно тоже входит в ряд заданий повышенной сложности. Что ещё в нём можно усложнить, только предполагаем 🤷♀️
💡 При выполнении задания обращайте внимание на формулировку!
Забирай бесплатный чек-лист по всем темам ЕГЭ по химии, чтобы не упустить ничего важного во время подготовки и быть готовым на все 💯
16 задание
Теперь задание относится к повышенному уровню сложности. Формулировка задания прежняя: необходимо определить, какие из указанных веществ являются веществами X и Y в схеме превращений. Как задание усложнится, можно только гадать, но скорее всего будут более сложные реакции.
💡 При выборе ответов обратите внимание на то, что одни и те же цифры не могут повторяться в ответе! X и Y — разные вещества. Это указано в формулировке задания.
23 задание
Задание проверяет умение проводить расчёты концентраций веществ в равновесной системе. В демо ЕГЭ 2023 по химии оно представлено в виде текста, а не таблицы.
Смотрите видео, где мы решаем все виды 23 задания ЕГЭ по химии. Эти задания дают 2 первичных балла, а решаются всего за минуту.
Подведём итог разбора демоверсии ЕГЭ 2023 по химии: значительных изменений в нет, задания практически такие же как в ЕГЭ 2022 года. Но есть задания, которые будут усложнены. Скорее всего, в них будут присутствовать более сложные, специфичные реакции и свойства веществ. На это стоит обратить внимание.
Материалы, которые помогут во время подготовки к ЕГЭ по химии:
📚 18 ресурсов и пособий для подготовки к ЕГЭ по химии
❗️10 типичных ошибок на ЕГЭ по химии
🧪Куда поступать с химией: 5 перспективных вариантов
👍Шпаргалки полезные материалы по химии
👩🏼🔬Специальности в химии: какую профессию выбрать
🧑🏼🔬«Поступить на химфак сложнее, чем его окончить»: история Таси Фламель
На нашем курсе «Основа» за 9 месяцев подготовки мы разбираем и отрабатываем на практике всю теорию, необходимую для получения заветной сотки по химии. На курсе тебя ждут:
- от 12 занятий в месяц, а также индивидуальный план подготовки;
- личный наставник, который объяснит непонятное, проверит домашку и мотивирует тебя на всём пути подготовки;
- ламповая атмосфера и удобный формат занятий.
⚡️ Видео с полным разбором демоверсии ЕГЭ по химии 2023 года:
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Чтобы поделиться, нажимайте
Задачи ЕГЭ по химии 2021
Предлагаем вашему вниманию задачи с подробными видео-объяснениями из реального ЕГЭ 2021 (основная волна 31 мая 2021 года), а также видео-разбор задач из демо ЕГЭ 2021 и досрочного ЕГЭ 2021. А ещё видео-разбор пробных (тренеровочных) вариантов ЕГЭ 2021.
Задания 34 представлены в начале статьи, а задания 35 — во второй половине (листайте ниже), а задания демо ЕГЭ 2021, досрочного ЕГЭ 2021 и пробных вариантов — в конце статьи (листайте ниже).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
ВНИМАНИЕ — в ЕГЭ 2022 года это будут задание 33 и 34 вместо 34 и 35 соответственно
В этом году в разных регионах были задачи, включающие разные типы решения. В основном это были задачи на растворы (массовую долю) плюс:
- 1. Электролиз + система уравнений
- 2. Электролиз + кристаллогидраты + растворимость
- 3. Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
- 4. На соотношение атомов (атомистика) + система уравнений + кислые/средние соли
- 5. На разделение раствора на несколько колб (частей).
Задачи на электролиз + система уравнений
1. Через 520 г 16,1%-ного раствора сульфата цинка пропускали электрический ток до тех пор, пока объем газа, выделившегося на катоде, не стал равен объему газа, выделившемуся на аноде. При этом массовая доля сульфата цинка понизилась до 10,3%. К полученному раствору добавили 212 г 10% раствора карбоната натрия. Вычислите массовую долю сульфата цинка в полученном растворе.
Решение: смотри видео
2. Через 400 г 36%-ного раствора нитрата железа (II) пропустили электрический ток до момента, когда объём газа, выделившегося на катоде, не стал в 2 раза меньше объёма газа, выделившегося на аноде. В полученном растворе массовая доля нитрата железа (II) уменьшилась до 10,19%. К полученному раствору прилили 120 г 40%-ного раствора карбоната аммония. Определите массовую долю нитрата железа (II) в конечном растворе. (Окислением ионов железа 2+ и их осаждением в прикатодном пространстве пренебречь.)
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на электролиз + кристаллогидраты + растворимость
3. Электролиз 5%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока на аноде не выделилось 8,4 л газа. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 96,6 г глауберовой соли (Na2SO4∙10H2O) в воде. В результате массовая доля сульфата натрия уменьшилась в 4,5 раза. Определите растворимость безводного сульфата натрия на 100г воды.
Решение: смотри видео
4. Электролиз 10%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока 4,2 моля воды не ушли. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 100 г медного купороса (CuSO4∙5H2O) в воде. В результате массовая доля сульфата меди (II) уменьшилась в 4 раза. Определите растворимость безводного сульфата меди (II) на 100г воды.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
5. Кристаллогидрат сульфата алюминия, в котором массовая доля серы в 5 раз меньше массовой доли кислорода, растворили в воде. При этом образовался раствор массой 722,4 г. Через полученный раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л газа. Затем к образовавшемуся растврору прилили раствор карбоната натрия массой 424 г с массовой долей соли 10%. При этом массовая доля карбоната натрия уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата.
Задачи на атомистику (на соотношение атомов) + система уравнений + кислые/средние соли
6. Смесь оксида фосфора (V) и оксида калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, а затем образовавшуюся смесь растворили в воде. В результате получили 447,4г раствора, в котором массовая доля атомов водорода равна 7,6%. Определите массу фосфата калия в полученном растворе.
Решение: смотри видео
7. Смесь оксида натрия и оксида фосфора (V), в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели и растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода равна 7,36%. Определите массу фосфата натрия в полученном растворе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на разделение раствора на несколько колб (частей):
8. Смесь, состоящую из нитрата цинка, нитрата меди (II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди (II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение: смотри видео
9. Раствор нитрата меди (II) массой 1760 г с массовой долей нитрата меди (II) 18,8%, содержащий в качестве примеси нитрат серебра (I) разлит на 2 колбы в соотношении 1:2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволку. После завершения реакции проволку извлекли из раствора. При этом массовая доля нитрата меди(II) в первой колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли избыток порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
10. Смесь бромида кальция и хлорида меди (II) растворили в воде, а образовавшийся раствор разделили на 3 колбы. В первую колбу, содержащую 200 г раствора, добавили 785 г 30% раствора нитрата серебра (I), в результате чего массовая доля нитрата серебра (I) уменьшилась вдвое. Во вторую колбу, содержащую 340 г исходного раствора солей, добавили избыток йодида калия, при этом в осадок выпала соль массой 64,94 г. Определите массовые доли солей в третьей колбе.
Решение: смотри видео
11. Смесь бромида калия и йодида калия растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 250 г прилили раствор массой 430 г 40%-ного нитрата серебра (I). После реакции массовая доля нитрата серебра (I) в растворе уменьшилась до 8,44%. Во вторую колбу с раствором массой 300 г прилили избыток раствора нитрата меди (II), в результате чего выпало 28,65 г осадка. Найдите массовые доли солей в третьей колбе колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
12. Смесь гидроксида и хлорида бария растворили в воде. Раствор разлили на три колбы. В первую колбу, масса раствора в которой равна 520 г, добавили избыток серной кислоты, при этом выпало 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20% раствора соляной кислоты, при этом массовая доля кислоты уменьшилась в 2 раза. Найдите массовые доли веществ в третьей колбе.
Решение: смотри видео
13. Смесь хлоридов бария и алюминия растворили в воде. Полученный раствор разделили на 3 колбы. К 300 г раствора в первой колбе прилили 164 г 10% раствора фосфата натрия, в результате чего все исходные вещества прореагировали полностью. К 120 г раствора второй колбы добавили 155,61 г 20 % раствора сульфата натрия, при этом массовая доля сульфата натрия в конечном растворе оказалась в 2 раза меньше, чем в исходном. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
14. Хлорид алюминия и хлорид магния смешали и растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 300 г добавили 164 г 10%-ного раствора фосфата натрия. Причём соль прореагировала полностью. Во вторую колбу с раствором массой 120 г прилили 155,64 г 20%-ного раствора сульфата натрия. Причём массовая доля сульфата натрия в исходном растворе была в два раза больше, чем массовая доля в конечном растворе. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
15. Смесь сульфата железа (II) и хлорида цинка растворили в воде. Полученный раствор разделили на 3 колбы. К 800 г раствора в первой колбе прилили избыток раствора нитрата бария, при этом выпал осадок массой 116,5 г. К 320 г раствора второй колбы добавили 462 г 40 %-ного раствора гидроксида натрия без доступа воздуха, при этом массовая доля щёлочи уменьшилась в два раза. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
16. Смесь нитрата алюминия и хлорида магния растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 750 г добавили раствор нитрата серебра (I), в результате чего выпал осадок массой 114,8 г. Во вторую колбу с раствором массой 300 г прилили 868,54 г 20%-ного раствора гидроксида натрия. Причём массовая доля щёлочи уменьшилась в 1,6 раз. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Демо ЕГЭ 2021
Демо ЕГЭ по химии 2021. Задание 34. (Аналогично демо ЕГЭ 2020)
При нагревании образца карбоната магния часть вещества разложилась. При этом выделилось 29,12 л (н.у.) углекислого газа. Масса твёрдого остатка составила 136 г. Этот остаток добавили к 763.6 г раствора бромоводородной кислоты, с массовой долей 53,04%. Определите массовую долю кислоты в полученном растворе, если растворимость соли, содержащейся в этом растворе, при данных условиях составляет 101,1 г га 100 г воды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
Демо ЕГЭ по химии 2021. Задание 35. (Аналогично демо ЕГЭ 2020)
При сгорании 26,2 г органического вещества получили 26,88 л углекислого газа (н.у.), 2,24 л азота (н.у.) и 23,4 г воды. При нагревании с бромоводородной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава C2H6NO2Br и третичный спирт.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
Досрочный ЕГЭ 2021
Задание 34. Открытый вариант ФИПИ. (Досрочная волна 2021)
Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 35. Открытый вариант ФИПИ. (Досрочная волна 2021)
При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода.
Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества Б — в sp3-гибридизации. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- 1. n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 20,16 л / 22,4 л/моль = 0,9 моль
n (С) = n (СО2) = 0,9 моль
m (C) = 0,9 моль ∙ 12 г/моль = 10,8 г
n (HCl) = 20,16 л / 22,4 л/моль = 0,9 моль
n (H) = n (HCl) = 0,9 моль
m (H) = 0,9 моль ∙ 1 г/моль = 0,9 г
m (Cl) = 0,9 моль ∙ 35,5 г/моль = 31,95 г
m (C) + m (H) + m (Cl) = 10,8 г + 0,9 г + 31,95 г = 43,65 г
m (O) = 43,65 г – 43,65 г = 0
n (C) : n (H) : n (Cl) = 0,9 : 0,9 : 0,9 = 1 : 1 : 1 = 6 : 6 : 6
Следовательно молекулярная формула C6H6Cl6
- Структурная формула
- Уравнение реакции
Пробные (тренировочные) варианты 2021
Задание 34. Пробный вариант 1
В 120 мл раствора с плотностью 0,591 г/мл, содержащего нитрат свинца (II) и нитрат меди (II) с массовыми долями 16,34 и 2,65% соответственно, насыпали 5,6 г железных опилок. Через некоторое время раствор отфильтровали. Масса твёрдых веществ составила 8,7 г. Определите соотношение числа ионов металлов в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 2
К 500 мл раствора гидроксида бария с плотностью 1,02 г/мл постепенно при перемешивании добавляли раствор гидрокарбоната натрия с массовой долей соли 5%. К тому моменту, когда соотношение числа ионов натрия и гидроксид-ионов в растворе стало равно 1:1, масса раствора стала равной 658,3 г. Определите массовые доли веществ в растворе, который получится при медленном добавлении 100 мл такого же исходного раствора гидроксида бария к раствору гидрокарбоната натрия, масса которого в два раза меньше, а массовая доля соли такая же, как и в первом эксперименте.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 3
141,5 г смеси фосфата калия и оксида фосфора (V), в которой массовая доля фосфора как элемента составляет 21,91%, растворили в 400 г воды. Определите массовые доли веществ в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 4
К 200 г раствора нитрата алюминия с массовой долей соли 12,78% добавили 123,9 мл раствора гидроксида натрия с массовой долей щёлочи 0,12 и плотностью 1,13 г/мл. Полученную смесь упарили и прокалили до постоянной массы. Определите массовую долю кислорода как элемента в твёрдом остатке после прокаливания.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 5
В два последовательно соединённых электролизёра поместили по 100 г растворов: в первый 10% (по массе) раствор хлорида натрия, во второй – 20% (по массе) хлорида золота (III) и включили ток. Через некоторое время электролиз прекратили и масса раствора в первом электролизёре уменьшилась на 3,285 г. Определите массовую долю хлорида золота (III) во втором электролизёре после электролиза. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 6
В раствор хлороводорода массой 165 г, в котором N(H)/N(O) = 2,123, поместили 10 г железной окалины. После полного окончания реакции в образовавшийся раствор погрузили избыток металлического железа. Рассчитайте массовую долю (%) соли в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 7
Смесь оксида железа (II), оксида железа (III) и оксида железа (II, III) общей массой 161 г полностью восстановили углеродом. При этом образовалось только железо и углекислый газ объёмом 39,2 л. Образовавшийся порошок железа засыпали в раствор хлорида меди (II) массой 1200 г с массовой долей соли 25% и оставили на несколько дней. Рассчитайте массовую долю (%) хлорида меди (II) в конечном растворе, считая, что железо прореагировало полностью, а в исходной смеси оксидов железа могли содержаться примеси оксидов железа нестехиометрического состава.
Задание 34. Пробный вариант 8
В закрытом сейфе рядом находятся два открытых стаканчика. В одном из них находится насыщенный раствор сульфата железа (II) массой 425 г, во втором – твёрдый сульфат кальция массой 27,2 г. В результате длительного хранения этих реактивов, сульфат кальция превратился в гипс (считать, что в воздухе сейфа паров воды не содержалось), а в первом стаканчике выпал осадок кристаллогидрата FeSO4∙7H2O. Рассчитайте массу выпавшего в осадок кристаллогидрата, если массовая доля FeSO4 в насыщенном растворе при данных условиях равна 14,6%.
Задание 34. Пробный вариант 9
Имеется смесь оксида кобальта (II), оксида кобальта (III) и оксида кобальта (II, III), содержащая примеси оксидов кобольта нестехиометрического состава. Эту смесь массой 0,782 г полностью восстановили водородом, в результате чего было получено твёрдое вещество массой 0,590 г. Эту же смесь массой 1,564 г полностью растворили в растворе бромоводородной кислоты массой 48,6 г с массовой долей растворённого вещества 10%. Рассчитайте максимальную массу кобальта, которую можно ещё растворить в полученном растворе, чтобы в нём содержалась только одна соль.
Задание 34. Пробный вариант 10
Горная порода, содержащая силикат кальция при взаимодействии с дождевой водой и углекислым газом из воздуха образует кварцевый песок и гидрокарбонат кальция. Рассчитайте объём (н.у., м3) углекислого газа, который вступил в реакцию с исходной горной породой массой 100 кг (массовая доля силиката 80%, примеси в воде не растворимы), если в результате реакции массовая доля CaSiO3 в твёрдом остатке составила 50%.
Задание 35. Пробный вариант 1
Неизвестное органическое вещество А содержит 34,62% углерода, а также водород и кислород, причём массовая доля кислорода в 15,982 раза больше массовой доли водорода. Известно, что 1 моль вещества А может вступить в реакцию с 2 моль гидроксида натрия, или 1 моль гидрокарбоната калия, или 1 моль метанола.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с избытком метанола (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества CxHyOz
ω (O + H) = 100% — 34,62% = 65,38%
Пусть ω (Н) = х %, тогда ω (О) = 15,982х %, следовательно получаем математическое уравнение:
х + 15,982х = 65,38
16,982х = 65,38
х = 3,85% (ω (Н)), ω (О) = 15,982∙3,67 = 61,53%
x : y : z = 34,62/12 : 3,85/1 : 61,53/16 = 2,885 : 3,85 : 3,85 = 3 : 4 : 4
Следовательно, молекулярная формула C3H4O4.
- По описанным данным, можно предположить, что раз это вещество реагирует только с 1 моль гидрокарбоната или 1 моль спирта, то значить в этом веществе находится одна карбоксильная группа, но так как это же вещество может реагировать с 2 моль щелочи, то значит есть эфирная связь, которая будет подвергаться щелочному гидролизу. Поэтому это монометиловый эфир щавелевой кислоты.
Структурная формула:
- Уравнение реакции:
Задание 35. Пробный вариант 2
При сгораниии 9,9 г органического вещества А получили 12,096 л углекислого газа, 0,672 л азота (н.у.) и 5,94 г воды.
Известно, что вещество А подвергается и щелочному и кислотному гидролизу, при этом образуется первичный насыщенный одноатомный спирт (молекула которого содержит 2 атома углерода) и органическая соль (соль образуется при любом типе гидролиза). Также известно, что вещество А можно получить каталитическим гидрированием вещества Б, в котором заместители максимально удалены друг от друга.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём каталитического гидрирования вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 12,096 л / 22,4 л/моль = 0,54 моль
n (С) = n (СО2) = 0,54 моль
m (C) = 0,54 моль ∙ 12 г/моль = 6,48 г
М(Н2О) = 18 г/моль
n (H2O) = 5,94 г / 18 г/моль = 0,33 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,33 моль = 0,66 моль
m (H) = 0,66 моль ∙ 1 г/моль = 0,66 г
n (N2) = 0,672 л / 22,4 л/моль = 0,03 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,03 моль = 0,06 моль
m (N) = 0,06 моль ∙ 14 г/моль = 0,84 г
m (C) + m (H) + m (N) = 6,48 г + 0,66 г + 0,84 г = 7,98 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 9,9 г – 7,48 г = 1,92 г
n (O) = 1,92 г / 16 г/моль = 0,12 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,54 : 0,66 : 0,06 : 0,12 = 9 : 11 : 1 : 2
Следовательно молекулярная формула вещества: C9H11NO2.
2) Анализируя информацию о веществе А, можно предположить, что гидролизу подвергаются такие классы органических веществ, как эфиры (включая жиры), углеводы, пептиды, ангидриды кислот и некоторые другие. Но с образованием спирта гидролизуются только эфиры. Причём если молекула спирта содержит только два атома углерода, то делаем вывод, что вещество А – это сложный эфир некой кислоты и спирта этанола. Необходимо заметить, что в независимости от тиипа гидролиза образуется соль, а такое возможно для аминокислот. Следовательно мы имеем сложный эфир, состоящий из остатков спирта этанола и некой аминокислоты, причем ароматической, так как молекулярная формула содержит малое количество атомов водорода. Используя информацию о получении вещества А гидрированием вещества Б, делаем вывод, что вещество Б –нитросоединение, содержащее NO2-группу, потому что при гидрировании нитро-группа переходит в амино-группу (NH2-). А также понимаем, что эта нитро-группа находится в пара-положении, так как только это положение подходит под описание, когда заместители максимально удалены друг от друга, там же будет и NH2-группа.
Следовательно, структурная формула —
3) Уравнение получения вещества А путём гидрирования вещества Б:
Задание 35. Пробный вариант 3
При сгорании 13,28 г органического вещества А получили 3,8528∙1023 молекул углекислого газа и 4,32 мл воды.
Известно, что вещество А содержит атомы углерода только в sp2-гибридизации, заместители максимально удалены друг от друга, а также может вступать в реакцию с метанолом (в присутствии серной кислоты) в соотношении либо 1:1 либо 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = N/NA, n = m/M
m = n ∙ M,
n (CO2) = 3,8528 молекул / 6,02∙1023 моль-1 = 0,64 моль
n (С) = n (СО2) = 0,64 моль
m (C) = 0,64 моль ∙ 12 г/моль = 7,68 г
т.к. плотность воды 1 г/мл, то m (H2O) = 4,32 мл ∙ 1 г/мл = 4,32 г
М(Н2О) = 18 г/моль
n (H2O) = 4,32 г / 18 г/моль = 0,24 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,24 моль = 0,48 моль
m (H) = 0,48 моль ∙ 1 г/моль = 0,48 г
m (C) + m (H) = 7,68 г + 0,48 г = 8,16 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,28 г – 8,16 г = 5,12 г
n (O) = 5,12 г / 16 г/моль = 0,32 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,64 : 0,48 : 0,32 = 2 : 1,5 : 1 = 4 : 3 : 2. Но составить структурную формулу с таким соотношением атомов не представляется возможным, поэтому данные индексы надо ещё раз удвоить.
Следовательно молекулярная формула вещества: C8H6O4.
2) Анализируя информацию о веществе А, можно предположить, что данное вещество является ароматическим, так как молекула содержит небольшое число атомов водорода. И так как реагирует со спиртами, то это может быть карбоновая кислота, но с учётом разного соотношения – дикарбоновая кислота, причем вторая карбоксильная группа находится в пара-полложении, так как сказано, что заместители максимально удалены друг от друга.
Следовательно, структурная формула — 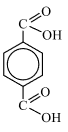
Задание 35. Пробный вариант 4
При сгораниии 13,7 г органического вещества А получили 15,68 л углекислого газа, 1,12 л азота (н.у.) и 6,3 г воды.
Известно, что вещество А содержит в составе одной молекулы 5 вторичных атомов углерода , один третичный и один первичный атом, а функциональная группа находится в пара-положении. Вещество А при реакции с парами хлороводорода в присутствии железа при нагревании переходит в органическое вещество Б немолекулярного строения.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 15,68 л / 22,4 л/моль = 0,7 моль
n (С) = n (СО2) = 0,7 моль
m (C) = 0,7 моль ∙ 12 г/моль = 8,4 г
М(Н2О) = 18 г/моль
n (H2O) = 6,3 г / 18 г/моль = 0,35 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,35 моль = 0,7 моль
m (H) = 0,7 моль ∙ 1 г/моль = 0,7 г
n (N2) = 1,12 л / 22,4 л/моль = 0,05 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,05 моль = 0,1 моль
m (N) = 0,1 моль ∙ 14 г/моль = 1,4 г
m (C) + m (H) + m (N) = 8,4 г + 0,7 г + 1,4 г = 10,5 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,7 г – 10,5 г = 3,2 г
n (O) = 3,2 г / 16 г/моль = 0,2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,7 : 0,7 : 0,1 : 0,2 = 7 : 7 : 1 : 2
Следовательно молекулярная формула вещества: C7H7NO2.
2) Анализируя информацию о веществе А, можно предположить, что это вещество является ароматическим (по указанию первичных, вторичных и третичных атомов углерода). Также для определения класса/группы перебираем известные в школе кислородсодержащие соединения и делаем вывод, что под получившуюся молекулярную формулу подходят либо нитросоединение либо аминокислота. Но так как вещество реагирует с железом и хлороводородом, то узнаём реакцию Зинина, по которой нитрогруппа переходит в аминогруппу с последующей реакцией с кислотой и с образованием органической соли, которая и является веществом Б немолекулярного строения. Вариант с аминокислотой исключаем, так как для реакции аминокислоты с HCl железо не нужно.
2) следовательно, структурная формула: 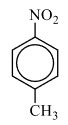
Задание 35. Пробный вариант 5
Вещество А содержит 65,06% углерода, 6,02% водорода, 28,92% кислорода по массе. Известно, что вещество А окисляется до бензойной кислоты. Также известно, что вещество А при взаимодействии с бромоводородом даёт бромопроизводное Б. При воздействии на это бромопроизводное Б спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной кислоты.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции окисления вещества А перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества А – CxHyOz
x : y : z = 65,06/12 : 6,02/1 : 28,92/16 = 5,422 : 6,02 : 1,808 = 3 : 3,33 : 1 = 9 : 10 : 3. Следовательно, молекулярная формула С9Н10О3.
2. Соединение С9Н10О3 окисляется до бензойной кислоты, значит его основу составляет бензолное кольцо. Отсюда следует, что заместитель имеет три атома углерода. Так как в конце всех превращений (описанных в задаче) образуется соль ненасыщенной кислоты, то вещество А содержит карбоксильную группу. Из трёх атомов кислорода в веществе А два входят в состав карбоксила, а третий принадлежит спиртовому гидроксилу, так как вещество А при взаимодействии с бромоводородом образует бромпроизводное Б, что невозможно в случае наличия фенольного гидроксила. При взаимодействии на это бромпроизводное спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной карбоновой кислоты, следовательно, спиртовой гидроксил находится в β-положении по отношению к карбоксильной группе, так как именно β-гидроксикислоты при нагревании отщепляют воду и образуют ненасыщенные соединения.
Структурная формула:
3. Уравнение реакции:
Задание 35. Пробный вариант 6
При сгорании органического вещества Н массой 7 г получено 8,96 л (н.у.) углекислого газа и 5,4 г воды. Известно, что вещество Н подвергается полному гидрированию при нагревании, повышенном давлении и в присутствии катализатора, в результате чего образуется предельный одноатомный первичный спирт В. Про исходное вещество Н также известно, что один из его концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества Н;
2) составьте структурную формулу вещества Н, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции полного гидрирования вещества Н при нагревании, повышенном давлении и в присутствии катализатора (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Исходное органическое вещество Н точно содержит в своём составе атомы элементов углерод, водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Но так как в условии задачи сказано, что при гидрировании вещества Н (а это реакция с водородом) образуется спирт (в котором есть атомы кислорода), то делаем вывод, что исходное вещество Н точно содержит атомы кислорода. Разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 8,96 л / 22,4 л/моль = 0,4 моль
n (С) = n (СО2) = 0,4 моль
m (C) = 0,4 моль ∙ 12 г/моль = 4,8 г
М(Н2О) = 18 г/моль
n (H2O) = 54 г / 18 г/моль = 0,3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,3 моль = 0,6 моль
m (H) = 0,6 моль ∙ 1 г/моль = 0,6 г
m (C) + m (H) = 4,8 г + 0,6 г = 5,4 г
m (O) = 7 г – 5,4 г = 1,6 г
n (O) = 1,6 г / 16 г/моль = 0,1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,4 : 0,6 : 0,1 = 4 : 6 : 1
Следовательно молекулярная формула вещества: C4H6O.
- Как правило, спирты образуются при гидрировании либо альдегидов, либо кетонов. Но первичные спирты образуются из альдегидов, поэтому делаем вывод, что СНО-группа находится на конце. Составляя структурную формулу, замечаем, что не хватает атомов водорода, чтобы получить насыщенный альдегид. Поэтому понимаем, что альдегид ненасыщенный, т.е. содержит двойную связь (именно двойная связь подходит по числу атомов водорода в молекуле). Но так как сказано, что один из концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации, делаем вывод, что двойная связь НЕ может быть на конце (так как атом углерода при двойной связи находится в состоянии sp2-гибридизации). Отсюда получаем, что кратная (двойная) связь отходит от второго атома углерода (между вторым и третьим).
Структурная формула:
3. Уравнение реакции:
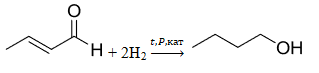
Задание 35. Пробный вариант 7
Вещество А содержит 48% углерода, 4% водорода и 48% кислорода по массе. Известно, что вещество А относится к гетероциклическим соединениям и получается дегидратацией при нагревании вещества Б, которое не содержит третичных и четвертичных атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём дегидратации вещества Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 48/12 : 4/1 : 48/16 = 4 : 4 : 3. Следовательно, молекулярная формула С4Н4О3.
- Соединение С4Н4О3 является гетероциклическим, а значит в состав цикла входят не только атому углерода, но и атомы кислорода. Учитывая, что это вещество образуется путём дегидратации, то можно предположить, что вещество А получается из карбоновой кислоты, так как при дегидратации спиртов образуются алкены, а альдегиды и простейшие эфиры не подвергаются дегидратации . Но так как образуется цикл, то в веществе Б должно быть две карбоксильные группы. И так как по условию задачи сказано, что вещество Б не содержит третичные и четвертичные атомы углерода, то значит его цепочка прямая и неразветвлённая, а значит карбоксильные группы расположены по концам. Как следствие, будет образовываться пятичленный цикл вещества А.
Структурная формула вещества А:
- 3. Уравнение реакции:
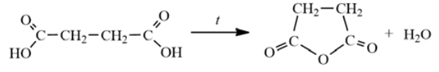
Задание 35. Пробный вариант 8
Неизвестное ациклическое органическое вещество содержит 73,17% углерода, 7,32% водорода и 19,51% кислорода по массе. Это вещество можно получить в реакции избытка спиртового раствора щёлочи с дихлорпроизводным, содержащим такое же число атомов углерода в молекуле как и неизвестное органическое вещество, причём атомы хлора располагаются по разным концам молекулы.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения неизвестного органического вещества путём взаимодействия дихлорпроизводного с избытком спиртового раствора щёлочи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 73,17/12 : 7,32/1 : 19,51/16 = 6,098 : 7,32 : 1,219 = 5 : 6 : 1. Следовательно, молекулярная формула С5Н6О.
- Анализируя условие задачи, можно предположить, что неизвестное органическое вещество будет либо спиртом, либо альдегидом, либо кетоном, либо карбоновой кислотой, либо эфиром. Но так как сказано, что вещество является ациклическим и получается из дихлопроизводного, в котором атомы хлора располагаются по противоположным концам молекулы, то значит при щелочном гидролизе отщепляются две молекулы хлороводорода и по концам образуются двойные связи, и, значит, кислород находится по центру у третьего атома углерода, а значит это ненасыщенный кетон.
Структурная формула неизвестного вещества:

Задание 35. Пробный вариант 9
Устойчивое органическое соединение количеством 0,25 моль окислили водным раствором перманганата натрия. В результате образовались только карбонат натрия массой 8,798 г, гидрокарбонат натрия массой 14,028 г, оксид марганца (IV) массой 28,971 г и вода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции описанное в условии задачи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
Видео-объяснение смотрите на Ютуб по ссылке или ниже
Задание 35. Пробный вариант 10
Вещество А содержит 72% углерода, 6,67% водорода и 21,33% кислорода по массе. Известно, что вещество А содержит два заместителя, которые максимально удалены друг от друга. Также известно, что вещество А получается при нагревании ацетилхлорида (хлорангидрид уксусной кислоты) с веществом Б, которое не вступает в реакции этерификации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём взаимодействия ацетилхлорида с веществом Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- 1. Общая формула вещества А – CxHyOz
x : y : z = 72/12 : 6,67/1 : 21,33/16 = 6 : 6,67 : 1,333 = 4,5 : 5 : 1 = 9 : 10 : 2. Следовательно, молекулярная формула С9Н10О2.
- Соединение С9Н10О2 является ароматическим, так как содержит небольшое число атомов водорода. Также по условию известно, что имеется два заместителя, которые максимально удплены друг от друга, а значит, что один из заместителей находится в пара-положении. Учитывая, что вещество А образуется путём взаимодействия с ацетилхлоридом, то можно предположить, что в первом заместителе содержится два атома углерода, а во втором – один. Учитывая, что исходное вещество Б не вступает в реакции этерефикации, но содержит один атом кислорода (так как один из атомов кислорода находится в ацетилхлориде), то оно относится к классу фенолов, в частности это пара-крезол. Отсюда получаем структурную формулу вещества А:
- Уравнение реакции:
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Возможные варианты задания 33 в ЕГЭ 2022
- Возможные варианты задания 34 в ЕГЭ 2022
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет и пробные (тренировочные) варианты ЕГЭ вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку