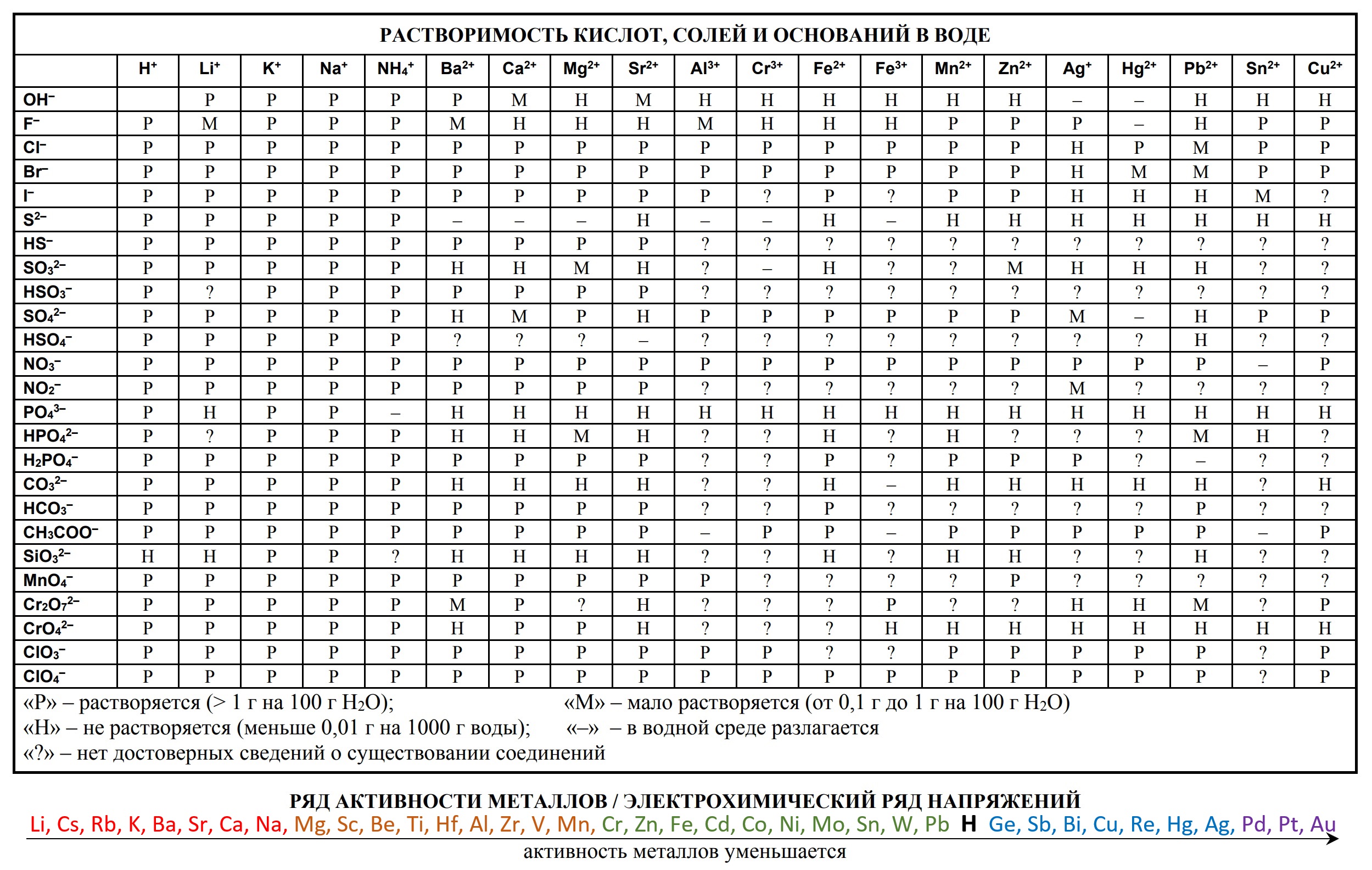
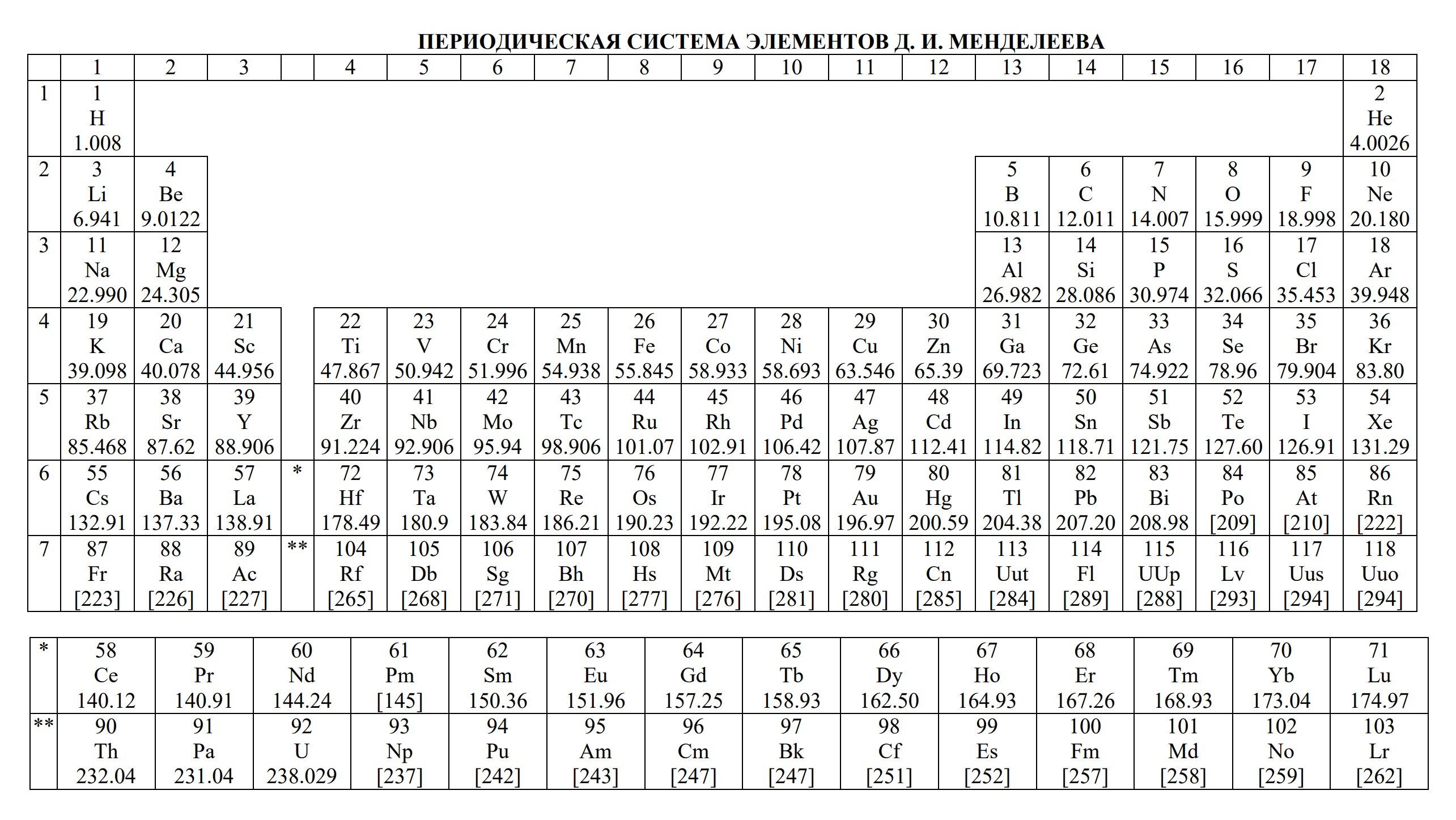
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»:
Опубликовано
admin
в 14:10
При выполнении работы ЕГЭ 2021 по химии разрешено использовать:
— периодическую систему химических элементов Д.И. Менделеева,
— таблицу растворимости солей, кислот и оснований в воде,
— электрохимический ряд напряжений металлов.
→ скачать и распечатать таблицы
Эти сопроводительные материалы прилагаются к тексту работы.
Для вычислений используйте непрограммируемый калькулятор.
Перечень дополнительных устройств и материалов, пользование которыми разрешено на ЕГЭ, утверждается приказом Минпросвещения России и Рособрнадзора.
Смотрите также:
2 досрочных варианта ЕГЭ 2020 по химии с ответами от ФИПИ
ЕГЭ 2021. Химия. Баллы за задания
Демоверсия ЕГЭ по химии 2021 года от ФИПИ
Тренировочные варианты ЕГЭ 2020 по химии СтатГрад
Хочешь больше полезных таблиц, шпаргалок и видео по химии?
Тогда вступай в нашу группу ВКонтакте: https://urlgeni.us/vk/himopis
— Инстаграм https://urlgeni.us/instagram/S0pO
Посты про химию, репетиторство и самодисциплину
— Мерч https://urlgeni.us/vk/merch
Наш маленький магазинчик вещей только для химиков
О себе:
— выпустили 117-стобалльников в 2019 году (каждый 10ый стобалльник России учился у нас!)
— 404 ученика сдали на 90+
— за 3 года работы выпустили 17000 учеников
— сотрудничаем с экспертом по подготовке к ЕГЭ
— готовим и рассылаем полезную теорию нашим подписчикам
— объясняем сложную химию простым и понятным языком
— придумываем ассоциации для легкого запоминания
На этом ютуб-канале я:
— рассказываю как хорошо сдать ЕГЭ
— Даю лайфхаки «как поступить в химический ВУЗ или Мед»
— Провожу бесплатные вебинары ЕГЭ по химии онлайн, которые сложатся в полноценный видеокурс
— Решаю сложные задачи ЕГЭ вместе с вами — покажу реальные способы решать задачи быстро.
Теперь и ты с нами!
Подписывайся на канал и добро пожаловать в химическую семью!
Если нужны крутые таблицы и чек листы Вот мегаполезная рассылка, подписывайся:
— Инстаграм
Посты про химию, репетиторство и самодисциплину — Мерч
Наш маленький магазинчик вещей только для химиков О себе: — выпустили 193 стобалльника за 2019-2020 год — 930 учеников сдали на 90+ — за 4 года работы выпустили более 20 000 учеников — сотрудничаем с экспертом по подготовке к ЕГЭ — готовим и рассылаем полезную теорию нашим подписчикам — объясняем сложную химию простым и понятным языком — придумываем ассоциации для легкого запоминания На этом ютуб-канале я: — рассказываю как хорошо сдать ЕГЭ — Даю лайфхаки «как поступить в химический ВУЗ или Мед» — Провожу бесплатные вебинары ЕГЭ по химии онлайн, которые сложатся в полноценный видеокурс — Решаю сложные задачи ЕГЭ вместе с вами — покажу реальные способы решать задачи быстро. Теперь и ты с нами! Подписывайся на канал и добро пожаловать в химическую семью!
Смотрите также
Вам необходимо зарегистрироваться для просмотра ссылок
№1 ОНЛАЙН-ШКОЛА ПО ПОДГОТОВКЕ К ЕГЭ ПО ХИМИИ
Наши преподаватели:
ЛИЯ МЕНДЕЛЕЕВА:
— преподаю онлайн с 2016 года
— выпустила 234 стобалльника за 2019-2021 год
— каждый вебинар составляю с экспертом по подготовке к ЕГЭ по химии
— в 2019 и 2020ом году каждый 10ый стобалльник России был моим выпускником
— переворачиваю устаревшую систему образования
— обучаю в формате движа: пора вспомнить, что учеба может быть в кайф
И УПС — занижаю ценность ЕГЭ: а то…
Вам необходимо зарегистрироваться для просмотра ссылок
Чек-лист для подготовки к ЕГЭ по химии
Материал по химии
Все темы ЕГЭ по химии

Новинки в 2023
На данный момент пока рано говорить о нововведениях в КИМы ФИПИ по химии. Следите за одновлениями здесь или в группе ВК.
Задание 1
Строение атомов и ионов:
- Строение электронных оболочек атомов первых четырех периодов.
- Правило Хунда и принцип Паули.
- Основное и возбужденное состояние атома.
- Конфигурация благородного газа. Строение электронной оболочки иона.
- Основное и возбужденное состояния атома.
- Особенности строения электронной конфигурации d-элементов.
- Квантовые числа.
- Понятие «валентные электроны».
Задание 2
Закономерности изменения свойств в периодах и группах ПС:
- Металлические и неметаллические свойства.
- Окислительные и восстановительные свойства.
- Электроотрицательность.
- Атомный радиус.
- Кислотные и основные свойства оксидов, гидроксидов, водородных соединений.
Задание 3
Валентность и степень окисления:
- Низшие и высшие степени окисления.
- Низшая и высшая валентность.
- Элементы-исключения (высшая валентность или высшая степень окисления не соответствует номеру группы).
- Элементы с постоянной валентностью.
- Элементы с постоянной степенью окисления в соединениях.
- Возможные промежуточные степени окисления.
Задание 4
Химические связи и кристаллические решетки
- Ковалентная неполярная связь.
- Ковалентная полярная связь.
- Донорно-акцепторный механизм образования ковалентных связей.
- Ионная связь.
- Металлическая связь.
- Водородная связь.
- Длина связи.
- Энергия связи.
- Аморфные вещества.
- Молекулярная решетка.
- Атомная решетка.
- Ионная решетка.
- Металлическая решетка.
- Вещества молекулярного и немолекулярного строения.
- Зависимость физических свойств от типа решетки.
Задание 5
Классификация веществ в неорганической химии:
- Оксиды (кислотные, основные, амфотерные, несолеобразующие).
- Гидроксиды (кислотные, основные, амфотерные)
- Кислоты (одноосновные, двухосновные, многоосновные, кислородсодержащие и бескислородные, сильные и слабые).
- Основания (растворимые и нерастворимые).
- Соли (нормальные, кислые, основные).
Подготовка к ЕГЭ по химии
Статьи
Тесты
Задания 6, 7, 8, 9, 31
Химические свойства неорганических веществ:
- Химические свойства простых веществ-металлов (реакции с неметаллами, кислотами, солями, оксидами). Особые свойства алюминия, цинка, бериллия.
- Химические свойства простых веществ-неметаллов (реакции с металлами и другими неметаллами, щелочами, концентрированными кислотами, водой, замещение одними неметаллами других).
- Характерные химические свойства основных оксидов (взаимодействие с водой, кислотами, кислотными оксидами, восстановителями). Получение основных оксидов.
- Характерные химические свойства кислотных оксидов (взаимодействие с основаниями и основными оксидами, водой). Получение кислотных оксидов.
- Химические свойства растворимых и нерастворимых оснований (реакции с кислотными оксидами и кислотами, амфотерными гидроксидами, солями средними и кислыми).
- Химические свойства кислот (взаимодействие с оксидами, основаниями и амфотерными гидроксидами, металлами, солями средними и кислыми).
- Химические свойства амфотерных оксидов и гидроксидов (взаимодействие со щелочами и кислотами, растворами некоторых солей и оксидами). Образование комплексных солей. Номенклатура и химические свойства комплексных солей (реакции с некоторыми кислотами и солями, разложение при нагревании).
- Химические свойства солей (взаимодействие со щелочами и раствором аммиака, с кислотами, друг с другом, с некоторыми оксидами и металлами).
- Соединения металлов IА-группы. Тривиальные названия (глауберова соль, едкий натр, поташ, селитра чилийская, кальцинированная сода, питьевая сода).
- Соединения металлов IА-группы. Образование оксидов и пероксидов, нитридов, гидридов, сульфидов, фосфидов, галогенидов, карбидов. Гидролиз нитридов, фосфидов, гидридов, карбидов.
- Соединения металлов IА-группы. Взаимодействие со сложными веществами: водой, аммиаком, спиртами и некоторыми алкинами.
- Окрашивание пламени солями щелочных металлов.
- Соединения металлов IIА-группы. Тривиальные названия (доломит, известняк, мрамор, мел, негашеная известь, гашеная известь, известковое молоко).
- Соединения металлов IIА-группы. Образование галогенидов, оксидов, пероксидов, гидридов, сульфидов, карбидов, нитридов и фосфидов.
- Соединения металлов IIА-группы. Реакции с водой.
- Окраска пламени солями щелочноземельных металлов.
- Жесткость воды и методы её устранения.
- Медь: тривиальные названия (малахит, медный купорос); получение из оксидов, из солей путем замещения и электролизом; Взаимодействие с галогенами, кислородом, азотной и серной кислотой.
- Оксид меди I: цвет, восстановительные свойства, образование комплексов с раствором аммиака.
- Оксид меди II: цвет, типичные химические свойства.
- Гидроксид меди II: цвет, типичные химические свойства оснований. Комплексообразование.
- Хром: методы получения; взаимодействие с азотной и серной кислотой, с кислородом, соляной кислотой и хлороводородом на воздухе.
- Оксид хрома III: получение путём разложения дихромата аммония и дихромата калия. Характерные амфотерные свойства.
- Оксид хрома VI: образование хромовой и дихромовой кислоты, хромата и дихромата калия/натрия.
- Окислительно-восстановительные свойства оксида хрома III, оксида хрома VI, хромата и дихромата калия/натрия.
- Оксид марганца IV: цвет, ОВ-свойства.
- Окислительно-восстановительные свойства манганатов и перманганатов. Цвета растворов.
- Железо. Особенности взаимодействия железа с кислородом, галогенами и соляной кислотой, с концентрированной серной и азотной кислотой.
- Оксид железа II: получение, ОВ-свойства, свойства типичного основного оксида, цвет. Гидроксид железа II: цвет, получение.
- Оксид железа III: получение, цвет, характерные амфотерные свойства, ОВ-свойства. Гидроксид железа III: цвет, получение, характерные амфотерные свойства.
- Железная окалина: получение, ОВ-свойства.
- Соли железа II: хлористое железо, железный купорос, желтая кровяная соль. Качественные реакции на соли железа II.
- Соли железа III: хлорное железо, красная кровяная соль. Качественные реакции на соли железа III.
- Водород: взаимодействие с металлами и неметаллами. Восстановительные свойства при реакциях со сложными веществами: оксидами и галогенидами.
- Лабораторные методы получения водорода (из кислот, щелочей, воды, гидридов). Промышленные методы получения водорода (электролизом, конверсией метана, крекингом углеводородов).
- Взаимодействие воды с металлами и неметаллами, амфотерные свойства воды. Получение и ОВ-свойства пероксида водорода.
- Агрегатное состояние и цвет элементов VIIА-группы (галогенов). Изменение окислительной активности в ряду галогенов на примере взаимодействия их с серой, фосфором, железом. Замещение одного галогена другим. Взаимодействие галогенов с водой и щелочами.
- Хлорсодержащие кислоты: хлорная, хлористая, хлорноватая, хлорноватистая, соответствующие им соли, их ОВ-свойства. Бертолетова соль, белильная известь, хлорка.
- Кислород: почему не проявляет степень окисления +6? Методы получения (из хлората калия, нитратов щелочных металлов, перманганата калия, оксида ртути II, пероксидов, электролизом, фракционной возгонкой).
- Кислород: образование оксидов, пероксидов, окалины. С какими элементами не реагирует? Реакции с серой и азотом. Реакции с сульфидами, метанов, сероводородом. Взаимодействие с оксидами металлов в промежуточной степени окисления.
- Сера: цвет, формулы: свинцового блеска, цинковой обманки, железного колчедана, серного колчедана, пирита. Получение серы из пирита, диоксида серы, сероводорода. Аллотропные модификации серы.
- Химические свойства серы: с какими элементами сера ведет себя как окислитель? Восстановительные свойства серы (реакции, в которых сера принимает значение степени окисления +4 и +6). Реакция серы со щелочами.
- Сероводород и сероводородная кислота: физические свойства, восстановительные свойства сульфид-иона. Качественные реакции на сульфид-ион. Получение сульфидов и гидросульфидов.
- Сравнение оксида серы IV и оксида серы VI: взаимодействие с водой, основными оксидами, основаниями, ОВ-свойства.
- Сравнение реакционной способности концентрированной и разбавленной серной кислоты.
- Разложение сульфатов. Качественные реакции на сульфат- и сульфит-ион.
- Азот и фосфор как простые вещества: сравнение свойств: агрегатное состояние, аллотропные модификации, взаимодействие с кислородом, водородом, металлами, серой, щелочами, кислотами.
- Сравнение свойств аммиака и фосфина: цвет, запах, токсичность, наличие водородных связей, растворимость, реакции с водой, кислотами, горение, восстановительные свойства.
- Нашатырь и нашатырный спирт. Качественные реакции на соли аммония. Разложение нитрита и нитрата аммония. Реакция раствора аммиака с растворимыми солями железа, меди, магния.
- Наиболее распространенные оксиды азота: NO и NO2, методы их получения, ОВ-свойства. Взаимодействие NO2 с водой и щелочами без доступа кислорода и в его присутствии.
- Сравнение концентрированной и разбавленной азотной кислоты.
- Фосфорный ангидрид: получение, взаимодействие с избытком и недостатком воды или щелочи, водоотнимающие свойства.
- Аллотропные модификации углерода. Взаимодействие с кислородом, водородом, серой, кремнием, восстановительная активность.Сравнение угарного и углекислого газа: строение, получение, ОВ-свойства, взаимодействие со щелочами. Химические свойства угольной кислоты.
- Кремний: методы получения, взаимодействие с водородом и галогенами, ОВ-свойства, реакция с щелочами, растворение в смеси азотной и плавиковой кислоты. Оксид кремния IV. Кремниевая кислота.
Задание 10
Классификация и номенклатура органических соединений
- Классификация углеводородов.
- Классификация кислород- и азотсодержащих органических соединений.
- Общие формулы и функциональные группы.
- Номенклатура органических соединений
Задание 11
Теория строения органических соединений.
- Гибридизация атомных орбиталей углерода.
- Гомология и изомерия. Основные типы изомерии.
- Типы связей в органических веществах.
Задания 12–16, 32
Органическая химия. Строение, получение, применение, химические и физические свойства:
- Алканов
- Алкенов
- Диенов
- Алкинов
- Циклоалканов
- Аренов
- Спиртов
- Карбонильных соединений
- Карбоновых кислот
- Аминов
- Анилина
- Аминокислот
- Белков
- Жиров
- Углеводов
Задание 17
Классификация химических реакций
- Классификация химических реакций в неорганической химии.
- Классификация химических реакций в органической химии.
Задание 18
Скорость химической реакции
- Зависимость скорости химической реакции от концентрации, температуры, давления, агрегатного состояния.
Задание 19, 29
Окислительно-восстановительные реакции
- Определение окислителей и восстановителей. Типичные окислители и восстановители, и продукты их окисления и восстановления.
- Молекулы и ионы как окислители и восстановители.
- Расстановка коэффициентов с помощью электронного баланса.
- Расстановка коэффициентов с помощью ионно-электронного баланса.
Задание 20
Электролиз
- Электролиз в расплавах.
- Электролиз в растворах. Катодные и анодные процессы.
- Получение веществ электролизом.
Задание 21
Гидролиз
- Классификация солей по способности гидролизоваться.
- Среда растворов, рН.
Задание 22
Химическое равновесие
- Смещение химического равновесия при различных воздействиях.
Задание 23
Решение задач по равновесным концентрациям
- Теория и разбор заданий.
Задание 24
Качественные реакции
- Качественные реакции в неорганической химии.
- Качественные реакции в органической химии.
Задание 25
Химическая промышленность
- Применение органических веществ в быту.
- Применение неорганических веществ в быту.
- Полимеры и их применение. Реакции полимеризации и конденсации.
- Классификация волокон и их получение.
- Производство серной и азотной кислоты, аммиака, метанола.
- Правила работы в лаборатории.
- Лабораторные приборы и посуда.
- Методы разделения смесей. Очистка веществ.
Задание 26
Задачи на растворы
- Решение простейших задач с применением понятия «массовая доля вещества в растворе».
- Решение простейших задач с применением понятия «кристаллогидраты».
- Решение простейших задач с применением понятия «растворимость».
Задание 27
Расчеты по термохимическим уравнениям
- Решение задач по термохимическим уравнениям.
Задание 28
Расчеты по химическим уравнениям
- Расчеты по известной массе, количеству вещества или объёму.
- Расчеты массовой или объёмной доли продуктов.
- Расчеты с применением понятия «массовая доля вещества в смеси».
Задание 30
Реакции ионного обмена
- Электролиты и неэлектролиты, сильные и слабые электролиты. Электролитическая диссоциация. Реакции ионного обмена.
Задание 33
Задачи повышенного уровня сложности (общая и неорганическая химия)
- Задачи на избыток и недостаток с применением понятий «массовая доля», «растворимость», «молярная концентрация».
- Задачи на избыток и недостаток с образованием кислых солей.
- Задачи на кристаллогидраты.
- Задачи на осаждение веществ двумя реакциями.
- Задачи на добавление оксида в раствор соответствующей кислоты.
- Задачи на систему двух уравнений (определение массовой доли веществ в первоначальной смеси).
- Задачи с использованием математической системы уравнений.
- Задачи на частичное разложение.
- Задачи на атомистику.
Задание 34
Установление молекулярной и структурной формулы вещества
- Расчеты по плотности газа, относительной молекулярной массе по известному газу, массе молекулы, плотности газа.
- Расчеты по массовой доли элементов в органическом веществе.
- Расчеты по массовой доле одного элемента известной группы веществ.
- Расчеты по продуктам сгорания.
- Расчеты по известному количеству кислорода при горении.
- Расчеты по реакционной способности.
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады