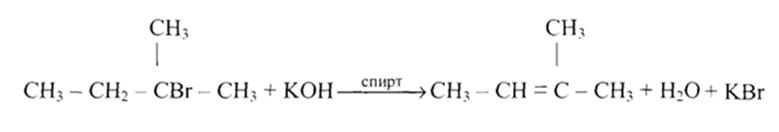
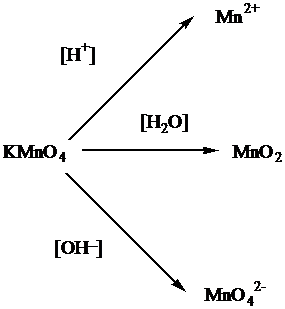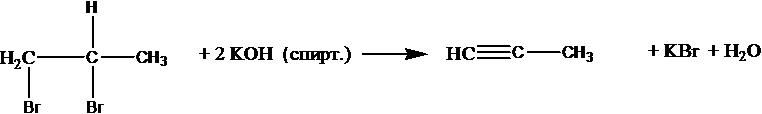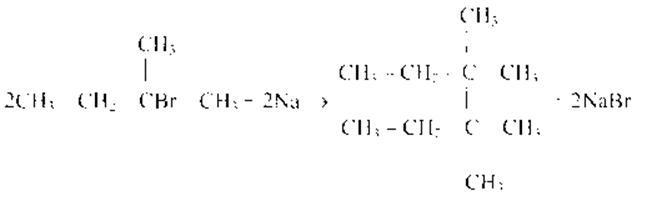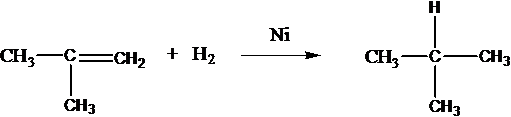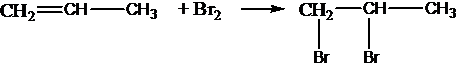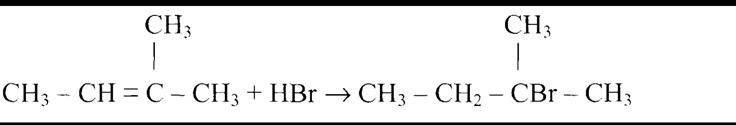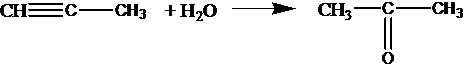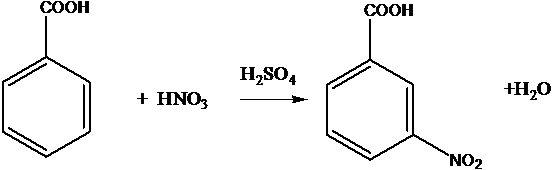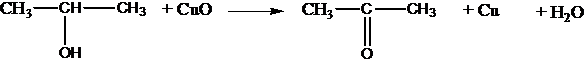Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Все сложные неорганические реакции из реальных заданий ЕГЭ по химии.
Практически все сложные неорганические реакции на ЕГЭ будут либо те же, либо полностью аналогичные.
neorganicheskie-reakcii.pdf
1)
Si + 2Cl2
→SiCl4
2)
SiCl4
+
3H2O→
H2SiO3
+
4HCl
3)
Ca3(PO4)2
+
5C + 3SiO2
→2P
+ 5CO + 3CaSiO3
4)
Ca3N2
+
6H2O→
3Ca(OH)2
+
2NH3↑
5)
2NH3
+
3CuO→
3Cu + 3H2O
+ N2↑
6)
Cu + 4HNO3(конц→.)
Cu(NO3)2
+
2NO2↑
+
2H2O
7)
2Cu(NO3)2
→2CuO
+ 4NO2
+
O2↑

4FeS + 7O2
→2Fe2O3
+
4SO2↑
9)
2H2S
+ SO2
→3S↓
+
2H2O
10)
S + 6HNO3
→H2SO4
+
6NO2↑
+
2H2O
11)
4Al(NO3)3
→2Al2O3
+
12NO2↑
+
3O2↑
12)
2Al2O3
→4Al
+ 3O2↑
(электролиз
раствора Al2O3
в
расплаве криолита)
13)
3KNO3
+
8Al + 5KOH + 18H2O
→3NH3↑
+
8K[Al(OH)4]
14)
CrO3
+
2KOH →K2CrO4
+
H2O
15)
2K2CrO4
+
H2SO4
→K2Cr2O7
+
K2SO4
+
H2O
16)
14HBr + K2Cr2O7
→2CrBr3
+
3Br2
+
7H2O
+ 2KBr
17)
H2S
+ Br2→
S↓
+
2HBr
18)
3Mg + N2
→Mg3N2
19)
Mg3N2
+
6H2O→
3Mg(OH)2↓
+
2NH3↑
20)
Cr2(SO4)3
+
6NH3
+
6H2O→
2Cr(OH)3↓
+
3(NH4)2SO4
21)
2Cr(OH)3
+
4KOH + 3H2O2
→2K2CrO4
+
8H2O
22)
2Ag + 2H2SO4(конц.)
→Ag2SO4
+
SO2↑
+
2H2O
23)
2KClO3
→2KCl
+ 3O2↑
(в
присутствии кат-ра)
24)
3Fe + 2O2
→Fe3O4
25)
Fe3O4
+
8HCl →FeCl2
+
2FeCl3
+
4H2O
26)
6FeCl2
+
14HCl + K2Cr2O7
→6FeCl3
+
2CrCl3
+
2KCl + 7H2O
27)
2Na + H2
→2NaH
28)
NaH + H2O→
NaOH + H2↑
29)
2NO2
+
2NaOH →NaNO2
+
NaNO3
+
H2O
30)
2Al + 2NaOH + 6H2O
→2Na[Al(OH)4]
+ 3H2↑
31)
Cu + 2H2SO4
→CuSO4
+
SO2↑
+
2H2O
32)
2CuSO4
+
4KI →2CuI↓
+
I2↓
+
2K2SO4
33)
2NaCl + 2H2O
→H2↑
+
Cl2↑
+
2NaOH (электролиз
раствора)
34)
Fe2O3
+
6HI →2FeI2
+
I2↓
+
3H2O
35)
Na[Al(OH)4]
+ CO2→
NaHCO3
+
Al(OH)3↓
36)
Al2O3
+
Na2CO3
(тв.)
→
2NaAlO2
+
CO2↑
(сплавление)
37)
Al4C3
+
12HBr →4AlBr3
+
3CH4↑
38)
2AlBr3
+
3K2SO3
+
3H2O
→2Al(OH)3↓
+
3SO2↑
+
6KBr
39)
3SO2
+
K2Cr2O7
+
H2SO4
→K2SO4
+
Cr2(SO4)3
+
H2O
40)
Zn + 2KOH + 2H2O
→K2[Zn(OH)4]
+ H2↑
41)
K2[Zn(OH)4]
→K2ZnO2
+
2H2O
42)
K2ZnO2
+
4HCl→
2KCl + ZnCl2
+
2H2O
43)
HI + KHCO3
→KI
+ H2O
+ CO2↑
44)
6KI + K2Cr2O7
+
7H2SO4
→4K2SO4
+
3I2↓
+
Cr2(SO4)3
+
7H2O
45)
2AlI3
+
3Na2S
+ 6H2O→
2Al(OH)3↓
+
3H2S↑
+
6NaI
46)
Fe3O4
+
10HNO3→
3Fe(NO3)3
+
NO2↑
+
5H2O
47)
Fe2O3
+
Fe →3FeO
48)
2Na + O2→
Na2O2
(горение)
49)
Na2O2
+
4HCl →2NaCl
+ 2H2O
+ Cl2↑
50)
3Cl2
+
10KOH + Cr2O3
→2K2CrO4
+
6KCl + 5H2O
51)
K2CrO4
+
BaCl2
→BaCrO4↓
+
2KCl
52)
2Cu(NO3)2
+
2H2O
→2Cu
+ O2↑
+
4HNO3
(электролиз
раствора)
53)
6KOH + 3S→
K2SO3
+
2K2S
+ 3H2O
54)
6KHCO3
+
Fe2(SO4)3
→2Fe(OH)3↓
+
3K2SO4
+
6CO2↑
55)
KH + H2O
→KOH
+ H2↑
56)
K2ZnO2
+
2H2SO4
→K2SO4
+
ZnSO4
+
2H2O
57)
FeSO4
+
2NH3
+
2H2O→
Fe(OH)2↓
+
(NH4)2SO4
58)
Fe(OH)2
+
4HNO3(конц.)
→Fe(NO3)3
+
NO2↑
+
3H2O
59)
2Fe(NO3)3
+
3K2CO3
+
3H2O
→2Fe(OH)3↓
+
3CO2↑
+
6KNO3
60)
4NO2
+
2Ca(OH)2
→Ca(NO3)2
+
Ca(NO2)2
+
2H2O
61)
3Ca + 2P →Ca3P2
62)
Ca3P2
+
6H2O
→3Ca(OH)2
+
2PH3↑
63)
PH3
+
8NaMnO4
+
11NaOH→
8Na2MnO4
+
Na3PO4
+
7H2O
64)
Na2MnO4
+
Na2SO3
+
H2O
→MnO2↓
+
Na2SO4
+
2NaOH
65)
P + 5HNO3→
H3PO4
+
5NO2↑
+
H2O
66)
4Zn + 2NO2
→4ZnO
+ N2↑
67)
2NaNO3
→2NaNO2
+
O2↑
68)
NaNO2
+
NH4I
→NaI
+ N2↑
+
2H2O
69)
2NaI + H2O2
+
H2SO4→
Na2SO4
+
I2↓
+
2H2O
70)
3I2
+
6NaOH(р−р)
→
NaIO3
+
5NaI + 3H2O
71)
H2O2
+
Ag2O
→2Ag↓
+
O2↑
+
H2O
72)
2ZnS + 3O2
→2ZnO
+ 2SO2↑
73)
Na2[Zn(OH)4]
→
Na2ZnO2
+
2H2O
74)
3Cu2O
+ Na2Cr2O7
+
10H2SO4
→6CuSO4
+
Cr2(SO4)3
+
Na2SO4
+
10H2O
75)
NaHCO3
+
NaOH→
Na2CO3
+
H2O
76)
K2Cr2O7(тв.)
+
14HCl(конц.
→)
2CrCl3
+
2KCl + 3Cl2↑
+
7H2O
77)
3NaNO2
+
2KMnO4
+
H2O
→2MnO2↓
+
2KOH + 3NaNO3
78)
MnO2
+
4HCl(конц.)
→MnCl2
+
Cl2↑
+
2H2O
79)
2Fe(OH)3
+
6HI →2FeI2
+
I2↓
+
6H2O
80)
3Na2CO3
+
2CrBr3
+
3H2O
→2Cr(OH)3↓
+
6NaBr + 3CO2↑
81)
5FeCl2
+
KMnO4
+
8HCl→
5FeCl3
+
MnCl2
+
KCl + 4H2O
82)
K2SiO3(р—р)
+
2H2O
+ 2CO2
→H2SiO3↓
+
2KHCO3
83)
Ba(OH)2
+
2NaHCO3→
Na2CO3
+
BaCO3↓
+
2H2O
(изб.
NaHCO3)
Ba(OH)2
+
NaHCO3
→BaCO3
+
NaOH + H2O
(изб.
Ba(OH)2)
или
84)
6KOH + 3Cl2→
KClO3
+
5KCl + 3H2O
85)
Cr2O3
+
KClO3
+
4KOH →2K2CrO4
+
KCl + 2H2O
86)
4NH3
+
5O2→
4NO
+ 6H2O
(кат.
Pt,
Cr2O3,
t, p)
87)
2NO + O2
→
2NO2
88)
NaNO2
+
2KMnO4
+
2KOH →2K2MnO4
+
NaNO3
+
H2O
89)
8KI(тв.)
+
9H2SO4(конц.
→)
8KHSO4
+
4I2↓
+
H2S↑
+
4H2O
90)
Al2O3
+
2NaOH + 3H2O→
2Na[Al(OH)4]
91)
Na[Al(OH)4]
+ 4HNO3
→NaNO3
+
Al(NO3)3
+
4H2O
92)
2Ca(OH)2
+
4NO2
+
O2
→2Ca(NO3)2
+
2H2O
93)
K[Al(OH)4]
+ SO2
→KHSO3
+
Al(OH)3↓
94)
8KOH + PCl5
→K3PO4
+
5KCl + 4H2O
95)
2KBr(тв)
+
2H2SO4(конц.,
гор.
→)
K2SO4
+
Br2
+
SO2↑
+
2H2O
96)
3Br2
+
6KOH→
5KBr + KBrO3
+
3H2O
97)
Br2
+
K2SO3
+
2NaOH →2NaBr
+ K2SO4
+
H2O
98)
Fe2O3
+
6HI →2FeI2
+
I2
+
3H2O
99)
Fe2O3
+
2NaOH(т→в.)
2NaFeO2
+
H2O
(сплавление)
100)
4NO2
+
O2
+
2H2O→
4HNO3
101)
NaFeO2
+
4HNO3(изб.)
→
NaNO3
+
Fe(NO3)3
+
2H2O
102)
FeO + 4HNO3(конц.)
→
Fe(NO3)3
+
NO2↑
+
2H2O
103)
Ca2Si
+ 4H2O→
2Ca(OH)2
+
SiH4↑
104)
3Na2SO3
+
Na2Cr2O7
+
4H2SO4→
Cr2(SO4)3
+
4Na2SO4
+
4H2O
105)
4Mg + 5H2SO4(конц.)
→
4MgSO4
+
H2S↑
+
4H2O
106)
CuS + 10HNO3→
Cu(NO3)2
+
H2SO4
+
8NO2
+
4H2O
CuS
+ 8HNO3(конц.)
→CuSO4
+
8NO2↑
+
4H2O
либо
(одинаково верно)
107)
3Cu + 8HNO3(разб.)
→3Cu(NO3)2
+
2NO↑
+
4H2O
108)
2Cu(NO3)2
+
2H2O→
2Cu↓
+
O2↑
+
4HNO3
(электролиз
раствора)
109)
Cu2O
+ 3H2SO4(конц.)
→2CuSO4
+
SO2↑
+
3H2O
110)
2NaI
+ 2NaMnO4
→I2↓
+
2Na2MnO4
(в
щелочном растворе)
111)
2Na2O2
+
2CO2
→2Na2CO3
+
O2
112)
8NaOH(р—р,
изб.)
+
Al2S3
→2Na[Al(OH)4]
+ 3Na2S
113)
4Ca + 5H2SO4(конц.)
→H2S↑
+
4CaSO4↓
+
4H2O
114)
2Fe(OH)2
+
H2O2
→2Fe(OH)3
115)
Na2O2
+
2H2O(хол.
→)
H2O2
+
2NaOH
116)
Ag2S
+ 10HNO3(конц.)
→
2AgNO3
+
H2SO4
+
8NO2
+
4H2O
Ag2S
+ 8HNO3
→Ag2SO4
+
8NO2
+
4H2O
117)
H2SO4
+
8HI →4I2
+
H2S
+ 4H2O
118)
H2SO4
+
2HBr→
Br2
+
SO2
↑
+
2H2O
119)
SO2
+
Cl2
+
2H2O→
H2SO4
+
2HCl (с
Br2
аналогично)
120)
PH3
+
8HNO3
→H3PO4
+
8NO2
↑
+
4H2O
121)
2FeSO4
+
2H2SO4
→Fe2(SO4)3
+
SO2
↑
+
2H2O
122)
2KMnO4
+
2NH3
→2KOH
+ N2
↑
+
2MnO2
+
2H2O
123)
2KMnO4
+
3(NH4)2SO3→
2MnO2
+
2(NH4)2SO4
+
K2SO4
+
2NH3
+
H2O
124)
(NH4)2SO3
+
Cl2
+
H2O
→
(NH4)2SO4
+
2HCl
125)
2Fe(OH)2
+
4H2SO4(конц.)
→
Fe2(SO4)3
+
SO2
+
6H2O
126)
NaHSO4
+
Ba(CH3COO)2
→
BaSO4
+
CH3COONa
+ CH3COOH
127)
2NaH2PO4
+
3Sr(OH)2
→
Sr3(PO4)2
+
2NaOH + 4H2O
128)
3Mg(H2PO4)2
+
12KOH→
Mg3(PO4)2
+
4K3PO4
+
12H2O
129)
5KClO3(тв.)
+
6P →
5KCl + 3P2O5
(при
сплавлении, не в растворе!)
130)
2KMnO4(подкисл.)
+
5SO2
+
2H2O
→
K2SO4
+
2MnSO4
+
2H2SO4
131)
K[Al(OH)4]
+ H2S
→
KHS + Al(OH)3
+
H2O
132)
3KHS + 2KMnO4
(изб.)
+
H2O
→
3S + 5KOH + 2MnO2
133)
Fe3O4
+
8HI →
3FeI2
+
I2
+
4H2O
134)
AlP + 3HCl→
AlCl3
+
PH3
135)
SO2
+
2HNO3
→
H2SO4
+
2NO2
136)
Cu2O
+ 6HNO3
(конц.
→)
2Cu(NO3)2
+
2NO2
+
3H2O
137)
3Ca(OH)2(изб.)
+
2(NH4)2HPO4→
Ca3(PO4)2
+
4NH3
+
6H2O
138)
2Na2CrO4
+
16HCl →4NaCl
+ 2CrCl3
+
3Cl2↑
+
8H2O
139)
4Na2Cr2O7
+
3PH3
+
16H2SO4
→4Na2SO4
+
4Cr2(SO4)3
+
3H3PO4
+
16H2O
140)
4Fe(NO3)2→
2Fe2O3
+
8NO2↑
+
O2↑
(как
в токе воздуха, так и без него)
141)
5Na2O2
+2KMnO4+8H2SO4→
5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
142)
Ba(HSO3)2
+
2H2O2
→BaSO4
+
H2SO4
+
2H2O
143)
BaSO4(тв.)
+
4H2→
BaS
+ 4H2O
146)
SiH4
+
8KMnO4
+
10KOH→
8K2MnO4
+
K2SiO3
+
7H2O
144)
2FeS +10H2SO4
→Fe2(SO4)3
+
9SO2↑
+10H2O
145)
SiO2
+
4Mg →2MgO
+ Mg2Si
147)
8Cr(OH)3
+
3KClO4
+
16KOH →8K2CrO4
+
3KCl + 20H2O
148)
FeI2
+
6HNO3
(конц.)
→Fe(NO3)3
+
I2
+
3NO2↑
+
3H2O
149)
Cu2S
+ 6H2SO4(конц.)
→2CuSO4
+
5SO2↑+
6H2O
150)
Zn3P2
+
6HCl →3ZnCl2
+
2PH3↑
151)
2CuI + 8HNO3
(конц).
→
2Cu(NO3)2
+
I2
+
4NO2↑
+
4H2O
152)
2FeI2
+
6H2SO4
(конц.)
→Fe2(SO4)3
+
2I2
+
3SO2↑
+
6H2O
153)
Mg3P2
+
6H2O
→3Mg(OH)2
+
6PH3↑
154)
2K2MnO4
+
Cl2
→2KMnO4
+
2KCl
155)
FeS2
+
18HNO3
(конц.)
→
Fe(NO3)3
+
2H2SO4
+
15NO2↑
+
7H2O
156)
Na2S
+ 2NaNO2
+
2H2SO4→
2Na2SO4
+
S + 2NO↑
+
2H2O
157)
Cu2S
+ 14HNO3(конц.)
→2Cu(NO3)2
+
H2SO4
+
10NO2↑
+
6H2O
158)
Na2CrO4
+
2CH3COOAg→
2CH3COONa
+ Ag2CrO4↓
159)
2H2O
+ 2KMnO4
+
3Mn(NO3)2→
5MnO2↓
+
2KNO3
+
4HNO3
160)
Cu + 2KNO3
+
2H2SO4
↓→
CuSO4
+
K2SO4
+
2NO2
+
2H2O161)
C(АМОРФ.)
+
2H2SO4
→CO2↑
+
2SO2↑
+
2H2O
161)
C(АМОРФ.)
+
2H2SO4
→CO2↑
+
2SO2↑
+
2H2O
162)
10HNO3(конц.)
+
I2
→2HIO3
+
10NO2↑
+
4H2O
163)
3Na2O2
+
2NH3
→6NaOH
+ N2↑
164)
4H2SO4(конц.)
+
PH3
→H3PO4
+
4SO2↑
+4H2O
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Неорганические реакции в ЕГЭ по химии
Неорганические реакции в ЕГЭ по химии
- 20.01.2020
Сборник неорганических реакций из реальных заданий ЕГЭ прошлых лет (по химии).
Собрано более 100 реакций, а также правильных ответов к ним.
Ценность в том, что задания взяты именно из реальных кимов ЕГЭ.
- Другая теория по химии для ЕГЭ
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #химияогэ #химик #егэхимия #химияегэ #репетиторпохимии
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Самые сложные реакции в ЕГЭ по химии | ХИМИЯ ЕГЭ | Лия Менделеева
Лия Менделеева — ЕГЭ химия

Самые сложные ОВР в задании 29 | Химия ЕГЭ | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2022 | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2023 | Parta
Parta химия ЕГЭ
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
15.05.2022
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl
100 ОВР, котрые помогут учащимся при сдаче ЕГЭ по химии.
1) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2) 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
3) 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
4) 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5) 2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
6) 2KMnO4 + 5Na2SO3 + 3H2SO4 = MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
7)SO2 + 2KMnO4 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O

9) K2Cr2O7 + 3NaNO2 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
10) K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
11) 4Mg + 10HNO3(оч.разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
12) Cr2(SO4)3 + 3Br2 + 16NaOH = 6NaBr + 2Na2CrO4 + 3Na2SO4 + 8H2O
13)Al2S3 + 30HNO3(конц.) = 2Al(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
14) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
15) FeCl2 + 4HNO3(конц.) = Fe(NO3)3 + 2HCl + NO2 + H2O
16) AlP + 11HNO3(конц.) = H3PO4 + 8NO2 + Al(NO3)3 + 4H2O
17) 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
18) 3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
19) 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
20) 3P2O3 + 2HClO3 + 9H2O = 6H3PO4 + 2HCl
21) Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
22) Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
23) 2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2Na2SO4 + 2H2O
24) 8KI + 9H2SO4(конц.) = 4I2 + H2S + 8KHSO4 + 4H2O
25) Cu + 2FeCl3 = CuCl2 + 2FeCl2
26) 3PH3 + 4HClO3 = 3H3PO4 + 4HCl
27) 3NO2 + H2O = NO + 2HNO3
28) I2 + K2SO3 + 2KOH = 2KI + K2SO4 + H2O
29) 2NH3 + 3KClO = N2 + 3KCl + 3H2O
30) 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
31) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
32) Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O
33) 3H2S + HClO3 = 3S + HCl + 3H2O
34) Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
35) 2KMnO4 + KI + H2O = 2MnO2 + KIO3 + 2KOH
36) I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
37) 3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 28NO + 9H2SO4
38) 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
39) MnO2 + 2KBr + 2H2SO4 = MnSO4 + Br2 + K2SO4 + 2H2O
40) 5HCOH + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
41) 3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH
42) NaClO + 2KI + H2SO4 = I2 + NaCl + K2SO4 + H2O
43) 2KNO3 + 6KI + 4H2SO4 = 2NO + 3I2 + 4K2SO4 + 4H2O
44) 14HCl + K2Cr2O7 = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
45) 2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
46) K2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4H2O
47) K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3 + 3Na2SO4 + 2KOH
48) 2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
49) 4Zn + KNO3 + 7KOH = NH3 + 4K2ZnO2 + 2H2O
50) 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
51) P2O3 + 6KOH + 2NO2 = 2NO + 2K3PO4 + 3H2O
52) 2KMnO4 + 2NH3 = 2MnO2 + N2 + 2KOH + 2H2O
53) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
54) 3NaNO2 + Na2Cr2O7 + 8HNO3 = 5NaNO3 + 2Cr(NO3)3 + 4H2O
55) B + HNO3(конц.) + 4HF = NO + HBF4 + 2H2O
56) 2CuCl2 + SO2 + 2H2O = 2CuCl + 2HCl + H2SO4
57) PH3 + 8AgNO3 + 4H2O = 8Ag + H3PO4 + 8HNO3
58) 2NH3 + 6KMnO4 + 6KOH = N2 + 6K2MnO4 + 6H2O
59) 5Zn + 2KMnO4 + 8H2SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8H2O
60) 3KNO2 + K2Cr2O7 + 8HNO3 = 5KNO3 + 2Cr(NO3)3 + 4H2O
61) FeS + 12HNO3(конц.) = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
62) KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
63) 2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
64) Fe2(SO4)3 + Na2SO3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
65) 3P2O3+ 2H2Cr2O7 + H2O = 2H3PO4 + 4CrPO4
66) 3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
67) 5Na2SO3(нед.) + 2KIO3 + H2SO4 = I2 + K2SO4 + 5Na2SO4 + H2O
68) 2CrBr3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
69) 8 KMnO4 + 5 PH3 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
70) 3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
71) 3P2O3 + 4HNO3 + 7H2O = 6H3PO4 + 4NO
72) 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + H2O
73) 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
74) 5AsH3 + 8KMnO4 + 12H2SO4 = 5H3AsO4 + 4K2SO4 + 8MnSO4 + 12H2O
75) 2CuI + 4H2SO4(конц.) = 2CuSO4 + I2 + 4H2O + 2SO2
76) Si + 2KOH + H2O = K2SiO3 + 2H2 (to)
77) B + 3HNO3 = H3BO3 + 3NO2
78) 8NH3 + 3Br2 = N2 + 6NH4Br
79) P4 + 3KOH + 3H2O = PH3 + 3KH2PO2
80) Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO(to)
81) H2S + HClO = S + HCl + H2O
82) 5KNO3(расплав) + 2P = 5KNO2 + P2O5
83) I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
84) H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
85) 8Zn + 5H2S2O7 = 8ZnSO4 + 2H2S + 3H2O
86) 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
87) Na2S + 8NaNO3 + 9H2SO4 = 10NaHSO4 + 8NO2 + 4H2O
88) Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
89) 5C + Ca3(PO4)2 + 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
90) 2NaI + H2O2 + H2SO4 = Na2SO4 + I2 + 2H2O
91) 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 7H2O + 2KBr
92) 2NH3 + 2KMnO4(тв.) = N2 + 2MnO2 + 2KOH + 2H2O (to)
93) 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
94) 2HMnO4 + 5H2S + 2H2SO4 = 5S + 2MnSO4 + 8H2O
95) 3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
96) 5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
97) P4 + 20HNO3 = 4H3PO4 + 20NO2 + 4H2O
98) 3NaClO + 4NaOH + Cr2O3 = 2Na2CrO4 + 3NaCl + 2H2O
99) Na2SO3 + 2KMnO4 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
100) Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 +8H2O
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно
сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами.
Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:
KOH + H2SO4 = K2SO4 + H2O

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав
исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4
+ Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО,
принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив
эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном.
При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от
обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение.
В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому
составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой,
твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на
границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество,
твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером
такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся
или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются
воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой
энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при
котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому
не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется — реакция экзотермическая)

Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются
вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное
количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя
энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик»)
является примером экзотермического разложения, при котором тепло выделяется.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.